新型氮氧自由基HPN对大鼠脑缺血再灌注损伤后缺氧相关蛋白表达的影响
梁 恒,钱 军,刘志鹏,罗红波
(遵义医科大学第五附属(珠海)医院 神经内科,广东 珠海 519100)
脑卒中是神经系统常见疾病之一。脑卒中分为缺血性卒中和出血性卒中,针对急性缺血性脑卒中,及时采用药物或介入手段使脑血流量恢复是早期治疗脑缺血最有效的临床手段,但随着血流的再通,会引起缺血区的脑组织细胞二次受损,称为脑缺血再灌注损伤(cerebral ischemia-reperfusion injury, CI-RI)[1-2]。缺血再灌注损伤的机制众多,如钙离子超载、氧化应激、细胞凋亡、炎症反应、血脑屏障破坏、线粒体功能障碍等[3]。线粒体是活性氧自由基(ROS)产生的主要场所,当线粒体功能障碍时,大量ROS产生会导致细胞功能障碍或凋亡。缺氧诱导因子-1(hypoxia inducible factor-1, HIF-1)作为一种核转录因子,广泛表达于全身各组织,其中缺氧诱导因子-1α(HIF-1α)与脑血管疾病密切相关,HIF-1α的表达受到多因素的调控,如氧浓度、ROS等,是脑卒中后调节氧稳态的重要介质[4]。正常氧浓度条件下,HIF-1α表达受到抑制,半衰期短,在缺氧状态下,HIF-1α的表达增强。ROS对HIF-1α的调控较为复杂且不稳定,可能与脑缺血缺氧的程度、ROS的水平、内源性抗氧化酶的活性等有关[5]。
在缺血缺氧情况下,一方面,HIF-1α通过激活下游的靶点基因,如血管内皮生长因子(VEGF)等,使之表达相关蛋白产物,增加组织对缺氧的耐受性,发挥抗缺氧作用[6-7]。VEGF可促进血管内皮再生、抑制内膜增厚,减轻脑缺血灌注损伤,外源性VEGF也可诱导脑组织血管生成,加快神经功能恢复[8]。另一方面, HIF-1α 通过诱导促凋亡因子,如 Nix,BNip3和 IL-20导致线粒体功能障碍导致细胞死亡,故HIF-1α的作用是双相模式,新型氮氧自由基4-羟基2-取代苯基硝基氮氧化物(4’-hydroxyl 2-substituted phenylnitronyl nitroxide, HPN)是一种新型的抗氧化剂和自由基清除剂(图1),与普通的氮氧自由基相比,HPN更容易跨过血脑屏障,有效清除缺氧诱导的活性氧自由基(ROS),更好的发挥神经保护作用[9-11]。在本实验中,我们构建脑缺血再灌注损伤的大鼠模型(MCAO/R),采用分子细胞生物学及病理学等方法,探究HPN对大鼠脑缺血再灌注损伤后缺氧相关蛋白HIF-1α、VEGF表达的影响。

图1 HPN化学结构式
1 材料与方法
1.1 材料
1.1.1 主要试剂 本实验主要试剂包括2,3,5-三苯基氯化四氮唑(TTC,货号:T8170);苏木素(HE,货号:H9627,Sigma公司);BCA蛋白浓度测定试剂盒(货号:PC0020,Solarbio公司);PAGE凝胶快速制备试剂盒(货号:PG112,中国雅酶公司);HIF-1α抗体(货号:340462,成都正能生物公司);VEGF抗体(货号:R26073,成都正能生物公司);β-actin(货号:380624,成都正能生物公司);Trizol(qpcr,货号:15596-026,Ambion公司)。
1.1.2 实验动物 所有实验动物均购买于珠海百试通生物科技有限公司,许可证号:SCXK(粤)2020-0051,健康成年的SPF级雄性SD大鼠,体重240~300 g。
1.2 方法
1.2.1 动物分组 根据前期实验研究[9],在高原缺氧小鼠模型中,神经保护最佳的给药浓度为100 mg/kg,故本实验选取100 mg/kg为基础给药浓度。将60只SD大鼠采用随机数表法分为假手术组、模型组、HPN低、中、高剂量组(100、150、200 mg/kg),每组12只,模型组于造模前20~30 min经腹腔注射0.9%等渗生理盐水,HPN低、中、高剂量组分别于造模前20~30 min经腹腔注射HPN(低:100 mg/kg;中:150 mg/kg;高:200 mg/kg)。假手术组仅分离右侧颈内动脉,其余各组采用改良的 Longa 线栓法构建右侧大脑中动脉阻塞再灌注模型[12]。本研究获得遵义医科大学(珠海校区)伦理委员会审批,审查编号为[2023]2023ZH0039。
1.2.2 Longa线栓法构建MCAO/R模型 使用1%的戊巴比妥腹腔注射麻醉动物,在手术过程中,首先暴露右侧颈总动脉、颈内动脉和颈外动脉并进行分离,然后结扎颈总和颈外动脉,在颈总动脉结扎线远心端开一小口,插入线栓阻塞动脉,并将线栓固定,最后缝合皮肤。在假手术组中,仅仅进行颈总动脉、颈内动脉和颈外动脉的暴露与分离,然后缝合皮肤。将造模后的小鼠置于37 ℃加热垫上保温复苏。线栓阻塞动脉2 h后,拔出线栓,让缺血侧脑组织血流灌注24 h。造模2 h后采用Zea-Longa法评分筛选2~3分大鼠入组,各组大鼠于断头取脑前进行mNSS评分进行神经功能缺损评分,对于失败模型,应排除,并按照随机原则补充大鼠,并重新制作MCAO/R模型,术后动物置于干净通风的鼠笼单笼饲养,自由进食。Zea-Longa评分法为0分:无神经损害症状;1分:左侧前爪不能完全伸展;2分: 向左侧转圈;3分:行走时向左侧倾倒;4分:不能自发行走及意识障碍; 选取2~3分大鼠入组进行后续实验[13]。
1.2.3 神经功能评分(mNSS评分) 缺血再灌注24 h后严格按照评分标准[14],从运动、感觉、平衡和反射4个方面进行评分。评分标准见表1。

表1 mNSS评分标准
1.2.4 TTC染色测定脑梗死体积 缺血再灌注24 h后,迅速取脑,放入-20 ℃冷冻20~30 min后,沿脑冠状面,人字缝处开始向前连续切5片,每片厚约2 mm,放入现配的1% TTC溶液中浸泡,37 ℃保温箱中避光孵育20 min后将脑组织翻面再次避光孵育20 min,用固定液(4%多聚甲醛)固定过夜后置于蓝色背景下拍照。采用Image-J软件对梗死体积进行分析。梗死体积百分比[15]=(对侧半球体积-梗死侧正常体积)/对侧半球体积×100%。
1.2.5 HE染色 缺血再灌注24 h后,迅速断头取脑,将其放置于多聚甲醛溶液(浓度4%)中浸泡固定48 h,然后脱水、石蜡包埋、切成厚度约为5 μm薄片,经过HE染色,再用树脂进行封片。接着利用显微镜观察脑组织病理学变化,最后进行拍照后分析。
1.2.6 实时定量PCR检测HIF-1α、VEGF基因表达 使用Trizol试剂提取总RNA,使用超微量紫外可见分光光度计测得OD260/OD280比值,比值为1.8~2.0时满足实验要求,采用两步法将RNA逆转录为cDNA,使用SYBR Green进行实时PCR,本实验所用引物见表2。
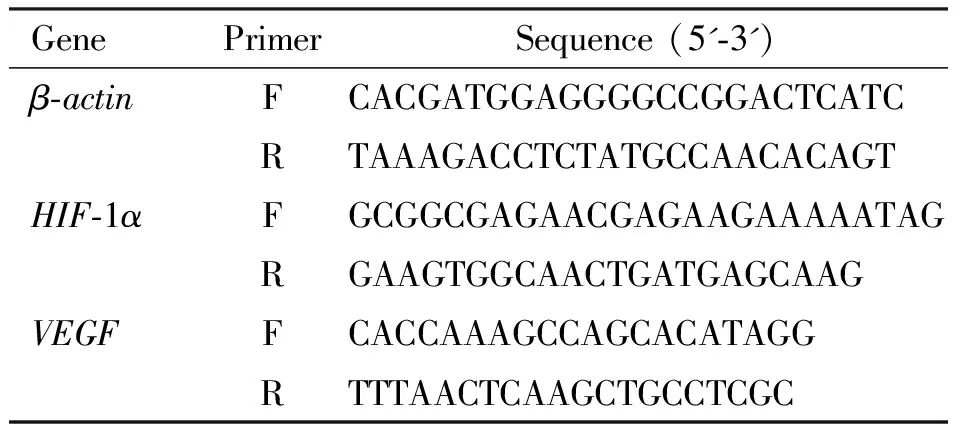
表2 qPCR基因的引物序列
1.2.7 Western blot检测HIF-1α、VEGF蛋白表达 称取适量脑组织在RIPA缓冲液(含有PMSF和磷酸酶抑制剂)中置于冰上研磨直至无明显块状组织,离心后(12 000 r/min, 20 min)取上清液,通过BCA蛋白检测试剂盒测定总蛋白浓度。用10% SDS-PAGE凝胶分离不同分子量的蛋白质,再转膜到PVDF膜上,用含无蛋白快速封闭液浸泡PVDF膜,在摇床上封闭15~30 min,加入一抗在4 ℃孵育过夜(HIF-1α,1∶1 000;VEGF,1∶200;β-actin,1∶20 000)。第2天用TBST洗去一抗后浸泡在二抗孵育液中(1∶10 000),避光孵育2 h,再将二抗洗去后用ECL显色剂增强化学发光进行观察。

2 结果
2.1 不同剂量HPN对神经功能缺损的影响 根据mNSS评分标准对缺血再灌注24 h进行神经功能缺损评分,分数越高,神经功能缺损越严重。实验结果如图2所示,假手术组无明显神经功能缺损,与假手术相比,模型组有明显神经功能缺损症状(P<0.01),与模型组相比,HPN给药组神经功能缺损均有改善(P<0.05),随HPN给药剂量的增加,神经功能缺损症状改善越明显,与HPN低剂量给药组相比,HPN中、高剂量给药组有明显改善(P<0.05),其中HPN高剂量组疗效最明显。
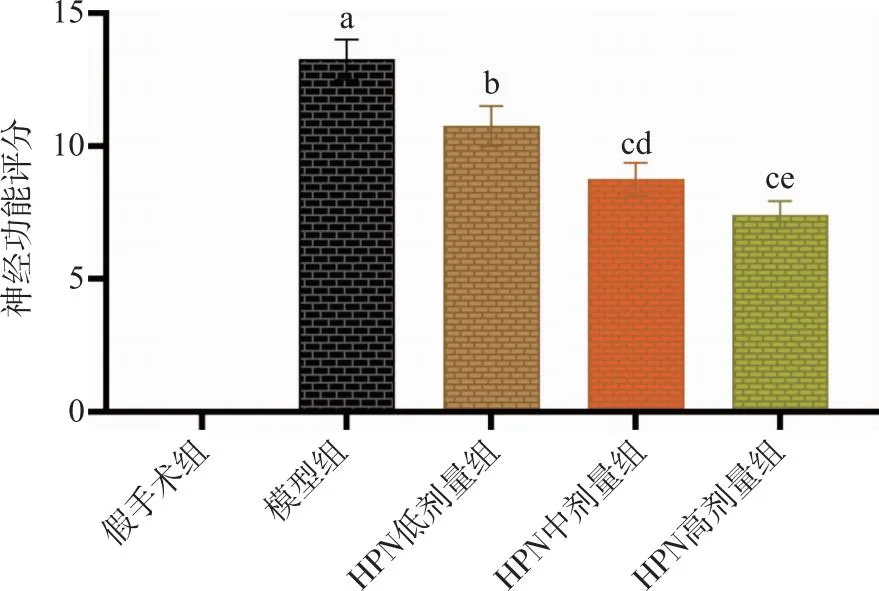
A:与假手术组比较,P<0.01;b、c:与模型组比较,P<0.05、P<0.01;d、e:与HPN低剂量组比较,
2.2 不同剂量HPN对脑梗死面积的影响 采用TTC染色测定脑梗死面积,如图3所示,与假手术组相比,模型组检测大面积的白色脑梗死区域(P<0.01)。与模型组相比,HPN给药组脑梗死面积均有明显改善(P<0.01)。与HPN低剂量给药组相比,HPN中、高剂量给药组有明显改善(P<0.01),随HPN给药剂量的增加,脑梗死面积改善越明显,以HPN高剂量组改善效果最明显。

A:TTC染色;B:脑梗死面积统计分析;a:与假手术组比较,P<0.01;b:与模型组比较,P<0.01;c:与HPN低剂量组比较,
2.3 不同剂量 HPN对梗死侧皮层组织形态的影响 如图4所示,在假手术组中,皮层细胞数量丰富,排列有序,细胞轮廓清晰,没有核固缩或坏死现象。相比之下,MCAO/R模型组中细胞核固缩形成明显的空洞状,具有明显坏死现象,细胞数量减少,并且排列紊乱。与MCAO/R模型组相比,各剂量组中的细胞状态得到改善,细胞死亡减少,其中以HPN高剂量给药组中表现出最明显的改善效果。

A:假手术组;B:模型组;C:HPN低剂量组;D:HPN中剂量组;E:HPN高剂量组;标尺为50 μm,放大倍数×200。
2.4 不同剂量HPN对缺氧相关蛋白HIF-1α、VEGF基因表达的影响 结果如图5所示,与假手术组相比,MCAO/R模型组中HIF-1α和VEGF基因表达明显增加(P<0.01)。与MCAO/R模型组相比,HPN各给药组中HIF-1α和VEGF基因表达明显降低(P<0.05,P<0.01)。与HPN低剂量给药组相比,HPN中、高剂量给药组HIF-1α和VEGF基因表达降低(P<0.01),以HPN高剂量组降低最显著。
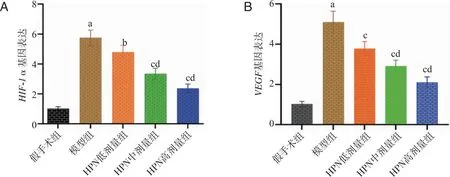
A:HIF-1α基因表达情况;B:VEGF基因表达情况;a:与假手术组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组比较,P<0.01;d:与HPN低剂量组比较,
2.5 不同剂量HPN对缺氧相关蛋白HIF-1α、VEGF蛋白表达的影响 结果如图6所示,假手术组与MCAO/R模型组相比,HIF-1α和VEGF表达在模型组中明显增加(P<0.01)。MCAO/R模型组与HPN给药组相比,HIF-1α和VEGF表达在HPN给药组中明显下降(P<0.05,P<0.01)。与HPN低剂量给药组相比,HIF-1α和VEGF表达在HPN中、高剂量给药组中有明显下降(P<0.05,P<0.01),以HPN高剂量组降低最显著。

A、B:Western blot检测蛋白表达;C、D:蛋白相对表达量;a:与假手术组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组比较,P<0.01;d:与HPN低剂量组比较,P<0.05;e:与HPN低剂量组比较,
3 讨论
急性缺血性脑卒中是一种严重的神经科疾病,具有高发病率、高致残率和高死亡率的特点,是中老年人致死、致残的主要病因,及时使脑血流量恢复,拯救缺血半暗带是治疗急性缺血性脑卒中的首要原则,但随着血流的再通,会引起脑缺血再灌注损伤(CI-RI)[1-2]。目前尚无明确治疗CI-RI的药物。HPN是课题组前期合成的一种新型的抗氧化剂和自由基清除剂,能有效清除缺氧诱导的活性氧自由基(ROS),从而发挥神经保护作用[9-11],但HPN在脑缺血再灌注损伤中的机制及作用靶点尚未完全清楚。
缺氧诱导因子-1α(HIF-1α)是一种核转录因子,在神经疾病中扮演十分重要的角色,大量研究发现HIF-1α与缺血再灌注损伤密切相关[16-17]。在缺血再灌注损伤后,机体自身也启动一系列抗损伤机制,该过程与HIF-1α的表达上调密切相关,HIF-1α通过增加下游基因表达相应蛋白,如血管内皮生长因子(VEGF),促红细胞生成素(EPO)等,参与血管生成、红细胞生成增加,糖酵解、葡萄糖转运等生物过程促进细胞存活。研究发现,通过低氧预处理或提前使HIF-1α积累,对脑缺血缺氧均表现出明显的保护作用[18-19]。血管内皮生长因子(VEGF)是一种可以促进血管内皮细胞生长因子,可促进血管通透性增加、血管内皮细胞迁移、增殖和新生血管形成等作用[20]。脑缺血缺氧后的VEGF的表达调控是多因素的,其中以缺血缺氧为主要的调节因素,缺血缺氧后,HIF-1α通过结合到VEGF基因的启动子区域上相关靶点结合,促进VEGF基因的转录和表达,从而促进血管生成和组织修复[21]。在本实验中,HIF-1α和VEGF的基因及蛋白表达在MCAO/R模型鼠脑中表达增加,如前所述,模型组中HIF-1α和VEGF的表达增加是机体自身的防御反应,增加机体对缺血缺氧的耐受,减轻脑缺血再灌注损伤。
本实验针对新型氮氧自由基HPN对缺血再灌注损伤后HIF-1α和VEGF表达的影响进行研究,结果表明,给予HPN处理后,脑皮层组织中HIF-1α和VEGF的表达减少,且随着HPN剂量的增加,HIF-1α和VEGF表达逐渐减少。此外,HPN处理后的模型大鼠脑梗死面积范围减少,脑皮层细胞死亡减少、组织间质水肿得到改善,减轻了脑缺血再灌注后的组织损伤。目前的一些研究发现,HIF-1α也参与细胞凋亡的发生,Helton等[22]发现HIF-1α在缺氧缺氧中的主要作用是促进细胞凋亡。Miao等[23]发现,缺氧诱导因子的抑制剂可抑制炎症反应保护缺血再灌注诱导的组织损伤。HIF-1α的表达受到多因素的调控,除了氧浓度为主要调节因素外,活性氧自由基(ROS)也参与HIF-1α的稳定性调节,但ROS对HIF-1α的调节是促进还是抑制均有报道,Guzy等[24]发现,ROS通过抑制HIF-1α的降解,在缺血缺氧条件下促进HIF-1α和下游靶基因的表达,但Guo等[25]发现,ROS清除剂N-乙酰半胱氨酸可诱导HIF-1α的表达。He等[26]发现,HIF-1α的作用是相互的,在早期表达促进细胞凋亡,晚期表达促进细胞存活。VEGF使得血管通透性增加的同时,会引起血脑屏障破坏,与脑水肿形成密切相关[27]。因此结合相关研究及实验结果,HPN调控脑皮层组织中HIF-1α和VEGF的表达减少,可能与氧化应激减轻、炎症反应的抑制、细胞凋亡的减少等途径有关。
综上所述,本研究探讨了新型氮氧自由基HPN对脑缺血再灌注损伤后HIF-1α和VEGF表达的影响,初步证实了HPN降低了脑缺血再灌注损伤后HIF-1α和VEGF的表达,并改善了大鼠脑缺血再灌注损伤。

