绞股蓝中达玛烷型四环三萜皂苷元的波谱学特征
王显婷,杜艺玫,谭道鹏
(遵义医科大学 药学院,贵州金钗石斛产业发展关键技术工程中心,贵州 遵义 563006)
葫芦科绞股蓝属植物绞股蓝(gynostemmapentaphyllum)广泛分布于亚洲大部分国家,在我国主要生长在秦岭和长江以南地区。作为一种传统中药,绞股蓝最早记载于明代《救荒本草》,具有清热解毒、止咳化痰、补气生津等功效[1-3]。因含有丰富的与人参皂苷相似的达玛烷型四环三萜类皂苷成分,素有“南方人参”之称[4]。皂苷类成分是绞股蓝中的主要活性成分,绞股蓝总皂苷已被开发为片剂、胶囊、滴丸等6种剂型药物,临床上用于糖尿病、高血脂症的治疗[5-9]。现代药理学研究表明,绞股蓝皂苷还具有抗肿瘤、降血糖、保肝、免疫调节、抗氧化等广泛的药理活性[10-14]。
据报道,从绞股蓝中已发现的皂苷类成分超过300种[15-16],其结构由母核结构达玛烷型四环三萜皂苷元和侧链糖基组成[17-19]。达玛烷型四环三萜皂苷因其具有多种药理活性一直是中药领域的研究热点,在自然界中,达玛烷型四环三萜皂苷主要存在于五加科人参属植物中,如人参、西洋参、三七等,在非人参属的药用植物中也有分布,如绞股蓝、酸枣仁等[20-22]。寻找具有更好活性的新的达玛烷型四环三萜皂苷成分一直是天然药物化学工作者持续的研究工作。对于天然产物的结构鉴定,一般可通过核磁共振波谱法(nuclear magnetic resonance spectroscopy, NMR)、质谱(mass spectrum, MS)、紫外光谱(ultraviolet and visible spectrum, UV)、红外光谱(infrared spectroscopy, IR)等进行解析,其中NMR是最为关键的天然产物化学结构鉴定技术手段[23-25],达玛烷型四环三萜皂苷类成分中存在的大量亚甲基、次甲基在NMR谱图中的信号叠加,是达玛烷型四环三萜皂苷成分的结构鉴定的关键难点。因此,本文将围绕已报道的绞股蓝皂苷元的NMR、MS、UV、IR的波谱学数据,对已报道绞股蓝皂苷类成分中皂苷元部分的波谱学数据进行归纳、总结,通过总结其波谱学规律发现其波谱学特征,为绞股蓝乃至其他药材中达玛烷型四环三萜皂苷类成分的结构解析提供科学依据。
1 绞股蓝中达玛烷型四环三萜皂苷元分类及结构特点
绞股蓝中的皂苷类成分属于达玛烷型四环三萜。其母核为达玛烷型四环三萜皂苷元,其结构由30个碳原子组成,从环氧角鲨烯的全椅式构象形成[26],结构特点包括:四个环为6/6/6/5环系,C-3、C-12、C-20位常被羟基取代,并有5组甲基特征信号,分别是C-4、C-25位的偕二甲基和C-8、C-10、C-14位的角甲基且C-8和C-10位的甲基均为β-构型,C-17位的侧链为β-构型,C-20的构型一般为R或S构型[27]。本文根据C-17侧链类型的不同将绞股蓝中的达玛烷型四环三萜皂苷元分为6个类型:链状型(I)、环烷型(Ⅱ)、环酮型(Ⅲ)、五元内酯环型(IV)[28]、呋喃环型(V)和吡喃环型(VI);根据A环的结构变化又将其分为A环异构型(Ⅶ)。不同类型代表化合物信息及结构见表1、图1。
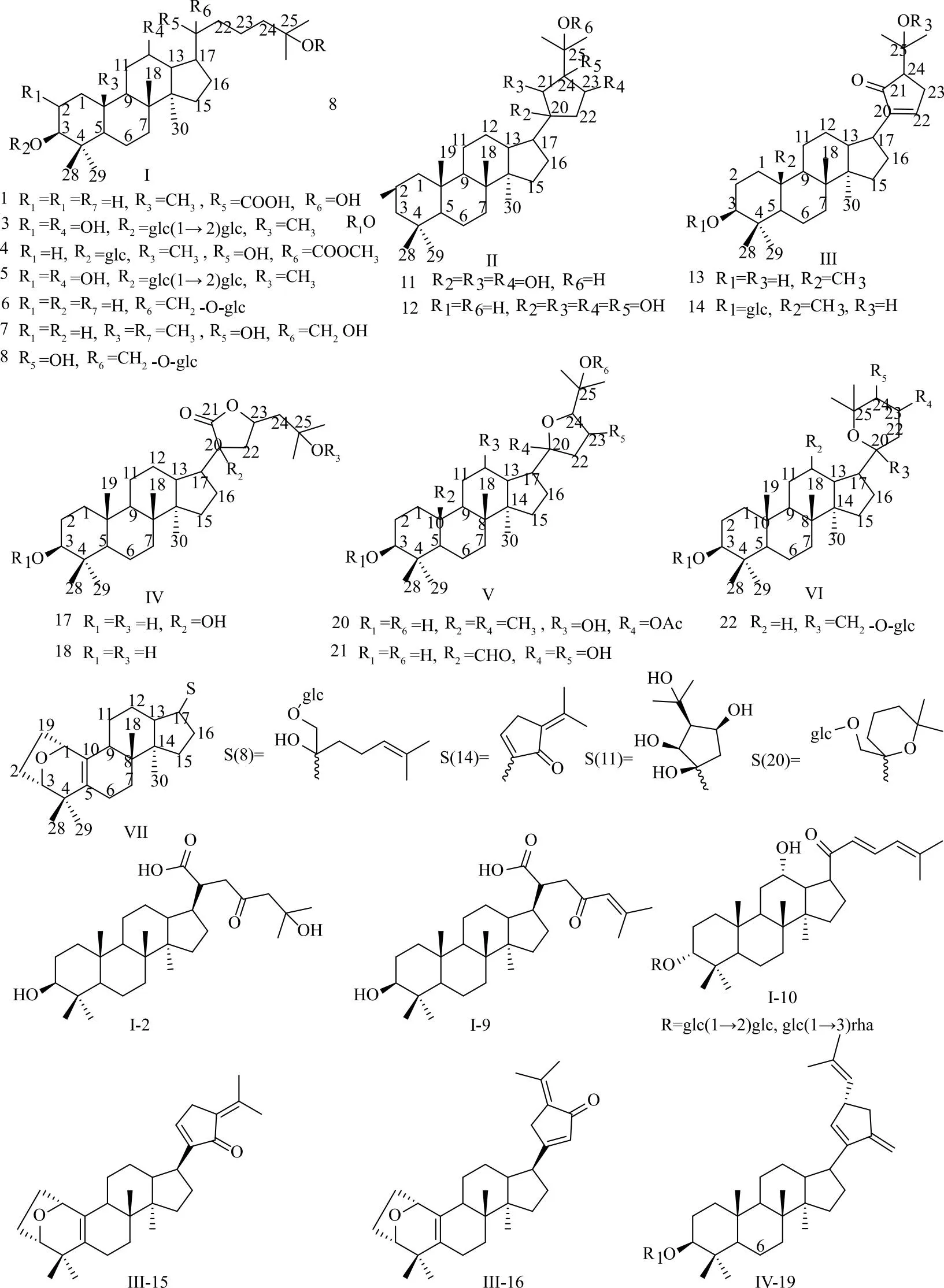
图1 达玛烷型绞股蓝皂苷元结构式
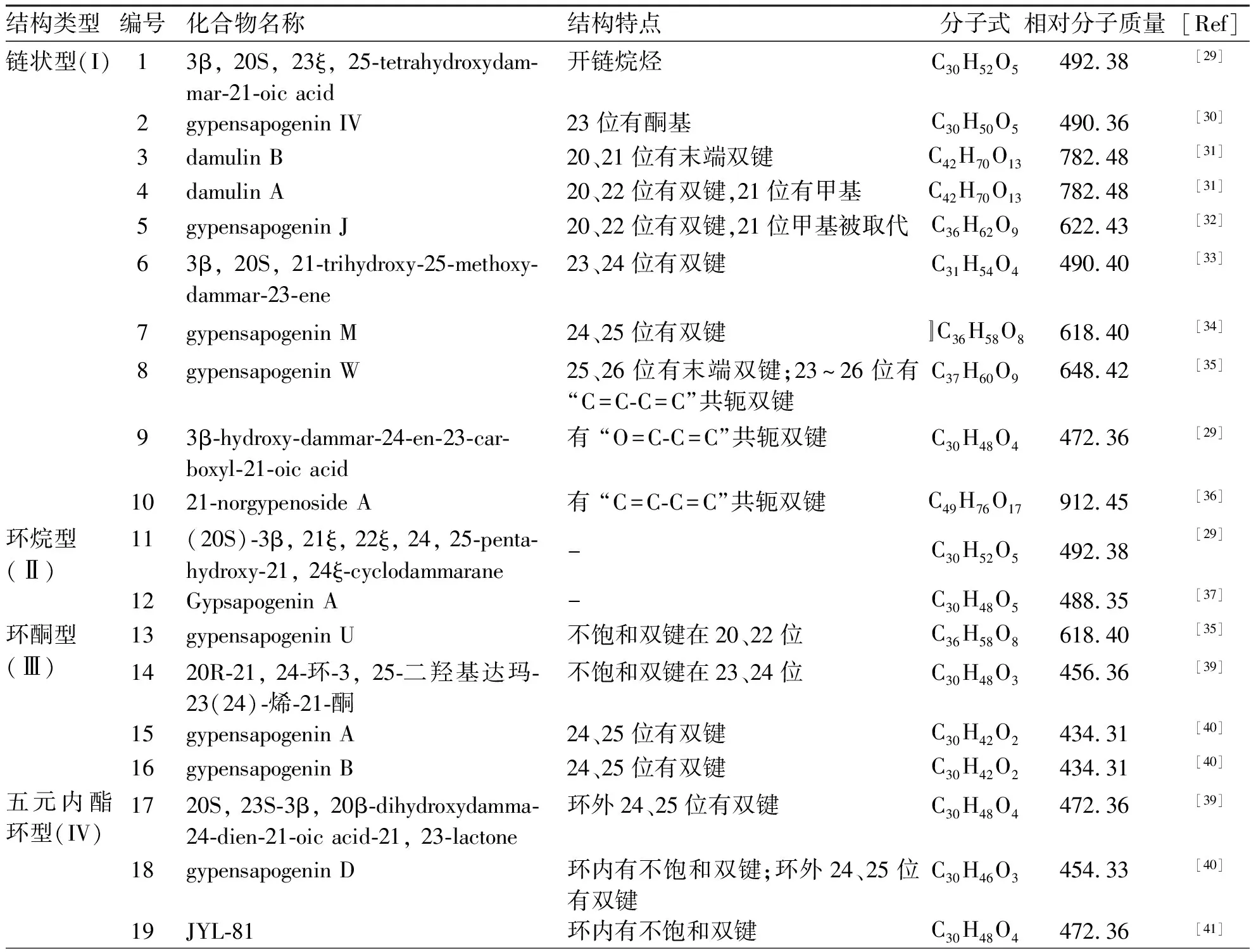
表1 达玛烷型绞股蓝皂苷元代表化合物
链状型(I)是绞股蓝皂苷类化合物中数量最多的一类,结构多样性在于双键的分布位置以及存在形式,主要分布在C-20~C-26,并有单个双键以及共轭双键2种存在形式。侧链为开链烷烃不含双键的如3β, 20S, 23ξ, 25-tetrahydroxydammar-21-oic acid[29](1);长链中有酮基不含双键的如gypensapogenin IV[30](2);单个双键的分布位置包括C-20与C-21如damulin B[31](3);C-20与C-22,如damulin A[31](4)和gypensapogenin J[32](5);C-23与C-24如3β, 20S, 21-trihydroxy-25-methoxydammar-23-ene[33](6);C-24与C-25,如gypensapogenin M[34](7)、C-25与C-26,如gypensapogenin W[35](8);共轭双键主要有“O=C-C=C”和“C=C-C=C”两种,如3β-hydroxy-dammar-24-en-23-carboxyl-21-oic acid[29](9)和21-norgypenoside A[36](10)。
环烷型(Ⅱ)是由C-21与C-24环合而成的五元环,环上一般有多个羟基取代。代表化合物gypsapogenin A[37](11)和(20S)-3β, 21ξ, 22ξ, 24, 25-pentahydroxy-21, 24ξ- cyclodammarane[38](12)。
环酮型(Ⅲ)是α, β-不饱和五元环酮。环由C-21与C-24环合而成,当酮基在C-21位时,α, β-不饱和双键在C-20与C-22位或C-23与C-24位,如gypensapogenin U[35](13)和20R-21, 24环-3, 25-二羟基达玛-23(24)-烯-21-酮[39](14);酮基在C-23位时,α, β-不饱和双键在C-20与C-22位,如gypensapogenin A[40](15)和gypensapogenin B[40](16)。
五元内酯环型(IV)的结构特点是C-21与C-23连氧环合,C-21位有羰基。代表化合物有20S, 23R-3β, 20β-dihydroxydamma-24-dien-21-oic acid-21, 23-lactone[39](17)、gypensapogenin D[40](18)、JGL-81[41](19)。
呋喃环型(V)结构是C-21与C-23或C-20与C-24连氧环合成呋喃环。C-20与C-24连氧环合形成的呋喃环结构的结构特点是C-20位连有甲基如(20S)-3β, 20ξ, 21ξ-trihydroxy-19-oxo-21, 23-epoxydammar-24-ene[33](20)和23-O-Acetyl-3β,12β,23S,25-trihydroxy-20S,25R-epoxydammarane[33](21)。
吡喃环型(VI)是侧链为吡喃环的结构,由C-20、C-25连氧环合而成,结构特点是环上C-25位有一组偕二甲基。代表化合物gypensapogenin N[34](22)。
A环异构型(Ⅶ)是一类结构新颖达玛烷型四环三萜皂苷衍生物,其结构特点体现在A环是一个七元环,在 C-1与C-3之间有一座氧桥,C-5与C-10之间有一对双键。C-19位的醛基可能是此类型化合物A环形成的关键原因:在环化过程中,C-3所连羟基的H+向C-19位的醛基进攻形成H2O+,然后C-3与C-19连氧环合,在脱去一分子H2O后C-19烷基从C-10位转移至C-1位[40]。目前发现了此类型结构共17个,代表化合物有gypensapogenin A[40](15)等。
2 绞股蓝皂苷元的波谱学特征
2.1 NMR图谱 绞股蓝皂苷元的1H NMR具有萜类化合物的特征:饱和烃质子多,高场区峰形复杂、信号易重叠,辨识与归属困难,故需关注1H NMR中的特征信号。在绞股蓝皂苷元的1H NMR高场区可见7个特征甲基的信号:(1)C-25连接的一组偕二甲基(26、27位):在环酮型(Ⅲ)绞股蓝皂苷元中,C-24与C-25存在双键时,2个甲基相对积分面积为3且为单峰(s)(图2 A),分别位于δH2.15~2.40及δH1.65~1.90; 五元环酯型(IV)或链状型(I)中C-24与C-25的双键在长链中时,偕二甲基分别为相对积分面积为3的单峰(图2 B)或分别裂分成二重峰(d)(图2 C),位于δH1.30~1.85且两个甲基峰位移值差值小于0.1 ppm,当C-25发生羟基化时,偕二甲基裂分成2个单峰(图2 D)且相对积分面积为3,位于δH1.35~1.85,位移值差小于0.05 ppm。(2)A环异构型(Ⅶ)绞股蓝皂苷元中28位甲基位移值远大于29位甲基(图2 E);C-4连接的一组偕二甲基(28、29位):相对积分面积分别为3且均为单峰,28位甲基为β构型并位于δH0.95~1.35,29位甲基为α构型并位于δH0.75~1.05,受构型的影响28位甲基位移值一般大于29位甲基(图2 F~G)。(3)18、19和30位的角甲基位于δH0.75~1.10,相对积分面积为3,且为单峰。总结角甲基的1H NMR规律发现,18、19、29和30的化学位移易发生重叠且不能简单通过峰形辨别,此时需通过二维图谱中HMBC谱的长链相关性来判断:(1)C-4连接的偕二甲基H-28和H-29与C-3、C-5具有相关性,且两个甲基之间互有长链相关性;(2)H-19的角甲基与C-1、C-5有相关性,H-18的角甲基与季碳C-14、C-8具有相关性,H-30的角甲基与季碳C-14、C-8和叔碳C-13具有相关性。

A~D: 26和27位甲基信号; E~G: 18, 19, 28, 29和30位甲基信号;H~K: 邻氧氢信号; M~P: 烯氢信号。
达玛烷型绞股蓝皂苷元的含氧基团一般在H-2、H-3、H-10、H-12、H-20、H-25取代,可在1H NMR谱图中观察到含氧质子信号峰。可根据H-3的位移值判断其取代情况:(1)当H-3被含氧基团如羟基、葡萄糖基取代时呈现为双二重峰(dd,J= 10.5~12.0 Hz, 5.0~6.5 Hz)或多重峰,位于δH3.10~3.50(图2H);(2)H-3被乙酰氧基(-OCOCH3)取代时呈双二重峰,位移值向低场移动位于δH4.40~4.70,耦合常数与(1)一致(图2I);(3)可根据H-1与H-3的位移值的变化判断A环异构型绞股蓝皂苷元(图2J),H-3呈多重峰或二重峰(J= 5.0~6.5 Hz),位移值向低场移动,位于 δH3.90~3.95, H-1位移值也向低场移动,位于δH4.30~4.60且为多重峰,;(4)五元内酯环型(IV)绞股蓝皂苷元H-23与氧原子相连,呈多重峰或且位于δH5.50~5.80(图2K)。
达玛烷型绞股蓝皂苷元中的烯氢一般位于侧链五元环、长链或长链末端:(1)当烯氢位于五元环,呈二重峰(J= 2.3~4.5 Hz)或单峰,位于δH5.95~7.50(图2L);(2)长链上的烯氢为二重峰(J= 8.0~8 .8 Hz)或多重峰,位于δH5.10~5.80(图2 M~N);与五元内酯环型(IV)中对比,长链中的烯氢与H-23化学位移值有重叠但图谱中两组信号峰互不重叠;(3)长链末端的烯氢呈现两组单峰,位于δH4.70~5.10(图2O)。不同类型达玛烷型绞股蓝皂苷元代表化合物的1H NMR数据见表2。
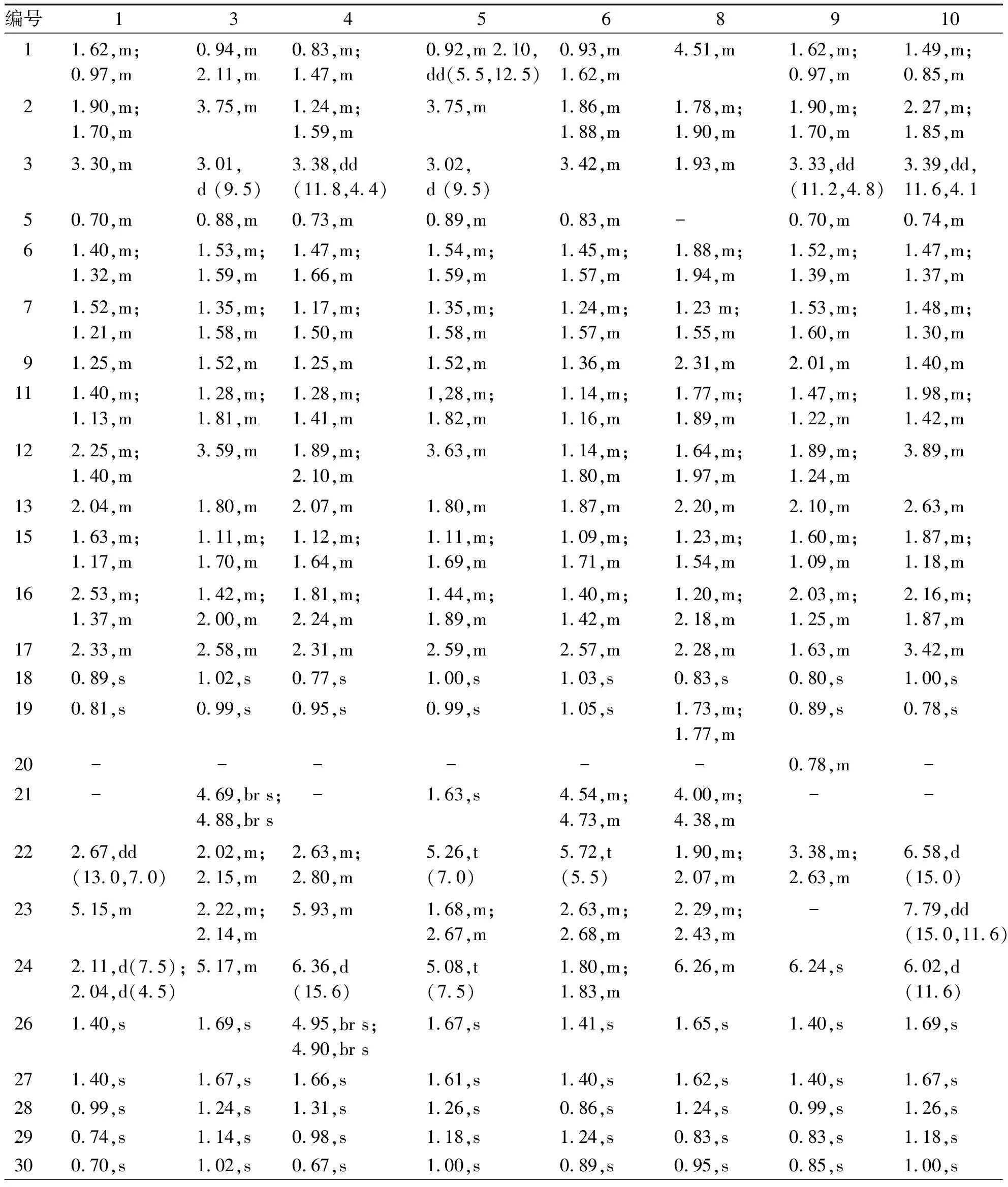
表2 不同类型代表性达玛烷型绞股蓝皂苷元的1H NMR特征信号( CDCl3/ C5D5N)
相比1H NMR,13C NMR对于绞股蓝皂苷元的结构鉴定具有更重要的意义。绞股蓝皂苷元的13C NMR可获得结构中的所有碳信号,解析时重点关注低场区基团碳原子信号。而在总结文献中绞股蓝皂苷元的核磁共振波谱数据发现, C-17侧链异构型和A环异构型的结构解析侧重点不同: C-17侧链异构型主要通过17位以及20~27位的氢谱和碳谱位移值变化判断;A环异构型则重点关注1、3、5、10、19位5个键位的氢谱、碳谱位移值。
在13C NMR中,由于低场区叔、仲、季碳信号存在重叠,不易辨认,因此需要重点关注高场区的碳信号,包括羰基、羧基、双键、连氧碳等信号。(1)酮基的信号位于δC196.5~215.0(图3A~C),(2)酯基位于δC170.0~179.5(图3D~E);羧基位于δC175.0~178.5(图3F),与酯基化学位移存在重叠,需要结合1H NMR、MS区别二者;双键位于δC105.0~155.0,此区域信号峰数量一般呈偶数,据此可判断化合物结构中的双键数量(图3G~K),当信号峰为单数时,需考虑2个碳信号的化学位移值发生重叠;连氧碳位于δC69.5~85.0,可通过信号峰数量判断与氧原子相连的碳原子数量(图3L~N),但不能据此判断氧原子个数如A环异构型(Ⅶ)绞股蓝皂苷元(图3O)。

A~C: 酮基信号; D~E: 酯基信号; F: 羧基信号; G~K: 烯碳信号; L~N: 邻氧碳信号。
链状型(I):在长链中,双键的位置和类型不同,相应的13C NMR数据有所差异。(1)当双键在C-20与C-21时为末端双键,在13C NMR中分别位于δC155.0左右和δC105.0左右,如damulin B[31](3),当末端双键在C-25与C-26时,受26、27位偕二甲基效应的影响,C-25位移值向高场移动位于δC140.0左右,C-26移向低场位于δC115.0左右,如gypensapogenin W[35](8);双键在C-20与C-22时,C-20位于δC137.5~140.5,若C-21位为甲基则C-22位于δC125.0左右,如damulin A[31](4),若C-21甲基发生取代则C-22位于δC130.5~133.5,如gypensapogenin J[32](5);双键在C-23与C-24时,分别位于δC132.0~137.5和δC138.0~142.5,如3β,20S,21-trihydroxy-25-methoxydammar-23-ene[33](6);当双键在C-24与C-25位时会受到26、27位的偕二甲基效应影响,分别位于δC124.5~126.0和δC131.0~132.0,如gypensapogenin M[34](7)。
环烷型(Ⅱ)可根据链状型和环烷型C-20、C-24碳信号位移值差异判断侧链是否发生环化,侧链环化后,C-20位移值向低场移动2.0~10.0 ppm,C-24位移值向低场移动15.0~25.0 ppm。
环酮型(Ⅲ)中的特征性酮基位于δC196.5~215.0。当C-20与C-21位的α, β-不饱和双键仅受共轭效应影响,α碳与β碳分别位于δC154.5、δC157.0左右,如gypensapogenin U[35](13);而在α, β-不饱和双键在C-23与C-24位,除了共轭效应双键还受到C-25上羟基的诱导效应影响,其α碳位移值比β增加约4.0 ppm,分别位于δC155.5、δC151.5左右如20R-21, 24-环-3, 25-二羟基达玛-23(24)-烯-21-酮[39](14);当C-24与C-25位发生脱水反应失去羟基形成双键,结构中形成两个共轭体系,酮基和不饱和β碳位移值分别减小约10.0 ppm,环外双键C-24与C-25位移值分别在δC130.0和δC145.0左右如gypensapogenin A[40](15)。
五元内酯环型(IV)具有特征羰基信号,位于δC170.0~178.9。当环内有α, β-不饱和双键时,为α,β,γ不饱和内酯环,不饱和双键位移值分别位于δC137.0~137.9、δC145.5~148.5如JGL-81(19)[41]。
吡喃环型(VI)偕二甲基C-26与C-27分别位于δC32.5~33.0、δC27.5~28.5,当C-24被含氧基团取代时C-26向高场位移。且相比呋喃环型,吡喃环型C-20位移值在更高场共振,代表化合物有gypensapogenin N[34](22)。
17位的碳氢信号可作为以上6个类型化合物的诊断信号,用于判断链状型(I)C-20位的取代基,还可用于区分其他5个类型的绞股蓝皂苷元:(1)环烷型(Ⅱ)位于δC41.0~50.0、δH1.70~2.20 (m);环酮型(Ⅲ)位于δC37.5~47.6、δH2.19~2.81(m);环酯型(IV)位于δH2.50~2.71 (m),C-20连有羟基时C-17位于δC45.0~47.6,脱水形成双键位于δC37.6~39.0;呋喃环型(V)和吡喃环型(VI)位于δC44.0~50.8, δH1.95~2.35(m)。
A环异构型(Ⅶ)在氢谱和碳谱中主要有两组特征信号:(1)C-1与C-3之间形成的氧桥:C-1位于δC71.5~74.5, H-1位于δH4.25~4.55 (m);H-3位形成氧桥前连接含氧基团裂分双二重峰(dd),位于δH3.10~3.45,耦合常数为11.3 Hz和5.0 Hz,形成氧桥后其峰形为多重峰 (m)或二重峰 (d),位于δH3.70~3.99,耦合常数为5.5~6.5 Hz。(2)C-5受到H-6的范德华力的作用,位移值比C-10小4.0 ppm,二者的双键分别位于δC129.0~130.8、δC133.0~134.8。不同类型达玛烷型绞股蓝皂苷元代表化合物的1H NMR数据见表3。

表3 不同类型代表性达玛烷型绞股蓝皂苷元的13C NMR特征信号( CDCl3/ C5D5N)
对于未报道过的新化合物,还需通过二维核磁共振波谱(2D NMR)鉴定平面结构,包括HMBC、HSQC、1H-1H COSY以及NOESY谱等。
2.2 MS图谱 目前主要通过高分辨率电喷雾电离源质谱(HR-ESI-MS)测定绞股蓝皂苷元的相对分子量,高分辨率质谱具有较高的精确度,能够区分相对分子量相差较小的两个皂苷元,也有研究通过电离质谱(EI-MS)[39]和飞行时间质谱(TOF-MS)[42]测定其分子量。HR-ESI-MS一般在正离子模式下测定绞股蓝皂苷元分子量,部分化合物采用负离子模式测定,在一级电离捕捉分子离子峰获得精确的相对分子量后通过二级电离或多级电离中的碎片离子峰推断结构[24]。一级电离中一般得到[M+]、[M + H]+、[M + Na]+、[M-H]-等分子离子峰或准分子离子峰信息。由于绞股蓝皂苷元结构复杂,还可能在MS的二级电离或多级电离中获得大量碎片离子峰。
链状型(I)的取代基位置和数量多样,可通过MS离子峰排除其他类型的绞股蓝皂苷元后结合NMR鉴定结构。
环烷型(Ⅱ)主要根据取代基在五元环烷上的取代情况确定。该类型化合物五元环烷与骨架结构断裂后,连续失去多个H2O分子,若C-25羟基化可见m/z 106(基峰)、124、142、160、176等碎片峰,C-25连接有末端双键时,除基峰外碎片离子峰扣除一个H2O分子的质量位移,即得到m/z 106(基峰)、124、160等碎片峰。
环酮型(Ⅲ)化合物以20R-21, 24-环-3, 25-二羟基达玛-23(24)-烯-21-酮[39,43](12)的EI-MS裂解途径(图4)为例:化合物分子离子峰m/z 456[M]+,化合物首先失去CH3和多个H2O分子,形成m/z 441(M-CH3)、423(M-CH3-H2O)、405(M-CH3-2H2O)的碎片离子峰,然后17位侧链与骨架发生断裂,可见脱去-H2O、-H质子的m/z 316、299、122(基峰)的碎片峰,骨架结构在电离源轰击下进一步裂解,连续失去H2O分子后可见m/z 207、189、175的A~B环碎片峰。当环酮型(Ⅲ)绞股蓝皂苷元C-25发生羟基化时,可见+H2O的碎片峰m/z 317、334。其它类型的绞股蓝皂苷元17位侧链的不同或随取代基在相应位置的变化而发生质量位移,根据其对质量位移的影响可初步完成相应侧链和取代基的种类确定。

图来源于文献39,43。
五元环酯型(IV)的质量位移主要根据环内双键、C-20羟基化的情况判断。当存在环内双键,五元环酯断裂时可见m/z 138的基峰;C-20羟基化的情况下环酯脱去1个H2O分子后得到基峰的碎片。若 C-25羟基化可见m/z 156的碎片峰。
根据呋喃环型(V)的结构特点可知,其质量位移主要受呋喃环上碳原子的羟基化影响。呋喃环断裂时,H-20被甲基取代则出现m/z 126的基峰,H-20被羟基取代则根据脱水情况可见m/z 158、140、122(基峰)的碎片离子峰。
吡喃环型(VI)最关键的判别方式在于基峰的质量位移m/z 114。
A环异构型(Ⅶ)的骨架结构依据侧链的断裂和骨架解离进行分辨,不同于图3所示骨架结构,A环异构型可见m/z 314、313、219、208的碎片峰。
因此,在MS判别的绞股蓝皂苷元类型的基础上,通过绞股蓝皂苷元结构特点和核磁共振波谱数据的归纳总结可快速鉴定其结构。
2.3 IR光谱 IR在鉴定绞股蓝皂苷元的化学结构中主要用于判断是否存在特殊基团。在IR光谱中,羟基的特征吸收峰在vmax3 400 cm-1左右并显示为宽峰(br),甲基在vmax1 380 cm-1左右。通过IR可以判断羰基在绞股蓝皂苷元中的存在形式:羰基的特征吸收峰位于vmax1 715 cm-1左右;α, β-不饱和酮的强吸收峰位于vmax1 680 cm-1附近;五元内酯环的羰基吸收峰在vmax1 610 cm-1左右,γ内酯环的羰基吸收峰一般在vmax1 751 cm-1左右。烯烃双键“C=C”吸收峰一般位于vmax1 640 cm-1左右。醚键可在vmax1 010~1 115 cm-1观察到特征吸收峰如呋喃环型(V)和吡喃环型(VI)。因此IR对于绞股蓝皂苷元的鉴定具有一定意义。
2.4 UV光谱 UV光谱在结构解析中主要用于判断化合物结构中是否存在共轭基团。部分绞股蓝皂苷元为饱和烃类结构,在UV中无紫外吸收。多数绞股蓝皂苷元的共轭基团在λmax≈ 240 nm处具有紫外吸收,环酮型(Ⅲ)和A环异构型(Ⅶ)在λmax≈ 262 nm处有紫外吸收,均不具有特征性。因此UV对于绞股蓝皂苷元结构鉴定无实际意义。
3 结束语
对绞股蓝的深入研究发现,绞股蓝皂苷是绞股蓝中的功能活性成分,对于降脂、调节血糖及抗肿瘤等临床应用具有重要意义。寻找具有更强活性的绞股蓝单体皂苷及其苷元是当前的研究热点。核磁共振波谱(NMR)是鉴定绞股蓝皂苷及苷元最有效、方便的技术,结合HR-ESI-MS可快速、准确鉴定绞股蓝皂苷及苷元结构。本文依据绞股蓝皂苷元的结构特点进行了分类,并归纳总结波谱学特征,为此类化合物的结构解析提供了参考依据。

