ICU体外循环术后患者口腔黏膜压力性损伤列线图预测模型的构建
陈 锐,王志伟,赵瑞玲,张 莉
(1.新疆医科大学第一附属医院 重症医学科,新疆 乌鲁木齐 830016;2.新疆医科大学 护理学院,新疆 乌鲁木齐 830011)
体外循环是心血管手术中最常见的重要生命支持技术,也是一种难度大、风险高、时间长且易导致血流动力学发生改变的术式,在术后常会出现压力性损伤等并发症[1-2]。在体外循环期间及术后气管导管为患者在呼吸支持与救治生命方面发挥了关键作用。但在气管导管使用过程中,由于气管导管与辅助装置的压迫及固定方法不当,易引起医源性口腔黏膜压力性损伤(oral mucosal pressure injury, OMPI)[3]。OMPI的发生为患者带来了痛苦,延长了患者住院时长,增加了患者经济负担及医疗人员的工作负担,且易引发医患矛盾[4]。研究报道,因气管导管造成OMPI的发生率从7%~45%[5-7]不等。目前,对于体外循环术后患者OMPI的评估量表构建及列线图预测模型鲜有报道。本研究将以OMPI为结局指标,构建可视化的列线图预测模型,为临床中预防体外循环术后患者发生OMPI提供参考。
1 材料与方法
1.1 对象 本研究为前瞻性研究分析,采用目的抽样法选取2023年1-6月新疆某三甲医院重症医学科(intensive care unite,ICU)体外循环术后455例患者为研究对象。根据是否发生OMPI将其分为OMPI组与非OMPI组。其中OMPI组135例,男性90例,女性45例,平均年龄(59.81±8.91)岁;非OMPI组320例,男性188例,女性132例,平均年龄(54.94±14.83)岁。
1.2 纳排标准 纳入标准:年龄≥18岁,入住ICU时间≥24 h;经口留置气管导管患者。排除标准:患有口腔黏膜疾病影响观察者;入ICU前已发生由气管导管所引起的OMPI;临床资料不完整者。
1.3 样本量计算 本研究分析体外循环术后患者发生OMPI的危险因素,依据经验法估算,所需样本量为影响因素的10~15倍[8]。本研究共纳入32项影响因素,因此样本量为320~480例,考虑10%~20%的缺失率,应纳入样本388例,本研究实际纳入455例。
1.4 OMPI的判别标准 本研究以澳大利亚学者 Reaper 及其研究团队基于 ICU 患者开发了一种用于评估口腔黏膜压力性损伤量表[9](the reaper oral mucosa pressure injury scale,ROMPIS),分为 1-3 期。每个分期的具体诊断为:1期:嘴唇和颊黏膜发红和分界;没有可见的上皮组织破坏、丧失、溃疡、水疱;嘴角出现不可褪色的红斑。2期:颊黏膜破坏和分化,表现为水疱,软凝块或凝血;非角化上皮组织浅表缺损;或嘴角的表皮和真皮层受损,但无下层筋膜受损迹象。3 期:黏膜和黏膜下组织缺损,表现为嘴唇或嘴角筋膜及下层肌肉的损伤暴露。
1.5 研究资料 集文献报道及专家咨询,最终确定以下影响因素:(1)一般资料:性别、年龄、体质指数(body mass index,BMI);(2)临床资料:高血压史、意识障碍、急诊手术、ICU停留天数、术前血清白蛋白、术前血红蛋白、术前红细胞压积、术前白细胞、术前血乳酸、术前氧合指数、术前空腹血糖;(3)手术相关资料:手术类型、麻醉分级、手术体位、术后使用体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)、术中最低体温、体外循环时间、手术时间、术中肝素钠用量、术中最低动脉压、术中出血量、术中输血量;(4)气管导管相关资料:气管导管留置时长、固定器类型、气管导管型号、气管导管材质、气管导管固定带类型、气管导管固定位置、是否声门下吸引。

2 结果
2.1 OMPI发生部位及分期 455例患者中135 例发生OMPI,发生率为29.7%,共发生204处压力性损伤(P<0.05,表1)
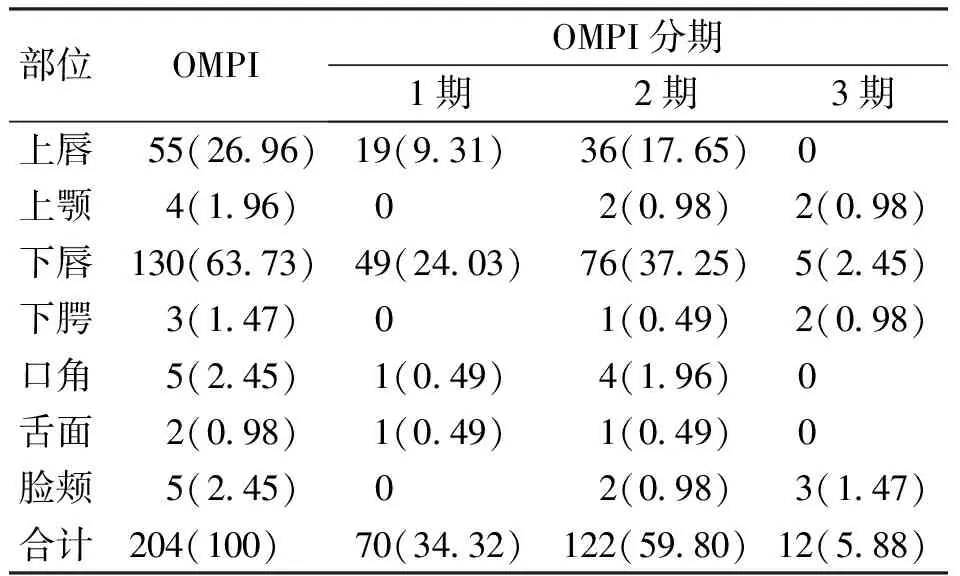
表1 体外循环术后患者OMPI发生部位及分期[处(%)]
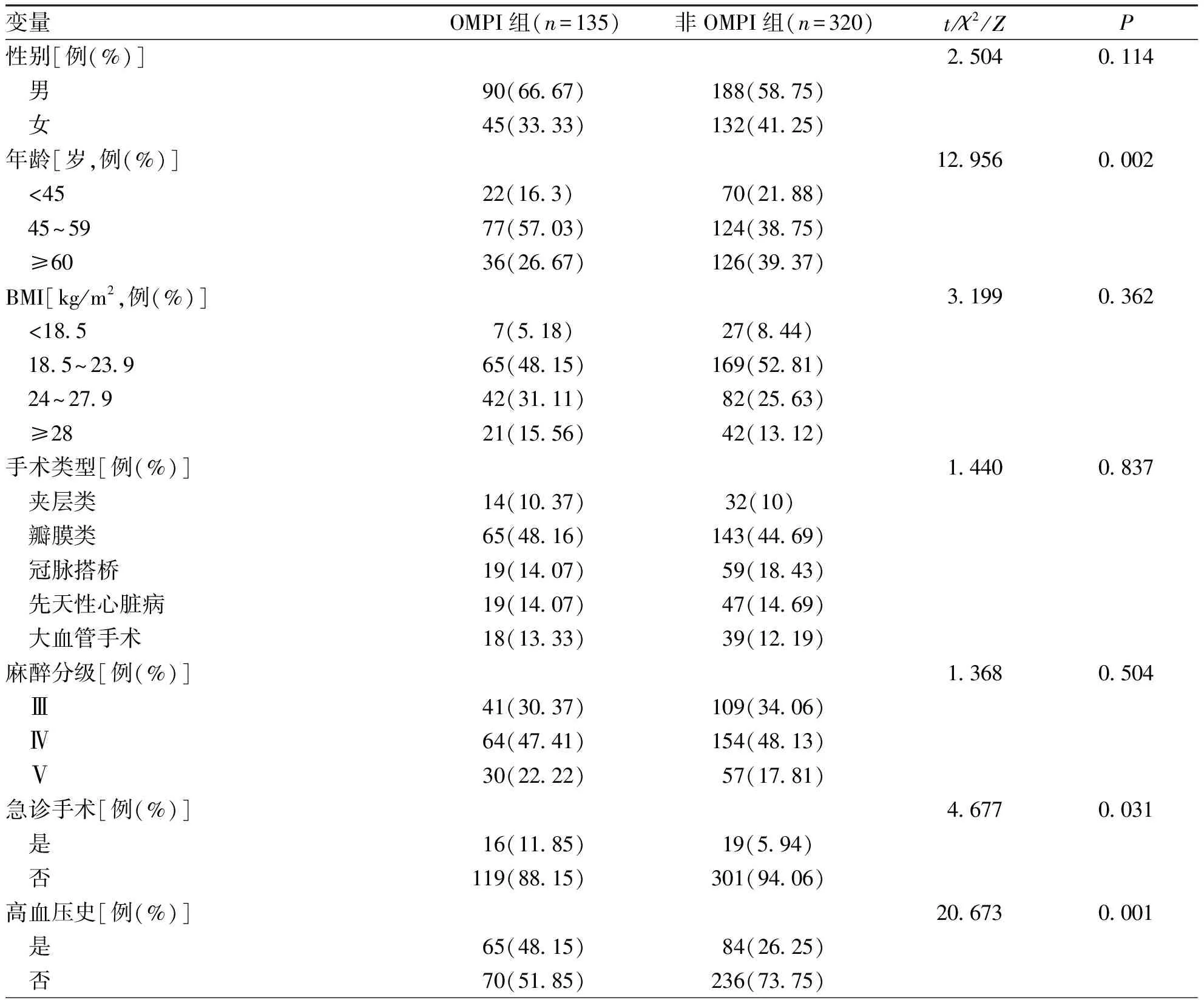
表2 体外循环术后患者OMPI的研究资料比较
2.2 两组患者研究资料比较分析 两组患者在年龄、急诊手术、高血压史、意识障碍、术后使用ECMO、术中最低体温、体外循环时间、手术时长、术中最低动脉压、术中出血量、术中输血量、术前血清白蛋白、术前红细胞压积、术前白细胞、术前血乳酸、术前氧合指数、术前空腹血糖、ICU停留天数差异均有统计学意义(P<0.05,表 2)。
2.3 两组气管导管及固定装置使用情况 两组在气管导管留置时长、气管导管型号差异有统计学意义(P<0.05,表3)。
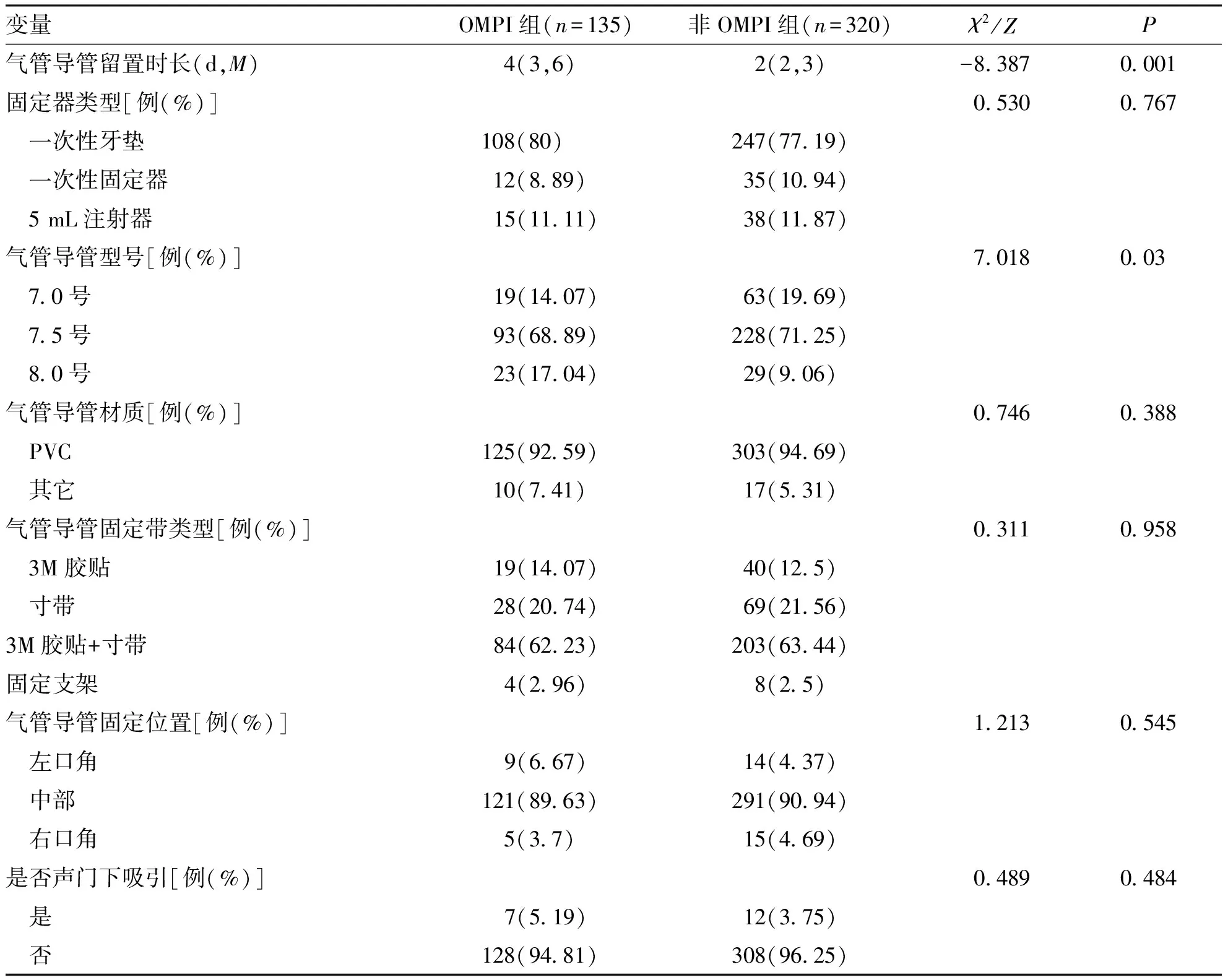
表3 两组气管导管及固定装置使用情况比较
2.4 影响ICU体外循环术患者OMPI发生的多因素分析结果 以是否发生OMPI为因变量(1=发生,0=未发生),两组研究资料结果中P<0.05的变量为自变量构建Logistic回归模型,Logistic回归分析中P<0.05的自变量赋值如下:高血压史(是=1,否=0)、术后使用ECMO(是=1,否=0)、红细胞压积(<40%=00,40%~50%=01,>50%=02)、术前空腹血糖(<7.0 mmol/L=00,7.1~11.0 mmol/L=01,≥11.1 mmol/L=02),术中最低体温原始值带入。结果显示,高血压史(OR=9.529,95%CI:2.685~33.089)、术后使用ECMO(OR=3.251,95%CI:1.380~7.662)、术前红细胞压积(40%~50%,OR=5.755,95%CI:1.703~19.453)、术前空腹血糖(7.1~11.0 mmol/L,OR=2.415,95%CI:1.717~4.975;>11.0 mmol/L,OR=3.401,95%CI:1.571~7.361)是体外循环术后患者发生OMPI的独立危险因素(P<0.05),术中最低体温(OR=0.283,95%CI:0.214~0.374)是保护因素(P<0.05,表4)。
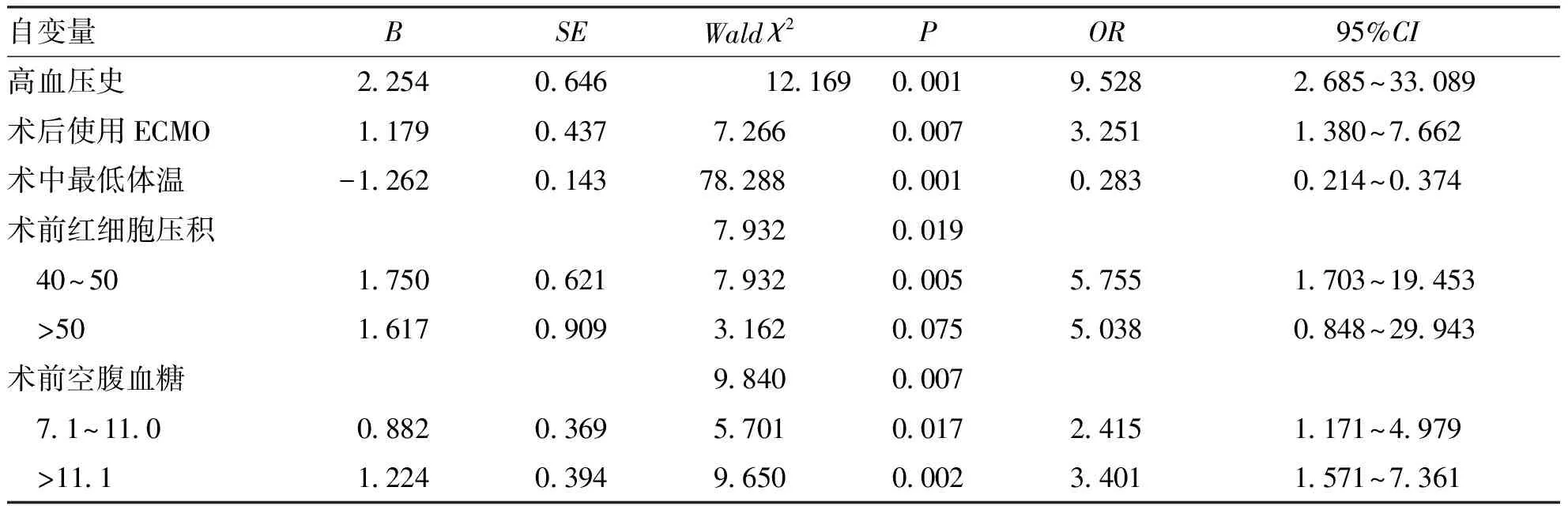
表4 体外循环术后患者OMPI影响因素的Logistic回归分析
2.5 列线图预测模型的构建与验证
2.5.1 应用R软件基于上述因素及所对应的回归系数,建立体外循环术后患者OMPI的预测模型构建列线图(图1)。图中每项变量对应上方标尺刻度(points)得到该变量分值,将各项分值相加汇总,汇总得分对应在发生风险轴上的数值即为体外循环术后患者发生OMPI的发生风险。
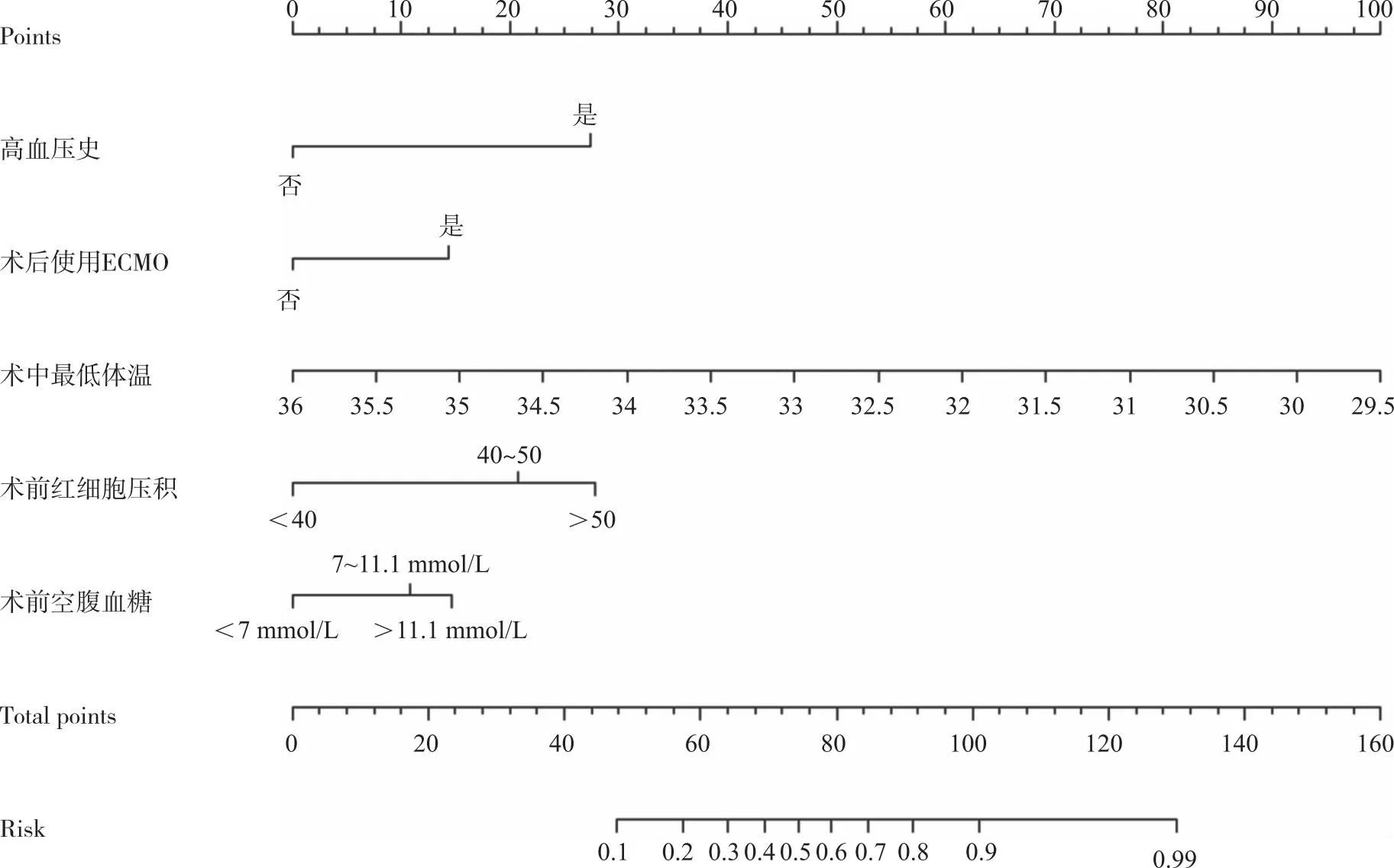
图1 ICU体外循环术后患者发生OMPI的风险列线图
2.5.2 列线图模型的效能分析 用Bootstrap法循环抽样1 000次,对列线图模型进行内部验证,Hosmer-Lemeshow检验结果:χ2=3.848,P=0.871;AUC=0.883,95%的CI为0.849~0.916,灵敏度86.7%,特异度77.2%(图2)模型准确度较好;校准曲线显示,预测结果与实际结果一致性良好(图3)。

图2 ICU体外循环术后患者发生OMPI 的ROC曲线
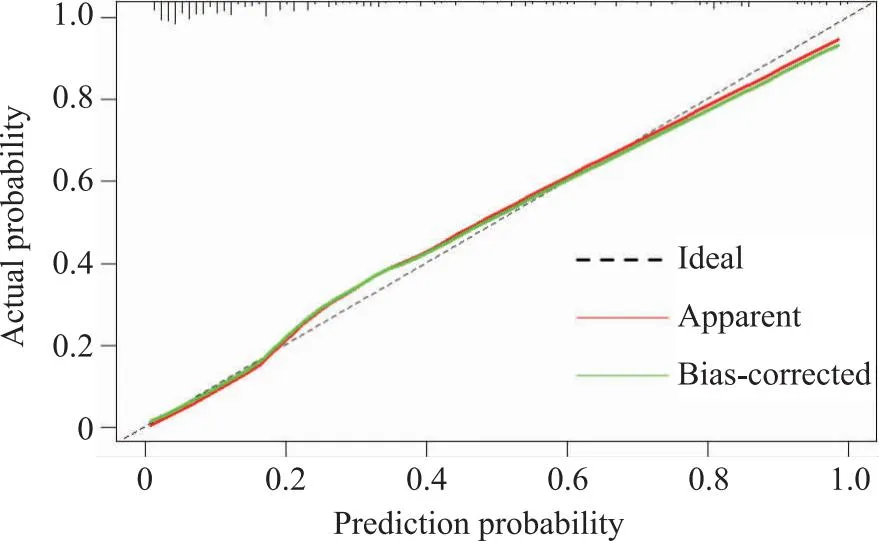
图3 ICU体外循环术后患者发生OMPI的校准曲线
3 讨论
3.1 体外循环术后患者发生OMPI影响因素分析
3.1.1 既往高血压史患者发生OMPI的风险更高 有研究表明,高血压史是围术期患者发生压力性损伤的危险因素[10]。本研究显示,既往高血压史患者发生OMPI是非高血压史患者发生OMPI的9.528倍。研究发现,长期高血压史可使动脉发生粥样硬化,血管纤维化等病理改变,尤以中小动脉的病理变化最为严重,同时也影响着毛细血管对组织的灌注,使皮肤组织弹性降低,导致压力性损伤发生风险增高[11]。而体外循环术后患者会应用大量血管活性药物来维持血流动力学的稳定。因此,对既往高血压史的患者应提高警惕,合理应用血管活性药物,使血压控制在合理范围内,并及时评估患者口腔黏膜组织的完整性以降低体外循环术后患者OMPI的发生风险。
3.1.2 术后ECMO的使用增加了患者OMPI的发生风险 ECMO是对存在心脏骤停、急性严重心功能与呼吸功能衰竭等疾病的患者进行生命支持,维持机体代谢的有效治疗方式[12]。研究发现,ECMO治疗是在短期内由体外循环系统为支持患者呼吸及循环功能的非生理过程,其使用的生理盐水预充管路时,所残留的成分使血液稀释并改变了机体水电解质平衡状态;同时,血液在管路中与非内皮细胞面接触,并在体外循环复杂动力学的影响下导致相关血细胞损伤及异常凝集,纤维蛋白溶解、补体和血液细胞等系统被激活,引起全身炎性反应,并伴随因微血管通透性增加而形成黏膜组织水肿[13-14],进而使患者易发OMPI。因此,对接受ECMO治疗的患者,应制定科学全面的护理计划,并由经验丰富,对ECMO设备和OMPI护理流程熟悉的多学科团队操作实施,以提高护理质量及ECMO的使用效率,从而降低体外循环术后患者OMPI的发生风险。
3.1.3 术中体温越低发生OMPI的风险就越高 体温即机体核心温度,其升高与降低均会引发机体不同程度的病理生理改变;当机体核心温度过低时,便会触发体温调节中枢,引起全身血管收缩,使组织细胞中含氧量降低,影响伤口愈合[15]。然而,心血管手术患者在体外循环开始后,需降低体温来改善机体对缺血缺氧的耐受性,当机体体温降低后,外周血液循环减慢,皮肤组织中血氧含量降低;同时,口腔黏膜在气管导管与固定装置的压迫下进一步加重了黏膜组织缺血缺氧症状,促使了OMPI的发生[16]。因此,定时监测患者术中体温,积极采取保温措施,以及术后及时对患者进行复温是关键举措。同时,及时评估气管导管固定状况,尽量减少气管导管与固定装置对口腔黏膜组织的压迫以降低体外循环术后患者OMPI的发生风险。
3.1.4 术前红细胞压积水平过低增加了体外循环术后患者OMPI发生风险 红细胞压积是指血液中红细胞所占全血的容积比,贫血、大出血等可导致其数值过低;其中,成年男性正常值为40%~50%,女性较男性略低[17]。有研究表明,红细胞压积与口腔上唇部及口角部位的压力性损伤分期呈正相关,也是心血管术后患者压力性损伤的重要预测因素[18]。同时,红细胞压积水平较低也表明患者处于贫血状态,此时患者体内细胞营养状态欠佳,便会减少对周围组织营养物质与氧气供应,延缓了皮肤组织中成纤维细胞的生长增殖,阻碍胶原蛋白形成,促使了压力性损伤的发生[19-20]。因此,应及时监测患者红细胞压积水平,及时补充血容量纠正贫血状态以降低体外循环术后患者OMPI的发生风险。
3.1.5 术前空腹血糖较高增加了体外循环术后患者OMPI的发生风险 空腹血糖升高意味着患者血糖控制不佳。研究发现,血糖异常易导致血管内皮细胞受损,使血管发生一系列病理生理改变,引起管腔狭窄及血栓形成,导致血管收缩失衡,引发机体微循环障碍,造成皮肤黏膜组织营养代谢紊乱与血流灌注减少[21-22],从而增加了体外循环术后患者OMPI发生风险。因此,对于血糖水平较高患者应积极采取干预措施使空腹血糖保持在正常水平之内,对空腹血糖控制效果不佳或应用肠内外营养而致血糖紊乱的患者应积极采取预防性措施以防止OMPI的发生。
3.2 ICU 体外循环术后患者OMPI发生风险列线图预测模型的构建与应用价值 本研究通过Logistic回归筛选出的5个指标所构建的列线图预测模型具有较好的区分度和校准度,可较好的预测体外循环术后患者OMPI的发生风险。结果显示,AUC为0.883表明模型对体外循环术后患者发生OMPI的识别能力较强,区分度较好;Hosmer-Lemeshow检验结果:χ2=3.848,P=0.871,表明构建的列线图预测模型预测体外循环术后患者OMPI发生风险与实际发生风险相近,校准度较好。经内部验证后,图3显示,实际曲线与参考曲线基本吻合,且与理想曲线偏差较小,表明模型能够较好的预测体外循环术后患者发生OMPI的概率。以上结果表明,高血压史、术后使用ECMO、术前红细胞压积低、术前空腹血糖高、术中最低体温预测ICU体外循环术后患者发生OMPI的拟合效果较好。因此,ICU临床护理人员可根据列线图预测模型预测体外循环术后患者OMPI的发生风险,并为此类高危人群提供预测工具。同时,基于此列线图预测模型为体外循环术后患者积极预防OMPI的发生而采取相关措施。如在术前应积极评估患者生理生化状态、血压、空腹血糖、红细胞压积等指标,若出现异常尽早干预,积极纠正。术中加强体温监测并积极采取保温措施,同时观察患者口腔黏膜状态并对气管导管固定松紧适宜,定时更换气管导管固定位置,减轻对口腔黏膜组织的压力与剪切力。术后应注重患者复温,对接受ECMO治疗的患者采用多学科团队以提高护理质量;对使用血管活性药物的患者,及时监测血压水平,保证患者血压水平处于平稳状态;对于糖尿病或血糖紊乱的患者,积极治疗糖尿病并控制血糖;对于贫血患者,积极补充血容量,改善组织灌注,加强营养,提高免疫力促进创口愈合,减少并发症的发生,从而降低体外循环术后患者OMPI发生风险。
3.3 本研究局限性 本研究为单中心研究,样本量较小,虽内部验证预测效果较好,但未进行外部验证。其次,本研究未纳入18岁以下的人群进行预测模型的构建,对于18岁以下的体外循环术后患者OMPI的预测效果欠佳。因此,应联合不同地域进行多中心大样本量开展研究,并进行内外部交叉验证以及纳入更多人群,构建预测效果更好的列线图模型。
综上所述,本研究基于以上 5项影响因素,构建的体外循环术后患者OMPI的风险列线图预测模型具有较高的风险预测能力,对临床具有重要的实际意义,可为ICU护理人员预防体外循环术后患者发生OMPI提供参考依据。

