不同年龄比格犬红细胞压积、生理脆性的测定
杜志国,张廷荣,宋俊霖,黄 凯,王 森,张丽萍,温奇凤,项露娟,郭 颖,尹燕博
(1.青岛农业大学动物医学院,山东 青岛 266109;2.青岛农业大学动物科技学院,山东 青岛 266109;3.青岛农业大学中心实验室,山东 青岛 266200;4.青岛博隆实验动物有限公司,山东 青岛 266200;5.沈阳军区总医院输血科 ,辽宁 沈阳 110000)
比格犬被广泛应用于医学、生物学、病理学、肿瘤学、免疫学、药理学、生物化学等生命科学领域[1]。目前实验动物研究人员已对比格犬的能量、蛋白需求[2-3],主要器官系数[4],心电图[5-6]等基础数据做了详细测定,但对比格犬红细胞压积、脆性的报道较少。隋丽华、王冬平等对8月龄以下的比格犬的红细胞压积做了详细分析[7-8]。到目前为止,国内尚未见对15月龄以上的比格犬的红细胞压积、脆性进行测定的报道。本次测定选取不同年龄段健康比格犬,对红细胞压积、脆性的数值进行准确检测,并分析其变化规律。
1 材料与方法
1.1材料
1.1.1实验动物 3月龄、6月龄、8月龄、1 ~8 岁龄健康比格犬(Covance中体型)120只,3月龄组20只,其余每个年龄组10只,体重相近,雌雄各半,均由青岛博隆实验动物有限公司提供。根据生长阶段分为幼年犬(3月龄)、育成犬(6~8月龄)、成年犬(1~6岁龄)、老年犬(7~8岁龄)4组。
1.1.2仪器与试剂 EDTA-K2抗凝管、肝素钠抗凝管,山东天爱医疗器械有限公司;Junior Vet 5血细胞分析仪,兰桥康泰医学科技有限公司;318C+酶标仪,上海沛欧分析仪器有限公司;细胞培养板,Costar公司;自配置梯度盐水。
1.2方法
1.2.1配置梯度盐水 盐水梯度见表1。
1.2.2样品采集 每只比格犬在相同时间段于前肢内侧静脉处采集血液,采集4 mL分别放入两种抗凝管,各2 mL,均在6 h内处理样品。
1.2.3样品的测定 将EDTA-K2抗凝管内的血液轻轻混匀,利用血细胞分析仪测定红细胞压积;将各个梯度的盐水分别依次加入5 mL离心管中,每管2.5 mL,并将生理盐水与蒸馏水各2.5 mL分别加入额外的两个5 mL离心管中做阴性对照与阳性对照,每组均设阴性对照与阳性对照,然后将肝素钠抗凝管内的血液轻轻混匀,向离心管中依次加入50 μL血液,轻轻混匀。在室温下静置1 h后,用移液枪小心的吸取每个离心管液面的液体100 μL,加入细胞培养板中,放入酶标仪总测定在570 nm波长下的吸光度值[9]。将各孔中液体在570 nm时的吸光度值(OD值)进行记录。液体中血红蛋白浓度越高,OD值越大,当红细胞完全溶解时,梯度盐水间OD值趋于稳定并近似于阳性对照。OD值开始升高时为开始溶血,其NaCl浓度为最小抵抗值,OD值趋于稳定并近似于阳性对照时为完全溶血,其最高NaCl浓度为最大抵抗值,记录最小抵抗值和最大抵抗值的盐水浓度。

表1 盐水梯度
1.2.4统计分析 采用 SPSS22软件进行统计分析。
2 结果
2.1红细胞压积结果分析 比格犬的红细胞压积随着年龄的增长,呈现先增长,再降低的情况;但不同性别比格犬的红细胞压积变化又存在一定差异,公犬的红细胞压积在4岁前随年龄逐渐上升,于4~6岁时达到最大值并呈现稳定状态,随后于7岁时降低;母犬的红细胞压积在5岁前随年龄逐步上升,于5岁时达到最大值,随后下降(见中插彩版图1)。
将所有比格犬按生长阶段、性别分组,分别对相应分组犬的红细胞压积进行独立样本t检验和单因素方差分析(表3)。结果显示,成年犬红细胞压积分别大于幼年犬,差异显著(P<0.01,F=4.102,df=68)、育成犬,差异显著(P< 0.01,F=0.354,df=78)、老年犬,差异显著(P< 0.05,F=0.069,df=78);老年犬红细胞压积分别大于幼年犬,差异显著(P<0.01,F=4.869,df=28)、育成犬,差异显著(P<0.01,F=0.563,df=38);育成犬红细胞压积大于幼年犬,差异显著(P<0.01,F=3.42,df=28);成年公犬红细胞压积大于母犬,差异显著(P<0.05,F=2.047,df=58),其他各组内公、母犬之间红细胞压积无显著差异(表2)。
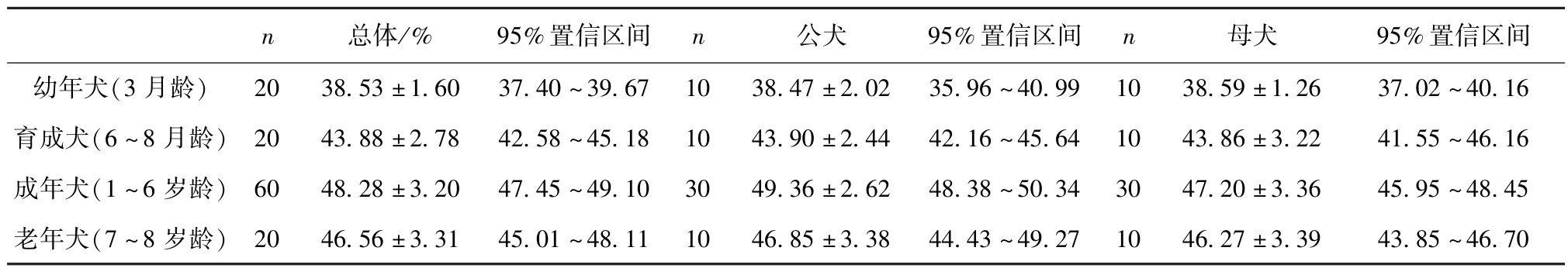
表2 不同生长阶段及性别红细胞压积的参考值
2.2红细胞脆性结果分析 红细胞脆性与年龄之间暂无变化规律可循。将所有比格犬按生长阶段、性别分组,分别对相应分组犬的红细胞脆性进行独立样本t检验和单因素方差分析(表5)。结果显示,红细胞脆性幼年犬与育成犬的最大抵抗值差异显著(P<0.05,F=0.662,df=28),最小抵抗值差异不显著,幼年犬与成年犬最小抵抗值差异显著(P<0.05,F=1.756,df=68),最大抵抗值差异不显著,幼年犬与老年犬最小抵抗值和最大抵抗值差异都不显著;育成犬与成年犬的最大抵抗值与最小抵抗值差异都不显著;育成犬与老年犬的最大抵抗值差异显著(P< 0.05,F=4.857,df=34.299),最小抵抗值差异不显著;成年犬与老年犬的最大抵抗值差异显著(P<0.05,F=0.055,df=78),最小抵抗值差异不显著;成年公、母犬之间红细胞脆性最大抵抗值差异显著(P<0.05,F=0.031,df=58),最小抵抗值差异不显著;其余各组公母犬红细胞脆性差异不显著(表3)。
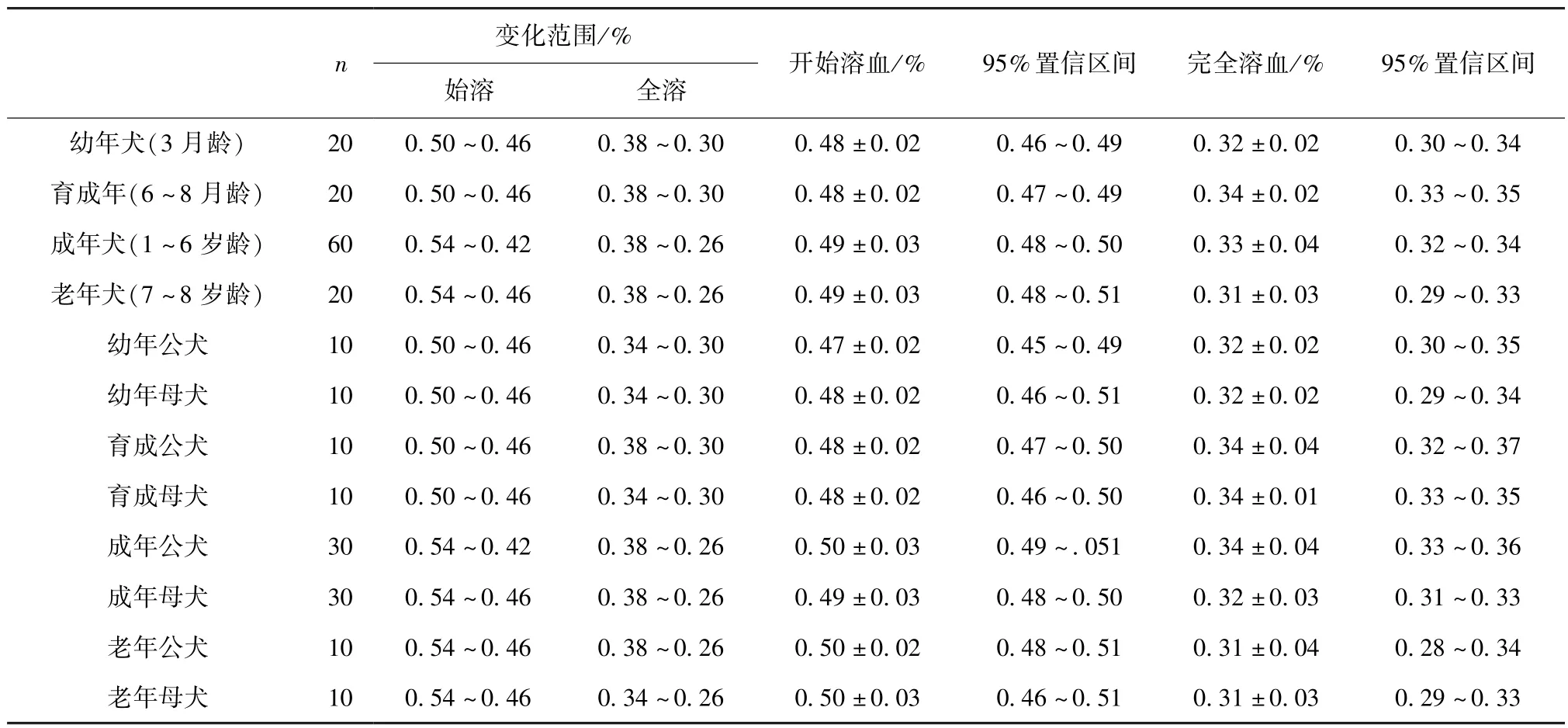
表3 不同生长阶段及性别红细胞脆性的参考值
3 讨论
不同种系、饲养环境、设施的变化会直接影响到比格犬的生理指标,使比格犬的基本生物学数据存在一定的差别[10]。隋丽华、王冬平等人检测某封闭群比格犬红细胞压积的结果显示[7-8],6月龄、8月龄比格犬的红细胞压积分别为34.43±8.16(%)和39.19±14.18(%),4~8月龄的比格犬红细胞压积随着年龄增长逐渐升高;本次测定发现6月龄和8月龄比格犬的红细胞压积分别为42.35±2.80(%)和45.40 ±1.81(%),虽然相似月龄的红细胞压积存在差异,但其变化规律与二人数值的变化规律相符。成年后比格犬红细胞压积的数据较少,暂未发现对比的数值。
成年犬的红细胞压积大于幼年犬、育成犬与老年犬的情况,与人类红细胞压积参考值的变化情况相似[11-13]。母犬的红细胞压积在6岁龄时下降,公犬在7岁龄时下降,应与随着年龄的增长,激素水平、身体机能下降有关。有研究表明,雄激素有刺激红细胞生成素(EPO)的合成与释放的作用,也有改善骨髓对EPO的反应性的作用。EPO是一种物理化学性质较稳定的糖蛋白,与红系祖细胞(CFUE)受体结合后能使其增值分化,并显著减慢CFUE脱氧核糖核酸(DNA)降解速率,抑制CFU-E凋亡,CFU-E能促进红细胞成熟,是红系造血的主要调节因子[13]。红细胞压积在公、母犬幼年时无明显差异,但成年时公犬大于母犬,与相关研究的情况相符。
本次测定不但检测了幼年犬和育成犬的红细胞压积,还检测了成年犬与老年犬的红细胞压积以及各生长阶段的红细胞脆性,并分析了其变化情况,丰富了动物实验的基础数据。
参考文献:

