恶性血液病合并血流感染病原菌分布及发生脓毒症休克危险因素分析
高 陆,彭志元,任娜娜,杨春秀,赵凌苇,任明强,冯永怀
(遵义医科大学附属医院 血液内科,贵州 遵义 563003)
恶性血液病患者由于免疫功能低下、化疗、粒细胞缺乏等因素,是发生血流感染(bloodstream infection,BSI)高危人群,我国住院患者BSI的发生率为5.7%,病死率高达28.7%[1-3]。恶性血液病合并BSI患者有27.3%的发生感染性休克,其中67.2%的休克患者在抗感染、补液及血管活性药物等处理后得以纠正。全国血流感染细菌耐药监测数据显示病原菌分布及耐药有明显地域差异,细菌耐药问题日益严峻[4]。因此,了解本诊疗病区BSI病原菌分布情况,分析发生脓毒症休克的危险因素,对指导临床经验性治疗恶性血液病患者血流感染抗生素选择及早期识别和诊治脓毒症休克有重要意义。
1 对象与方法
1.1 对象 收集纳入研究的2016年1月至2023年8月在遵义医科大学附属医院血液内科治疗的223例恶性血病患者BSI病例资料,根据BSI后是否并发脓毒症休克,发生脓毒症休克25例为病例组,未发生脓毒症休克 198例为对照组。
1.2 纳入及排除标准
1.2.1 纳入标准 (1)符合恶性血液病合并BSI病例;(2)恶性血液病诊断符合张之南主编《血液病学》标准[5];(3)BSI标准符合《医院感染诊断标准(试行)》标准[6];(4)脓毒症休克参考2021年国际脓毒症和脓毒性休克管理指南诊断标准[7]。
1.2.2 排除标准 (1)血液病合并脓毒症休克,但血培养阴性者;(2)同一患者分离的重复菌株;(3)剔除资料不完整病例。
1.2.3 抗休克治疗策略 补液,晶体液 30 mL/kg,应避免液体超负荷;根据患者年龄、脏器功能,及时进行微生物学培养检测,尽早使用广谱强效抗菌药;若充分补液后平均动脉压仍低于65 mmHg,及时使用血管活性药物如去甲肾腺素;同时进行重要脏器功能的保护。
1.2.4 血细菌培养 所涉及血细菌培养适应症、标本的采集时机、病原菌的鉴定、药敏试验等参考血液培养技术用于血流感染诊断临床实践专家共识(2022年版)[8]。
1.3 资料收集及数据处理 收集纳入研究患者的临床资料、血培养结果及药敏等资料。根据恶性血液病合并血流感染住院期间治疗结局,分为脓毒症休克组和非脓毒症休克组,比较组间差异,以是否发生脓毒症休克作为因变量,分析与发生脓毒症休克相关的影响因素。
1.4 统计学分析 运用SPSS 22.0进行统计分析。病原菌分布以构成比表示,采用二分类Logistic进行危险因素分析,单因素分析中P<0.05变量纳入多因素分析回归模型。以P<0.05为差异具有统计学意义。
2 结果
2.1 原发疾病类型及血流感染病原菌分布情况 本研究恶性血液病223例,男性137例,女性86例。平均年龄(46.92±14.64)岁。223例血流感染的患者中,共检出病原菌238株,其中13例患者为同一次血细菌培养检出为两种或两种以上的病原菌感染。基础疾病类型及病原菌分布,其中急性髓系白血病(acute myeloid leukemia,AML)122例,革兰氏阴性杆菌前三位的病原菌中,大肠埃希菌41株,占17.2%,肺炎克雷伯菌15株,占6.3%,铜绿假单胞菌10株,占4.2%;革兰氏阳性球菌以人葡萄球菌和表皮葡萄球菌为主,均占15株,占6.3%。急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)31例,革兰氏阴性杆菌前三位的病原菌中,大肠埃希菌15株,占6.3%,肺炎克雷伯菌4株,占1.6%,铜绿假单胞菌3株,占1.2%;革兰氏阳性球菌以金黄色葡萄球菌为主,2株,占2.1%。恶性淋巴瘤38例(malignant lymphoma,ML),革兰氏阴性杆菌前三位的病原菌中,大肠埃希菌9株,占3.7%,肺炎克雷伯菌4株,占1.6%,铜绿假单胞菌3株,占1.2%;革兰氏阳性球菌以人葡萄球菌和表皮葡萄球菌为主,分别有7株和5株,占2.9%和2.1%。各类恶性血液病合并血流感染主要病原菌分布情况(表1)。
本研究恶性血液病223例,血细菌培养共检出238株菌株,革兰阴性菌142株 (59.70%),其中铜绿假单胞菌(18例)、肺炎克雷伯菌(25例)、大肠埃希菌(75例)。革兰阳性菌93株 (39%),其中金黄色葡萄球菌(9例)、表皮葡萄球菌(22例)、人葡萄球菌(28例),真菌3株 (1.30%),克柔假丝酵母菌、热带念珠菌、近平滑假丝酵母菌各1例。本研究所有223例恶性血液病合并BSI患者病原菌分布及构成(表2)。

表2 恶性血液病合并BSI患者病原菌分布及构成
2.2 伴随不同感染部位病原菌分布情况及转归 223例患者血液病合并BSI,伴随感染灶,伴2个或2个以上感染灶患者30例(13.4%)。伴单一感染灶者,关节腔软组织感染1例(0.4%),泌尿道感染4例(1.7%),皮肤软组织感染8例(3.5%),口腔感染10例(4.5%),肛周感染13例(5.8%),肠道感染21例(9.4%),肺部感染64例(28.6%),无明确感染灶有72例(32.2%)。恶性血液病合并BSI不同感染部位病原菌分布(表3)。223例恶性血液病合并BSI患者发生感染性休克25例,死亡16例(64%),其中耐碳青霉烯类药物的肠杆菌科细菌(CRE)感染7例,耐甲氧西林金黄色葡萄球菌(MRSA)2例。

表3 恶性血液病合并BSI伴随不同感染部位病原菌分布
2.3 药敏试验
2.3.1 主要革兰阴性菌对常用抗菌药物的耐药情况 3种主要革兰氏阴性杆菌对亚胺培南、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦、阿米卡星药物敏感性高。对左氧氟星、头孢曲松、环丙沙星耐药率高。产超广谱β-内酰胺酶的大肠埃希菌31株,肺炎克雷伯杆菌3株。耐碳青霉烯类肠杆菌7株,其中大肠埃希菌4株,肺炎克雷伯均2株,铜绿假单胞菌1株(表4)。
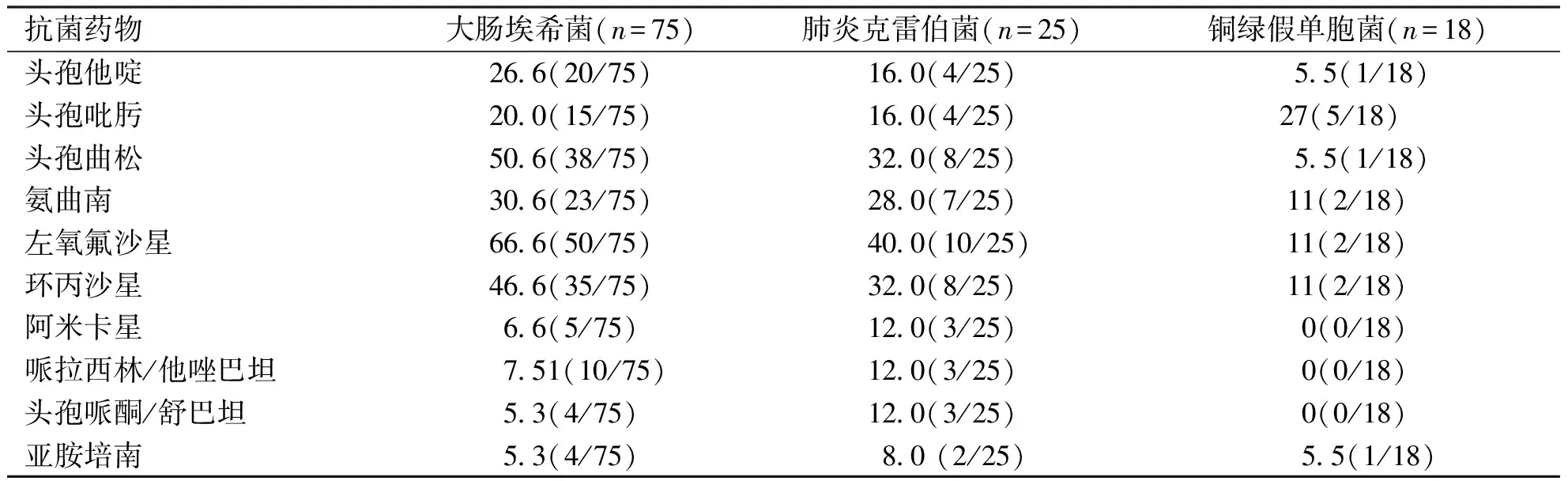
表4 恶性血液病合并BSI革兰阴性菌耐药率(%)
2.3.2 主要革兰阳性菌对常用抗菌药物的耐药情况 3种主要的革兰阳性球菌对青霉素耐药率100%,苯唑西林及环丙沙星耐药率均高。对万古霉素、利奈唑胺、替考拉宁的敏感率较高(表5)。
2.4 危险因素
2.4.1 单因素分析 223例血液病合并血流感染病例中,发生脓毒性休克25例,死亡16例。单因素分析,结果表明,脓毒症休克组和非脓毒症休克组在粒细胞缺乏时间(P<0.001)、是否合理使用抗生素(P=0.007)、是否多重耐药(P=0.017)、是否合并心功能不全(P=0.018)、是否肾功能不全(P<0.001)中存在差异(表6)。

表6 恶性血液病患者血流感染发生脓毒症休克的单因素分析[n(%)]
合理使用抗菌药物定义:指经验性使用的抗生素能覆盖血细菌培养所检出病原菌。
2.4.2 多因素危险因素分析 将单因素分析有意义的相关危险因素进行多因素分析,显示粒细胞缺乏时间≥7 d(OR=3.306,P=0.008,95%CI:1.224~8.927)、不合理使用抗生素(OR=2.612,P=0.004,95%CI:1.187~5.004)、心功能不全(OR=6.291,P=0.008,95%CI:1.930~20.508)、急性肾功能不全(OR=8.419,P=0.002,95%CI:2.198~32.241),见表7。

表7 恶性血液病血流感染发生脓毒症休克的多因素Logistic分析
3 讨论
目前全球BSI的发生率及死亡率呈持续增长的趋势[9]。恶性血液病患者由于免疫功能低下、化疗、造血干细胞移植等治疗相关的免疫抑制[10],更易发生BSI且死亡率更高[11]。张国扬等[12]研究显示242例血液病患者血流感染,血流感染患者死亡42例(17.4%)。
本研究中,223例恶性血液病患者发生BSI,基础疾病主要以急性白血病为主。原发病状态初诊92例,复发42例,完全缓解44例,中心静脉置管133例,粒细胞缺乏时间>7 d 77例。伴随感染灶,以肺部感染为主,其次是肠道感染、肛周感染,与徐春晖等[1]、张国扬等[12]报道一致。
本研究中恶性血液病患者合并BSI血细菌培养病原体分布,主要为革兰阴性菌(59.70%),其次为革兰阳性菌(39%)。其中革兰阴性杆菌以大肠埃希氏菌、肺炎克雷伯菌为主,与孟雪斐、刘德华等研究一致[13-14]。Peirano 等研究表明,产超广谱β-内酰胺酶的菌株在BSI患者中检测率明显增加[15-17],大肠杆菌对头孢他啶、头孢哌酮等三代头孢菌素类药物的耐药率也在不断上升[18]。近年来,CRE感染的发生率逐渐升高。由于CRE感染的有效治疗药物有限,有效的抗感染治疗往往被延迟,因此CRE感染患者的死亡率较高[19]。本研究中革兰氏阴性菌中产超广谱β-内酰胺酶的大肠埃希菌31株,肺炎克雷伯杆菌3株。耐碳青酶烯类肠杆菌7株,其中大肠埃希菌4株,肺炎克雷伯均2株,铜绿假单胞菌1株,7例患者均发生感染性休克,因多器官功能衰竭死亡,与张国扬等[12]报道一致。
本研究3种主要的革兰阳性球菌对青霉素耐药率100%,苯唑西林及环丙沙星耐药率均高。对替考拉宁、万古霉素、利奈唑胺的敏感率较高。革兰阳性菌病原菌分布及耐药与曹文彬、刘维佳等[20-21]研究报道一致。本研究223例恶性血液病BSI患者发生脓毒症休克25例,经积极补液、抗感染、血管活性药物抗休克治疗,死亡16例(64%),血流感染患者发生脓毒症休克死亡率明显上升。
本研究中多因素分析结果显示粒细胞缺乏期≥7 d(OR=3.306,P= 0.008)、不合理使用抗生素(OR=2.612,P= 0.004)、心功能不全(OR=6.291,P= 0.008)、肾功能不全(OR=8.419,P= 0.002)是恶性血液病BSI发生脓毒症休克的不良危险因素。与张国扬等[12]报道一致。有研究表明,粒细胞缺乏期≥7 d的恶性血液病患者合并BSI发生脓毒症休克的独立危险因素[12],与本研究结果一致。由于恶性血液病患者接受化疗或者造血干细胞移植,导致免疫和造血系统受到受损,粒细胞缺乏和免疫功能低下,从而导致患者发生致命感染风险高。经验性使用抗生素未能覆盖可能引起严重并发症和致命性感染的病原菌,导致病情进展,发生脓毒症休克,这类不合理使用抗生素策略是发生脓毒症休克的高危因素[22]。肾功能不全是影响恶性血液病合并BSI发生脓毒症休克的不良危险因素,BSI时肾脏血流灌注不足,导致肾微循环系统及肾小管细胞功能障碍,在急性肾功能损伤的发病机制有重要作用[23]。积极有效的液体复苏、及时进行微生物学培养检测,合理使用抗菌药物,尽早应用血管活性药物、保护心、肺、肾等重要脏器功能、倡导个性化的1 h集束化治疗策略,减少血流感染死亡风险[24-25]。
本研究的局限性恶性血液病合并BSI,发生脓毒症休克患者死亡率高达16例(64%),可能与部分BSI发生脓毒症休克未得到充分治疗,如因经济原因放弃治疗有关。多因素分析中多重耐药等无统计学意义,可能与本研究样本量较少有关,需扩大样本量进一步验证。
因此,恶性血液病合并BSI病原菌以革兰氏阴性菌为主,缩短粒缺期、尽早合理使用抗菌药、改善心功能不全、肾功能不全,是减少恶性血液病BIS患者发生脓毒症休克的措施。

