人参总皂苷对博莱霉素诱导肺纤维化小鼠IL-6及IL-1β的影响
肖 红,罗 婷,凌 虹,杨会云,邓 江,2
(1.遵义医科大学 基础药理教育部重点实验室暨特色民族药教育部国际合作联合实验室,贵州省基础药理重点实验室,药学院药理学教研室,贵州 遵义 563006;2.中国药理学会—贵州省药理学联合实验室,贵州 遵义 563006)
肺纤维化(pulmonary fibrosis,PF)是一种慢性、进行性、不可逆肺部疾病的病理表现,经诊断后中位生存期为2~5年,严重威胁人类生命健康[1]。多种致病因素如环境污染、病毒感染或抗肿瘤药等可引起肺泡上皮细胞持续损伤,细胞凋亡,免疫细胞大量浸润,激活白细胞介素-1β(interleukin-1β,IL-1β)和白细胞介素-6(interleukin-6,IL-6)等炎症因子异常表达,诱发肺组织炎症反应,进而促进病理性纤维化的发生发展[2-3]。人参总皂苷为五加科植物人参的主要有效活性成分,具抗氧化、抗炎等作用,可抑制细胞凋亡,减少炎症反应[4],而炎症反应在肺纤维化主要病理过程中发挥重要作用[5]。为探索人参总皂苷是否通过调控炎症因子IL-6及IL-1β而抑制肺纤维化的病程进展,本研究拟建立博莱霉素诱导的小鼠肺纤维化模型,探讨人参总皂苷对博莱霉素诱导的肺纤维化小鼠肺组织中促炎细胞因子IL-6及IL-1β的影响。
1 材料与方法
1.1 试剂、药品与仪器 人参总皂苷(total ginsenosides,TG),北京恒康益百科技有限公司生产,批号:20210601,纯度80%;注射用盐酸博莱霉素(bleomycin hydrochloride for injection,BLM),翰晖制药有限公司生产,批号:21150111;吡菲尼酮(pirfenidone,PFD),北京康蒂尼药业股份有限公司生产,批号:国药准字H20133376。Ⅰ型胶原蛋白(type-I collagen,COL Ⅰ),HUABIO,货号:ET1609-68;IL-1β(interleukin-1β,IL-1β),MCE,货号:HY-FS-230818011;IL-6(interleukin-6,IL-6),proteintech,货号:21865-1-AP以及β-actin,proteintech,货号:66009-1-IG;Olympus正置显微镜,日本Olympus公司,型号:BX43+DP2b;Chemi Doc化学发光凝胶成像系统,美国BIO-RAD公司,型号:Chemi Doc。
1.2 实验动物及分组给药 购自湖南斯莱克景达实验动物有限公司(许可证编号:SCXK(湘)2019-0004)的60只SPF级雄性昆明小鼠,平均体重28~30 g,周龄6~7周,分笼于SPF级动物房,使用辐照灭菌实验鼠粮饲养,进食、饮水自由。小鼠适应环境1周后,随机分为6组,即正常组(Control),模型组(BLM,气管内滴注BLM 3 mg/kg),人参总皂苷40、80、160 mg/kg给药组(BLM+TG40,BLM+TG80,BLM+TG160),吡菲尼酮阳性药组(PFD),各组气管内滴注液体容量为0.02 mL/10 g,每组10只。在造模次日灌胃给药(i.g),正常组与模型对照组均以同体积蒸馏水灌胃,连续给药14 d。
1.3 肺纤维化小鼠模型制备 将小鼠以2%戊巴比妥钠(40 mg/kg)进行腹腔注射麻醉后取俯卧位,固定小鼠上门齿打开口腔,以小鼠压舌板压住舌根处,将博莱霉素(3 mg/kg)沿口腔上颚中线经主支气管滴注入肺,滴注后立即使小鼠身体竖立并沿纵轴旋转,以使药液均匀分布于双肺中,观察并监测生命体征。待小鼠清醒后送SPF级观察室常规饲养。所有实验操作与饲养过程均遵守实验动物管理与动物伦理保护相关准则,伦理号:伦审(2018)2-120。
1.4 小鼠肺组织病理形态学观察 取材观察小鼠肺组织大体形态的变化,随后取小鼠左肺组织以10%甲醛溶液(PBS∶甲醛=9∶1)常温固定48 h,经梯度酒精脱水、石蜡包埋切片备用,分别进行HE以及Masson染色。根据Szapiel及Ashcroft评分标准表(表1、2),评估肺泡结构的完整性、炎症细胞浸润以及纤维化的严重程度[6-7]。

表1 Szapiel评分标准
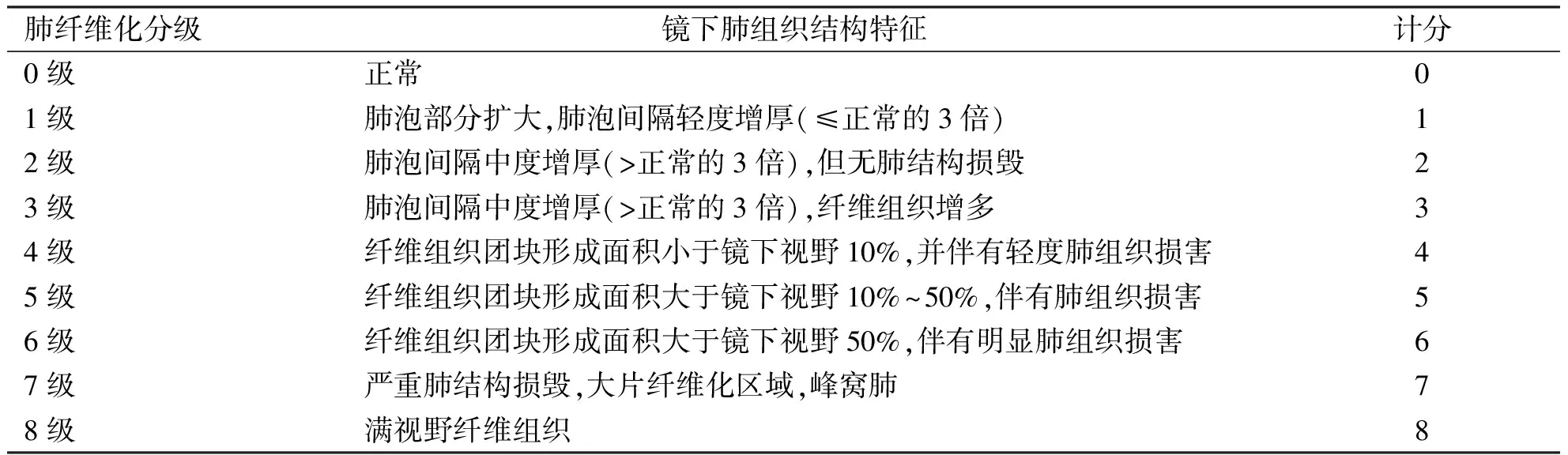
表2 Ashcroft评分标准
1.5 小鼠肺组织中COLⅠ以及炎症因子IL-6及IL-1β蛋白水平测定 使用标准SDS-聚丙烯酰胺凝胶电泳法进行蛋白质印迹[8],从肺组织中提取总蛋白在10%SDS-PAGE凝胶上分离后,并通过电泳盒半干转到PVDF膜上,然后与以下一抗:Collagen Ⅰ(HUABIO,货号ET1609-68,稀释度1∶2 000);IL-1β(MCE,货号HY-FS-2308180118,稀释度1∶1 000);IL-6(proteintech,货号21865-1-AP,稀释度1∶1 000)于4度摇床孵育过夜(20 h),并与蛋白质免疫印迹IgG底物结合。通过Chemi Doc-Touch化学发光成像系统显影并保存,使用Image J软件分析条带的灰度值。

2 结果
2.1 人参总皂苷对肺纤维化小鼠一般情况及肺组织病理形态的影响 口腔内气管单次滴注博莱霉素1周左右,小鼠开始出现活动减少,食欲不振毛发干枯,呼吸短促等症状。给予博莱霉素14 d后取材显示,正常组小鼠肺大体组织颜色红润,模型组小鼠肺大体组织颜色灰暗,可见明显淤血、水肿,TG可显著改善小鼠的一般状态及肺组织大体形态学的变化(图1)。
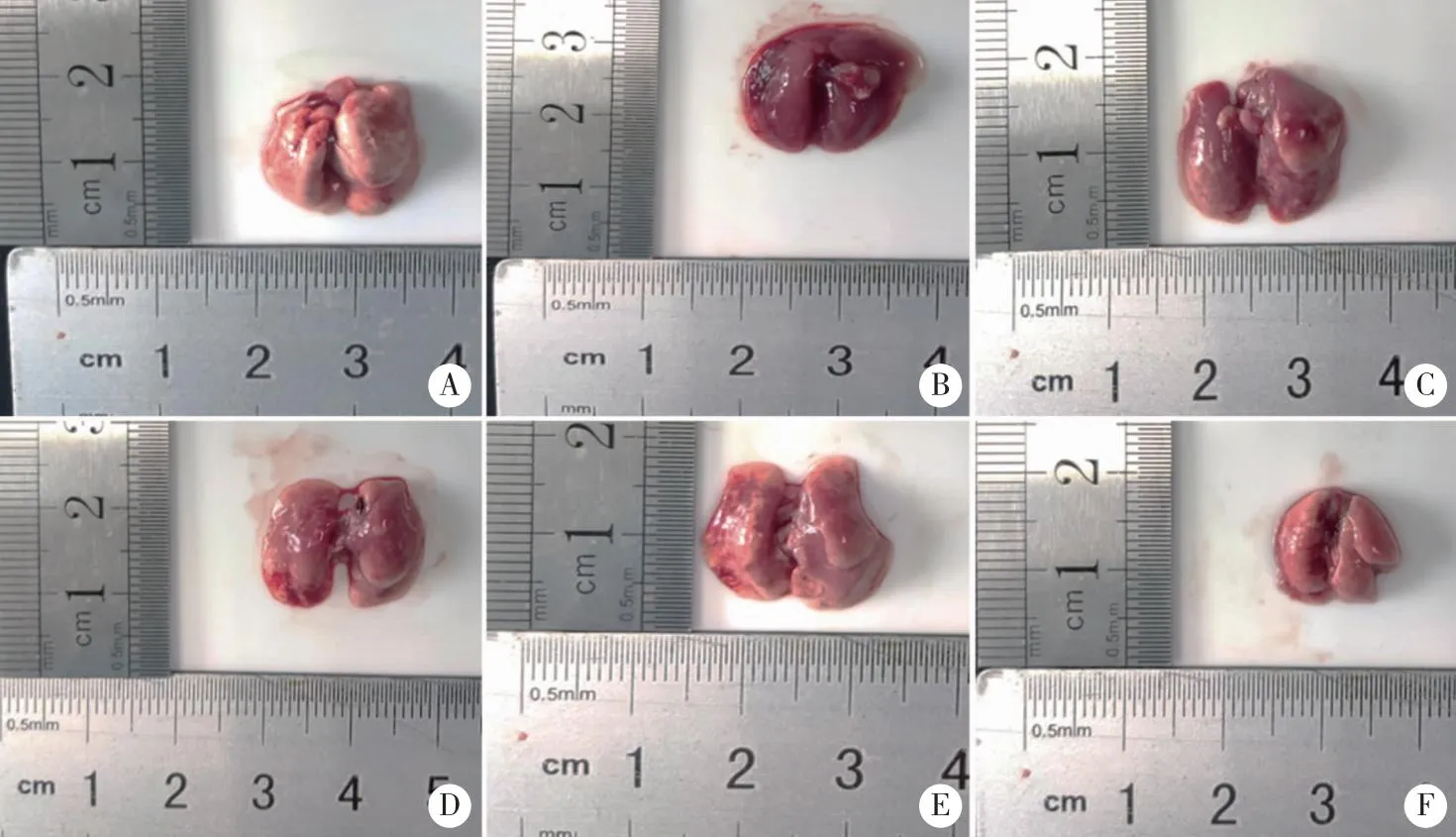
A:Control组;B:BLM组;C:BLM+TG40组;D:BLM+TG80组;E:BLM+TG160组;F:BLM+PFD组。
HE染色结果显示,正常组小鼠肺组织结构连续完整,无明显肺泡炎症细胞浸润和肺组织纤维化。给予博莱霉素14 d后,小鼠肺组织肺泡间隔增厚,肺泡间出现明显水肿,肺组织塌陷,炎症细胞浸润,形成大量纤维组织团块;提示在气管内单次滴注博莱霉素导致了小鼠肺组织的炎症损伤加快肺纤维化进程。并且在给予TG后可显著改善博莱霉素所致的病理组织塌陷,减轻肺水肿(图2)。
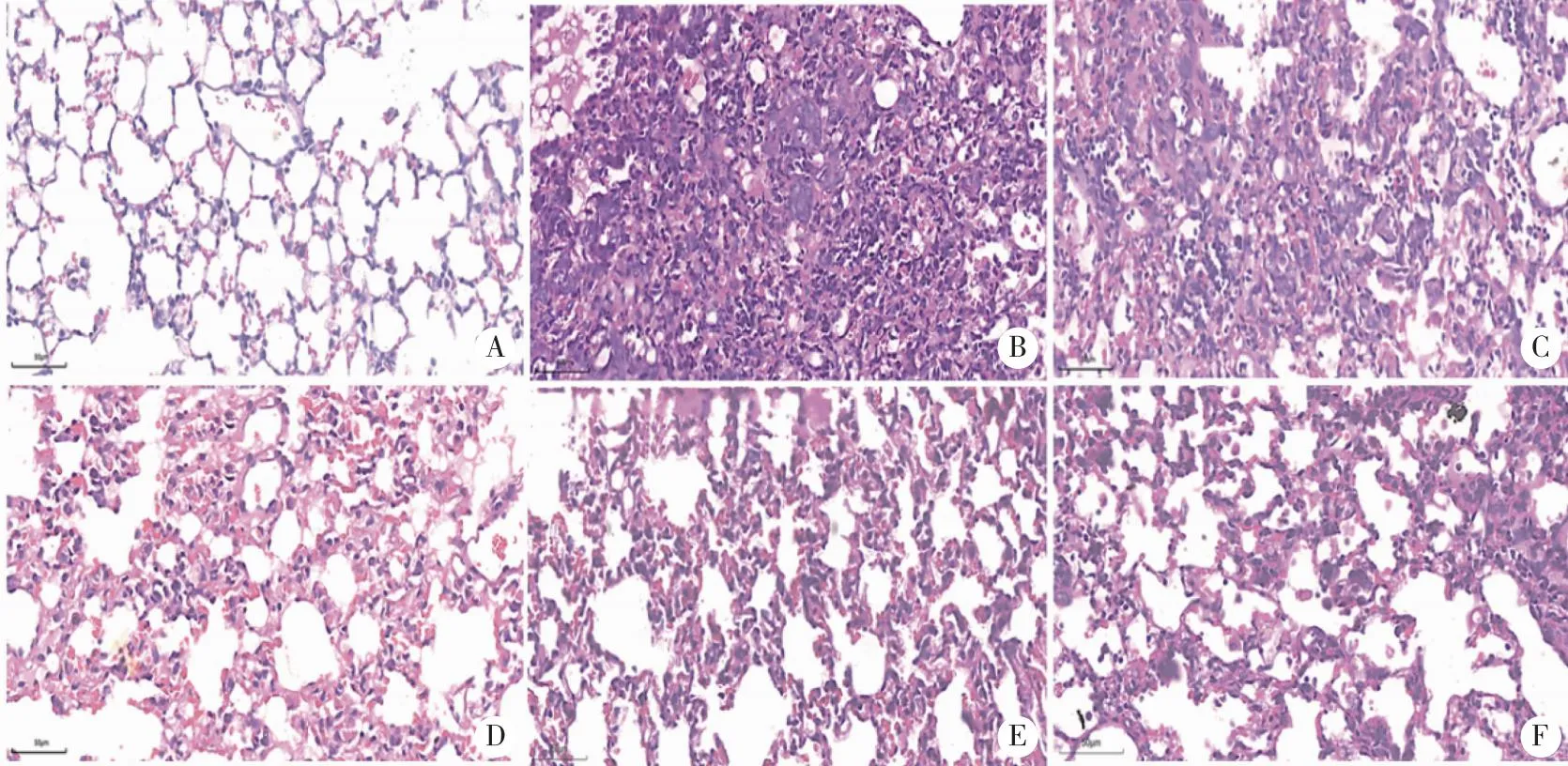
A:Control组;B:BLM组;C:BLM+TG40组;D:BLM+TG80组;E:BLM+TG160组;F:BLM+PFD组,HE,Bar=50 μm,n=6。
在HE染色的基础上根据Ashcroft评分标准以及Szapiel评分标准得出,博莱霉素使小鼠肺组织中Ashcroft评分、Szapiel评分显著增高(P<0.05);且TG显著降低了Ashcroft评分、Szapiel评分(P<0.05),进一步说明了TG可改善博莱霉素所诱导的小鼠肺纤维化(图3)。

组与对照组比较, P<0.05;#:TG组与BLM组比较, P<0.05。
Masson染色结果显示,正常组小鼠肺组织正常,有少量蓝色胶原纤维沉积。给予博莱霉素14 d后,小鼠肺组织中出现大面积蓝色胶原纤维在细胞外基质中沉积,表明博莱霉素导致了小鼠肺组织损伤以及进一步肺纤维化。同时给予TG可显著抑制胶原纤维在小鼠肺组织中大量沉积(图4)。
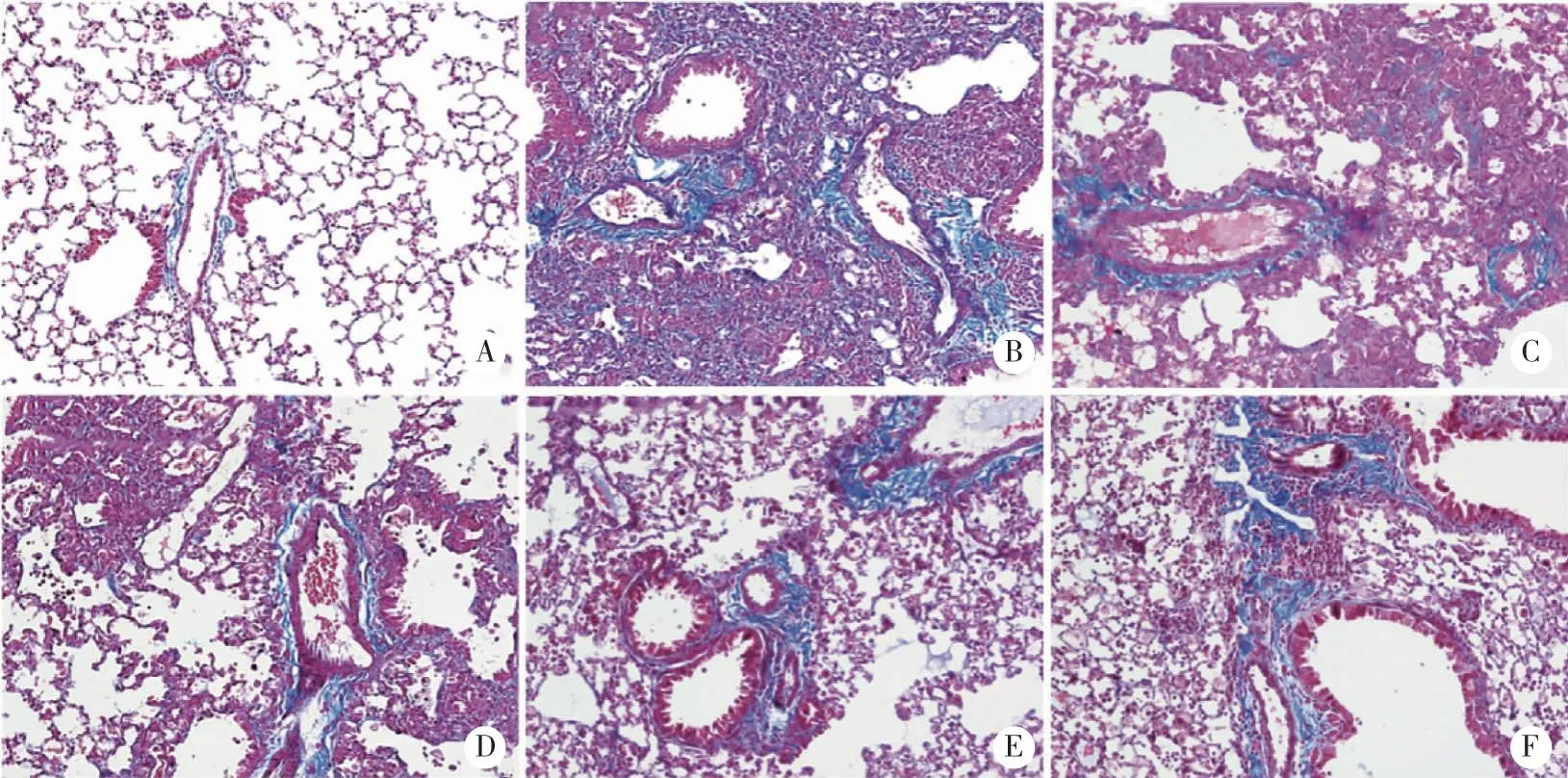
A:Control组;B:BLM组;C:BLM+TG40组;D:BLM+TG80组;E:BLM+TG160组;F:BLM+PFD组;Masson,Bar=50 μm,n=6。
在Masson染色基础上,进一步分析胶原纤维在小鼠肺组织整体中的占比(即胶原容积分数%)得出,博莱霉素可使小鼠肺组织中胶原容积分数显著增高(P<0.05),给予TG后可降低胶原容积分数(P<0.05,图5)。

组与对照组比较, P<0.05;#:TG组与BLM组比较, P<0.05。
2.2 人参总皂苷对博莱霉素诱导的肺纤维化小鼠肺组织中COL Ⅰ蛋白表达水平的影响 为了研究COL Ⅰ在博莱霉素诱导的肺纤维化小鼠体内肺组织中以及在人参总皂苷给药后小鼠肺组织中的变化情况,采用Western blot法检测COL Ⅰ蛋白表达水平的变化,数据分析结果表明,博莱霉素诱导的肺纤维化小鼠肺组织中COL Ⅰ蛋白水平明显增加(P<0.05),人参总皂苷给药14 d后肺纤维化小鼠肺组织中COL Ⅰ显著降低(P<0.05,图6)。

组与对照组比较,P<0.05;#:TG组与BLM组比较, P<0.05。
2.3 人参总皂苷对博莱霉素诱导的肺纤维化小鼠肺组织中促炎细胞因子IL-6及IL-1β的影响 组织炎症反应的发生与IL-6及IL-1β密切相关,从昆明小鼠肺纤维化肺组织大体形态学变化、HE以及Masson染色等病理组织学结果以及Western blot结果显示TG80 mg/kg改善PF的效果显著。故后续研究选择TG80 mg/kg剂量组进一步研究,肺纤维化发展过程中IL-6及IL-1β的变化,在BLM诱导的PF小鼠肺组织中BLM组的炎性介质IL-6及IL-1β蛋白表达水平明显上调(P<0.05),给予TG80 mg/kg后IL-6及IL-1β蛋白表达水平显著下调(P<0.05,图7)。这些研究数据表明,TG80 mg/kg可能通过调节炎性介质IL-6及IL-1β来改善BLM诱导的小鼠PF。

组与对照组比较, P<0.05;#:TG组与BLM组比较, P<0.05。
3 讨论
促炎细胞因子白细胞介素6(IL-6)和白介素1β(IL-1β)与肺纤维化的发生与发展密切相关,可以促进炎症反应,诱导肌成纤维细胞活性增加而引起肺纤维化[9-11]。IL-6可由多个器官系统内的免疫和非免疫细胞产生,并反作用于这些细胞,并且它的过度合成可导致急性全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)[12-13]。在各种潜在免疫疾病(自身免疫性疾病和炎症性疾病)中,IL-6蛋白表达水平显著升高,加速疾病的进程[12,14]。IL-1β被认为是急性炎症反应的引发剂,参与肺纤维化的发展并引发相关的炎症反应[15]。此外,IL-1β可增强IL-6和TNF-α的表达,破坏肺泡结构,导致胶原沉积和肺成纤维细胞增加[19-20]。博莱霉素诱导的小鼠肺纤维化模型是最常用的、最经典的模型之一,并且它可在小鼠体内诱发肺组织急性炎症,3~5 d后达到峰值,随后成纤维细胞增殖、胶原沉积和肺纤维化[16-18]。值得注意的是,在本研究结果中,博莱霉素诱导的肺纤维化小鼠体内IL-6和IL-1β蛋白水平明显上调,出现大量炎症反应及纤维化反应。胶原蛋白纤维化标志物之一,在肺纤维化中起着关键作用[21]。胶原蛋白(如COL Ⅰ)的异常沉积可导致细胞外基质异常沉积,损害小鼠肺功能,加重肺纤维化发展进程[22]。为了验证博莱霉素是否可以通过诱导COL Ⅰ的表达而导致肺纤维化的形成,本研究以6~7周龄SPF级雄性昆明小鼠为研究对象,经口腔内气管单次滴注博莱霉素(3 mg/kg)14 d后,在HE染色以及Masson染色的组织病理形态结果显示,大量炎症细胞浸润,肺部炎症反应严重,并表现出肺纤维化典型的组织学变化:肺组织水肿,肺泡间隔增厚,肺泡壁塌陷,肺组织结构严重破坏等;肺纤维化小鼠组织学显著改变导致肺组织纤维化评分、肺泡炎评分以及胶原容积分数增加。在本实验结果中,博莱霉素诱导肺纤维化小鼠肺组织中蓝色胶原纤维沉积显著增多以及COL Ⅰ蛋白水平明显增多,并且肺组织结构损伤,导致肺功能障碍,使肺纤维化小鼠出现明显的呼吸急促以及呼吸困难导致小鼠食欲不振及活动量减少等情况。验证了博莱霉素可以通过诱导COL Ⅰ的表达而形成肺纤维化。人参总皂苷是中国传统中药五加科植物人参的主要有效成分,具有抗肿瘤、抗炎、抗氧化等活性[23]。在本研究发现,在博莱霉素诱导的肺纤维化小鼠中给予人参总皂苷不仅可以改善了肺纤维化小鼠呼吸困难、蜷缩、发抖,毛色灰暗干枯、以及进食饮水减少和活动量减少等情况。而且从小鼠肺组织病理切片显示给予人参总皂苷14 d后减轻了胶原纤维沉积以及肺组织结构损伤,蛋白印迹结果也发现IL-6、IL-1β以及COL Ⅰ的蛋白表达水平降低。因此,人参总皂苷可通过降低COL Ⅰ的蛋白表达水平,下调促炎症因子IL-1β和IL-6而改善博莱霉素诱导的肺纤维化进程,但其调控机制有待进一步深入研究。

