黄海中部近岸产卵场小黄鱼卵子的自然死亡特征❋
曲宁新,叶振江❋❋,张文超,王艺翰,张艺笑,蒋慧东,张新贵,卢志光
(1. 中国海洋大学水产学院,山东 青岛 266003; 2. 日照山海天旅游度假区海洋发展局,山东 日照 276827)
海洋鱼类作为人类食品供给的重要资源,其早期生活史阶段对环境变化较为敏感,卵与仔鱼存活情况可造成补充量显著的年际波动,是影响资源变动的关键因素[1-3]。鱼类早期补充失败或不足会影响种群亲体数量,种群在卵、仔鱼、稚鱼等不同早期发育阶段数量的过度衰减甚至缺失都会导致成鱼数量减少,渔获产量降低,这就需要其在后续成鱼阶段用更高的成活率进行补偿,以维持种群年龄和长度组成结构的平衡[4-5]。鱼类自然死亡可代表鱼种在外界干扰下种群数量的变化,鱼卵、仔稚鱼、幼鱼死亡率的变动对种群数量的影响程度远高于成鱼阶段[6]。量化分析灾难性事件发生后鱼类早期生命阶段死亡对种群生物量和渔获量变动的影响,估计影响的持续时间,亦是衡量种群恢复力的重要基础[7]。影响种群数量变动的机制相当复杂,确定这些机制如何受到气候和捕捞的影响一直是支持可持续渔业管理的主要研究目标,也是基于生态系统的渔业管理的关键组成部分,这尤其适用于探究物理环境对早期生活史阶段存活、死亡以及输运过程的影响,以及仔稚鱼与其食物来源是否匹配[8]。因此,评估和预测鱼类早期生活史阶段死亡,评估经济鱼类种群补充即将进入渔业的情况,这对渔业管理来说至关重要。
国内外对海洋鱼类早期发育阶段的自然死亡已有了一些研究报道。Iseki等在东海将调查样品中发育异常和物理损伤的鳀鱼(Engraulisjaponicus)鱼卵定性为死亡,并根据不同水层鱼卵死亡的比例,探索了鱼卵死亡后沉降的特征[9];万瑞景等利用发育畸形的卵子数量占总样品数量的比例研究了黄渤海鳀鱼卵子的自然死亡特征[10];Kim等假设鱼卵阶段和卵黄囊期仔鱼阶段的死亡率相似,基于每日产卵量和鱼卵数据构建了朝鲜半岛海域鳀鱼卵死亡率曲线,计算得到鱼卵春季死亡率为0.33~1.23 d-1,夏季死亡率为0.78~1.69 d-1[11];李日嵩等利用物理-生物耦合输运模型探索了卵仔鱼输运过程对东海日本鲭(Scomberjaponicus)个体存活的影响[12]。对于鱼卵死亡的影响机制,研究认为内源性遗传因素(如卵黄囊质量、油球质量和卵子大小)对卵子死亡存在显著的影响[13],同时环境因素和捕食则是最重要的2个外源性原因[14-17]。目前国内关于鱼类早期发育阶段个体死亡的研究主要基于室内受控试验下观察等温度、盐度、酸碱度、污染物等因子对鱼卵和仔鱼的发育、生长和存活的影响[18-20],但对近海天然产卵生境经济鱼类的鱼卵死亡特性、变动机制及对资源动态的影响机理尚不清晰,渔业保护与管理缺乏科学基础。
小黄鱼(Larimichthyspolyactis)是石首鱼科近海暖温性底层重要经济鱼类,广泛分布于中国东海、黄海和渤海以及朝鲜半岛西岸海域,近年在中国年渔获量可高达28万t[21],在中国海洋渔业中占有重要的经济地位。黄海中部近岸水域是影响黄海渔业资源的重要产卵场,对黄海鱼类种群的补充作用非常重要[22]。本文利用2013—2018年春季在黄海中部近海开展鱼类浮游生物综合调查获得的数据,基于马尔科夫链构建鱼类卵子死亡评估模型[23],分析黄海小黄鱼卵子自然死亡情况,旨在探索小黄鱼卵子自然死亡的特征及变动机制,深入了解环境因素对小黄鱼早期补充过程的影响,为小黄鱼资源动态研究提供科学依据,为中国海洋渔业资源的科学管理与利用提供科学支撑。
1 材料与方法
1.1 数据来源
研究数据来自在黄海中部近岸海域进行的鱼类浮游生物调查,调查时间为2013年5—6月、2015年5月、2017年4—6月和2018年5—6月,共计11个航次。为保持分析空间范围一致,提高数据统计分析的可靠性,根据调查区域与小黄鱼鱼卵分布特征,将研究区域限定于34.4°N—35.6°N、119°E—121°E,水深20 m以浅区域,研究海域及站位分布详见表1、图1。海上调查系租用渔船进行,其中2013年为37.28~134.23 kW渔船,2015和2017年为193.88 kW渔船,2018年为298.28 kW马力渔船。利用水平拖网方式采集鱼卵,2013年采用浅水Ⅰ型网(网口直径0.5 m,网目0.505 mm),后续年份使用大型浮游生物网(网口直径0.8 m,网目0.505 mm),每站位水平拖网10 min,拖网船速2~3 kn,网口皆附流量计(型号:Hydrobios 438110)以观测滤水量,对鱼卵数量进行标准化(单位:ind./100 m3)。样品采集后立即保存在5%的甲醛/海水缓冲溶液中,调查结束后运回到实验室,基于形态学方法进行鱼卵种类和发育分期鉴定[15]。温度、盐度、水深等产卵场环境数据来自各站位调查时同步进行的CTD环境观测。分期鉴定标准采用Bunn等[15]的方法,将硬骨鱼类胚胎发育分成6个时期(见图2):①Ⅰa期:从鱼卵受精开始,经由连续分裂产生一个细胞团;②Ⅰb期:胚盘持续发育,形成一个环状(类似戒指),直到首个原肠胚出现的迹象为止;③Ⅱ期:从原肠胚出现开始至胚孔关闭,最终胚体长至绕卵黄囊半周;④Ⅲ期:尾芽生长超出卵黄囊,结束时胚体围卵黄囊3/4周,该时期眼开始发育,胚体出现可见色素斑;⑤Ⅳ期:尾巴持续生长直至胚体包住整个卵黄囊,胚体首尾相连;⑥Ⅴ期:尾部继续生长而超过头部,眼上开始出现色素,胚胎孵化。
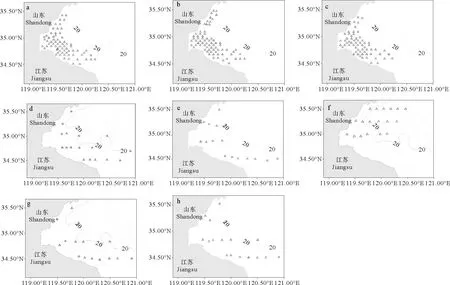
(a—c: 2013年5—6月; d: 2015年5月; e: 2017年4月、2018年5月; f: 2017年5月上旬; g: 2017年5月下旬; h: 2017年6月、2018年6月。 a—c: May—June,2013; d: May,2015; e: April,2017 and May,2018; f: Early May,2017; g: Late May,2017; h: June,2017 and June,2018.)图1 调查航次与站位分布Fig.1 Survey cruises and stations distribution
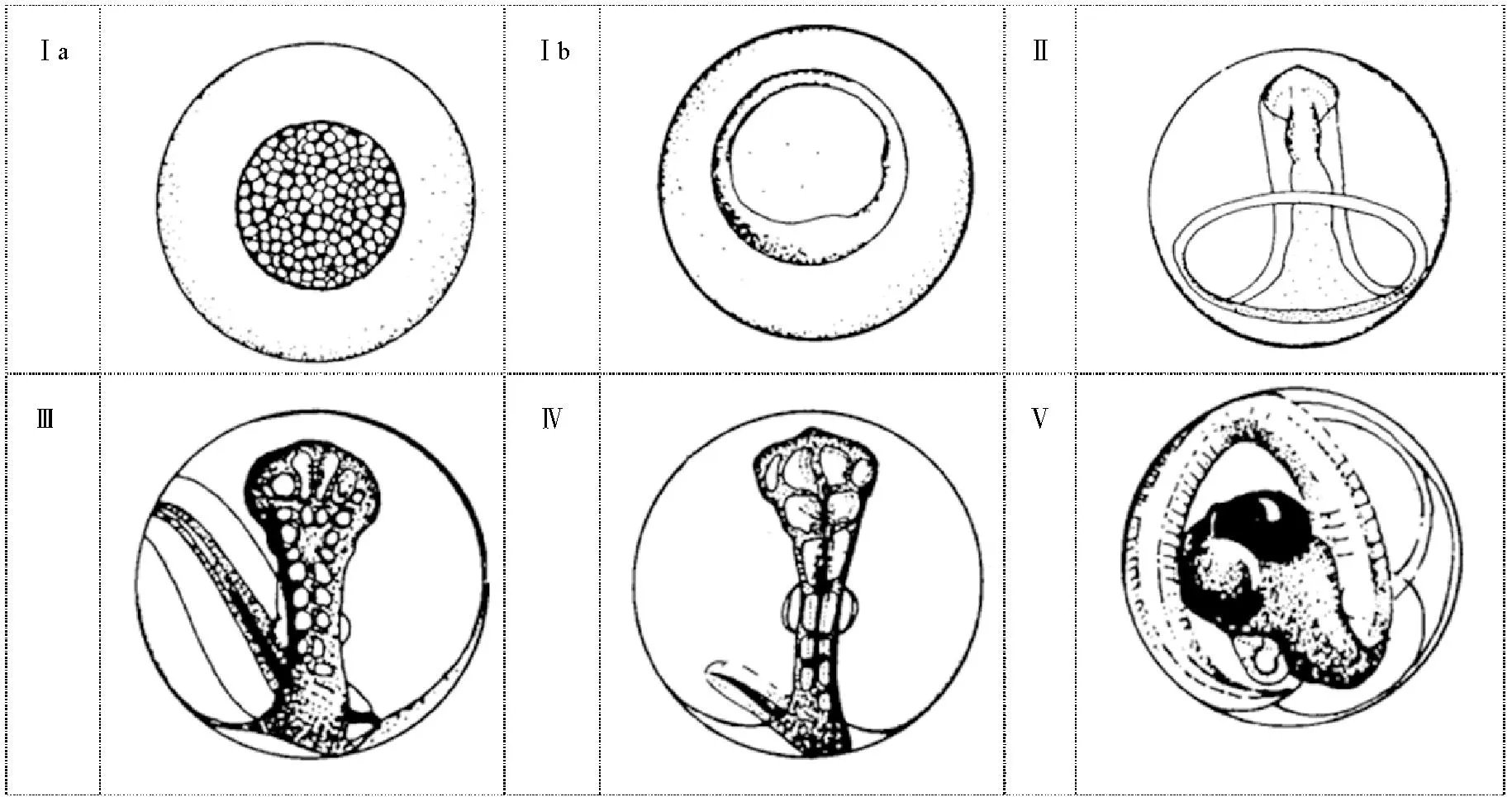
图2 鱼类Ⅰa期至Ⅴ期胚胎发育示意图 [15]Fig.2 Schematic diagram of fish embryonic development from stages Ⅰa to Ⅴ[15]
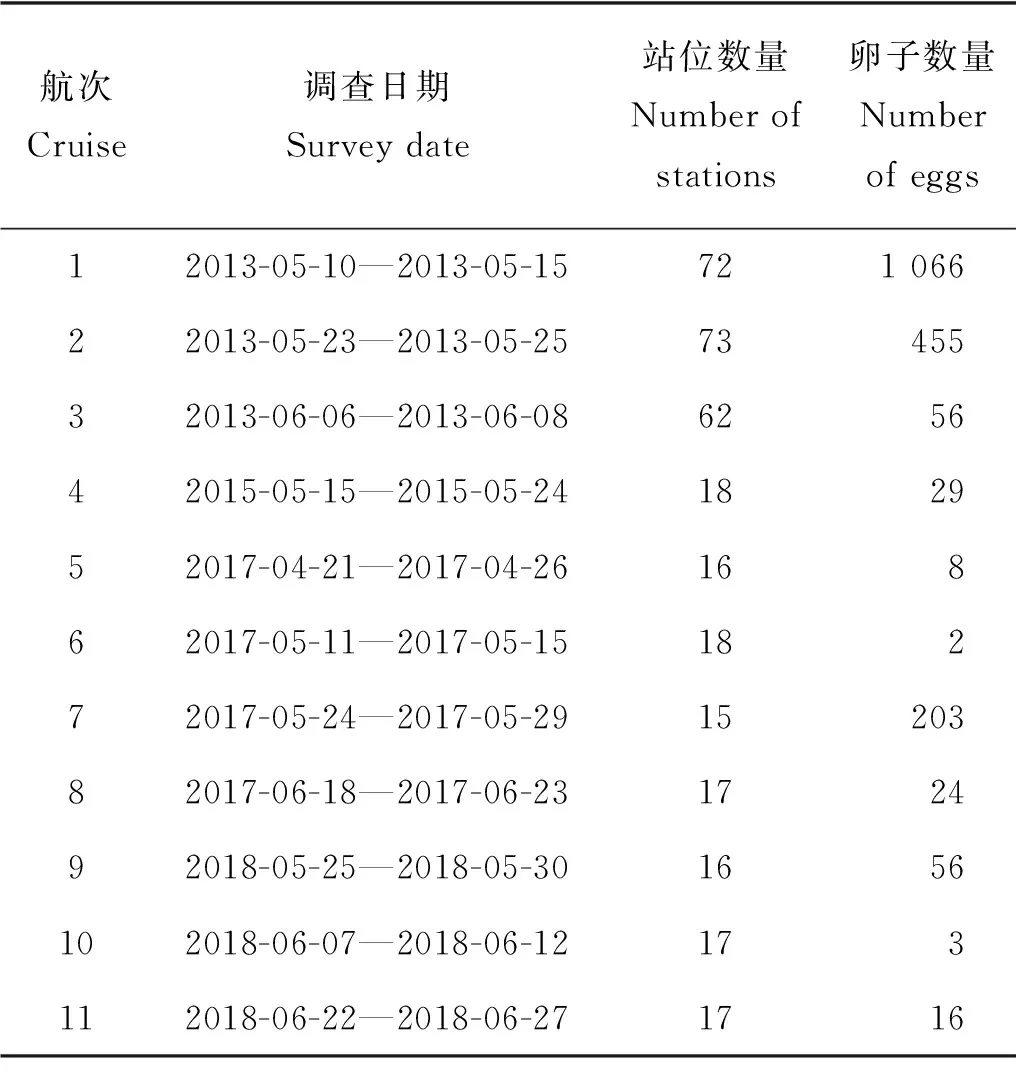
表1 调查航次、日期、站位与样品组成Table 1 Survey cruise,date,stations and samples composition
1.2 数据处理与分析
1.2.1 聚合站位 依据海洋鱼类卵子分期数目比例估算死亡参数时,由于鱼类产卵位置、时刻及卵子输运过程的复杂性,在任何一个单独的调查站位,采集的卵子样品可能来自于不同的产卵时间、空间位置或产卵批次,普遍会存在某个鱼种鱼卵数目为零或某一发育时期数量大于前一时期的问题,难以对单独站位的卵子死亡进行估算。为此,国际上相关卵子死亡的研究一般是采用聚合站位的方法进行数据分析[23-25]。参照此方法,本研究中我们以每个航次调查区域为一个分析单元,将限定研究区域内所有站位获得的分期卵子数据整合在一起,解决单独站位卵子发育阶段数量组成不规则的问题,基于马尔科夫链原理对每个调查航次的小黄鱼卵子死亡进行评估[23]。
1.2.2 胚胎发育模型 不同温度下卵子发育的速率是解析鱼卵自然死亡的基础生物学参数。Fox C. J.等人提出鱼卵发育时间与发育温度符合双参数模型[26]:
E=α+β×lnT。
(1)
式中:E为鱼卵发育时间(单位:d/℃);T为鱼卵孵化时的平均水温(单位:℃);α和β为模型参数。利用该模型及已有报道的小黄鱼卵子发育数据可建立小黄鱼胚胎发育模型,用于卵子自然死亡的评估[27-29]。
1.2.3 鱼卵自然死亡评估模型 参考Portilla等人的方法,将鱼卵孵化过程视作马尔科夫链,认为鱼卵由一个时期发育至下一个时期或在该时期死亡这两个事件符合竞争性的泊松分布,构建相关评估公式模型[23]。
模型中,鱼卵发育至下一时期发生死亡的概率用公式表示为
(2)
式中:mk为小黄鱼鱼卵在第k发育阶段发生死亡的概率;πk为鱼卵属于第k发育阶段的概率,可利用鱼卵各发育阶段的数量比例计算;λk为单位时间内鱼卵成功发育至下一阶段的事件发生次数,通过下式估计:
(3)
式中:tk为鱼卵在第k阶段成功发育至下一阶段的时间,系通过现场观测水温和胚胎发育模型的数据获得。
同时,使用zk代表卵子在第k阶段的瞬时死亡率,即鱼卵在第k阶段数量发生指数衰减的速率;tk为鱼卵在发育阶段的平均时间;可用下式估算zk:
(4)
由于小黄鱼初始总产卵量未知,无法评估Ⅰ期卵子的自然死亡情况,本文假设小黄鱼Ⅰ期与Ⅱ期自然死亡率相同[23],仅对Ⅱ期至Ⅴ期卵子自然死亡率进行评估。
1.2.4 统计分析 使用 SPSS 18.0 统计软件进行数据的统计分析。采用斯皮尔曼秩相关系数(Spearman’s rank correlation)分析鱼卵自然死亡情况与环境因子之间的关系。小黄鱼卵子为浮性卵,卵子发育受海洋表层环境影响较大,因此选择水深(Depth)、海水表层温度(Sea surface temperature,SST)、海水表层盐度(Sea surface salinity,SSS)、离岸距离(Offshore distance)和鱼卵丰度(Fish egg abundance)分析环境对鱼卵自然死亡的影响。分析所用环境数据为各航次的各个站位现场观测数据的算术平均值,死亡概率、瞬时死亡率为各航次小黄鱼整体鱼卵数据的评估结果。为保障数据分析的可靠性,在进行调查的11个航次中,本文仅使用小黄鱼卵子样品数量在29粒以上的2013年3个航次,及2015年5月、2017年5月和2018年5月共6个航次的数据用于卵子自然死亡分析。同时,考虑到样品中Ⅳ、Ⅴ期阶段的小黄鱼卵子数量相对较少,本文以Ⅱ期鱼卵数据分析环境因子对卵子自然死亡的影响。
2 结果
2.1 小黄鱼胚胎发育模型
利用FOX C.J.提出的胚胎发育公式,结合文献[26]中的小黄鱼卵子发育数据,建立了小黄鱼胚胎发育模型(见图3)。小黄鱼卵子发育各时期的胚胎发育公式如下:
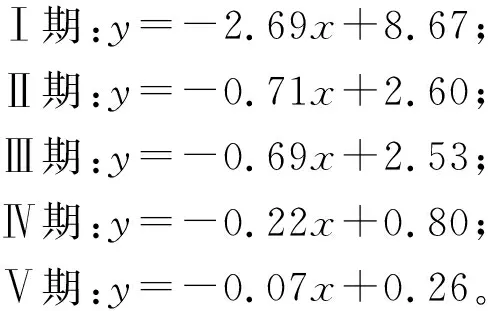
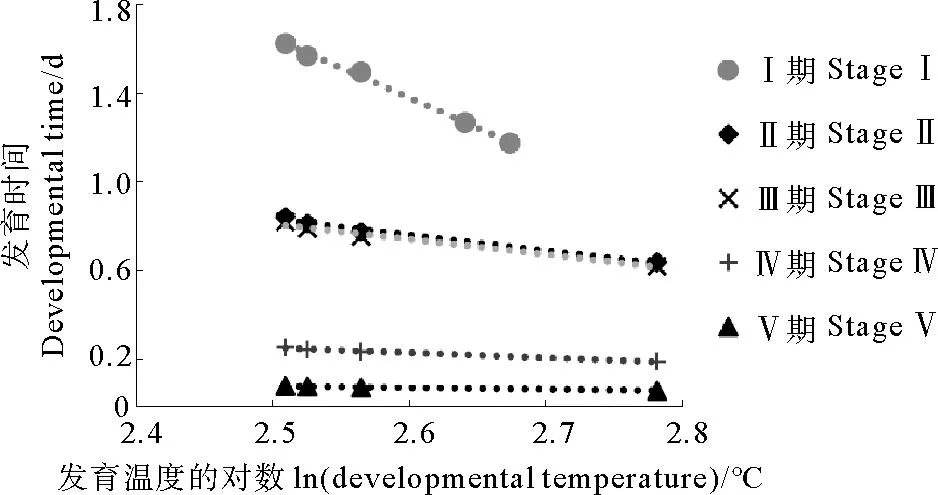
图3 小黄鱼鱼卵各阶段发育时间与温度关系Fig.3 Relationship between the duration of the egg stage and developmental temperature for the small yellow croaker
(5)
式中:y为鱼卵发育时间(单位:d),x为鱼卵孵化时的平均水温(单位:℃)。
在卵子的各个发育阶段,随发育温度提高,小黄鱼卵子发育时间缩短。
2.2 小黄鱼卵子不同发育阶段的自然死亡
利用6个航次的调查数据分析表明,小黄鱼Ⅱ期卵子死亡概率在0.80~0.98范围变化,平均0.87;Ⅲ期卵子死亡概率0.05~0.81,平均0.46;Ⅳ期卵子死亡概率0.62~0.78,平均0.68,具体见图4。
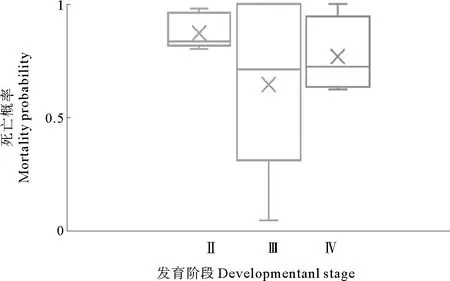
图4 小黄鱼卵子各发育阶段的死亡概率Fig.4 Interstage mortality probability of small yellow croaker eggs at various developmental stages
小黄鱼Ⅱ期卵子瞬时死亡率在16.43~364.24 d-1范围变化,平均93.50 d-1,其中部分航次死亡概率超过0.90,导致所求瞬时死亡率较高超过100 d-1;Ⅲ期卵子瞬时死亡率0.09~16.94 d-1,平均5.66 d-1;Ⅳ期卵子瞬时死亡率3.18~7.31 d-1,平均4.83 d-1,详见图5。调查中未发现Ⅴ期卵子,该阶段卵子自然死亡情况未进行评估。
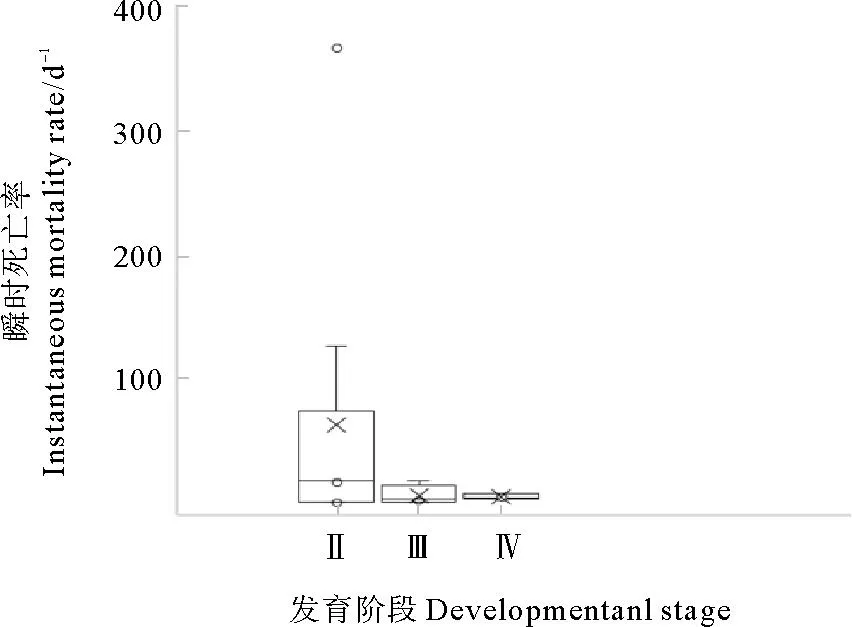
图5 小黄鱼卵子各发育阶段的瞬时死亡率Fig.5 Interstage instantaneous mortality rate of small yellow croaker eggs at various developmental stages
2.3 环境因子对卵子自然死亡的影响
各航次小黄鱼Ⅱ期卵子自然死亡情况及对应的环境特征见表2、图6、图7。由表2可见卵子自然死亡率2017—2018年5月下旬较2013—2015年显著上升。斯皮尔曼相关性分析表明,海表温度、海表盐度、离岸距离、水深、卵子密度5个因子与小黄鱼卵子Ⅱ期死亡概率(m2)与瞬时死亡率(Z2)皆未呈显著相关关系(P>0.05)。

图6 小黄鱼Ⅱ期卵子死亡概率及栖息地环境Fig.6 Mortality probability and habitat environmental characteristics of stage Ⅱ eggs of small yellow croaker
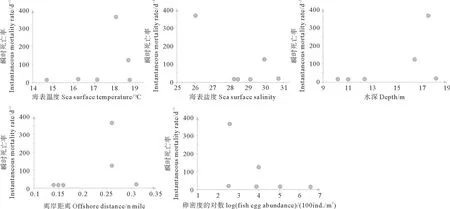
图7 小黄鱼Ⅱ期卵子瞬时死亡率及栖息地环境Fig.7 Instantaneous mortality rate and habitat environmental characteristics of stageⅡeggs of small yellow croaker
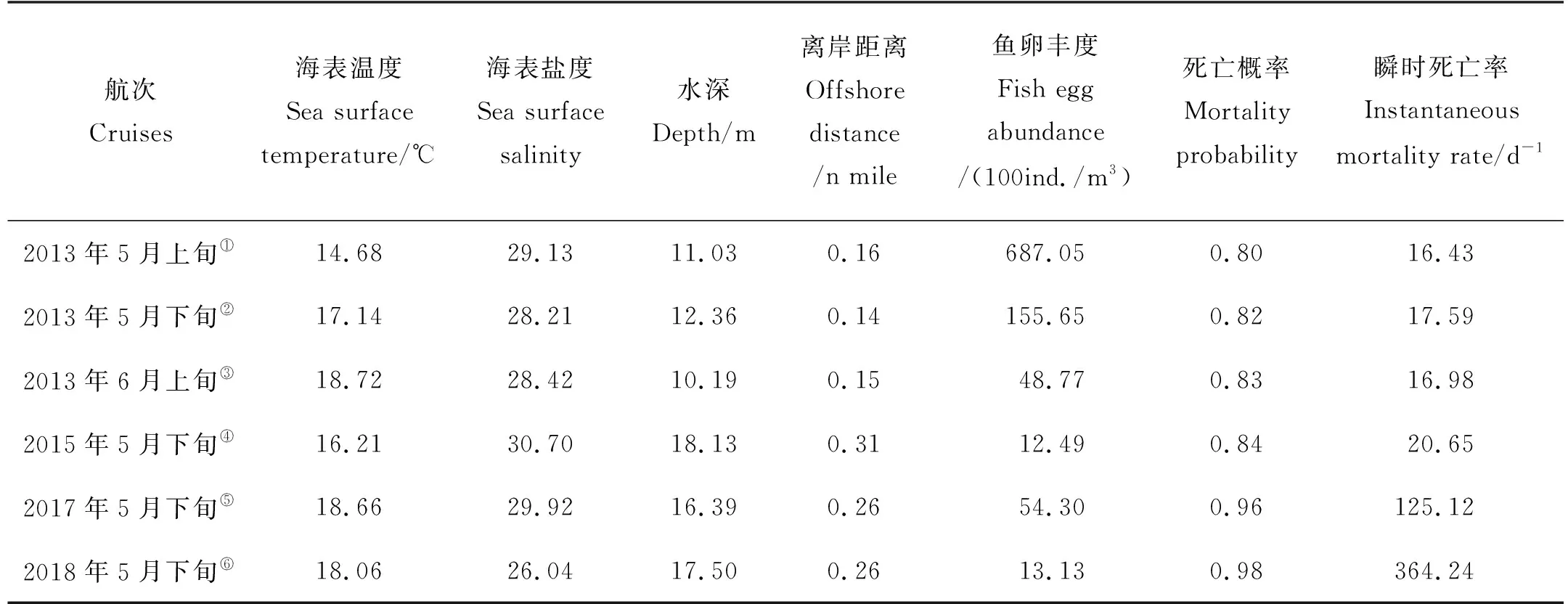
表2 小黄鱼Ⅱ期卵子自然死亡及栖息地环境特征Table 2 Natural mortality of stageⅡeggs and habitat environmental characteristics of small yellow croake
3 讨论
3.1 小黄鱼鱼卵自然死亡特征
本文结果表明,小黄鱼卵子发育过程中发育早期阶段的自然死亡率要高于晚期,其中Ⅱ期阶段死亡率最高。小黄鱼卵子早期高死亡率的原因可能是鱼类卵子早期更脆弱、更容易受到外界环境影响[17]。这种现象在其他研究中亦有发现,如Rogers曾发现黑线鳕的鱼卵最高死亡率出现在Ⅱ期[30],Buslov和Smirnov报道黄线狭鳕卵最高死亡率出现在Ⅰ期和Ⅲ期[31]。小黄鱼Ⅳ期卵子死亡概率较Ⅲ期显著上升,同时调查中未采集到Ⅴ期小黄鱼卵子,代表Ⅴ期阶段可能有偏高的自然死亡率。这种Ⅳ—Ⅴ期卵子自然死亡率的上升与一些鱼种的研究结果类似,可能与卵子发育后期胚体可视性增强,受到捕食的机率增大有关[32]。
本文结果中,小黄鱼Ⅱ、Ⅲ和Ⅳ期卵子的瞬时死亡率平均值为93.50、5.66和4.83 d-1。研究表明,东北大西洋的大西洋鲭(Scomberscombrus)和竹荚鱼(Trachurustrachurus)Ⅱ、Ⅲ、Ⅳ、Ⅴ期卵子瞬时死亡率平均值都小于1 d-1[23]。小黄鱼卵子自然死亡系数较上述2种鱼类偏高,其更深层的遗传和环境影响机制尚需进一步探索[23]。目前小黄鱼人工繁育已经成功,针对小黄鱼卵子发育过程中发育早期阶段的自然死亡过程,可采集不同发育阶段的受精卵,结合室内实验进行进一步的验证。
3.2 环境对鱼卵自然死亡的影响
影响海洋鱼类卵子自然死亡的因素相当复杂,涉及内源性与外源性两个方面。鱼卵大小与卵内脂肪含量成正比,卵子脂肪含量高有助于抵御更恶劣的环境;亲鱼的基因也可能影响卵子质量[33-35]。影响卵子自然死亡的外源性因素包括环境、捕食、寄生虫、海洋污染等[36],其中环境和捕食是最重要的2个因素[14-16]。一般认为,环境温度是影响海洋鱼卵死亡的重要环境因子。关于阿根廷无须鳕(Merlucciushubbsi)和日本鲭(Scomberomorusniphonius)的研究表明,鱼卵可以通过代谢保持卵内温度以适应外界环境,在适宜的温度范围内,温度升高能加快鱼卵发育速度,可以使个体快速通过比较脆弱的鱼卵阶段,降低个体被捕食造成的死亡概率[37-39]。基于实验结果对大西洋鳕鱼卵子死亡的研究表明,温度可通过影响胚胎发育时间、卵子大小影响卵子死亡,当温度过低或过高超出卵子适宜孵化温度范围时,鱼卵会出现胚胎畸形和死亡情况[40]。海水盐度是影响海洋鱼类卵子死亡的另一环境因素。对大西洋鳕鱼卵子死亡的研究表明,在低盐环境下,鱼卵发育前期阶段死亡率较高,但胚胎发育到原肠期鱼卵的死亡率较低[41]。亦有研究表明,鱼卵输运过程受到洋流产生的机械压力、氧气交换等因素的影响,可导致鱼卵死亡率上升[42-44]。海洋污染是影响鱼卵生存的另一潜在因素。石油污染物进入鱼卵内部后会与脂溶性物质结合并引起遗传物质改变造成畸形等疾病,鱼卵被卷入石油污染区时可互相粘连、卵膜空隙堵塞最终窒息死亡[45];重金属污染物能通过卵膜的间隙进入内部,引起鱼卵胚胎发育停滞、畸形甚至是鱼卵死亡,或造成孵出的仔鱼活力下降、行为迟缓[46];近岸水体富营养化可促进浮游植物的大量繁殖,消耗氧气远超过补充,形成低氧环境,且大量藻类遮蔽光线、影响浮游生物运动,部分有毒物质会对生物产生严重危害,亦可能给产卵场鱼类卵子生存带来威胁[47-49]。
本文研究表明,海表温度、海表盐度、离岸距离、水深、卵子密度5个因子与小黄鱼卵子Ⅱ期死亡均未呈现显著影响。笔者认为这并不代表海域环境对小黄鱼卵子自然死亡没有影响。由于鱼卵死亡研究的特殊性,单个站位不同发育时期卵子的数量衰减往往都是不正常的[23],这客观上造成必须以整个航次某种鱼类的全部样品数据评估卵子自然死亡,这样一是产卵场内部不同空间的环境差异及对卵子自然死亡的潜在影响有可能被同化,二是用于评估的原始数据量受限,一些常规的环境影响评估手段,如广义加性模型分析等,都需要30个航次以上的调查数据才可以实施。中国海洋鱼类早期生活史研究起步较晚,数据积累和研究体系尚不完整。除了室内生态实验手段外[18,40-42],针对天然产卵水域卵子自然死亡的调查与研究尚需不断地积累和探索,以阐明温度、盐度、生物、幼体早期输运等对卵子自然死亡的影响。
3.3 海洋鱼类卵子自然死亡评估方法
基于Portilla等提出的马尔科夫链模型估算自然海域鱼卵自然死亡并广泛应用于鱼类产卵量计算、种群丰度评估等[50-51]。如前所述,由于同一站位采集的卵子来源非常复杂,受到产卵时间、空间、产卵亲鱼等综合因素的影响,基于个别站位的调查数据难以开展卵子死亡的估算,因此一般采用聚合站位的方法进行处理[23-24],这客观上使得可用于分析的数据单元总量偏小。在数据量受限条件下,一些量化的研究手段如GAM模型分析、混合效应模型分析等统计手段无法应用。在调查与研究过程中探索经济鱼类产卵发生的时刻、水层及扩散过程,摸索和开发一套基于鱼类产卵策略及幼体扩散水动力学模型的鱼卵自然死亡外业调查方案,摆脱聚合站位方法的局限,提高产卵场鱼卵自然死亡的评估效果,这可能是本领域未来研究的一个方向。

