入侵种真江蓠保护性细菌与条件致病菌的分离与鉴定❋
侯明磊,任艺飞,Luisa Düsedau,Florian Weinberger,王高歌❋❋
(1. 中国海洋大学海洋生命学院,山东 青岛 266003; 2. 中国海洋大学海洋生物多样性与进化研究所,山东 青岛 266003; 3. 亥姆霍兹海洋研究中心海洋生态学部,德国 基尔 24105)
海藻作为初级生产者,在海洋生态系统中扮演着重要的角色。海藻表面通常附生着大量的细菌,这些附生细菌在其海藻宿主的健康、发育和疾病中扮演着重要的角色[1]。一方面,一些表面附生细菌有利于其海藻宿主的形态、发育和生长[1-2]。另一方面,表面附生细菌也可能是有害的。例如,海藻表面的附生细菌群落中存在条件致病菌,当光强、温度、pH等环境因子发生变化时,这些条件致病菌往往会转变为致病菌,进而引起病害的发生[3-5]。
海藻表面附生细菌的组成受到藻体宿主本身和环境因子(盐度、pH及温度等[6])的影响。温度是海藻生长中非常重要的一个环境因子。前期研究表明,海水升温会引起海藻表面附生细菌群落的变化。Stratil等[7]发现,当温度从5 ℃上升到25 ℃时,墨角藻(Fucusvesiculosus)表面附生细菌群落的操作性分类单元(Operational taxonomic unit,OTU)在15 ℃时的多样性要高于其在5和25 ℃时的多样性,但细菌数量却随着温度的升高而增加,这可能会导致海藻宿主抗逆性的改变。Saha等[8]通过进行进一步的研究发现,温度从5 ℃上升到25 ℃的过程中,墨角藻藻体表面的二甲基巯基丙酸内盐(Dimethylsulfoniopropionate,DMSP)含量会逐渐下降,导致条件病原菌在藻体表面定殖,部分藻体出现病烂现象。
真江蓠(Gracilariavermiculophylla)是一种原产于太平洋西北部的海洋红藻。在过去的几十年里,它成功入侵了欧洲、北美、南美等地区的多个沿海栖息地[9]。真江蓠的入侵对当地沿海群落结构、物种丰富度和生态系统功能造成了严重的负面影响[10],被列为欧洲最具入侵性的海藻之一[11]。藻枝体白化是一些养殖或野生红藻如江蓠属(Gracilariaconferta)、卡帕藻属(Kappaphycus)及野生红藻(Deliseapulchra)的常见病症[12-14]。研究证明,条件致病菌如创伤弧菌(Vibriovulnificus)、副溶血性弧菌(Vibrioparahaemolyticus)和美人鱼发光杆菌(Photobacteriumdamselae)等可引起这种藻体脱色的病症[13-15]。Saha与Weinberger[15]以健康的入侵种真江蓠为材料,分离、鉴定了58种可培养附生细菌,并进行了侵染实验,该实验表明这些附生细菌可分为条件致病菌、保护性细菌和中性菌,条件致病菌可诱导真江蓠产生白化的病症,保护性菌则能抑制条件致病菌产生白化病症。这些研究结果表明,真江蓠表面附生细菌群落中的保护性细菌可保护其免受条件致病菌的侵染,也说明真江蓠在入侵过程中伴随着保护性细菌的选择。Li等[16]发现暗棕色杆菌属的BS52(Phaeobactersp. BS52)是野生红藻(D.pulchra)白化病致病菌的拮抗菌,能够缓解由致病菌引起的D.pulchra表面附生细菌群落的变化,从而降低白化病的发病率。这些研究结果表明,有益菌对海藻宿主表面微生物群落的稳定性发挥着重要的作用。
在全球气候变化的背景下,预计到22世纪,全球海水表面温度将上升0.5~2.5 ℃,甚至上升到5 ℃[17]。鉴于表面附生细菌对真江蓠成功入侵具有重要的生态学作用,因此,有必要了解海水升温对其表面可培养附生细菌的影响。本文运用传统的微生物培养方法,分离并纯化23和26 ℃条件下入侵种真江蓠表面可培养附生细菌,通过16SrRNA基因同源性分析进行分离菌鉴定。通过侵染实验,筛选出保护性细菌和条件致病菌。研究海水温度升高对入侵种真江蓠表面可培养附生细菌群落的影响,可从全球变暖的角度来阐明未来海水升温对入侵种真江蓠表面附生细菌的影响,填补该领域空白,同时,本文筛选的保护性菌株也可为防控真江蓠白化病的爆发提供技术支撑。
1 材料和方法
1.1 真江蓠实验材料的采集与处理
2019年5月22日,从德国基尔的Falkensteiner海湾(54°23′53.7″N,10°11′25.7″E)采集入侵种真江蓠个体。采集到的样本保存在冷却箱中,2 h内转移至亥姆霍玆海洋研究中心实验室。将真江蓠样本放置于5 L的水箱中,在室内15 ℃、盐度14(接近取样地点的盐度)条件下驯化7 d后,进行温度暴露实验。
温度实验是于2019年5月28日—8月28日在德国基尔Helmhotlz海洋研究中心,通过人造海实系统(Benthocosm系统)进行的。该系统通过离海面1 m深处的管道,不断供应基尔海湾的海水;海水参数(温度、pH和盐度)的波动通过内部传感器上传至Benthocosm系统,水箱中的海水温度可由加热系统自行控制。因此,可实现当地海水温度的实时模拟。本实验将室外水箱分为两组,一组水箱里的温度为模拟当地波罗的海的海水温度,即正常温度(Normal temperature,Nt),另外一组水箱的温度则始终高于正常海水温度3 ℃,即偏高温度(Higher temperature,Ht);每个水箱里放入1个装有1.0 g真江蓠的网兜,将网兜置于每个水箱的中心,让真江蓠样本尽可能地暴露在阳光下;Nt组和Ht组各有4个水箱,分别代表4个生物学重复。
1.2 真江蓠表面附生细菌的采集与分离培养
2019年8月28日,采集Nt组和Ht组中培养的真江蓠样本。其中,Nt组约为23 ℃,Ht组温度约为26 ℃。Nt组真江蓠的4个重复样本的编号分别为Nt2、Nt3、Nt6和Nt11。由于实验过程中Ht组中有1个网兜里的真江蓠腐烂,因此只收集到了3个重复样本,编号分别为Ht4、Ht9和Ht12。将真江蓠表面水分用无菌棉纱吸干,用无菌手术刀剪取1.0 g真江蓠个体。然后将每个样品各放入一个装有15 mL无菌海水和30 个灭菌玻璃珠的50 mL 离心管(品牌:Falcon)中。在转速150 r/min下离心含有真江蓠样品和玻璃珠的试管(品牌:Falcon)5 min,从而收集到含有真江蓠表面浮生细菌原液。然后将离心好的水样转移至准备好的无菌离心管中,并避免将藻体和玻璃珠导入离心管中。
将悬浊液稀释至原浓度的10-1、10-2、10-3、10-4和10-5,然后从每种稀释液中各吸取60 μL,并分别涂布至5个含ZoBell 2216E 培养基及 1/2 ZoBell 2216E琼脂平板上,放入23 ℃(Nt组分离的菌株)或26 ℃(Ht组分离的菌株)培养箱培养24 h。根据菌落的形状和颜色来挑取不同的菌株进行划线培养,3次纯化后,将培养后的菌液放入装有30 %(v/v)甘油的1.5 mL 离心管中,并保存于-20 ℃冰箱备用。
1.3 16S rRNA基因的扩增与测序
将分离到的菌株分别接种于5 mL ZoBell 2216E培养基或5 mL 1/2 ZoBell 2216E培养基的灭菌离心管中。120 r/min 23 ℃黑暗条件下于震荡培养箱中培养3 d,从而使菌株分布均匀然后使用Ezup柱式细菌基因组DNA抽提试剂盒(供应商:生工生物工程股份有限公司,上海),并按照操作说明书提取DNA。
使用NanoDrop ND-2000c微量分光光度计检测DNA的浓度,以OD260/OD280在1.8~2.0之间的DNA为模板,16SrRNA基因通用引物为27F (AGAGTTTGATCCTGGCTCA)和1 492R(GGTTACCTTGTTACGACTT)。30 μL PCR反应体系为:Taq DNA聚合酶(5 U/μL)0.3 μL,10×buffer 3 μL,dNTP Mixture 4.8 μL,MgCl23 μL,引物27F(10 μmol/L)和1 492R(10 μmol/L)各0.6 μL,模板DNA 0.6 μL,加ddH2O至30 μL。PCR扩增程序为95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火1 min,72 ℃延伸1.5 min,30个循环;72 ℃延伸10 min。扩增产物经凝胶电泳检测后,送往青岛擎科生物科技有限公司进行16SrRNA基因全长测序。测序结果通过EziBioCloud基因数据库(https://www.ezbiocloud.net/)进行对比分析。
1.4 系统发育树的构建
如果2种细菌的基因序列一致性比对结果低于98.65%,可假定这2种细菌为不同的种[18]。采用Clustal W进行序列比对,使用MEGA Ⅹ软件利用邻接法(Neighbor-joining)构建系统进化树[19],进化树各分支的自举检验值(Bootstrap value)均是通过1 000次重复检验获得的。
1.5 侵染实验
真江蓠藻枝体尖端侵染实验于2020年8月27日—10月29日之间进行,健康的真江蓠个体采集自青岛海滨雕塑园附近(36°04′48.39″N,120°27′06.70″E)。将采集的真江蓠样品保存在自封袋中,低温4 h之内送往实验室。然后将其保存在装有20 L无菌海水的水箱中,室内驯化5 d后用于侵染实验。驯化条件:23 ℃下持续充氧,光周期为12 h∶12 h (光∶暗),光照强度为75 μmol·m-2·s-1。
将保存在-20 ℃冰箱的分离菌株取出,解冻后吸取0.7 mL菌液接种至含有5 mL ZoBell 2216E液体培养基的灭菌离心管中。将Nt组和Ht组的菌株分开培养,其中:Nt组菌株培养温度为23 ℃,120 r/min; Ht组菌株培养温度则为26 ℃,120 r/min。从而这两组菌株均分布均匀,然后二者均在黑暗条件下震荡培养箱中培养。12 h后更换新的ZoBell 2216E培养基继续培养,重复该步骤2~3次,最终使它们的OD610保持在0.2~0.3之间。
参考Saha和Weinberger[15]的侵染方法,将真江蓠藻枝体尖端侵染实验方法稍作改进,具体步骤为:(1)使用无菌手术刀将室内驯化后的健康真江蓠个体的藻枝体尖端切成2~3 cm的片段,然后用灭菌镊子分别向装有2 mL无菌海水的24孔板中添加6个藻枝体尖端片段。向每个孔板中均添加20 μL万古霉素和20 μL头孢噻肟两种抗生素(每种浓度为0.1 mg/mL),以除去真江蓠表面的附生细菌。(2)将加有抗生素的24孔板放置在光照培养箱中培养2 d (预处理)。培养条件:23 ℃,光照75 μmol·m-2·s-1,光周期为12 h∶12 h (光∶暗)。(3)准备新的24孔板,并向每个孔里添加2 mL无菌海水。用灭菌后的镊子将冲洗过后的藻枝体尖端放入24孔板中,立即添加20 μL OD610在0.2~0.3的菌液,每组设置6个重复,对照组则添加20 μL无菌海水。(4)将经步骤(3)处理的24孔板放置在光照培养箱中培养5 d (培养条件:温度23 °C、光照强度75 μmol·m-2·s-1),然后在解剖镜下统计侵染结果。(5)藻枝体尖端白化的相对风险的计算公式:白化的相对风险R=(实验组白化的个数/实验组健康的个数)/(对照组白化的个数/对照组健康的个数)。并使用卡方检验来进行差异显著性分析,设R>1且p≤0.05的为条件致病菌,R<1且p≤0.05的则为保护性菌株,其余为中性菌。
2 结果
2.1 真江蓠表面附生细菌分类学鉴定
本文作者共分离出79株菌株,从Nt组和Ht组中分别分离出44和35株菌株。经16SrRNA基因全长序列比对可知:这些菌株隶属于厚壁菌门(Firmicutes)或变形菌门(Proteobacteria)(见表1);67 %的菌株属于厚壁菌门芽孢杆菌纲(Bacilli)中的肠球菌属(Enterococcus)(51株)、微小杆菌属(Exiguobacterium)(1株)和Mammaliicoccus(1株)3个属;33 %的菌株属于变形菌门γ-变形菌纲(Gammaproteobacteria)弧菌属(Vibrio)(26株菌株)。

表1 真江蓠可培养附生细菌的分类学鉴定Table 1 Taxonomic identification of the isolated epibacterial strains from G. vermiculophylla
将所有菌株的16SrRNA基因全长序列与EziBioCloud基因数据库对比,将相似度高于98.65%的菌株视为同种菌株[18]。结果表明:Nt组的44株菌株被鉴定为来自5种细菌,分别是粪肠球菌(Enterococcusfaecalis)、墨西哥微小杆菌(Exiguobacteriummexicanum)、松鼠葡萄球菌(Mammaliicoccussciuri)、新喀里多尼亚弧菌(Vibrioneocaledonicus)和相模原弧菌(Vibriosagamiensis),其中粪肠球菌的占比最高,为68%(见图1a);Ht组的35株细菌被鉴定为来自4种细菌,分别为粪肠球菌、溶藻弧菌(Vibrioalginolyticus)、新喀里多尼亚弧菌和相模原弧菌,其中粪肠球菌在Ht组的占比也是最高的,为60%(见图1b)。有趣的是,在Ht组的样本中未分离出墨西哥微小杆菌和M.sciuri。同样,在Nt组的样本中也未发现溶藻弧菌。

((a) Nt组不同可培养菌株的占比Proportion of different isolated bacterial strains in Nt group;(b) Ht组不同可培养菌株的占比Proportion of different isolated bacterial strains in Ht group。)图1 Nt组和Ht组不同可培养菌株的占比Fig.1 Proportion of different bacterial strains in Nt and Ht groups
2.2 16S rRNA 基因序列分析
编号为Nt2-2、Ht4-5、Nt6-4、Ht9-6、Nt11-1和1/2Ht12-4的分离菌株同EziBioCloud基因数据库中已知标准菌株的16SrRNA基因序列的相似性均小于98.65%,故推断这些未知菌株可能为新种。本研究以AkkermansiaglycaniphilaPytT为外群菌株,对序列比对相似性小于98.65%的菌株构建了系统进化树(见图2)。其中菌株Nt2-2和1/2Ht 12-4 二者的16SrRNA基因序列同肠球菌属的粪肠球菌标准菌株EnterococcusfaecalisATCC 19433T的16SrRNA基因序列的相似性分别为98.25%和98.56%。菌株Ht4-5、Ht9-6和Nt11-1三者的16SrRNA基因序列同弧菌属的相模原弧菌标准菌株VibriosagamiensisLC2-047T的16SrRNA基因序列的相似性分别为98.23%、98.61%和98.31%。而菌株Nt6-4的16SrRNA基因序列同Mammaliicoccus属的M.sciuriDSM 20345T的16SrRNA基因序列的相似性为98.47%。由图2可见,Nt2-2和1/2 Ht12-4、Ht9-6和Nt11-1在进化树中均为独立分支,说明这些菌株可能是真江蓠表面附生细菌中新的未鉴定的菌株。
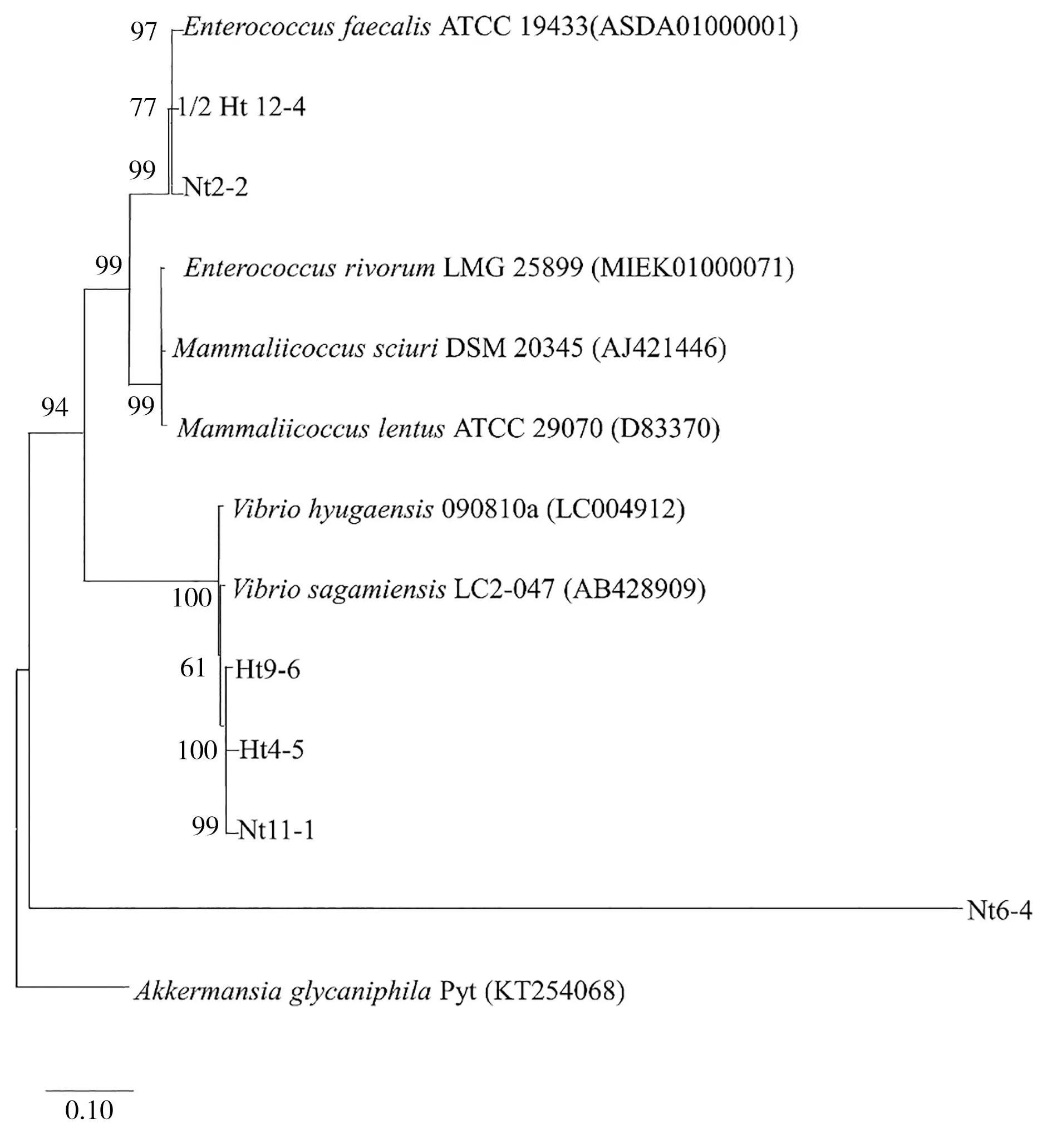
(菌株名称后括号内的序号为NCBI序列编号;分支点上数字为重复1 000次的自展值;标尺0.10为核苷酸替换率。NCBI accession numbers were listed behind strain numbers in parentheses,numbers at nodes indicate percentage levels of bootstrap support based on a Neighbor-Joining analysis of 1 000 resampled datasets,bar = 0.10 indicates 0.10 substitutions per nucleotide position.)图2 基于16S rRNA 基因序列构建的新种NJ系统进化树Fig.2 A neighbor-joining phylogenetic tree of new species based on the 16S rRNA gene sequences
2.3 侵染实验结果
侵染实验结果如图3所示,光照培养箱中培养5 d后,添加保护性菌株的真江蓠藻枝体未出现白化的现象(见图3a),添加条件致病菌的样本则出现了藻枝体尖端白化现象(见图3b和c)。由表2可知:Nt组中,相模原弧菌是保护性菌株(R<1且p≤0.05),新喀里多尼亚弧菌和粪肠球菌均是条件致病菌(R>1,p≤ 0.05);而Ht组中,相模原弧菌也是保护性菌株,条件致病菌包括新喀里多尼亚弧菌、粪肠球菌和溶藻弧菌(R=4.474,P=0.005)。

(a:健康藻枝体Healthy thallus tip;b和c:雌和雄白化藻枝体Bleaching thallus tip。黑色箭头所指的方向为出现白化病症的部位Black arrows indicating the bleaching symptom。)图3 真江蓠藻枝体尖端白化病症的特征Fig.3 Characteristics of tips bleaching in G. vermiculophylla

表2 入侵种真江蓠保护性细菌和条件致病菌Table 2 Protective bacteria and opportunistic pathogenic bacteria isolated from G. vermiculophylla
3 讨论
本文运用传统微生物学培养的方法从常温和高于正常海水温度3 ℃的处理条件下共分离、纯化79株可培养细菌。经16SrRNA基因序列同源性分析后,将它们鉴定为6种细菌,分别是粪肠球菌、墨西哥微小杆菌、松鼠葡萄球菌、溶藻弧菌、新喀里多尼亚弧菌和相模原弧菌。侵染实验结果表明,相模原弧菌是保护性细菌,而粪肠球菌、溶藻弧菌和新喀里多尼亚弧菌均是条件致病菌。
Saha等[9]通过宏基因组学方法,研究了入侵种真江蓠表面附生细菌群落的组成与多样性,结果表明,真江蓠的表面附生细菌群落的优势菌门为厚壁菌门和变形菌门。本研究中分离的79株菌株中有67%隶属于厚壁菌门,33%隶属于变形菌门支持了该观点。厚壁菌门和变形菌门均是不同发育时期海带表面附生细菌群落的优势菌门[20],这说明许多大型海藻上有共同门水平的表面附生细菌群落[1]。厚壁菌门的成员可以抵抗多种环境压力的影响,拥有高效的能量生成系统[2],厚壁菌门的相对丰度较高,这可能与真江蓠具有较强的抗逆性有关。本研究发现:在Nt组和Ht组中粪肠球菌、新喀里多尼亚弧菌和相模原弧菌都是优势菌属,这可能是由于入侵种真江蓠对温度胁迫具有较高的抗性,可在5~30 ℃的环境下存活[21-22],高于正常海水温度3 ℃的条件下对真江蓠表面附生细菌群落的影响较小,甚至没有造成影响;粪肠球菌、新喀里多尼亚弧菌和相模原弧菌可能都同真江蓠建立了紧密的关系,属于真江蓠的藻际微生物,在藻际微环境中真江篱的分泌物为这3种菌提供了其偏好的有机营养,由于环境温度的变化对海藻分泌物的影响不大,因此这3种菌的优势地位未发生改变[1]。
Saha和Weinberger[15]发现真江蓠表面附生细菌中存在着一些保护性细菌,能够降低条件致病菌导致的藻枝体尖端白化的风险。这种保护性细菌不仅存在于其他江蓠属的海藻中[23],也存在于红藻D.pulchra[24]、珊瑚[25]以及墨角藻中[26]。本文中,相模原弧菌是能够抑制真江蓠出现白化病症的保护性菌株。相模原弧菌最初是由Yoshizawa等[27]从日本相模湾和赤道地区的海水中分离出来。相模原弧菌为革兰氏阴性菌,呈杆状,单极鞭毛且能够移动,能够在10~37 ℃的条件下于0.5%~6%的NaCl溶液(最适浓度为3%~5%)中生长,标准菌株为V.sagamiensisLC2-047T。目前,有关该菌的相关研究还很少,因此其对海藻宿主的保护机制仍需进一步研究。
在本研究中,粪肠球菌、溶藻弧菌和新喀里多尼亚弧菌是能够引起真江蓠出现白化病症的条件致病菌。粪肠球菌广泛分布于自然界的各种环境中,包括土壤、地表水、植物以及恒温动物(包括人类的)胃肠道中[28]。肠球菌属的细菌能够耐受各种环境压力和恶劣环境,包括极端温度(小于5 ℃或大于65 ℃)、极端pH(小于4.5或大于10.0)和高盐环境中,使它们能够在广泛的生态位中定殖[29]。Enterococcus属的物种在过去被认为是对人类无害的,因此其被广泛当作食品工业中的发酵剂或被视为益生菌[30]。最近,Enterococci已成为最常见的医院病原体之一,患者死亡率高达61%[31]。本研究的结果表明,肠球菌属的一些物种不仅是人类致病菌,也可能是海藻的条件致病菌。弧菌属的一些细菌如创伤弧菌[32]、副溶血性弧菌[3]、霍乱弧菌[33]分别是紫菜、海带和江蓠的条件致病菌。同前人的研究结果一致,本研究也发现溶藻弧菌和新喀里多尼亚弧菌也是引起真江蓠白化病症的条件致病菌。溶藻弧菌是一种生活在海洋和河口环境中的嗜盐细菌,也是引起人类疾病的十几种弧菌属的细菌之一,可导致严重的软组织感染、败血症和肠道感染[34]。溶藻弧菌还是南美对虾、蛤蜊、鳗鲡等水产动物的致病菌[35-36]。新喀里多尼亚弧菌的标准菌株为V.neocaledonicusNC470T,菌落呈圆形,乳黄色,菌落大小为2~3 mm,是一种潜在的降解有机污染物的细菌[37]。王印庚等[38]报道新喀里多尼亚弧菌可能是凡纳滨对虾苗细菌性玻化症的条件致病菌之一。
Bonthond等[39]利用16SrRNA基因高通量测序技术,发现全球尺度下的入侵种真江蓠表面附生细菌群落的优势菌属为独岛菌属(Dokdonia)、假交替单胞菌属(Pseudoalteromonas)、希瓦氏菌属(Shewanella)和弧菌属等。但在本研究分离、鉴定细菌的结果中,除了弧菌属,未见其他优势菌属的菌株。这可能是因为微生物培养方法仅能分离只有1%左右的海洋微生物[40]。因此,传统的微生物学培养方法有很大的局限性。需要建立新的培养方法或研制出新的培养基,才有可能把16SrRNA基因高通量测序测出的优势菌分离出来。16SrRNA基因高通量测序鉴定出的潜在致病菌需通过传统微生物培养和实验室内侵染实验来验证,以确定其是否为真正的致病菌。
4 结语
本研究中,通过利用德国基尔Helmhotlz海洋研究中心的Benthocosm系统、传统的微生物培养方法及侵染实验发现,海水温度升高3 ℃可影响入侵种真江蓠表面附生细菌群落的结构,还可能增加真江蓠的患病几率。本文筛选、鉴定的保护性细菌与条件致病菌不仅丰富了入侵海藻真江蓠表面附生细菌相关知识的体系,同时为防控真江蓠白化病的爆发提供了技术支撑。未来仍需对条件致病菌的致病机理和保护性菌株的功能进行深入研究。

