隐秘小环藻藻际细菌分离鉴定及其对藻细胞生长的影响❋
刘 雨,张 裕,李 赟,朱葆华,潘克厚,2❋❋
(1. 海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003;2. 青岛海洋科学与技术试点国家实验室 海洋渔业科学与食物产出过程功能实验室,山东 青岛 266237)
藻际细菌与微藻之间存在着复杂的相互作用[1-4],许多研究表明,大多数相互作用基于溶解有机物的微生物降解与转化[5-6]。某些细菌可以吸收利用微藻释放到周围水体中的溶解有机碳(Dissolved organic carbon,DOC),或附着在死亡细胞碎屑上代谢颗粒有机碳维持自身的生长[7-8],同时,提供维生素、氨基酸及植物激素等促进微藻的生长,这些细菌被称为微藻的藻际促生菌[9]。例如,细菌Ruegeriapomeroyi可利用假微型海链藻产生的DOC和硫代谢物进行繁殖,同时合成维生素B12促进假微型海链藻的生长[10-11]。普通小球藻释放的DOC被细菌降解利用,细菌大量繁殖,代谢活动产生的DIC含量升高,增强了微藻光合作用的无机碳供应,从而促进了微藻的生长[5]。Azospirillumbrasilense促进Chlorellasorokiniana叶绿素含量的同时,也提高了微藻的脂质含量和脂肪酸种类[12]。Wang等[13]从栅藻(Scenedesmusobliquus)藻液中分离纯化出一株促生菌,可将微藻生物量提高24.8%。玫瑰杆菌类群可利用多列拟菱形藻(Pseudo-nitzschiamultiseries)分泌的色氨酸合成吲哚-3-乙酸,从而促进藻细胞的分裂,调节藻细胞生长周期[14-15]。作为溶解有机物的一部分,EPS在微藻和细菌共生的细胞通讯中起关键作用[16],其浓度的增加可能有利于菌藻共培养系统的稳定[17]。Brenner等[18]证明了硅藻EPS多糖可作为其藻际细菌的底物,且不同的细菌菌株可利用EPS多糖的不同部分。目前,菌藻共培养研究主要集中在废水处理[19-20],关于有益藻菌共生体系在微藻规模化养殖中的应用还相对较少。系统了解微藻与细菌之间的关系,对构建高效的藻菌共培养体系具有重要的意义。
隐秘小环藻(Cyclotellacryptica)作为一种广盐性海洋硅藻,其油脂含量可达总生物量的40%,甘油三酯含量占总脂含量的55%左右,是一种良好的脂质生产者[21-23]。另外,隐秘小环藻具有纳米级到微米级的多孔结构,具有很好的止血、药物缓释能力,已有研究表明隐秘小环藻具有非常广阔的综合利用潜力。
无菌化处理前后隐秘小环藻的生长结果显示,无菌化处理后,隐秘小环藻的生物量比无菌化处理前降低16%左右[24],说明隐秘小环藻的培养液中可能存在促进该藻株生长的菌株。为筛选隐秘小环藻藻际促生菌,本文首先运用传统的微生物分离培养方法,分离纯化隐秘小环藻藻际细菌,并完成分类学鉴定。其次,比较了分离菌株对隐秘小环藻生长和脂质含量的影响。最后,分析了2株促生菌的藻菌共培养体系中溶解有机碳,溶解无机碳(Dissolved inorganic carbon,DIC)及胞外聚合物浓度的变化,阐明藻菌可能的互作模式。
1 材料和方法
1.1 藻际细菌分离与鉴定
本实验所用的隐秘小环藻(Cyclotellacryptica)由中国海洋大学应用微藻生物学实验室提供(编号LAMB147),保存于f/2培养基[25]中。将隐秘小环藻培养物浓度稀释为1/106~1/104,取100 μL稀释液均匀涂布于ZoBell 2216 E固体培养基[26]中,在37 ℃培养箱中培养一周,挑取不同形态特征的单菌落,多次划线纯化至无杂菌污染,获得纯培养细菌。
反复冻融法提取细菌DNA:挑取单菌落于1.5 mL离心管中,加入50 μL无菌水,涡旋混匀,先后置于液氮和100 ℃水浴锅中反复冻融3次(10 min/次),于4 ℃下12 000 r/min离心10 min,取上清。
16S rDNA PCR扩增的引物为细菌通用引物:27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1 492R (5′-TACGGTTACCTTGTTACGACTT-3′)。PCR产物经2%琼脂糖凝胶电泳鉴定,通过凝胶提取试剂盒(Beckman Coulter Genomics,Danvers,MA,USA)纯化,由上海生工生物公司进行测序。将测序获得的16S rDNA序列分别与EzBioCloud server数据库的标准菌株比对,完成分类学鉴定。使用MEGA11软件中的Neighbor-jionig(NJ)法构建系统发育树。
1.2 藻菌共培养体系的建立
1.2.1无菌藻株及培养条件 使用抗生素处理获得无菌隐秘小环藻[24]。将指数生长期的隐秘小环藻接种于新鲜无菌的f/2培养基中,添加 600 μg/mL硫酸庆大霉素、800 μg/mL硫酸卡那霉素和800 μg/mL硫酸链霉素联合处理3 d;离心洗涤后重新接种于新鲜f/2培养基,培养3 d;再次离心洗涤,接种于新鲜f/2培养基,追加 25 μg/mL盐酸环丙沙星处理3 d。将除菌后的隐秘小环藻转入不含抗生素的f/2培养基中,传代5次(各代培养7 d)后获得无菌藻株。采用荧光染色观察法检验其无菌性:取100 μL无菌藻液,加入0.1 μL SYBR Green I核酸染料染色20 min,在荧光显微镜下未观察到被染色的细菌。
无菌隐秘小环藻培养基为f/2培养基。培养条件:温度22 ℃,光强40 μmol·m-2·s-1,光暗周期12 h∶12 h的光照培养箱中培养。离心(3 000 r/min,5 min)收集指数生长期的无菌藻株,洗涤后重悬于300 mL f/2培养基,调节初始OD750=0.1(藻细胞密度约为2.0×105cells/mL)。
1.2.2 细菌对微藻生长的影响 细菌培养基为ZoBell 2216E液体培养基。将8株分离菌分别按2%(体积比)接种量接种于ZoBell 2216 E液体培养基中,在37 ℃和200 r/min下培养12 h,OD600均达到0.6 ~ 1.0(指数期)。将菌液8 000 r/min离心10 min,f/2培养基洗涤并重悬细菌细胞,调节菌悬液OD600=1.0(细菌密度约为1×108CFU/mL)。取9 mL菌悬液接种到上述无菌小环藻培养物中,使初始菌藻细胞比为15∶1。每个处理组设置3个平行。共培养实验条件:温度22 ℃、光照强度40 μmol·m-2·s-1、光暗周期12 h∶12 h,连续培养8 d。
使用血球计数板每两天统计微藻细胞数,并绘制生长曲线。培养结束时采用干质量法测定微藻的生物量。将孔径为0.45 μm的混合纤维滤膜置于60 ℃烘箱中烘干至恒重W1,取10 mL混匀的藻液,3 000 r/min离心5 min,向沉淀中加入10 mL f/2培养基,将藻细胞重悬后进行抽滤,再次将滤膜烘干至恒重记为W2,并计算总生物质浓度(Dry weight,DW,单位g/L):CDW=(W1-W2)/V。
每两天取1 mL共培养液,用无菌水稀释1×105倍,取100 μL稀释液进行ZoBell 2216 E琼脂涂板,平板置于37 ℃恒温培养箱中培养3 d,然后统计菌落数,计算共培养体系中的细菌密度。
1.3 脂质含量与脂肪酸组成测定
脂质的提取采用氯仿∶甲醇提取法,含量测定基于质量法[27]。按上述培养条件连续培养8 d后,收集藻细胞,冷冻干燥后取15 mg(m0),加入3 mL提取缓冲液(氯仿∶甲醇=2∶1),室温涡旋15 min,震荡摇晃10 h,离心(8 000 r/min,10 min)取上清后,再次向沉淀中加入3 mL提取缓冲液,重复上述步骤1次。将两次上清液合并,加入1/5体积0.9% NaCl溶液,涡旋5 min后静置分层。吸取氯仿层,通过0.22 μm滤器过滤到玻璃管(m1)中,55 ℃水浴加速氯仿挥发,再放入烘干箱中烘干,称重为m2,总脂含量=(m2-m1)/m0×100%。
参照Niu[28]等描述的方法提取脂肪酸,使用气相色谱法分析其组成。气相色谱仪的条件设置:载气为N2和H2,流速分别为40和25 mL/min;进样口温度250 ℃;内部程序升温至150 ℃维持1 min,再以15 ℃/min升高至250 ℃保留10 min。数据处理采用面积归一化法。
1.4 溶解有机碳、溶解无机碳及胞外聚合物浓度测定
每2d检测共培养体系中胞外聚合物的蛋白质与多糖浓度变化。取2 mL共培养液,在4 ℃下8 000 r/min离心10 min,上清液通过0.45 μm滤膜过滤,收集上清部分的胞外聚合物;将沉淀重悬于2 mL三蒸水中,并在60 ℃下震荡水浴30 min,再次离心后通过0.45 μm滤膜收集细胞结合部分的胞外聚合物[15]。使用牛血清白蛋白作为标准品,通过BCA蛋白浓度测定试剂盒(索莱宝科技有限公司,北京)测定蛋白质浓度,以葡萄糖为标准品,通过苯酚-硫酸法测定多糖浓度。在培养的第4天和第7天,通过总有机碳分析仪检测共培养体系中的溶解有机碳和溶解无机碳含量[29]。
1.5 数据处理
三组平行的实验数据均用于结果分析,计算平均值及标准差Mean ± SE,使用Origin软件进行数据整理并作图,采用 SPSS 软件对数据进行单因素方差分析(ANOVA),并进行多重比较(LSD,Duncan),显著性水平为p<0.05。
2 结果与分析
2.1 藻际细菌的分离鉴定
经ZoBell 2216 E平板涂布划线,从隐秘小环藻藻际中分离纯化8株可培养细菌,菌落特征如表1所示。8株菌株的菌落均为光滑、湿润的圆形,但菌落大小、颜色明显不同。依据菌落特征,分别将分离菌株标记为C-1、C-2、C-3、C-4、C-5、C-6、C-7和C-8。
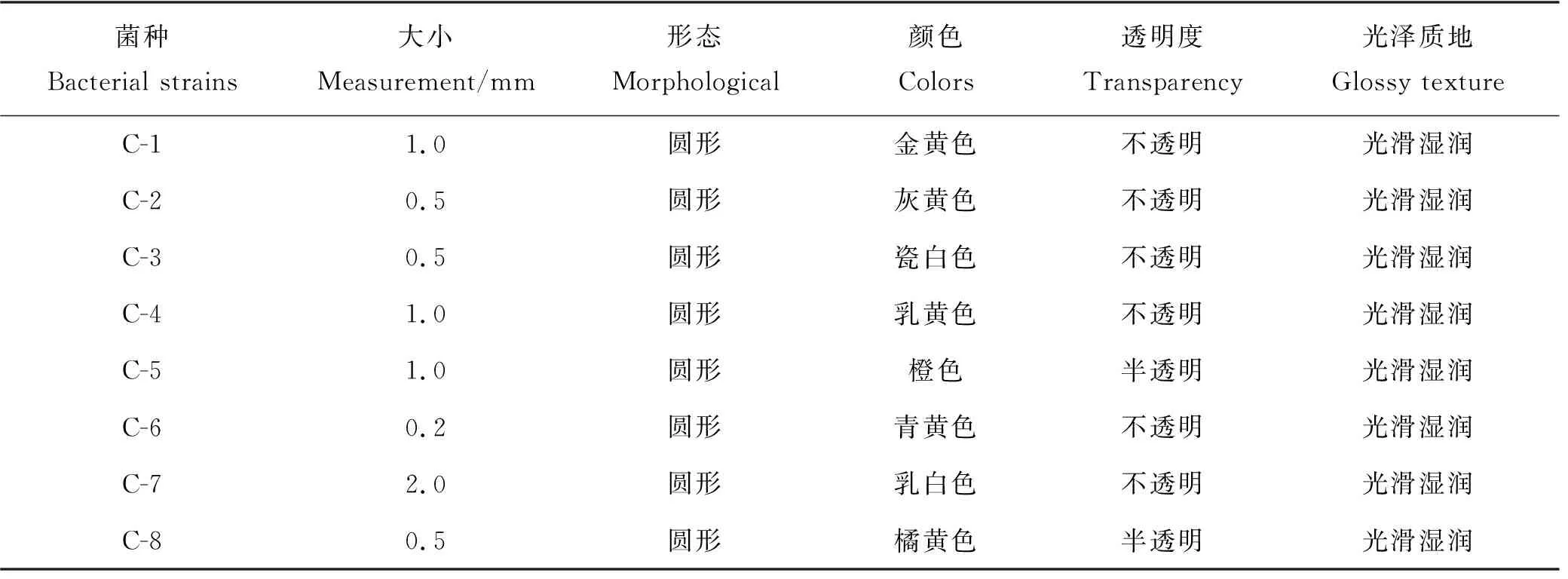
表1 分离菌株菌落的表观特征Table 1 Apparent characteristics of the isolated strain colonies
运用PCR方法,本文获得了8株细菌的16S rDNA部分序列,与EzBioCloud server数据库的标准菌株比对,利用Neighbor-jionig(NJ)法构建系统发育树,结果如图1所示。菌株C-1和C-7分别属于α变形菌门的赤细菌属(Erythrobactersp.)和海杆菌属(Marinibacteriumsp.);菌株C-4属于γ变形菌门的盐单胞菌属(Halomonassp.);菌株C-2、C-3和C-8分布于厚壁菌门两个不同的科,菌株C-2与C-3均为葡萄球菌属(Staphylococcussp.),菌株C-8属于芽孢杆菌属(Bacillussp.);菌株C-5为拟杆菌门中的鼠尾菌属(Muricaudasp.),菌株C-6属于放线菌门的纤维单胞菌属(Cellulomonassp.)。
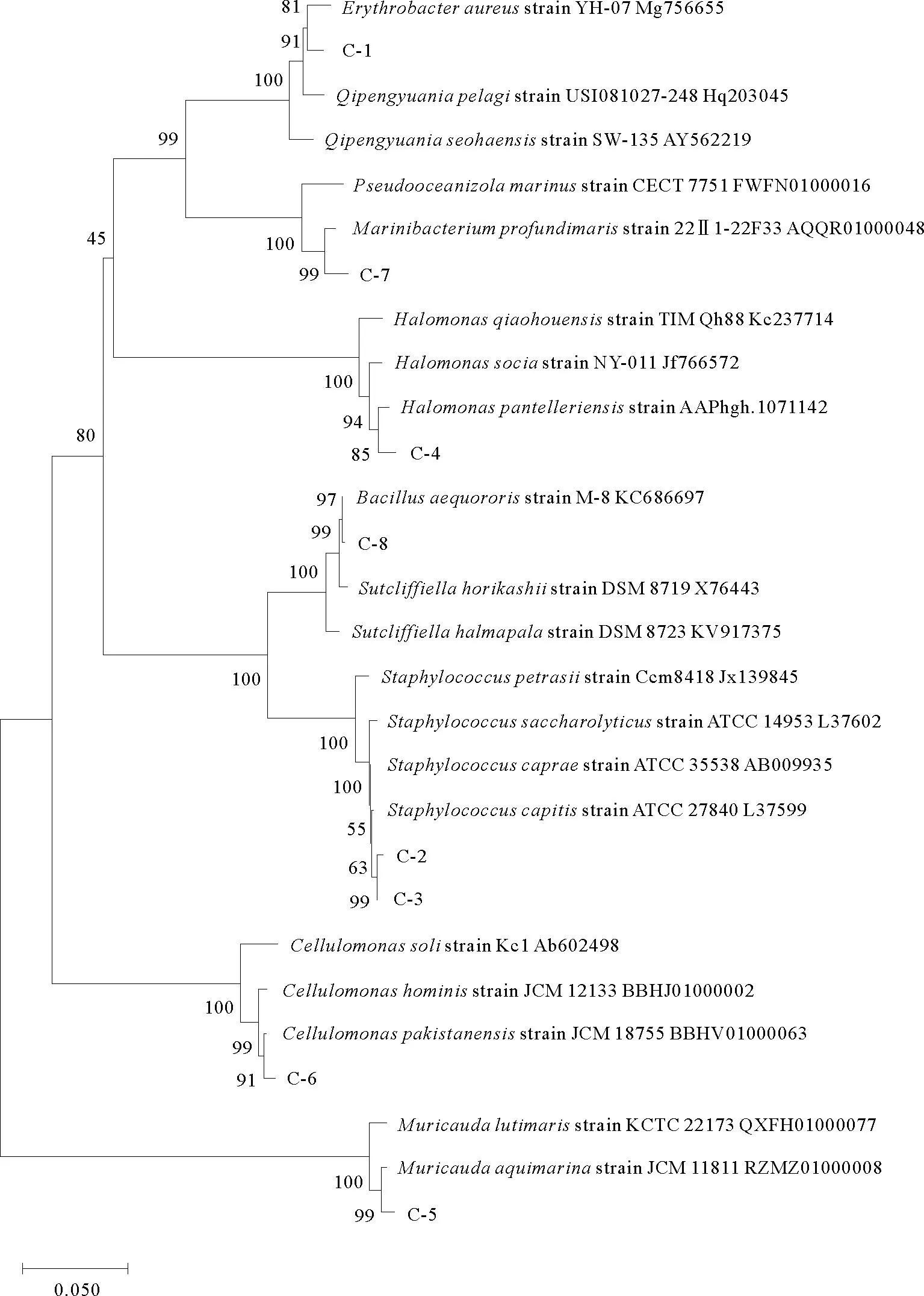
图1 基于16S rDNA部分序列构建的8株细菌(C-1—C-8)的系统发育树Fig.1 Phylogenetic tree of eight strains of bacteria(C-1—C-8)based on partial 16S rDNA sequences
2.2 共培养体系中微藻与细菌的生长情况
无菌纯培养时,小环藻从初始接种的2.0×105cells/mL增长至第4天进入平台期,细胞数维持在(4.8±0.1)×105cells/mL,藻细胞密度增加了1倍以上(见图2)。菌株C-2与C-3分别与小环藻构建的菌藻体系中,培养的8 d时间内,藻细胞密度虽均有增长,但总是低于无菌纯培养对照组。实验结束时,两个藻菌共培养体系的藻细胞数分别比无菌纯培养对照组降低了(6.4±0.5)%和(10.1±1.5)%。而其他6株藻菌构建的共培养体系,与对照组相比,小环藻的细胞数目均显著性增加,说明这6株分离菌均对小环藻的生长有促进作用。其中,菌株C-1和C-7的促进效果最好,培养至第8天,微藻细胞数分别为(6.2±0.2)×105和(6.0±0.5)×105cells/mL,分别比对照组提高了(27.1±1.6)%和(23.9±3.9)%。菌株C-4、C-5、C-6和C-8共培养体系的藻细胞密度分别比对照组提高了(13.5±0.7)%、(5.3±0.9)%、(15.1±1.4)%和(8.7±0.8)%(见图2和图3)。

(Co-C-1:无菌隐秘小环藻与菌株C-1共培养;Co-C-2:无菌隐秘小环藻与菌株C-2共培养;Co-C-3:无菌隐秘小环藻与菌株C-3共培养;Co-C-4:无菌隐秘小环藻与菌株C-4共培养;Co-C-5:无菌隐秘小环藻与菌株C-5共培养;Co-C-6:无菌隐秘小环藻与菌株C-6共培养;Co-C-7:无菌隐秘小环藻与菌株C-7共培养;Co-C-8:无菌隐秘小环藻与菌株C-8共培养。Co-C-1:Axenic C.cryptica co-cultivation with strain C-1;Co-C-2:Axenic C.cryptica co-cultivation with strain C-2;Co-C-3:Axenic C.cryptica co-cultivation with strain C-3;Co-C-4:Axenic C.cryptica co-cultivation with strain C-4;Co-C-5:Axenic C.cryptica co-cultivation with strain C-5;Co-C-6:Axenic C.cryptica co-cultivation with strain C-6;Co-C-7:Axenic C.cryptica co-cultivation with strain C-7;Co-C-8:Axenic C.cryptica co-cultivation with strain C-8.)图2 隐秘小环藻与细菌共培养的生长曲线Fig.2 Growth curve of C.cryptica in the co-culture with the isolated strains

图3 隐秘小环藻与细菌共培养第8天细菌促进/抑制小环藻生长的百分比Fig.3 Percentage of growth promotion/ inhibition by the bacteria in 8th day of C.cryptica co-culture with the isolated bacterial strains
伴随着微藻的生长,菌株C-1、C-2、C-4和C-7均能在共培养体系中稳定生长,在培养第4~8天,菌细胞数目保持相对稳定,菌落数分别为7.35×107、4.87×107、3.57×107和4.0×107CFU/mL(见图4)。而菌株C-3在共培养的第1和第2天迅速繁殖,之后菌落数在4×107CFU/mL左右剧烈波动。菌株C-6在共培养前4 d快速生长,至第4天菌落数为5.5×107CFU/mL,但在第6天后迅速死亡,第8天菌落数仅为3.2×107CFU/mL。菌株C-5在培养前2 d有所生长,随后菌落数下降至初始接种量水平。菌株C-8在共培养过程中始终生长缓慢,培养第8天,菌落数仅为1.95×107CFU/mL。
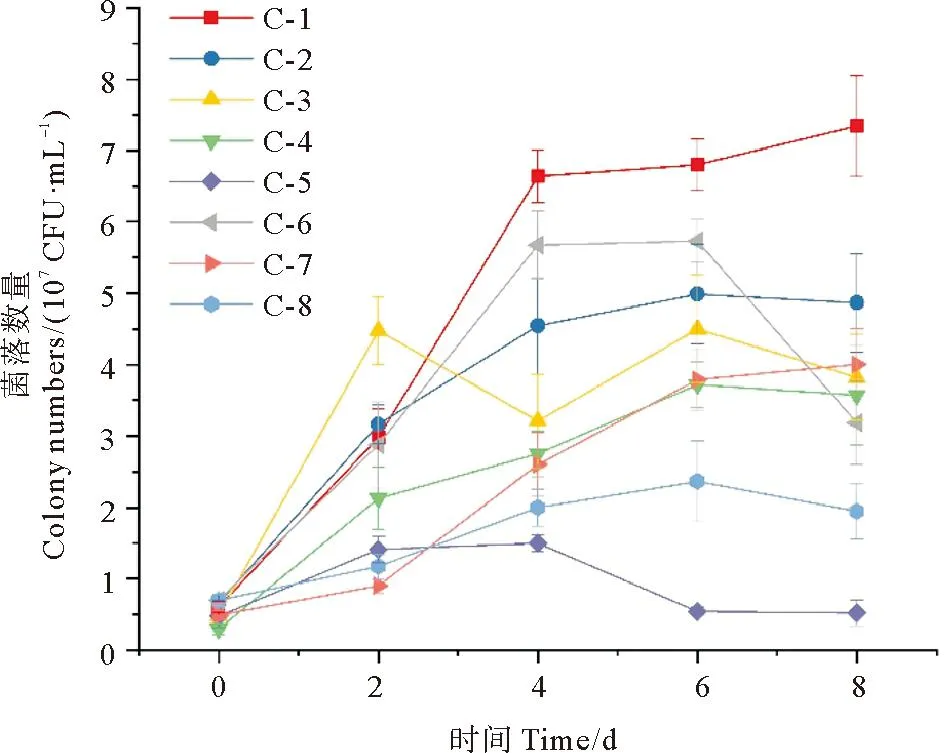
图4 共培养体系中细菌的菌落数量Fig.4 Colony numbers of the isolated bacterial strains in the co-culture system
综合上述细菌促生长效果与其自身在共培养体系中的生长情况,菌株C-1、C-4与C-7可能是隐秘小环藻的促生菌。
2.3 隐秘小环藻脂质含量与脂肪酸组成
分别与菌株C-1、C-4和C-7共培养8 d,所有实验组小环藻均生长至平台期,其最终干质量含量分别为0.31、0.26和0.29 g/L(见表2),比无菌纯培养分别提高了29.17%、8.33%和20.83%。与菌株C-1共培养,获得最高的脂质含量(43.53%)和脂质产率(16.69 mg·L-1·d-1),分别比无菌纯培养提高了8.93%和37.37%(P<0.05)。菌株C-4与C-7并未显著改变小环藻的脂质含量(P>0.05),但由于C-7显著提高了小环藻的终生物量(0.29 g·L-1),因此脂质产率比无菌纯培养提高了24.61%。

表2 与菌株共培养下隐秘小环藻的干质量和脂质产率Table 2 Dry weight and lipid productivities of C.cryptica co-cultured in co-culture with different strains of bacteria
气相色谱(Gas chromatography)分析(见图5)显示,隐秘小环藻的主要脂肪酸种类为C16∶0、C16∶1、C17∶1和C20∶5 n-3(EPA),这些脂肪酸占总脂肪酸的76%左右。隐秘小环藻中单不饱和脂肪酸(Monounsaturated fatty acid)含量最高,占总脂肪酸的43.16%±2.70%,其次为饱和脂肪酸(Saturated fatty acid),占总脂肪酸的36.03%±1.92%,而多不饱和脂肪酸(Polyunsaturated fatty acid)仅为20.66%±2.34%。菌株C-1、C-4、C-7并未显著改变小环藻饱和脂肪酸、单不饱和脂肪酸与多不饱和脂肪酸的比例(P>0.05),但棕榈油酸甲酯含量为(26.38%±1.20%)~(26.73%±1.38%),显著低于无菌纯培养的29.95%±1.76%(P<0.05)。与菌株C-7共培养的藻细胞中十七烷酸甲酯和EPA含量为14.07%±0.75%和14.77%±0.84%,分别比无菌纯培养提高了6%和7.8%。与菌株C-1共培养的藻细胞中十七酸甲酯含量为9.66%±0.05%,比无菌纯培养提高了7.5%。说明细菌对小环藻的脂肪酸组成虽有影响,但影响不显著。

((a) 不同种类脂肪酸的占比;(b) 饱和脂肪酸、单不饱和脂肪酸与多不饱和脂肪酸的占比。数据为三次重复的平均值。(a) Percentage of different types of fatty acids;(b)Percentage of SFA、MUFA and PUFA. Data are mean values of three repetitions.)图5 与细菌共培养8天后隐秘小环藻的脂肪酸组成Fig.5 Fatty acid profile of C.cryptica after 8 days of co-culture with bacteria
2.4 溶解有机碳和溶解无机碳浓度
隐秘小环藻与菌株C-1和C-7共培养体系中溶解有机碳(DOC)与溶解无机碳(DIC)含量变化如图6所示,随着培养时间的延长,无菌纯培养对照组和2个藻菌共培养体系的DOC和DIC浓度均呈现出增高趋势,但共培养体系中的DOC始终低于无菌纯培养对照组,DIC始终高于无菌纯培养对照组。培养第4天,菌株C-1共培养体系的DOC浓度为(50.3±2.7) mg/L,显著低于对照组的(67.3±8.5) mg/L;而菌株C-7共培养体系的DOC含量与对照组无显著性差异(P>0.05)。但在培养第7天,菌株C-1、C-7共培养体系的DOC含量分别为(86.2±12.2) mg/L和(108.9±7.8) mg/L,分别比对照降低了28.4%和9.6%(P<0.05)。
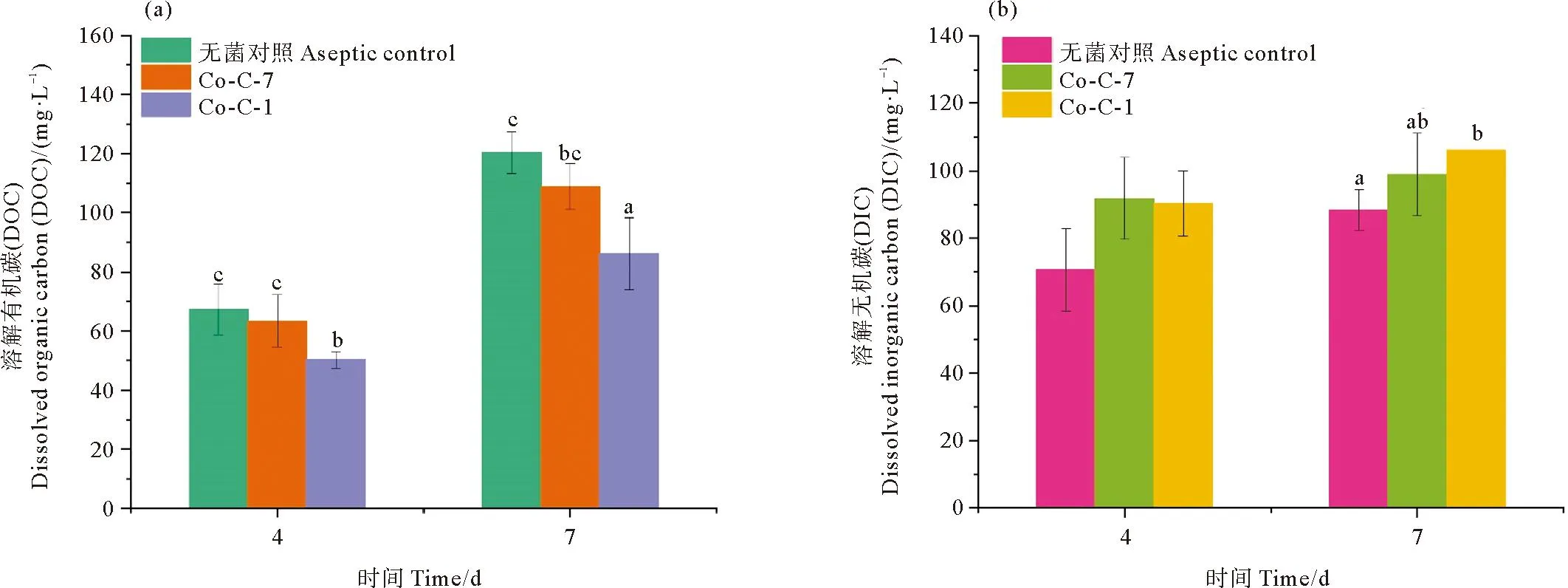
((a)DOC含量的变化;(b)DIC含量的变化。Co-C-1: 无菌隐秘小环藻与C-1共培养组;Co-C-7: 无菌隐秘小环藻与C-7共培养组。(a)Changes in DOC content; (b)Changes in DIC content. Co-C-1:Group of axenic C.cryptica co-cultivation with C-1;Co-C-7:Group of axenic C.cryptica co-cultivation with C-7.)图6 隐秘小环藻细菌共培养体系中DOC和DIC含量的变化Fig.6 Changes of DOC and DIC content in co-culture system of C.cryptica with bacteria
2个藻菌共培养体系中的DIC含量在第4天均与对照组无显著差异(P>0.05),到第7天C-1共培养体系中DIC含量为106 mg/L,比对照显著提高了20%(P<0.05),C-7共培养体系中DIC含量为(98.9±12.2) mg/L,仅比对照显著提高了12%(P>0.05)。
2.5 胞外聚合物浓度的变化
隐秘小环藻与菌株C-1和C-7构建的藻菌共培养液中多糖与蛋白浓度的变化如图7所示。培养前4 d,2个藻菌共培养液的上清胞外聚合物(Soluble-extracellular polymeric substances,SL-EPS)的多糖和蛋白浓度与无菌纯培养之间无显著差异(P>0.05),但在第4天后,共培养液中SL-EPS的浓度较无菌纯培养显著降低。其中,与菌株C-1共培养第6天SL-EPS多糖和蛋白浓度分别为(6.4±0.5) mg/L和(5.0±0.4) mg/L,分别比无菌纯培养对照组降低了27.3%和66.4%(P<0.05)。与菌株C-7共培养第6天,SL-EPS多糖和蛋白浓度分别为(7.6±1.0) mg/L和(9.3±1.0) mg/L,分别比无菌纯培养对照组降低了13.6%和37.6%(P<0.05)(见图7(a)、图7(c))。
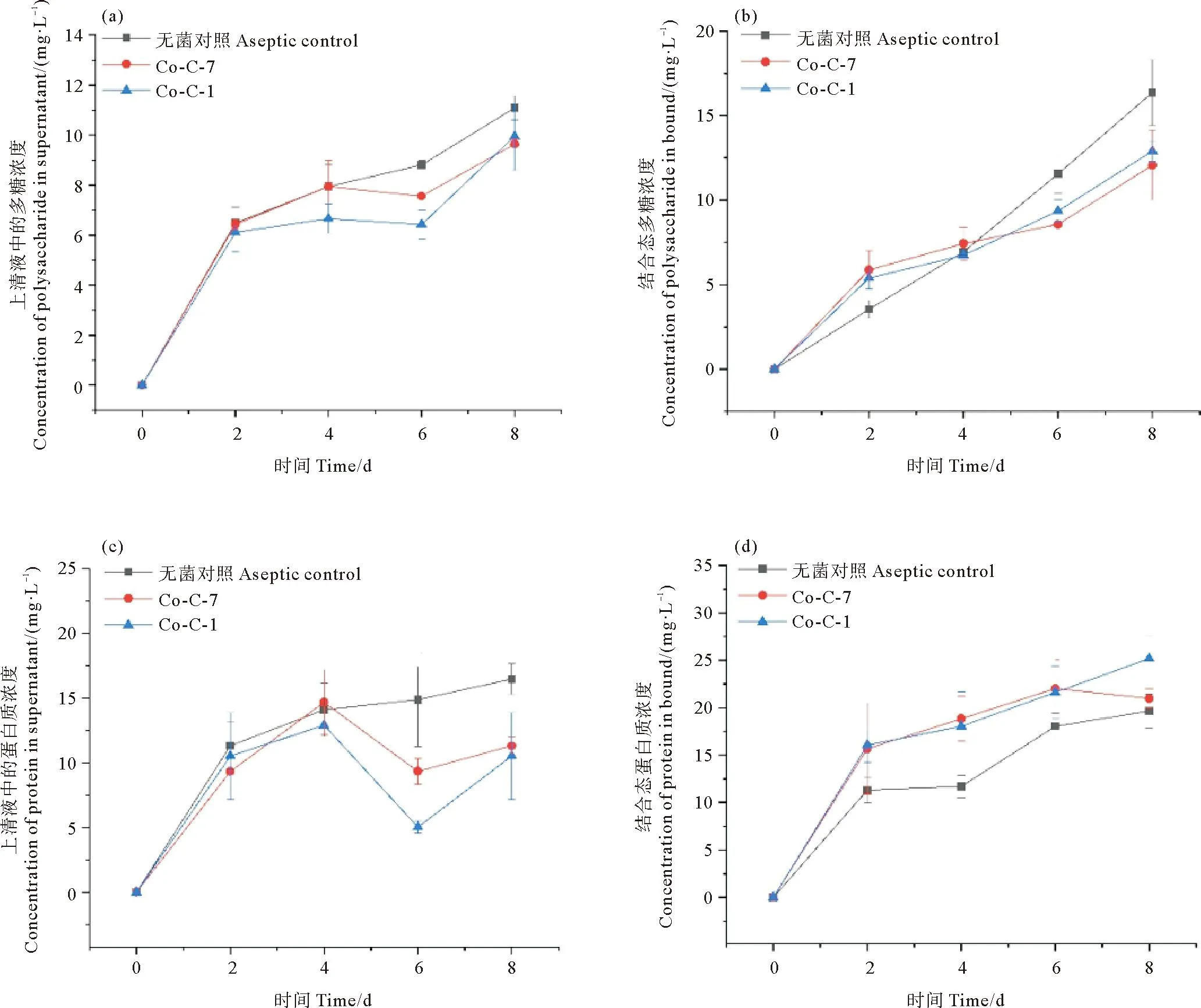
((a) SL-EPS多糖含量的变化; (b) B-EPS多糖含量的变化; (c) SL-EPS蛋白含量的变化; (d) B-EPS蛋白含量的变化。Co-C-1: 无菌隐秘小环藻与C-1共培养组;Co-C-7: 无菌隐秘小环藻与C-7共培养组。(a) Changes in polysaccharide concentration of SL-EPS; (b) Changes in polysaccharide concentration of B-EPS; (c) Changes in protein concentration of SL-EPS; (d) Changes in protein concentration of B-EPS. Co-C-1: Group of axenic C.cryptica co-cultivation with C-1; Co-C-7: Group of axenic C.cryptica co-cultivation with C-7.)图7 隐秘小环藻细菌共培养胞外聚合物浓度的变化Fig.7 Changes in the concentration of extracellular polymers in Co-culture of C.cryptica and bacteria
菌株C-1和C-7藻菌共培养液的结合胞外聚合物(Bound-extracellular polymeric substances,B-EPS)的多糖浓度在第2天分别为(5.4±0.6) mg/L和(5.9±1.1) mg/L,分别比对照提高了54.3%和68.6%;共培养至第4天,菌株C-1和C-7藻菌共培养的多糖浓度分别升至(6.7±0.4) mg/L和(7.4±0.9) mg/L。但随后共培养体系的B-EPS多糖浓度均显著低于对照;至培养第8天时,菌株C-1、C-7共培养体系的B-EPS多糖分别为(12.9±0.6) mg/L和(12.1±2.1) mg/L,分别比对照组的(16.4±1.9) mg/L降低了21.3%和26.2%(见图7(b));而共培养体系的B-EPS蛋白浓度在整个培养过程中始终高于无菌纯培养对照组,在培养第4天,菌株C-1、C-7共培养体系的B-EPS蛋白含量分别为(18.1±3.6) mg/L和(18.8±2.4) mg/L,与对照组差别最大,分别比对照组提高了54.7%和60.7%(见图7(d))。
3 讨论
微藻在自然界或规模化养殖过程中,其藻际微环境中存在着丰富的细菌群落[20]。已有的研究显示,无菌培养条件下,微藻在自营养条件下的生长速度普遍非常缓慢[30]。同样,本研究中无菌培养的隐秘小环藻,其生物量比原始藻株降低了16%[24]。微藻的培养液中可能存着在促进该藻株生长的细菌。本研究从隐秘小环藻藻液中分离鉴定8株细菌,分别与无菌隐秘小环藻共培养,结果显示,菌株C-1、C-4、C-7和C-6对隐秘小环藻的生长具有明显的促进作用。且菌株C-1、C-4和C-7均能在藻液中随着隐秘小环藻的生长而稳定增殖,培养第8天实验结束时,细菌数目达到初始接种量的8~12倍。Cho等[5]发现小球藻藻际中存在4株细菌可显著增加藻细胞数量(>100%),且其中2株细菌在藻菌共培养后期迅速生长。周真真等[31]研究发现,6株藻际分离细菌均能促进微藻的生长,但只有2株细菌能够在藻菌共培养体系中稳定繁殖,且只有这2种藻菌体系能够保持相对稳定。本研究中菌株C-6在共培养初期快速繁殖,在培养第8天时死亡。因此,菌株C-6可能无法与隐秘小环藻维持长期稳定的共生关系。虽然菌株 C-5和C-8也促进了小环藻的生长(<10%),但这2株菌在藻液中始终增殖缓慢,这可能是由于隐秘小环藻分泌了限制细菌生长的化合物或细菌对隐秘小环藻胞外有机物的利用能力较弱导致的[32]。同时,本研究发现菌株C-2和C-3属于Staphylococcussp.,均抑制了小环藻的生长。某些细菌可能与微藻竞争营养物质,产生抑制微藻生长的代谢产物,或分泌杀藻物质导致藻细胞溶解[33]。一个成功的藻菌共生系统应该对该系统中所有的微生物都有益。因此,本研究分离的菌株C-1和C-7是隐秘小环藻理想的促生菌株,可与小环藻构建藻菌共培养体系。
研究表明,与促生菌共培养不仅可以提高微藻生物量,还可能有利于脂质的积累[34-37]。本研究中,与菌株C-1共培养,可同时提高隐秘小环藻的生物量和脂质含量,最终提高了隐秘小环藻的脂质产率。菌株C-7可提高隐秘小环藻的生物量,但并未显著改变小环藻的脂质含量。Croft等发现,Halomonassp.可吸收利用藻类分泌的DOC,产生维生素B12促进微藻生长[38]。Amin等[39]发现Marinibacteriumsp.释放弧菌铁蛋白螯合Fe3+供微藻利用,同时微藻产生DOC支持细菌生长。本研究结果显示,藻菌共培养体系中的DOC浓度始终低于无菌纯培养对照组。DIC浓度始终高于无菌纯培养对照组。这说明藻菌之间的碳交换可能发挥了重要作用[9]。微藻释放的DOC被细菌降解利用,同时,由于藻类向细菌提供了固定碳,细菌大量繁殖,代谢活动产生的DIC含量升高,增强了微藻光合作用的无机碳供应,从而促进了微藻的生长。
胞外聚合物(EPS)在藻际环境中具有重要的生态功能,可影响藻菌共生关系的建立以及调节藻际微生物群落组成等[40-42]。藻际环境中的EPS可分为上清EPS和细胞结合态EPS,这两部分EPS均主要由多糖和蛋白组成。本研究中,与无菌纯培养对照组相比,藻菌共培养体系中上清多糖与上清蛋白的浓度均有所降低,表明细菌可能利用这部分EPS作为碳与能量的来源,降低了上清EPS的积累速率。Bruckner等[43]研究发现,拟杆菌-32可大幅降低上清多糖含量并增加结合多糖水平,上清多糖的减少可能是由于细菌的直接消耗,或通过减少上清多糖,而优先形成结合多糖来增加细菌在藻细胞上的附着,以此加强两者之间的相互作用。本研究中,菌株C-1和C-7共培养体系的结合蛋白浓度显著高于对照组,尤其是在培养第4天达18.1~18.8 mg/L,比对照组提高了60%左右,而结合多糖的含量在培养前期高于对照组,第4天后较对照组有所降低。这说明在共培养前期,藻类可能通过分泌的较高水平的结合多糖吸引细菌在藻细胞表面附着[44],培养后期通过降低结合多糖的含量,增加结合蛋白浓度,增强细菌与微藻之间的紧密连接[45],以促进二者之间的相互作用,维持共生系统的稳定性。
4 结语
本研究从隐秘小环藻藻液中分离纯化出8株可培养细菌,经16S rDNA序列比对分析,8株可培养细菌分别是Erythrobactersp.(C-1)、Staphylococcussp.(C-2和C-3)、Halomonassp.(C-4)、Muricaudasp.(C-5)、Cellulomonassp.(C-6)、Marinibacteriumsp.(C-7)和Bacillussp.(C-8),其中菌株C-1和C-7为促生菌。这2株促生菌分别与隐秘小环藻构建藻菌共培养体系,均可显著提高微藻的生物量和脂质产率。菌株C-1和C-7可吸收利用隐秘小环藻分泌的DOC,同时释放DIC。同时,细菌对共培养体系中不同种类的EPS影响不同,这反映出隐秘小环藻与细菌之间的相互作用关系。本研究结果为探究藻菌互作和微藻的规模化养殖提供了一条新策略。

