围术期血压变异性对肝移植术后急性肾损伤的影响
徐磊,张韬,曹林,周斌,段满林
南京大学医学院附属金陵医院 麻醉科,江苏 南京 210002
肝移植是终末期肝病最有效的治疗措施,然而肝移植术后急性肾损伤[1](post-liver transplant acute kidney injury,post-LT AKI)是影响手术成功率和受者长期生存率的主要原因。一项纳入了13 422例患者的荟萃分析结果显示:post-LT AKI的发病率高达40.7%[2]。post-LT AKI由多种因素引起,包括炎症反应、不稳定的血流动力学、超负荷容量状态和暴露于肾毒性药物,常见原因是围术期低血压导致的器官缺血和再灌注损伤[3-4]。平均动脉压(mean arterial pressure,MAP)低于65 mmHg的绝对阈值或下降超过基线血压的20%与肾损伤显著相关[5-6]。然而不仅是术中低血压与post-LT AKI关系密切,术中血压其他方面仍值得关注。理论上,生理范围内血压的频繁变化也可导致灌注失衡,尽管血压一直高于低血压阈值[7]。血压变异性(blood pressure variability,BPV)用来描述这种频繁的血压波动,是血流动力学、神经体液、行为和环境因素相互作用的结果。多项研究表明,除了传统的血压外,BPV的评估和定量还可以提供重要的病理生理和预后信息,BPV已被证明是痴呆、中风、终末期肾病、心血管事件和死亡率的独立风险因素[8-9]。终末期肝病患者常合并肾损伤,且手术时间长,术中常伴随着下腔静脉阻断与开放等因素使得术中血压管理变得异常困难。手术室血压多采用动脉血压实时持续监测,为研究围术期血压变化提供了可能,本研究通过回顾我单位移植中心近10 年来的肝移植围术期血压数据,分析术中BPV是否影响术后post-LT AKI的发生。
1 资料和方法
1.1 一般资料
回顾性收集南京大学医学院附属金陵医院2013年6月1日至2023年5月31日期间于全身麻醉下行肝移植的受者临床资料。
病例纳入标准:(1)拟全身麻醉下首次行肝移植术;(2)术前3个月内至少1次肌酐值为基线值。排除标准:(1)再次肝移植;(2)术前存在肾功能障碍(肌酐>133 μmol/L);(3)术前30 d内接受过手术;(4)术中发生心跳骤停;(5)肝肾联合移植;(6)数据采集不完整(术中动脉血压采集缺失大于10%);(7)术后7 d内未行肌酐值测量;(8)术后因吻合口漏、出血等再次手术干预。本研究获得医院临床试验伦理会批准(批号:2023DZKY-001-01),并免除了知情同意。
1.2 数据采集
本研究为回顾性病例-对照研究,为保证数据准确性,由两人分别同时收集肝移植受者的住院电子病历系统、麻醉记录单和实验室管理系统中的数据,并对数据进行整理和校对,不一致的地方由团队的第三人员介入,访问原始文件后组内讨论决定。收集患者年龄、性别、身体质量指数(body mass index,BMI)、原发病、美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级、终末期肝病模型(model for end-stage liver disease,MELD)评分、合并疾病、术前实验室检查、术中动脉血压数据、手术时间、无肝期时间、出血量、尿量、总输液量、输注悬浮红细胞、输注血浆、输注白蛋白、去甲肾上腺素、特利加压素、利尿剂。导出麻醉系统采集到的每分钟动脉血压数据集,缺失及异常值采用前后2个血压数据的平均值进行填充,对于异常值血压的判断采用以下标准:(1)仅测量收缩压或舒张压;(2)收缩压大于舒张压的10倍;(3)收缩压>300 mmHg或舒张压>200 mmHg;(4)测量收缩压<30 mmHg或舒张压<20 mmHg;(5)舒张压>收缩压的95%。
1.3 相关定义
依据2012 年改善全球肾脏病预后组织制定的诊断标准:48 h内肾脏功能急剧下降,血清肌酐浓度上升≥26.5 μmol/L,或血清肌酐浓度≥基础水平(已知或之前7 d内)的1.5 倍,或术后因AKI死亡或在90 d内透析。参照文献[10-11],本研究选取了4个指标用来描述BPV,分别为:MAP的标准差(standard deviation,SD),变异系数(coefficient of variation,CV),平均真实变异性(average real variability,ARV),独立于均值的变异(variation independent of mean,VIM)。低血压累积时间:术中MAP低于65 mmHg的累积时间;低血压累积面积:术中MAP低于65 mmHg的曲线下面积值。
1.4 统计学分析
采用SPSS 25.0 统计软件对数据进行分析,Shapiro-Wilk方法对计量资料进行正态性检验,符合正态分布的计量资料用()表示,组间比较采用两独立样本t检验;非正态分布的计量资料用[M(P25,P75)]表示,组间比较采用Mann-WhitneyU检验。计数资料以例(%)表示,组间比较采用χ2检验或Fisher确切概率法检验。对单因素分析中P<0.1(共线性变量仅纳入其中一个)及既往研究独立影响因素变量纳入多因素Logistic回归分析,用R软件(R4.2.2)的regplot包构建列线图模型,使用受试者工作特征曲线、校准曲线及拟合优度检验评估预测效果。P<0.05为差异有统计学意义。
2 结果
2.1 纳入对象及分组
2013年6月1日至2023年5月31日期间于我院共有458例肝移植。根据排除标准:2例为二次肝移植,3例已合并肾功能障碍,1例术前30 d内接受过肺部手术,2 例术中发生心跳骤停而进行了较长时间的复苏,2例肝肾联合移植,8例数据采集不完整(术中动脉血压采集缺失大于10%),3例术后因吻合口漏、出血等再次手术,本研究共排除21 例,最终纳入437例。根据诊断标准有162例出现AKI,发生率为37.07%;根据术后是否发生AKI分为AKI组(n=162)和NO-AKI组(n=275)。
2.2 post-LT AKI术前因素分析结果
两组肝移植受者术前因素分析,AKI组合并糖尿病病史的受者有59例(36.4%),相比NO-AKI组62例(22.5%)差异具有统计学意义(P=0.002);年龄、性别、BMI、原发病、ASA分级、MELD评分、COPD、术前实验室检查在两组间差异无统计学意义(P>0.05)。见表1。
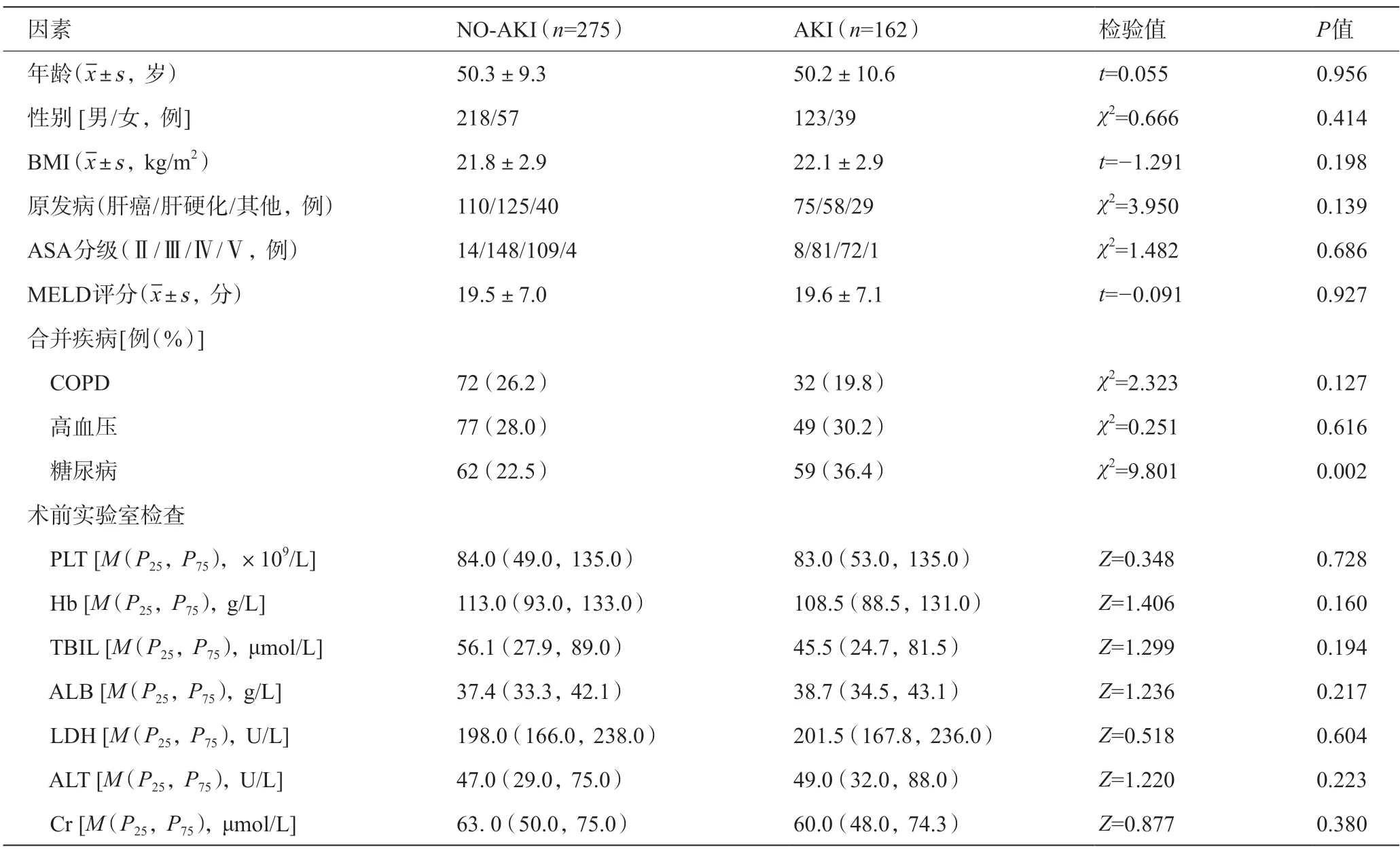
表1 post-LT AKI的术前因素分析结果
2.3 post-LT AKI术中因素分析结果
两组肝移植受者术中因素分析,AKI组与NOAKI组相比:CV、ARV、VIM、MAP低于65 mmHg累积时间、MAP低于65 mmHg累积面积、术中出血量、术中尿量、使用特利加压素等因素差异具有统计学意义(P<0.05)。而MAP、SD、手术时间、无肝期时间、总输液量、术中输注悬浮红细胞、输注血浆、输注白蛋白、使用去甲肾上腺素和使用利尿剂等因素两组间差异无统计学意义(P>0.05)。见表2。

表2 post-LT AKI的术中因素分析结果
2.4 post-LT AKI的多因素Logistic回归分析结果
将单因素分析P<0.1 或既往文献中指出的AKI的独立危险因素纳入多因素Logistic回归分析,结果显示:糖尿病[OR=2.141,95%CI1.267-3.616,P=0.004]、ARV [OR=1.149,95%CI1.091-1.209,P<0.001]、VIM [OR=2.430,95%CI1.303-4.533,P=0.005]、MAP低于65 mmHg累积时间[OR=1.051,95%CI1.028-1.073,P<0.001]、MAP低于65 mmHg累积面积[OR=1.008,95%CI1.004-1.012,P<0.001]、术中出血量增加[OR=1.017,95%CI1.002-1.032,P=0.029]是post-LT AKI的独立危险因素;术中尿量增加[OR=0.935,95%CI0.902-0.968,P<0.001]和使用特利加压素[OR=0.582,95%CI0.359-0.942,P=0.028]是post-LT AKI的保护因素。见表3。
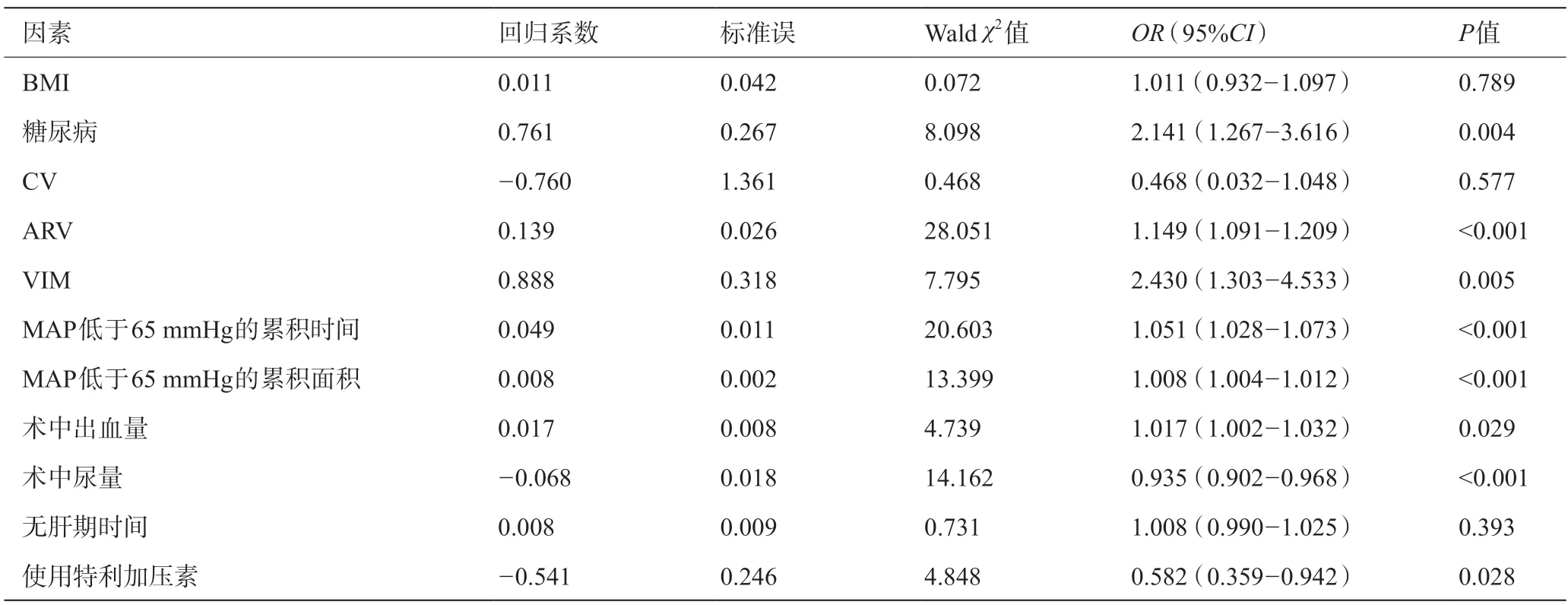
表3 post-LT AKI的多因素Logistic回归分析结果
2.5 预测post-LT AKI的列线图模型
利用以上影响因素(P<0.05)构建列线图预测模型(图1),其ROC曲线下面积(AUC)为0.833,95%CI为0.800-0.875(图2);进行拟合优度检验提示拟合优度较好(χ2=14.503,P=0.07)。为进一步评估列线图模型及临床应用价值,绘制了校正曲线(图3)和决策曲线(图4),均提示模型临床适用性较好。
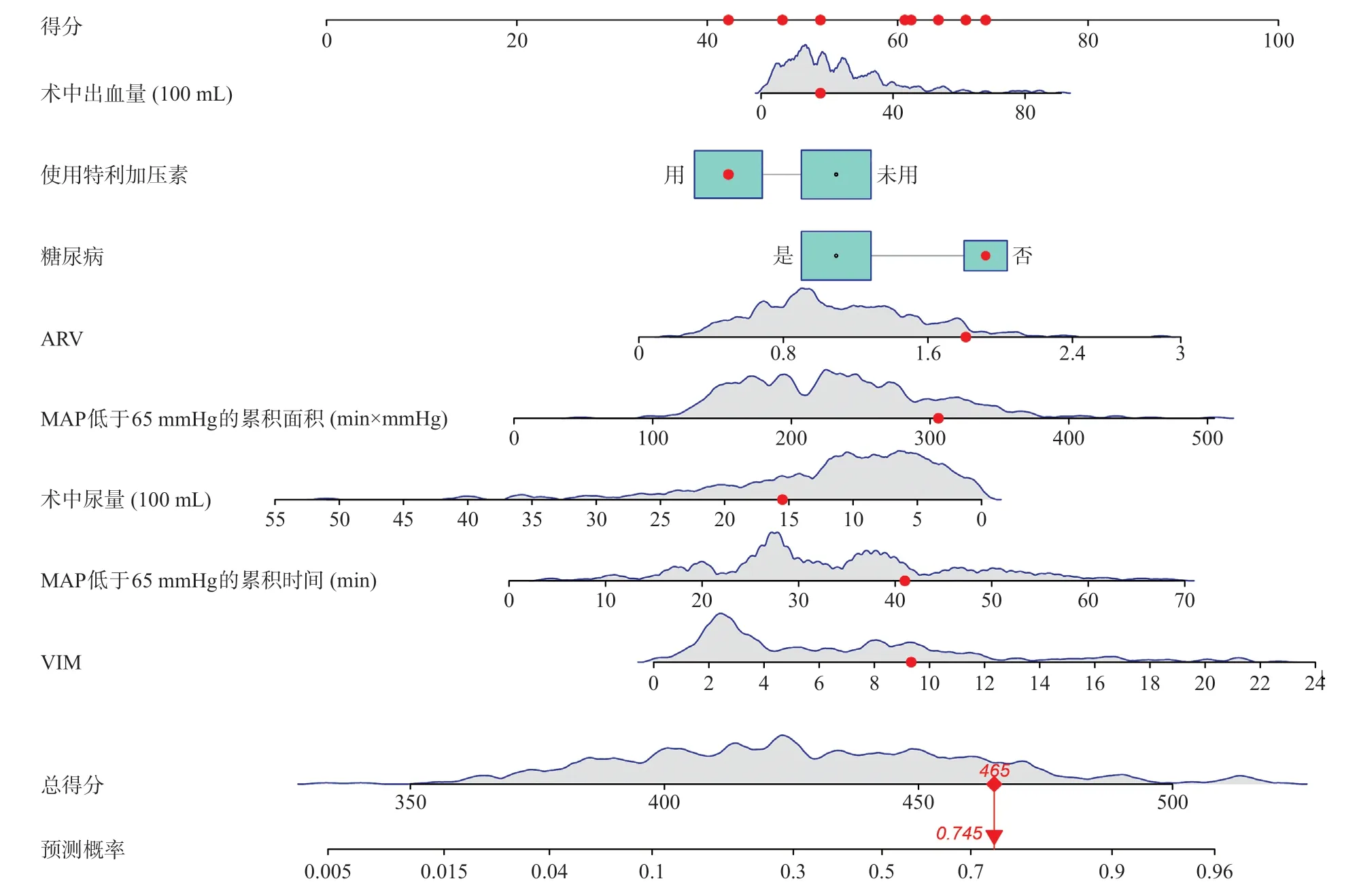
图1 post-LT AKI列线图模型构建(圆点为第一例受者的预测结果)
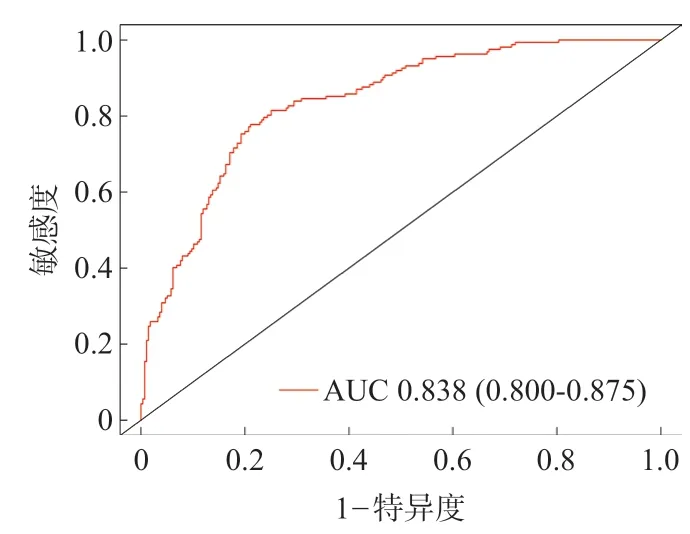
图2 post-LT AKI预测模型的ROC曲线
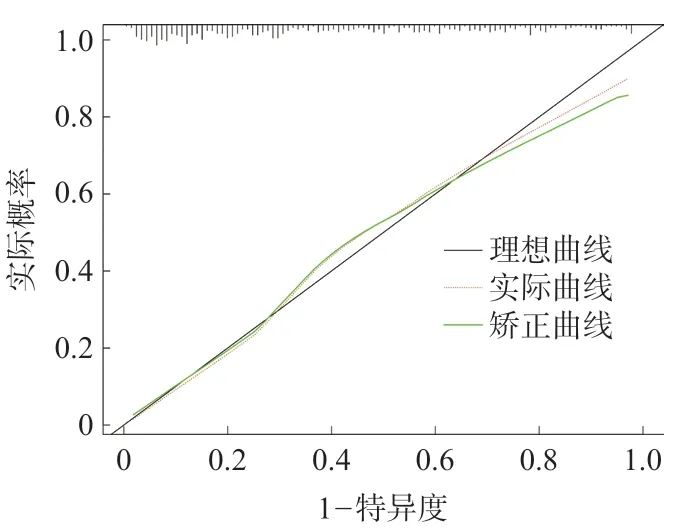
图3 post-LT AKI预测模型的校正曲线
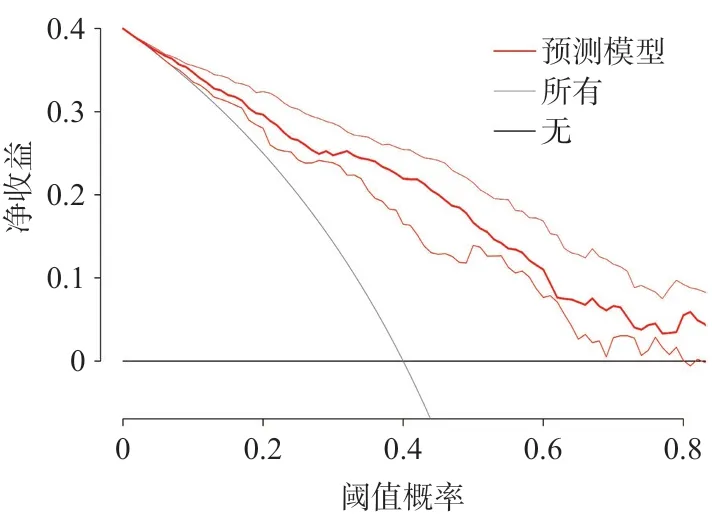
图4 post-LT AKI预测模型的决策曲线
3 讨论
低血压是影响肾脏灌注最常见的指标,与post-LT AKI关系密切,但在既往研究中未纳入这一关键变量[12]。本研究将MAP 65 mmHg作为低血压阈值,结果与Park等[11]的结果一致:无论是低血压的累积时间还是累积面积都与post-LT AKI发生率高度相关。不同的是,因肝终末期患者特殊的病理生理学机制,其术中低血压常难以避免,在Park等[11]的探索队列中,29.5%的患者未发生低血压,而本研究中100%的受者存在低血压(最低累积时间4 min)。在肝移植下腔静脉阻断和再开放的几分钟内,受者易出现低血压且常难以纠正,麻醉医师可通过了解手术进程,预先给予处理,进而缩短低血压持续时间,以获得最佳器官灌注[13]。血压快速变化可能超过机体适应能力进而导致组织灌注紊乱,先前的研究已经证明短期BPV与肾脏损伤之间存在关联[14-16]。然而哪种维度的BPV更具有意义,尚无明确的结论。ARV是连续血压测量之间绝对差异的平均值,对单个血压测量顺序更敏感,是表示短期变化的较好指标[17],但由于ARV和平均血压密切相关,基于ARV的预后模型无法排除平均血压的影响。为了避免这种影响,VIM是一种测量与平均血压无关的BPV新统计方法[18]。本研究为避免结果的偏倚,用4个维度描述BPV,结果表明ARV和VIM都与post-LT AKI独立相关。
BPV增高的潜在机制不完全清楚,但可从以下方面考虑。首先是容量超负荷可引起较大的动脉张力,从而降低血管调节血压的缓冲能力。其次,BPV与靶器官损伤的发展有关:包括大动脉硬度增加,微循环的血管重塑(介质/管腔比增加、管腔直径减小、血管舒张受损),炎症反应的激活,交感神经和肾素-血管紧张素-醛固酮系统的激活等,这会削弱主动脉调节和维持血压的能力[19-20]。另外,麻醉深度可能在BPV的形成中发挥作用,过量的麻醉药物会干扰自主神经系统的反应,导致交感神经抑制[21]。因此,可通过麻醉深度监测在一定程度上避免交感神经的过度抑制,维持血流动力学的稳定性。也有研究表明,联合口服钙通道阻滞剂和噻嗪类利尿剂在降低慢性高血压患者的BPV方面具有优越性[22],然而在术中应用钙通道阻滞剂是否可以降低围术期的BPV尚无此类型研究。
糖尿病会导致肾小球结构改变:基底膜增厚、足突融合和系膜基质增多等。高血糖使肾小球入球小动脉扩张同时出球小动脉收缩,使肾小球滤过压升高,进一步损伤肾单位,因此糖尿病常作为AKI的危险因素[23]。出血量增加会导致血液的携氧能力下降,组织器官灌注不足而造成肾损伤。维持足够的红细胞压积和心输出量,有助于增加或维持新肝再灌注前肾脏的静脉血氧饱和度,避免肾损伤[24]。尽管存在争议,术中尿量仍是预测AKI的关键指标,尤其是新肝期尿量,能更加贴切地反映肾脏组织灌注,关注围术期尿量可以更好地预测术后AKI。特利加压素为高选择性V1受体激动剂,具有强烈的内脏血管收缩性,可降低门静脉压力并增加肾灌注,在我们之前的统计分析中特利加压素可降低严重AKI的发生,并增加术中尿量[25]。另外,再灌注综合征常伴严重持续性低血压而造成肾损伤,近期研究表明预防性输注特利加压素也可降低肝移植受者的再灌注后综合征发生率[26]。
本研究尚存在一些不足。这是一项单中心回顾性研究,时间跨度长,手术操作及临床管理方面的一致性略差。其次,MAP常作为一个重要参数被纳入到与预后相关的研究中[27-28],本研究以MAP的变异性作为评估指标,但不排除研究收缩性血压变异性或舒张性血压变异性同样具有研究意义。另外,在评估AKI时未将术后尿量纳入结局的统计,这将导致一部分符合少尿诊断标准的AKI未纳入统计。鉴于围术期血压管理极度复杂,血管容量、血管活性药及手术操作都相互影响,本研究仅关注了血管活性药是否使用,未对使用剂量与BPV关系进一步定量分析,使用血管活性药和调节血管容量来降低BPV,是否会使患者获益更大,仍是一个庞大的课题。本研究利用单中心数据构建了预测模型,分析得出BPV与AKI显著相关,但样本量仍不足以找出BPV的几个维度的合理阈值,且模型未在其他医学中心进行外部验证,未来将进一步开展相关研究。
综上所述,肝移植术中MAP低于65 mmHg的累积时间、面积,ARV,VIM与术后AKI显著相关,未来开发带有BPV指标的监护仪可为临床医师提供重要参考;术前合理控制血糖、降低术中出血量和增加术中尿量对降低AKI具有积极意义,推荐术中泵注特利加压素以降低AKI的发生。

