肝内胆管癌患者根治性手术后肝衰竭和复发的术前危险因素分析
陈磊,何超,刘攀,付强,罗乾坤,张宏伟,秦涛
郑州大学人民医院 肝胆胰腺外科,河南 郑州 450003
肝内胆管癌(intrahepatic cholangicarcinoma,ICC)是临床上较为常见的一种原发性肝癌,近几年其发病率不断上升,在过去的40年里增加了120%以上[1]。ICC临床发现多为晚期,且恶性程度高、预后差、生存率低。许多患者诊断时已为晚期,从而丧失手术机会,只有约20%~40%患者适合进行根治性手术,且ICC患者术后复发率高达40%~80%,只有不到三分之一的患者在接受根治性手术切除后存活超过5年[2-3]。ICC患者术后发生肝衰竭同样是较为严重的致死性并发症之一。因此,术前预测ICC术后发生肝衰竭和复发的风险对临床ICC患者行手术治疗具有一定指导意义。本研究通过分析术前血肌酐与胱抑素C比值(creatinine-cystatin C ratio,CCR)及其他指标,探讨ICC患者术后发生肝衰竭及复发风险的危险因素。
1 资料和方法
1.1 一般资料
回顾性分析2017 年6 月至2022年6 月就诊于郑州大学人民医院(河南省人民医院)肝胆胰腺外科行ICC根治术(包括开腹和微创)治疗的患者。
纳入标准:(1)年龄≥18岁;(2)术前未进行任何辅助治疗,如:放疗、化疗、靶免治疗、介入栓塞治疗等抗肿瘤治疗;(3)术中冰冻表明手术切缘均为阴性、淋巴结清扫至阴性;(4)术后病理结果均为ICC;(5)术前患者手术指征符合ICC治疗指南及共识。排除标准:(1)合并其他器官功能衰竭;(2)术后因其他原因1年内死亡;(3)患者临床资料不完整或患者拒绝随访。
共纳入56例符合标准的病例,其中行腹腔镜根治术18例,开腹根治术38例;男22例,女34例,年龄32~82岁,平均(63.9±9.2)岁。根据术后是否复发,分为复发组(n=22)和非复发组(n=34),根据肝切除术后肝功能衰竭(post-hepatectomy liver failure,PHLF)的定义和分级[4],分为术后肝衰竭组(n=16)和非肝衰竭组(n=40)。
术前及术后相关临床指标及检查结果通过手术时住院期间病例资料记录查询。通过门诊、住院复查资料和电话进行随访,结局变量为术后1 年内复发或因复发导致的死亡。
1.2 统计学分析
所有数据采用SPSS 26.0统计软件分析,计量资料以()表示,组间比较采用t检验;计数资料组间比较采用χ2检验。通过受试者工作特征(receiver operating characteristic,ROC)曲线分析CCR对ICC患者术后复发和肝衰竭的预测价值,采用多因素Logistic回归分析影响ICC患者术后肝衰竭和复发的独立危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 ICC术后肝衰竭和复发的单因素分析
CCR在复发组和非复发组[(53.49±3.90)vs(72.46±2.10)]、肝衰竭组和非肝衰竭组[(54.67±4.49)vs(69.14±2.48)]中差异均有统计学意义;其他临床指标如体质量减轻≥5 kg、肝炎病毒定量≥104IU/mL、肿瘤低分化、肿瘤最大径≥5 cm、肿瘤数目多发以及有淋巴结转移与ICC患者术后1年内复发相关,详见表1;体质量减轻≥5 kg、肝炎病毒定量≥104IU/ML、既往胆管疾病史、肿瘤最大径≥5 cm以及肿瘤数目多发与术后肝衰竭相关,详见表2。
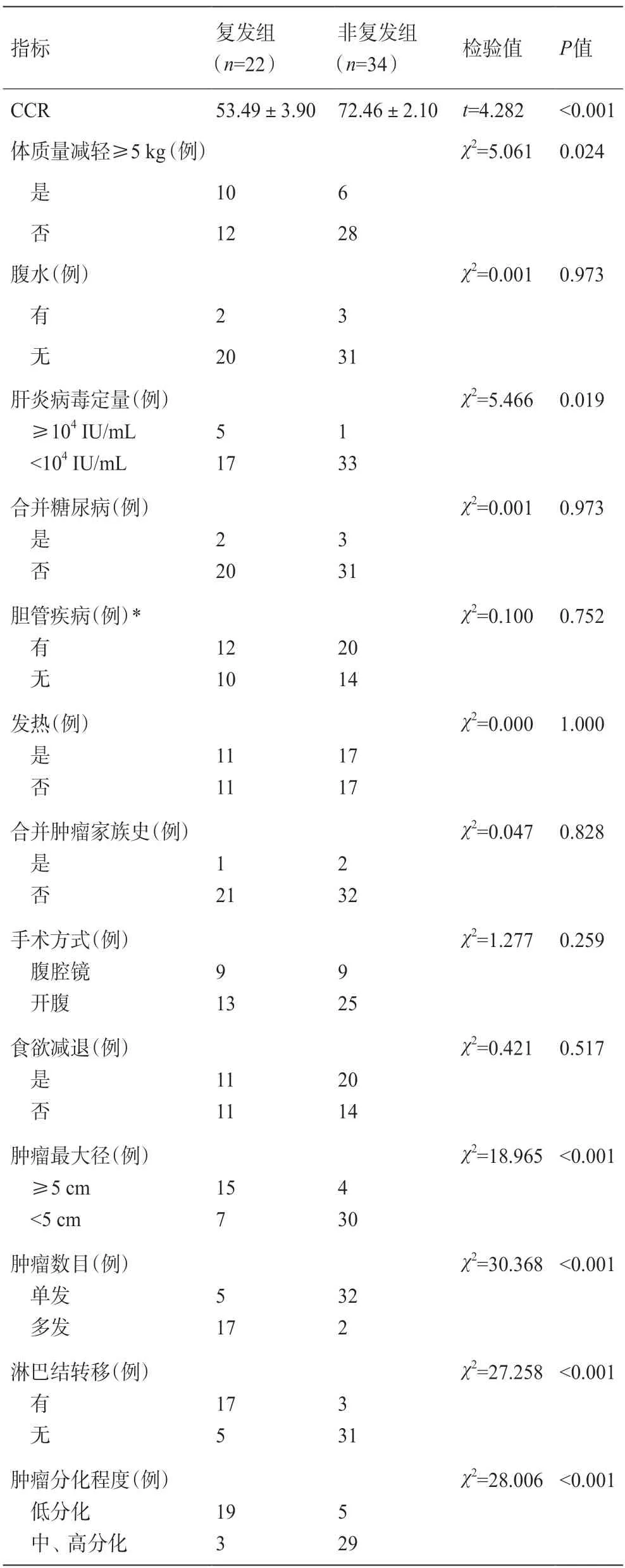
表1 ICC根治性手术后1年内复发的单因素分析
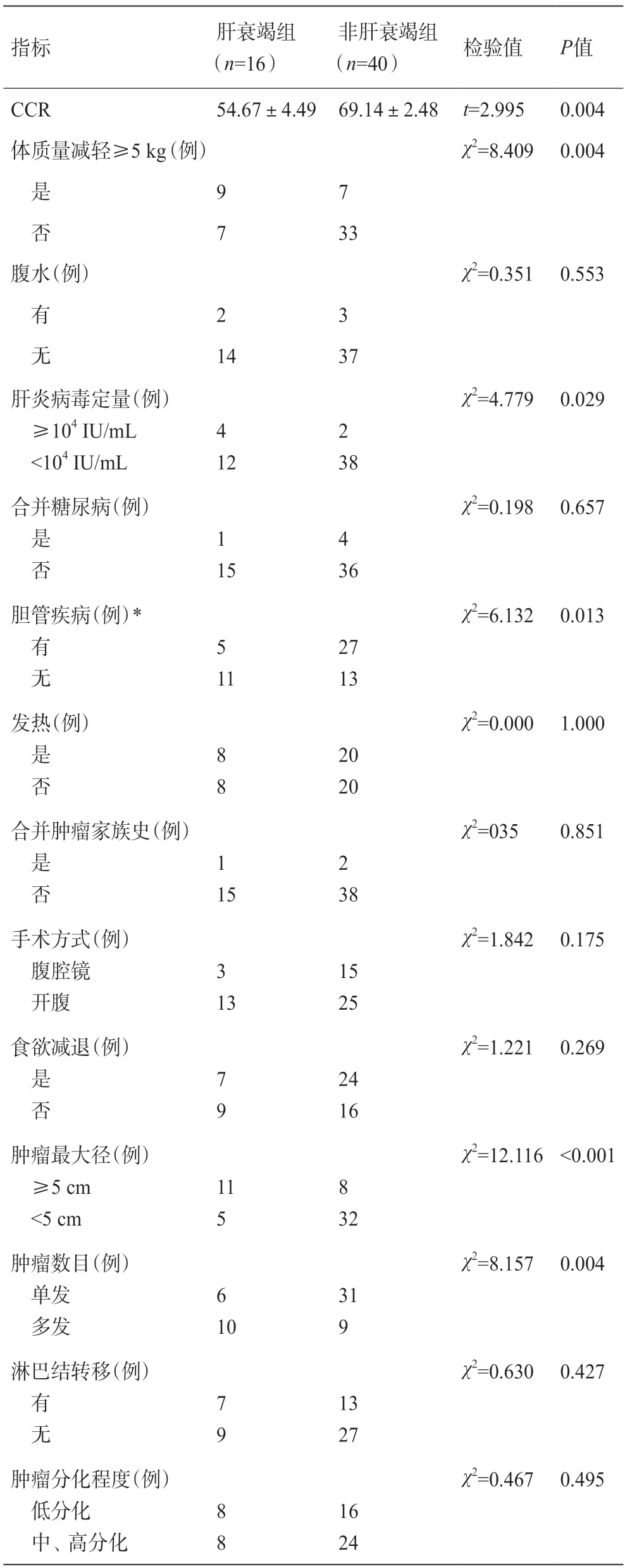
表2 ICC根治性手术后肝衰竭的单因素分析
2.2 CCR预测术后复发和肝衰竭的ROC曲线及临界值
ROC曲线分析结果表明CCR预测ICC术后1年内复发的曲线下面积(area under curve,AUC)为0.814(95%CI0.690-0.939),P<0.001,约登指数最大(1.577)时CCR的最佳临界值为62.34(图1);CCR预测ICC术后肝衰竭的AUC为0.723(95%CI0.572-0.875),P<0.001,约登指数最大(1.577)时CCR的最佳临界值为64.82(图2)。

图1 CCR预测术后1年内复发的ROC曲线
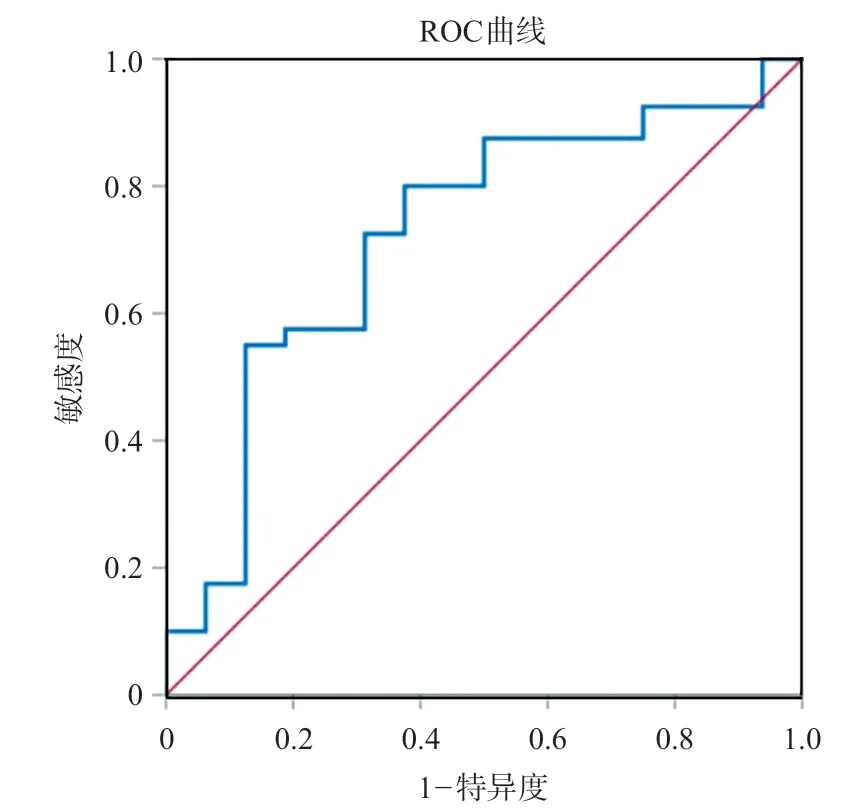
图2 CCR预测术后肝衰竭的ROC曲线
2.3 ICC术后肝衰竭发生和复发的独立危险因素分析
根据计算所得CCR的最佳临界值,分析复发因素时,以CCR<62.34 为低比值组;分析肝衰竭因素时,CCR< 64.82为低比值组。多因素Logistic回归分析结果表明CCR低、肿瘤数目多发、有淋巴结转移以及肿瘤分化程度低是ICC术后1年内复发的独立危险因素,详见表3;肿瘤最大径≥5 cm是ICC术后发生肝衰竭的独立危险因素,详见表4。
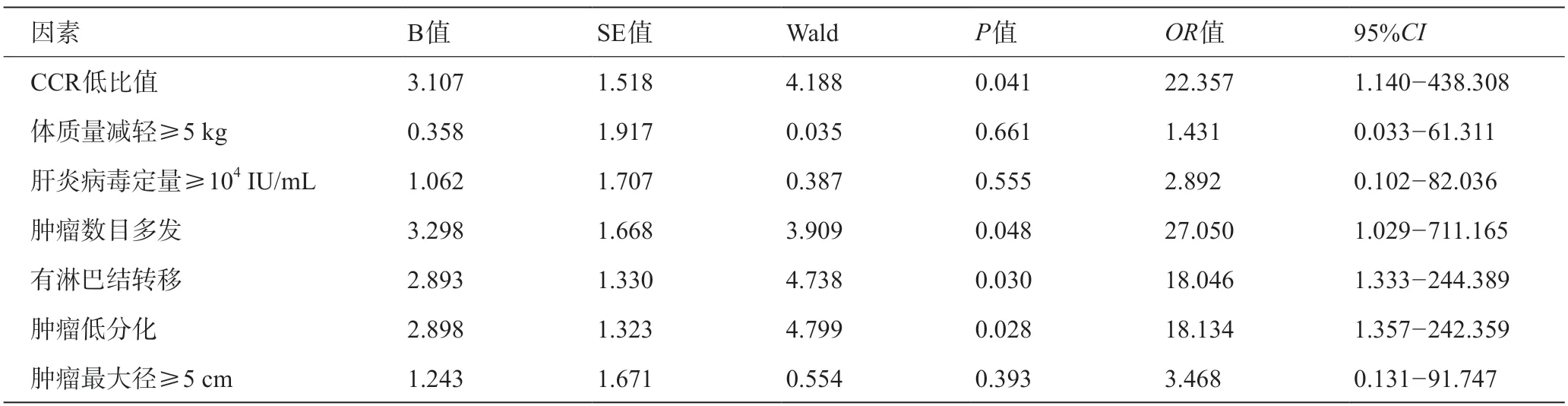
表3 多因素Logistic回归分析ICC术后1年内复发的独立危险因素
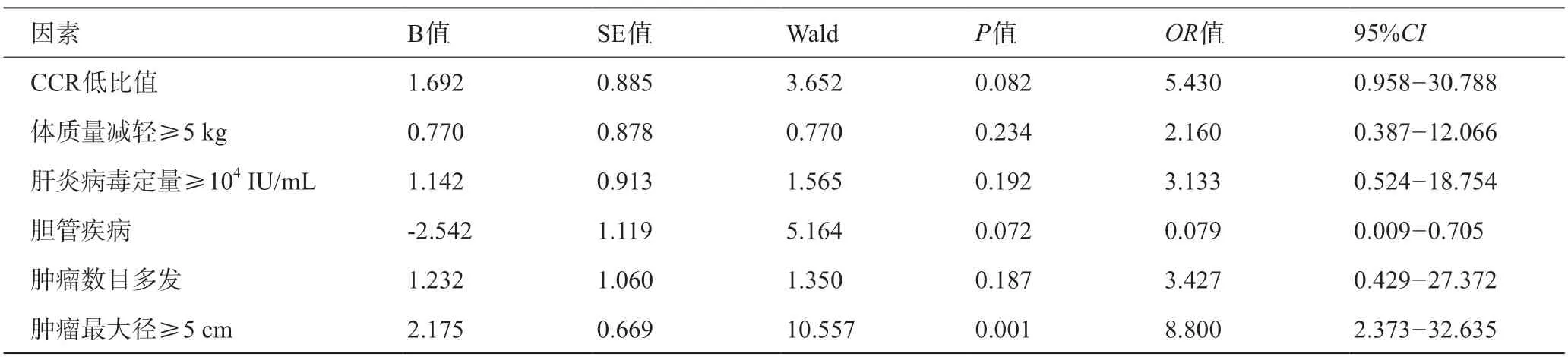
表4 多因素Logistic回归分析ICC术后肝衰竭的独立危险因素
3 讨论
目前ICC的诊疗面临巨大困难,五年生存率仅约9%左右,因早期临床特征不明显,确诊时大多数患者已处于晚期,即使早期发现并行根治性切除,五年生存率也仅为20%~35%[6-7]。ICC手术治疗目前面临六大挑战,其中术后复发风险高和术后残余肝脏的体积及其功能能否代偿是关键[8]。我们针ICC术后肝衰竭和复发的术前临床指标预测患者术后病情发展,为手术后管理提供参考。CCR与肿瘤患者的预后评估如生存率、住院时间均有关,对肿瘤的分期也有重要的临床意义[9-10]。且患者住院或ICU治疗时间随着CCR增加而减少,这预示着CCR可能与患者整体状况有着密切关系。CCR还是肾功能生物标记物,低CCR反映了患者术前和术后化疗对患者的毒副作用和预后风险[11]。
在本研究中,ICC患者术后肝衰竭和复发的危险因素不仅有CCR低,还包括其他临床指标。而单因素分析显示与ICC患者术后复发或肝衰竭相关的一般临床指标,如体质量减轻、合并肝炎,在多因素分析中无统计学意义,这些指标可能是肿瘤进展的体现或原因,对术后肝衰竭及复发有一定的影响,但却不能作为特异性指标。ICC患者术后1年内复发的独立危险因素主要为与肿瘤恶性程度和肿瘤分期相关的指标,如肿瘤低分化、数目多发、合并淋巴结转移等。术后肝衰竭则更侧重于患者肝功能代偿能力。本研究显示肿瘤最大径≥5 cm是ICC患者术后肝衰竭的独立危险因素,肿瘤越大,患者手术切除肝脏体积越多,术后肝衰竭的可能性更大。
除了本研究的临床指标外,其他研究显示东部肿瘤合作组织绩效状态评估(Eastern Cooperative Oncology Group,ECOG)、术中肝门阻断时间等也是影响ICC患者生存预后的独立危险因素[12]。此外,白细胞较高的患者的血清肌酐相对较低,在慢性炎症患者中同样观察到胱抑素C水平较高,这表明CCR可能是炎症状态的体现[13]。肿瘤细胞通过驱动炎性细胞因子促进肿瘤的生长、转移和扩散,CCR所预测的肿瘤患者预后情况可能仅为炎症介导所致[14]。因此,有无炎症及炎症的轻重程度指标也需考虑在内,如血清C反应蛋白(C-reactive protein,CRP)、系统免疫炎症指数(systemic immune-inflammation index,SII)等。因此,未纳入患者术前相关炎症指标是本研究的缺陷。
综上,本研究认为,CCR可在术前预测ICC患者术后肝衰竭和1年内复发概率,无论ICC肿瘤大小、分期、病理类型,CCR均可作为ICC术后1年内复发的预测指标。

