近红外Ⅰ/Ⅱ区荧光成像技术在肝胆胰外科中的应用现状与展望
王懿,陈康,罗权能,成伟,2
1.湖南师范大学附属第一医院/湖南省人民医院 肝胆外科,湖南 长沙 410002;2.湖南省血吸虫病防治所/湖南省第三人民医院,湖南 岳阳 414022
1 近红外荧光成像技术
分子成像技术使我们能够在分子水平上观察活体组织的生理或病理过程,从而在早期准确诊断疾病。光学成像技术可以实现组织和病理过程的动态监测,在生物医学领域具有广阔的应用前景。近红外区根据光谱波长划分为近红外Ⅰ区(near infrared Ⅰ,NIR-Ⅰ)和近红外Ⅱ区(near infraredⅡ,NIR-Ⅱ),波长范围分别为700~900 nm和900~1 700 nm[1]。近红外荧光成像技术与肝胆外科常规影像学技术如CT、胆道造影等比较,具有成本低廉、使用简便、无放射性、安全性高等优点[2]。
目前国内外开展的荧光引导手术常用的染料是吲哚菁绿(indocyanine green,ICG)。ICG主要用于NIR-Ⅰ荧光成像,可被波长为750~810 nm的光激发,发射波长为840 nm的近红外光,由硅镜头接收后成像。ICG具有灵敏度高、脂肪组织中淋巴结显影效果好、过敏反应发生率低等优点[3]。NIR-Ⅱ荧光成像可以减少组织光子吸收、组织自发荧光和散射,实现更高的保真度和空间分辨率效应[4]。NIR-Ⅱ成像具有优越的空间、时间分辨率和深度组织穿透性,可以清晰区分解剖结构(如内脏器官、脉管系统、淋巴结、骨骼和肿瘤),适用范围包括:(1)无创解剖成像;(2)实时获取解剖和血流动力学信息;(3)监测血管疾病(如缺血、动脉血栓形成、肿瘤和血管生成)的血流动力学和血液灌注,以及常规成像技术无法捕捉的快速生理过程;(4)检测生理和药物作用的动态过程;(5)用于图像引导的临床手术(例如肿瘤切除)[5]。近红外Ⅰ区和近红外Ⅱ区荧光探针的主要区别在于两者激发光源的波长不同。大多数探针主要是通过肿瘤血管的高通透性和滞留效应被动靶向。由于肿瘤是一种非正常组织,有着非常复杂的结构和独特的微环境,如低氧、低pH值等。通过肿瘤微环境和正常组织微环境之间的差异设计提高了靶向能力的探针,ICG是唯一被美国FDA批准用于临床的荧光染料。ICG在近红外Ⅰ区和近红外Ⅱ区广泛使用,现以ICG为例解释其靶向机理:ICG通过外周静脉注射后,能够与低密度脂蛋白和高密度脂蛋白中的磷脂亲水端相结合。当ICG和脂蛋白的复合物进入肝脏后,在正常生物体内,ICG只能被具有主动转运膜蛋白功能的肝细胞所摄取,而无法被机体的其他细胞所摄取[6]。ICG的摄取主要依靠有机阴离子转运体1B3(organic anion transporting polypeptide 1B3,OATPlB3)和钠离子-牛磺胆酸共转运蛋白(Na+-taurocholate co-transporting polypeptide,NTCP)共同完成,其排泄通过毛细胆管上表达的多耐药相关蛋白2(multidrug resistance-associated protein 2,MRP2)载体系统进行[7],基于上述原理ICG进行肝胆荧光显影。术中静脉注射ICG,在高分化肝细胞癌(hepatocellular carcinoma,HCC)中保留了门静脉摄取的ICG,并伴有胆道排泄障碍,导致ICG在癌组织中蓄积,这使得术中ICG荧光成像能够高度敏感地识别HCC[8]。局部注射ICG,ICG被淋巴系统吸收并与淋巴系统中的白蛋白结合,随淋巴系统引流至淋巴结最终回流至血液系统。由于淋巴系统转运缓慢,ICG可在淋巴系统内存在较长时间,从而实现淋巴结定位[9]。胰腺癌的肿瘤血管生成过程中会形成有缺陷的毛细血管。当ICG灌注时,可从这种新生的脉管系统渗出,从而对胰腺肿瘤定位[10]。
2 NIR-Ⅰ ICG荧光成像技术的应用
ICG在肝胆外科、乳腺外科、胃肠外科等多个临床科室已经得到广泛应用。本文将分别从以下几个方面介绍ICG在当前肝胆胰外科中的应用。
2.1 NIR-Ⅰ ICG荧光成像在肝脏手术中的应用
ICG经肝脏特异性摄取并经胆道排泄的特性使其在肝胆外科中得到广泛的应用。ICG荧光成像主要用于肝脏肿瘤的精准定位,肝切除术中实时导航,微小病灶的侦测,以及肿瘤分化程度的初步判定等[11]。自2009年Ishizawa等[12]首次将近红外荧光技术应用于HCC肝切除术,近红外荧光成像技术在肝胆外科使用频率逐年升高,其功能与作用也不断得到开发和改进。对于腹腔镜肝切除术,ICG荧光染色主要分为两种:(1)正向染色法,通过术中解剖或术中超声等手段辨别预切除肝段的门静脉分支,使用细针穿刺并注入ICG溶液行预切除肝段或肝叶的荧光显影;(2)反向染色法,分离出预切除肝段的门静脉并切断,此后经外周静脉使用ICG行保留肝脏部分的荧光显影。ICG有多种用途:评估肝脏储备功能,判断肿瘤性质,原发性肝癌的定位与边界界定,定位转移性肝癌,肝段染色等[13]。术中微小肝癌病灶的侦测与处理对于预后十分重要。以往外科医师主要通过CT、MRI检查识别微小肝癌病灶,但无法用于实时定位[14]。术中超声可用于定位切除,但对微小肝癌灵敏性较低,且多数早期的肝癌病灶(<1 cm)无典型新生血管,影像学特征难以在术前侦测识别[15]。ICG荧光成像对微小肝癌具有较高的灵敏度,不仅可以术中实时侦测肝癌病灶,还能够侦测到术前CT、MRI未发现的微小病灶,从而降低肿瘤残余风险,提升患者预后[16]。ICG荧光染色在HCC中可呈现出全荧光、部分荧光、环形荧光等类型,荧光来源于HCC细胞的细胞质和假腺结构。高分化HCC中参与ICG摄取的膜转运蛋白仍然存在于癌细胞表面,但胆道排泄功能异常,导致ICG聚集在病灶内表现为全荧光型;低分化HCC对ICG摄取减弱,且周围正常组织受肿瘤压迫导致ICG延迟排泄,故常表现为环形荧光型;中分化HCC的癌灶介于上述两者之间,表现为部分荧光型[17]。肝内胆管细胞癌本身不摄取ICG,由于肿瘤压迫或浸润导致胆道充血,周围非肿瘤组织被染色,其肿块型呈现边缘型荧光,而混合型则呈现由胆管肿瘤浸润引起的节段性荧光,其机制需要进一步研究证实[18]。ICG荧光成像技术在肝脏肿瘤染色、解剖性肝切除、活体肝移植、肝包虫病手术等方面具有重要的临床价值及应用前景,有助于提高肝脏外科手术精准度及肿瘤学疗效(图1)[19]。

图1 不同肝脏肿瘤病灶ICG荧光染色[19]
2.2 NIR-Ⅰ ICG荧光成像在胆道手术中的应用
Ishizawa等[12]证实了术中胆道造影的有效性。Aoki等[20]将ICG荧光成像用于腹腔镜胆囊切除术(laparoscopic cholecystectomy,LC)导航,在14例患者中成功识别出10例患者的胆总管和胆囊管。Boogerd等[21]在用ICG引导LC时,其胆囊管检出成功率高达96%,表明ICG能精准可视化胆管系统。Kaibori等[22]验证了ICG荧光胆管造影可用于预防肝切除术后胆汁渗漏。在一项随机对照LC中,相比白光组,荧光胆道成像组具有更高的肝外胆管解剖结构识别率,尤其在肝总管和副肝管的解剖识别具有显著优势(图2)[23]。有研究用放射造影剂与ICG混合稀释后获得了更加清晰的肝内外胆管结构成像[24]。在活体肝移植供体获取肝切除术中,荧光成像可用于判断胆管离断位置,指导胆管吻合,有利于降低术后胆漏、胆管吻合口狭窄等并发症发生率,用于判断移植肝脏胆汁分泌功能[25]。荧光胆道成像能够发现胆囊管扩张及胆囊管内的结石,但不能排除胆总管内结石的存在[26]。

图2 ICG荧光染色胆道成像[23]
2.3 NIR-Ⅰ ICG荧光成像在胰腺手术中的应用
目前ICG在胰腺外科的应用尚处于起始阶段,原因在于胰腺实质血供不及肝脏丰富,ICG难以有效富集于胰腺肿瘤,ICG在胰腺手术中应用的报道较少。ICG荧光成像识别胰腺肿瘤,虽然不是常规方法,但是具有广阔的应用前景。在腹腔镜胰十二指肠切除术中ICG荧光成像被用于验证胰腺系膜的完全切除,有利于改善预后[27]。有研究报道,由于肿瘤供血血管的差异,ICG荧光成像对胰腺神经内分泌肿瘤的准确识别率是100%,对胰腺囊性肿瘤的识别率是90.9%(图3)[28]。ICG能够识别完整的胰腺神经内分泌肿瘤,甚至可以识别切除边缘残留的神经内分泌组织,Paiella等[29]对10例胰腺神经内分泌肿瘤患者术中注射ICG(25 mg,分5次注射,每次注射5 mg),荧光显像率为100%。

图3 ICG荧光染色胰腺神经内分泌肿瘤[28]
3 NIR-Ⅱ荧光成像技术的应用
Welsher等[30]于2009年首次实现NIR-Ⅱ活体荧光成像。许多研究设计和开发了在NIR-Ⅱ窗口发射的新型荧光探针,包括半导体量子点(QDs)、有机荧光(NPs),单壁碳纳米管(SWCNTs)等[31]。NIR-Ⅱ荧光探针可用于体内肝损伤模型的动态成像,监测药物诱导的肝毒性,准确诊断和有效治疗缺氧性肿瘤,及时跟踪和评价放疗的疗效,以及肝缺血再灌注损伤病变的导航和病理分析,原位肝肿瘤的术前定位,评估胰腺肿瘤类型并鉴定肿瘤边缘,胰腺癌的动态成像并监测低剂量放疗和化疗诱导的肿瘤相关巨噬细胞数量,预测胰腺炎的严重程度等(表1)。
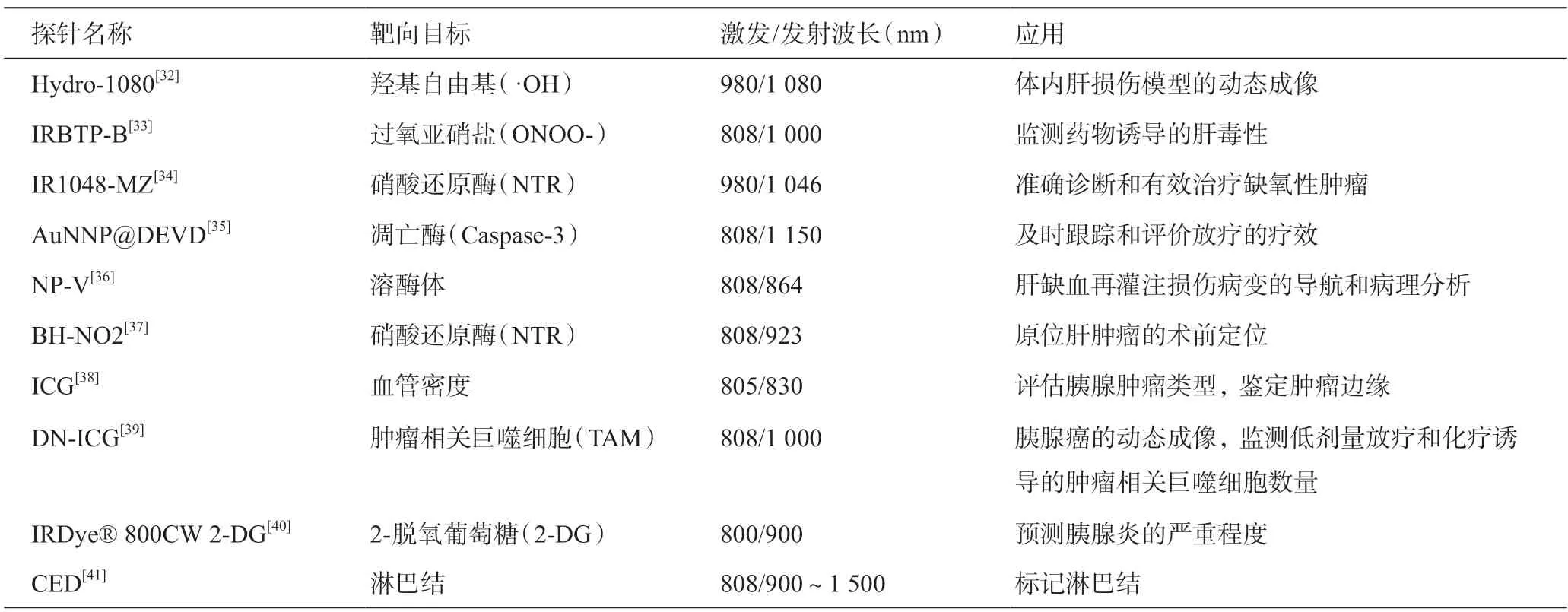
表1 NIR-Ⅱ荧光探针及应用
Chen等[42]NIR-Ⅱ荧光成像可更好地对肝脏成像。2020 年首次报道NIR-Ⅱ荧光成像引导下的肝癌手术,23例患者进行了原发性和转移性肝肿瘤的切除,术中发现NIR-Ⅱ成像对肿瘤检测灵敏度更高[43](图4)。NIR-Ⅱ成像能够显示一些被NIR-Ⅰ成像遗漏的肿瘤病变(表2)。

表2 NIR-Ⅱ成像能够显示遗漏病灶

图4 NIR-Ⅱ荧光成像引导下的肝癌切除术[43]
4 近红外Ⅰ/Ⅱ区荧光成像技术的局限性
4.1 NIR-Ⅰ荧光成像技术的局限性
ICG受激发后发出荧光的组织穿透最大深度为8 mm,组织穿透深度欠佳[46]。ICG荧光成像特异性较低,单纯的ICG不具备肿瘤靶向性,对于非恶性病变如肝硬化结节、囊肿等也可显示荧光信号,在术中难以区分微小癌灶或良性病变。特别是对于肝硬化较严重的患者,ICG潴留在肝硬化结节中,术中单凭肉眼难以区分微小癌灶或肝硬化结节。对于深部病灶,ICG荧光成像侦测深度有限,无法探及肝实质深部结节,假阳性率高。
ICG的定量研究主要集中在评估组织的血流灌注方面,但在肝脏手术中仍缺乏荧光的量化指标。在确定胆管的解剖位置和走行区域时,使用NIR-Ⅰ荧光成像技术进行胆管检查,由于肝脏的高自发荧光背景,使肝门部胆管结构图像受到干扰而难以辨别;再加上胆管解剖变异,胆管炎性水肿,NIR-Ⅰ荧光难以穿透较厚结缔组织,所获图像的信背比和分辨率较低,难以准确识别胆管走行[47]。此外,NIR-Ⅰ荧光成像技术无法有效降低医源性胆管损伤的风险。
4.2 NIR-Ⅱ荧光成像技术的局限性
NIR-Ⅱ荧光成像技术的瓶颈包括:(1)对于肝脏等大实质器官仍难以突破几厘米的穿透深度;(2)通过肝脏、肾脏的代谢缓慢,毒性大;(3)缺乏合适的成像仪器和光学探头,仪器价格昂贵;(4)大多数NIR-Ⅱ探针未在临床实践中得到测试,临床转化速度慢。
5 小结与展望
近红外荧光成像已成为临床尤其是肝胆胰外科重要的诊断利器。在现有的诊断方法下,红外荧光成像给医师、患者均带来了新的希望,有助于改善患者的预后。NIR-Ⅰ荧光成像在肝胆胰外科中取得了较好的疗效,但NIR-Ⅰ难以穿透深部、深厚结缔组织,假阳性率高。NIR-Ⅱ荧光成像较NIR-Ⅰ荧光成像在穿透深度、空间分辨率和抗自发背景荧光干扰方面效果更好,在前哨淋巴结定位、血管成像肿瘤探查、胆管识别[48]、引导肿瘤手术等方面均显示了良好的临床效应,但其毒性高、缺乏特异性组织靶向特点限制了其在临床上的应用。开发安全、具有靶向基团的新型荧光探针迫在眉睫。未来我们需要医学、光学、材料学等多学科联合开发新的荧光染色剂和成像设备,为患者带来福音。

