沉默cFLIP在重症急性胰腺炎肺损伤中的作用机制研究
王宝枝,彭和平,张风华,黄海霞,陈育宾,杨学伟
广州医科大学附属第二医院番禺院区 普外科,广东 广州 511400
急性肺损伤(acute lung injury,ALI)是重症急性胰腺炎(severe acute pancreatitis,SAP)的严重并发症之一。中性粒细胞在病理过程中的功能是伴随炎症过程的趋化因子和细胞因子级联反应的激活;同时在病理生理条件下,中性粒细胞呈现多种不同的死亡形式,如凋亡、焦亡、自噬、坏死及坏死性凋亡等。SAP在并发全身性炎症反应综合征(systemic inflammatory reaction syndrome,SIRS)时,中性粒细胞较正常生理状态的凋亡率明显下降,外周血中性粒细胞数量急剧增加,进一步形成中性粒细胞外诱捕网(neutrophil extracellular traps,NETs),肺泡及血浆中过度形成的NETs可导致肺损伤[1-2]。
细胞型Fas相关死亡区域蛋白样白介素-1β转换酶抑制蛋白(cellular FLICE-like inhibitory protein,cFLIP)基因表达两种蛋白产物:cFLIPL和cFLIPS。cFLIP在生理状态下参与组织修复、抑制细胞死亡,在病理过程中cFLIP抑制炎症细胞的生理性死亡,加剧炎症反应[3-4]。治疗SAP合并ALI的其中关键环节之一是控制外周爆发的过度激活炎症反应,尤其是中性粒细胞的过度激活及其炎症因子的大量释放,促进中性粒细胞凋亡,抑制NETs形成可以缓解SAP病情进展[5]。
我们在以往的研究中发现,通过大鼠尾静脉注射cFLIP siRNA沉默下调cFLIP后,促进外周血中性粒细胞的凋亡,可以降低胰腺腺泡细胞的损伤。cFLIP是否可通过调控中性粒细胞凋亡进而改善SAP诱发的ALI?本研究拟利用SAP大鼠模型观察下调cFLIP后外周血中性粒细胞凋亡率及肺损伤病理变化,了解沉默cFLIP是否可以减轻SAP继发的ALI。
1 材料和方法
1.1 实验动物
雄性SD大鼠74只,体质量250~300 g,购自湖北省疾控中心。
1.2 实验试剂
cFLIPL siRNA1、cFLIPL siRNA2、cFLIPL siRNA3、cFLIPS siRNA1、cFLIPS siRNA2、cFLIPS siRNA3 和cFLIP siRNA-NC,由美国Ambion公司设计并合成;白介素6(IL-6)ELISA Kit、白介素1β(IL-1β)ELISA Kit和肿瘤坏死因子α(TNF-α)ELISA Kit,购自南京森贝伽生物科技有限公司;Annexin V凋亡试剂盒,购自武汉普诺赛生物科技有限公司;cFLIP抗体,购自美国Enzo Life Sciences公司;RIP1、caspase-8和GAPDH抗体购自英国Abcam公司。
1.3 筛选抑制率最高的cFLIPL siRNA和cFLIPS siRNA
取1 2 只S D 大鼠,随机分为4 组:对照组、cFLIPL siRNA1 组、cFLIPL siRNA2 组和cFLIPL siRNA3 组,每组3 只。各组尾静脉给予1 nmol/mL cFLIPL siRNA溶液,给药量为大鼠体质量的10%。对照组注射cFLIP siRNA-NC。转染72 h,进行qRTPCR,检测cFLIPL mRNA的抑制情况。
另取12 只SD 大鼠,随机分为4 组:对照组、cFLIPS siRNA1 组、cFLIPS siRNA2 组 和cFLIPS siRNA3 组,每组3 只。各组尾静脉给予1 nmol/mL cFLIPS siRNA溶液,给药量为大鼠体质量的10%。对照组注射cFLIP siRNA-NC。转染72 h,进行qRTPCR,检测cFLIPS mRNA的抑制情况。
分别筛选出对cFLIPL和cFLIPS抑制率最高的siRNA。
1.4 静脉血中性粒细胞提取
siRNA干扰大鼠72 h后,开腹留取下腔静脉血,利用梯度离心法提取中性粒细胞。
1.5 qRT-PCR检测cFLIPL mRNA和cFLIPS mRNA的表达
Trizol法提取中性粒细胞总RNA。按照SYBR®PremixExTaqTMⅡ试剂盒说明书,检测cFLIPL mRNA和cFLIPS mRNA的表达。cFLIPL上游引物:5’-GCTCACCATCCCTGTACCTG-3’,下游引物:5’-CAGGAGTGGGCGTTTTCTT-3’;cFLIPS上游引物:5’-GCAGCAATCCAAAAGAGTCTCA-3’,下游引物:5’-ATTTCCAAGAATTTTCAGATCAGGA-3’;GAPDH上游引物:5’-AACGACCCCTTCATTGA C-3’,下游引物:5’-TCCACGACATACTCAGCA-3’。
1.6 SAP模型的建立[2]及干预处理
取50 只SD大鼠,随机分为5 组:假手术组、模型对照组、cFLIP siRNA-NC组、cFLIPS siRNA组、cFLIPL siRNA组,每组10只。除假手术组外,其余组大鼠3%戊巴比妥钠(30 mg/kg)腹腔麻醉并固定,暴露胰腺区域,找到主胰管,3%牛磺胆酸钠溶液30 mg/kg以微泵12 mL/h速度注入胰胆管内。假手术组大鼠仅开腹。在造模24 h后,每组随机处死1只SD大鼠,获取胰腺病理组织来判断造模是否成功,见图1。cFLIPS siRNA组、cFLIPL siRNA组和cFLIP siRNA-NC组大鼠给予一次性尾静脉注射1 nmol/mL siRNA溶液,模型对照组和假手术组注射同等剂量的0.9% NaCl溶液。
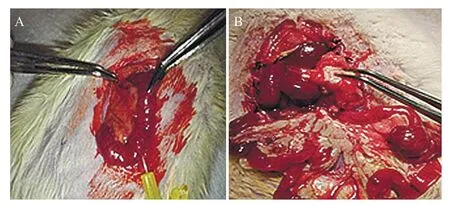
图1 造模及造模24 h后开腹观察大体改变
1.7 HE染色检测肺组织病理学变化
转染后72 h,麻醉大鼠,取肺组织,4%多聚甲醛固定72 h。切片于光学显微镜下,观察分析各组肺组织的病理变化并计算其肺损伤病理评分[6]。评分标准包含以下3项:(1)肺组织中红细胞、白细胞的浸润范围;(2)肺泡腔内红细胞、白细胞的计数;(3)肺泡腔内所含渗出物的量。每项标准按照其严重程度又分成5 项,并以0~4 分进行记录。每组样本随机选取4张切片(×200),每张切片选取5个视野。
1.8 ELISA检测IL-6、IL-1β和TNF-α含量
取大鼠下腔静脉血,4 ℃、2 500 r/min离心15 min,取上清液,-80 ℃条件下保存。ELISA试剂盒检测血清中IL-6、IL-1β和TNF-α含量。
1.9 全自动分析仪检测静脉血白细胞数、中性粒细胞数和血细胞比容
取大鼠下腔静脉血,美国Beckman全自动分析仪检测静脉血白细胞数、中性粒细胞数。
1.10 流式细胞术检测中性粒细胞凋亡
参照1.4所示,分离1.6所述5 组SD大鼠静脉血中性粒细胞,流式细胞仪检测。
1.11 Western blotting检测中性粒细胞cFLIPL、cFLIPS、RIP1和caspase-8蛋白表达
1.12 统计学分析
2 结果
2.1 cFLIPL siRNA和cFLIPS siRNA干扰效率筛选
qRT-PCR结果显示,对照组、cFLIPL siRNA1组、cFLIPL siRNA2组和cFLIPL siRNA3组cFLIPL mRNA表达量差异具有统计学意义(F=80.654,P<0.001);与对照组cFLIPL mRNA表达量(1.006±0.044)相比,cFLIPL siRNA1组(0.740±0.055,P<0.001)、cFLIPL siRNA2组(0.400±0.059,P<0.001)和cFLIPL siRNA3 组(0.481±0.053,P<0.001)cFLIPL mRNA表达量明显降低。其中cFLIPL siRNA2组干扰效率最明显,因此选择cFLIPL siRNA2 组进行后续实验,在后续分组中简称cFLIPL siRNA组。
对照组、cFLIPS siRNA1 组、cFLIPS siRNA2组和cFLIPS siRNA3 组cFLIPS mRNA表达量差异具有统计学意义(F=97.465,P<0.001);与对照组cFLIPS mRNA表达量(1.002±0.040)相比,cFLIPS siRNA1 组(0.384±0.031,P<0.001)、cFLIPS siRNA2 组(0.677±0.061,P<0.001)和cFLIPS siRNA3组(0.529±0.049,P<0.001)cFLIPS mRNA表达量明显降低。其中cFLIPS siRNA1组干扰效率最明显,因此选择cFLIPS siRNA1组进行后续实验,在后续分组中简称cFLIPS siRNA组。如图2所示。
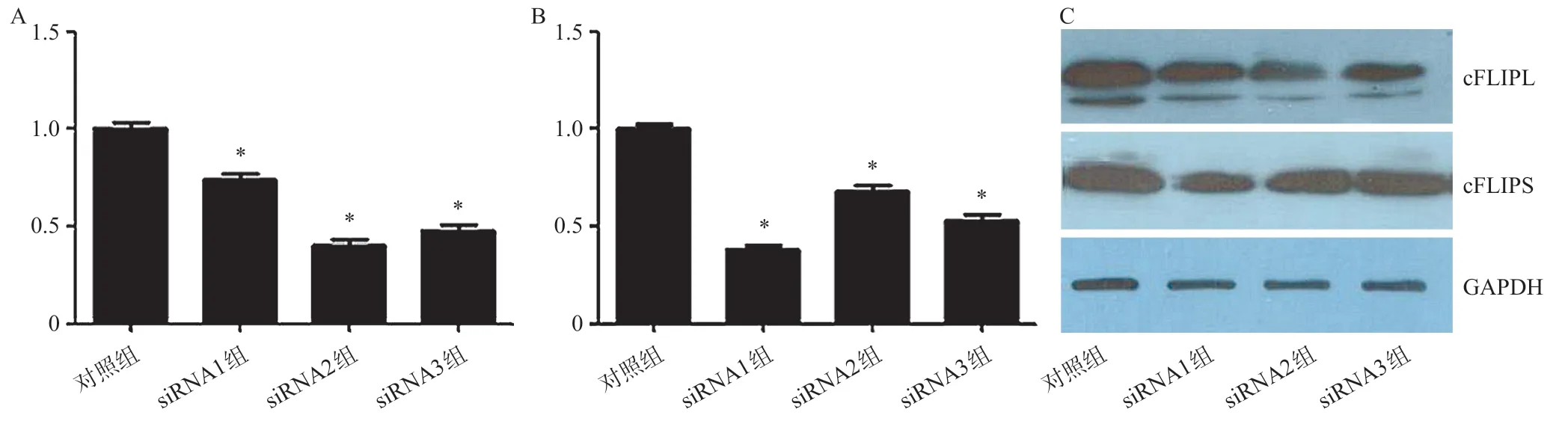
图2 各组大鼠静脉血中性粒细胞中cFLIPL和 cFLIPS的mRNA及蛋白相对表达量
2.2 5组大鼠肺组织病理学变化
HE染色结果显示,假手术组大鼠肺泡结构无明显异常;与假手术组相比,模型对照组大鼠肺泡结构紊乱,肺泡壁增厚,出现大面积肺泡融合和弥漫性炎症细胞浸润;与模型对照组相比,cFLIPL siRNA组和cFLIPS siRNA组大鼠肺泡结构损伤减轻,肺泡壁变薄,炎症细胞浸润减少。A~E组大鼠肺组织损伤病理评分为(0.45±0.59)、(7.50±0.41)、(6.60±0.37)、(3.10±1.28)和(2.50±1.21),差异具有统计学意义(F=113.481,P<0.001)。如图3所示。
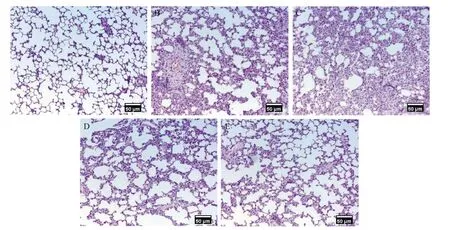
图3 各组大鼠肺组织病理学变化(HE,×200)
2.3 各组大鼠血清相关指标的变化
ELISA结果显示,与模型对照组相比,cFLIPL siRNA组和cFLIPS siRNA组IL-6、IL-1β、TNF-α含量均明显降低(P<0.05)。如表1所示。
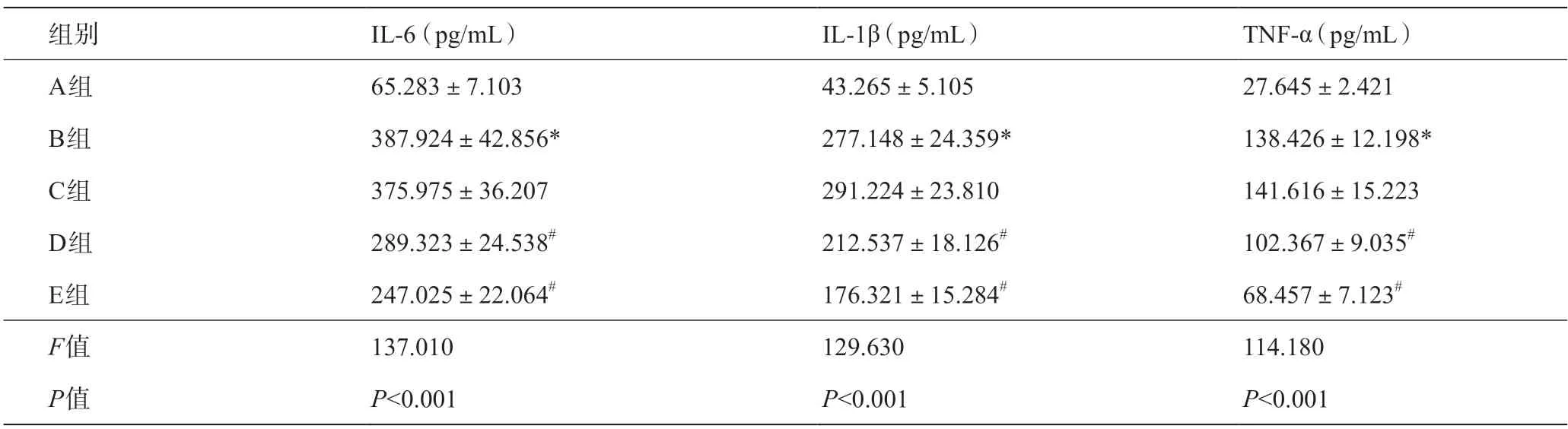
表1 各组大鼠IL-6、IL-1β和TNF-α含量变化
2.4 各组大鼠静脉血白细胞数、中性粒细胞数变化
自动分析仪检测结果显示,与模型对照组相比,cFLIPL siRNA组和cFLIPS siRNA组大鼠静脉血白细胞数、中性粒细胞数明显降低(P<0.05)。如表2所示。
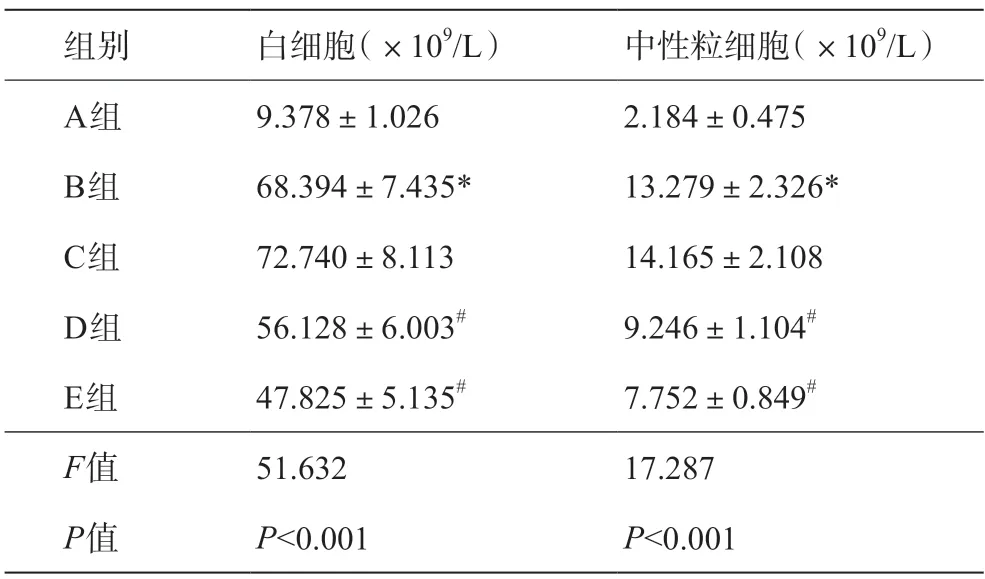
表2 各组大鼠静脉血白细胞、中性粒细胞数
2.5 各组大鼠中性粒细胞凋亡的变化
流式细胞术结果显示,A~E组大鼠中性粒细胞凋亡率分别为(18.490±0.999)%、(2.751±0.377)%、(3.177±0.415)%、(11.478±1.282)%和(12.583±1.202)%,差异具有统计学意义(F=153.081,P<0.001)。
与假手术组相比,模型对照组大鼠中性粒细胞凋亡率明显降低(P<0.001);与模型对照组相比,cFLIPL siRNA组和cFLIPS siRNA组大鼠中性粒细胞凋亡率明显升高(均P<0.001)。如图4所示。

图4 各组大鼠中性粒细胞凋亡的变化
2.6 各组大鼠中性粒细胞cFLIPL、cFLIPS、RIP1和caspase-8蛋白表达的比较
Western blotting 检测结果显示,A~E 组大鼠cFLIPL蛋白表达量为(0.155±0.012)、(1.429±0.123)、(1.385±0.130)、(0.256±0.038)、(1.359±0.120),cFLIPS蛋白表达量为(0.173±0.019)、(1.365±0.122)、(1.328±0.115)、(1.294±0.120)、(0.288±0.035),R1P1蛋白表达量为(0.197±0.021)、(1.144±0.118)、(1.181±0.133)、(0.781±0.083)、(0.698±0.072),caspase-8 蛋白表达量为(1.074±0.104)、(0.328±0.035)、(0.340±0.042)、(0.570±0.055)、(0.617±0.069),差异均具有统计学意义(F=132.099,P<0.001;F=124.058,P<0.001;F=62.634,P<0.001;F=63.607,P<0.001)。
与假手术组相比,模型对照组大鼠cFLIPL、cFLIPS和R1P1 蛋白表达量明显升高(均P<0.001),caspase-8蛋白表达量明显降低(P<0.001);与模型对照组比较,cFLIP siRNA组cFLIPL、cFLIPS和RIP1蛋白表达量明显降低,caspase-8蛋白表达量明显升高;与cFLIP siRNA-NC组相比,cFLIPL siRNA组大鼠cFLIPL和R1P1蛋白表达量明显降低(均P<0.001),caspase-8 蛋白表达量明显升高(P=0.002),cFLIPS蛋白表达量差异无统计学意义(P=0.669);与cFLIP siRNA-NC组相比,cFLIPS siRNA组大鼠cFLIPS和R1P1 蛋白表达量明显降低(均P<0.001),caspase-8蛋白表达量明显升高(P<0.001),cFLIPL蛋白表达量差异无统计学意义(P=0.757)。见图5和图6。

图5 各组大鼠中性粒细胞cFLIPL和cFLIPS蛋白表达的比较
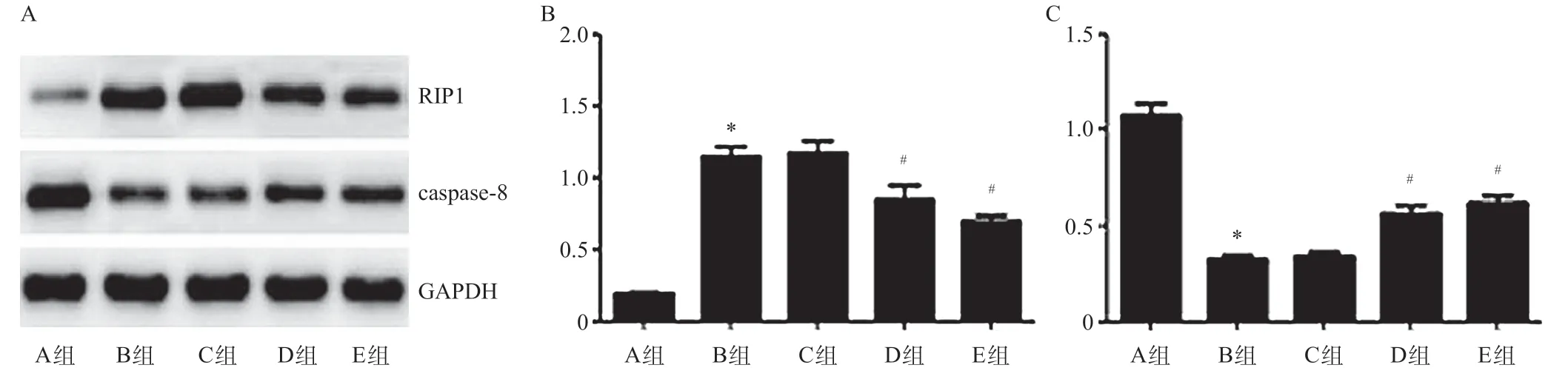
图6 各组大鼠中性粒细胞RIP1和caspase-8蛋白表达的比较
3 讨论
3.1 SAP和ALI的中性粒细胞凋亡改变
全身炎性反应综合征(SIRS)是SAP发展至多器官功能不全和多器官功能衰竭的主要原因,其特征是失控的过激炎症反应损伤。中性粒细胞是炎症反应过程中的重要效应细胞,正常情况下中性粒细胞主要以凋亡方式死亡,被巨噬细胞识别并清除。维持中性粒细胞正常凋亡是炎症反应得以自控的一个重要机制。SIRS外周血中性粒细胞凋亡延迟及过度激活是SAP发展至多器官衰竭的重要病理机制之一[7]。
SIRS外周血中性粒细胞凋亡延迟及中性粒细胞凋亡率下降,均会导致外周血中性粒细胞数量增多,大量的中性粒细胞可产生包含多种生物活性物质的NETs。过度产生的NETs可通过水解蛋白诱导炎症反应,影响肺泡巨噬细胞功能,激活凝血,导致肺组织损伤[8-9]。
3.2 沉默cFLIP可促进SAP中性粒细胞凋亡
cFLIP作为NF-κB下游基因的表达产物,可与procaspase-8 结合形成异源二聚体,cFLIPL和RIP1 酶活性能调控死亡诱导信号复合物(deathinducing signal complex,DISC)的形成,从而抑制caspase-8活化,在抗凋亡过程中发挥重要作用。本研究通过RNA干扰分别下调cFLIP的单体型cFLIP(L)和cFLIP(S),发现中性粒细胞caspase-8蛋白表达明显增加,RIP1 蛋白表达明显减少;大鼠外周血检测显示静脉血白细胞数、中性粒细胞数明显降低;这表明下调cFLIP使中性粒细胞朝着凋亡程序化途径进行。本研究中对SAP大鼠进行cFLIP在体RNA干预,通过上调caspase-8关键蛋白,加速过度激活中性粒细胞的凋亡,抑制外周血中性粒细胞的过度激活。有研究表明促进中性粒细胞凋亡可以减轻肺损伤程度[10]。
3.3 沉默cFLIP调控炎症因子释放及中性粒细胞凋亡,缓解肺损伤
中性粒细胞通过改变其寿命并迁移到炎症部位,过度激活后形成NETs并释放大量炎症因子,进而导致继发性组织损伤。在肺损伤过程中,炎症因子TNF-α、IL-6及IL-1β均会大量释放,TNF-α可以上调cFLIP的表达。cFLIP也通过调控炎症因子参与肺损伤疾病发展过程,过量的cFLIP促进促炎和趋化细胞因子TNF-α的释放,TNF-α通过JNK/FoxO3a信号通路介导中性粒细胞凋亡,促进肠源性肺损伤的发生[11]。cFLIP也通过调控TNF-α参与其他器官组织的损伤修复,cFLIP敲除小鼠观察到皮肤炎症反应减少,明显减弱TNF-α介导的炎症细胞局部浸润[12]。调控cFLIP有助于凋亡控制及组织修复。本研究结果也显示,敲低cFLIPL和cFLIPS,炎症因子检测发现大鼠外周血IL-6、IL-1β和TNF-α含量明显降低,而且在肺组织病理切片中也显示炎症细胞浸润减少、肺泡壁水肿减轻,明显改善SAP大鼠肺组织病理学损伤。该结果表明,敲低cFLIPL或cFLIPS有可能通过减少炎症介质释放及中性粒细胞在组织中的浸润,从减少肺脏的中性粒细胞募集这一个环节,进而抑制肺脏局部炎症反应,阻止SAP疾病ALI的进展。
综上所述,本研究结果表明,靶向沉默cFLIP可能通过上调caspase-8和抑制RIP1的表达,促进中性粒细胞凋亡,减少炎症介质TNF-α、IL-6、IL-1β释放,抑制肺组织中的中性粒细胞浸润,缓解SAP的肺组织损伤,在SAP中发挥保护作用。该研究结果为明确SAP中中性粒细胞过度激活的机制和开发新的临床治疗SAP中ALI的策略提供了新的科学思路。

