LncRNA TMPO-AS1调节miR-340-5p/RUNX1轴对结直肠癌细胞增殖、迁移和侵袭的影响
许汉兵 韩建涛 张成鹏
结直肠癌(colorectal cancer,CRC)是常见的消化道恶性肿瘤之一,位居我国恶性肿瘤病死率第三位,且发病率、病死率仍呈逐年上升趋势,严重危及国民的生命安全[1]。CRC早期诊断率低、术后复发转移率高、化疗耐药导致其预后很差[2],因此了解其癌细胞的增殖、迁移和侵袭对CRC患者至关重要。长链非编码RNA(long non-coding RNA,lncRNA)是一种长度>200个核苷酸的非编码RNA,在多种疾病中异常表达[3],TMPO反义RNA1(TMPO antisense RNA1,TMPO-AS1)是一种lncRNA,有报道表明其在多种癌症中高表达,促进癌细胞发展[4],如在肺癌细胞中,沉默TMPO-AS1上调miR-143-3p表达从而抑制肺癌细胞增殖、迁移及侵袭能力,并诱导癌细胞凋亡[5],但TMPO-AS1在CRC发展中的作用尚未阐明。miRNAs是在真核生物中发现的一类内源性的非蛋白质编码的RNA分子,能够与特定的mRNA结合,并在转录后负调控基因的表达,其大小为18~25个核苷酸[6]。有研究表明,miR-340-5p在多种癌症中低表达,上调后可抑制癌细胞的侵袭,转移等[7],利用软件分析发现TMPO-AS1与miR-340-5p有互补结合位点。miRNAs能够与特定的mRNA结合,并在转录后负调控基因的表达,RUNT相关转录因子1(Runt-associated transcription factor 1,RUNX1)是RUNX转录因子家族的成员,该家族进化高度保守[8],有研究表明RUNX1在CRC组织中高表达,促进CRC转移[9],利用软件分析发现miR-340-5p与RUNX1存在互补结合位点。综上所述,对其机制做出以下推测:LncRNA TMPO-AS1调节miR-340-5p/RUNX1轴影响CRC细胞增殖、迁移和侵袭。
1 材料与方法
1.1 实验材料 人正常结肠上皮细胞HCoEpiC、人CRC细胞SW480、HCT116、LOVO、HT-29均购自普诺赛生物科技有限公司。
1.2 主要试剂 Firefly &Renilla Dual Luciferase Assay Kit购自苏州宇恒生物;Lipo3000转染试剂购自默克;CCK-8试剂盒购自上海经科化学公司;EDU细胞增殖检测试剂盒购自锐博生物;RUNX1、PCNA、MMP-2抗体购自CST公司。
1.3 细胞培养 将HCoEpiC、SW480、HCT116、LOVO、HT-29细胞置于含有10%胎牛血清的培养基中,在37℃、5% CO2的环境中培养。
1.4 qRT-PCR检测HCoEpiC、多种CRC细胞中TMPO-AS1、miR-340-5p、RUNX1表达 Trizol试剂提取不同细胞中的总RNA,将获得RAN逆转录为cDNA后,以cDNA为模板进行荧光定量PCR扩增。TMPO-AS1、RUNX1以GAPDH为内参,miR-340-5p以U6为内参,使用2-△△Ct方法计算TMPO-AS1、miR-340-5p、RUNX1的相对表达量。引物序列如下:TMPO-AS1:正向5-TTAGGATTCTTGCGGGTGGT-3;反向5-AGCCAGACCTCTACAATCGG-3’;RUNX1:正向5-GTTTGTCGGTCGAAGTG-GAAGA-3;反向5-AGGGTTAAAGGCAGTG-GAGTGG-3’;GAPDH:正向5’-CTGGGCTACACTGAGCACC-3’;反向5’-AATGGTCGTTGAGGGCAATG-3’;miR-340-5p:正向5-GCGGTTAAAGCAATGAGA-3;反向5-GTGCGTGTCGTGGAGTCG-3’;U6:正向5’-CTCGCTTCGGCAGCACA-3’;反向5’-AACGCTTCACGAATTTGCGT-3’。
1.5 细胞分组与转染 将HCT116细胞分为si-ctrl组(细胞转染si-ctrl)、si-TMPO-AS1组(细胞转染si-TMPO-AS1)、mimics NC组(细胞转染mimics NC)、miR-340-5p组(细胞转染miR-340-5p mimics)、si-TMPO-AS1+anti-miR-ctrl组(细胞转染si-TMPO-AS1和anti-miR-ctrl)、si-TMPO-AS1+anti-miR-340-5p组(细胞转染si-TMPO-AS1和anti-miR-340-5p)。将细胞转染48 h,进行后续实验。
1.6 qRT-PCR检测6组HCT116细胞中TMPO-AS1、miR-340-5p、RUNX1表达 方法同1.4。
1.7 CCK-8法检测6组HCT116细胞活力 HCT116细胞转染48 h后,换取新鲜的培养基并向每个孔中加入CCK-8溶液。孵育2 h后,使用酶标仪监测450 nm处吸光度。
1.8 EDU法检测6组HCT116细胞增殖 HCT116细胞转染48 h后,每孔加入EDU培养基,孵育2 h,PBS清洗细胞,根据EDU细胞增殖检测试剂盒说明依次进行固定、通透、洗涤、染色,最后进行荧光检测。
1.9 Transwell检测6组HCT116细胞迁移和侵袭 转染48 h后,制成细胞悬液,加入Transwell上室,下室加入完全培养基,培养24 h后,擦去未迁移的细胞,固定,结晶紫染色,倒置显微镜下观察细胞计数。细胞侵袭实验需提前包被基质胶,其他步骤同迁移实验。
1.10 Western blot检测6组HCT116细胞RUNX1、PCNA、MMP-2表达 转染48 h后,细胞弃去上清,加入RIPA裂解液获得蛋白,将蛋白用BCA法进行定量后,进行Western blot检测,具体操作为电泳,转膜,封闭,孵育一抗(RUNX1、PCNA、MMP-2、GAPDH),孵育二抗,ECL显色,凝胶成像系统采集图像,Image J软件将蛋白条带进行灰度值分析。
1.11 双荧光素酶报告基因实验 构建TMPO-AS1野生型质粒(TMPO-AS1-WT)和突变型质粒(TMPO-AS1-MUT),将TMPO-AS1-WT和TMPO-AS1-MUT分别与mimics NC或miR-340-5p mimics共转染于HCT116细胞,48 h后,检测荧光素酶活性。构建RUNX1野生型质粒(RUNX1-WT)和突变型质粒(RUNX1-MUT),将RUNX1-WT和RUNX1-MUT分别与mimics NC或miR-340-5p mimics共转染于HCT116细胞,48 h后,检测荧光素酶活性。

2 结果
2.1 HCoEpiC细胞与多种CRC细胞中TMPO-AS1、miR-340-5p、RUNX1表达比较 与HCoEpiC细胞比较,不同CRC细胞中TMPO-AS1、RUNX1 mRNA表达显著性升高,miR-424-5p表达显著性降低(P<0.05),且HCT116细胞变化结果更显著,故后续实验选择HCT116细胞。见表1。

表1 HCoEpiC与CRC细胞中TMPO-AS1、miR-340-5p、RUNX1表达比较 n=6,
2.2 6组HCT116细胞TMPO-AS1、miR-340-5p、RUNX1 mRNA水平比较 与si-ctrl组比较,si-TMPO-AS1组HCT116细胞TMPO-AS1、RUNX1 mRNA水平显著性降低(P<0.05),miR-340-5p mRNA水平显著性升高(P<0.05);与mimics NC组比较,miR-340-5p组HCT116细胞RUNX1 mRNA水平显著性降低(P<0.05),miR-340-5p mRNA水平显著性升高(P<0.05);与si-TMPO-AS1+anti-miR-ctrl组比较,si-TMPO-AS1+anti-miR-340-5p组HCT116细胞RUNX1 mRNA水平显著性升高(P<0.05),miR-340-5p mRNA水平显著性降低(P<0.05)。见表2。

表2 6组HCT116细胞TMPO-AS1、miR-340-5p、RUNX1 mRNA水平比较 n=6,
2.3 6组HCT116细胞活力比较 与si-ctrl组比较,si-TMPO-AS1组HCT116细胞活力A值显著性降低(P<0.05);与mimics NC组比较,miR-340-5p组HCT116细胞活力A值显著性降低(P<0.05);与si-TMPO-AS1组比较,si-TMPO-AS1+anti-miR-ctrl组HCT116细胞活力A值差异无统计学意义(P>0.05);与si-TMPO-AS1+anti-miR-ctrl组比较,si-TMPO-AS1+anti-miR-340-5p组HCT116细胞活力A值显著性升高(P<0.05)。见表3。

表3 6组HCT116细胞活力A值比较 n=6,A值,
2.4 6组HCT116细胞增殖能力比较 与si-ctrl组比较,si-TMPO-AS1组HCT116细胞EDU阳性细胞率显著性降低(P<0.05);与mimics NC组比较,miR-340-5p组HCT116细胞EDU阳性细胞率显著性降低(P<0.05);与si-TMPO-AS1组比较,si-TMPO-AS1+anti-miR-ctrl组HCT116细胞EDU阳性细胞率差异无统计学意义(P>0.05);与si-TMPO-AS1+anti-miR-ctrl组比较,si-TMPO-AS1+anti-miR-340-5p组HCT116细胞EDU阳性细胞率显著性升高(P<0.05)。见表4,图1。
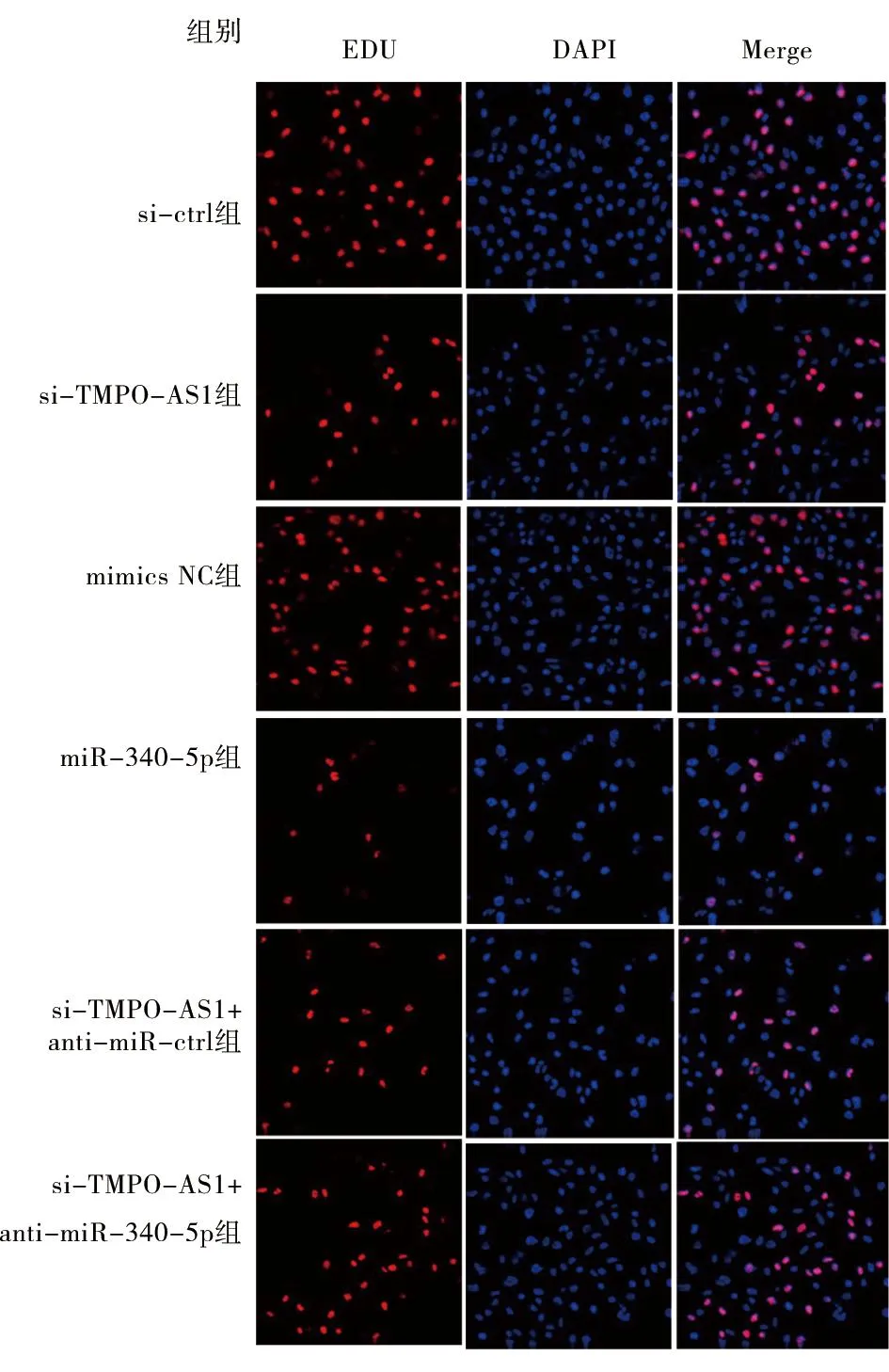
图1 EDU染色检测6组HCT116细胞增殖(×200)

表4 6组HCT116细胞增殖能力比较 n=6,
2.5 6组HCT116细胞迁移和侵袭能力比较 与si-ctrl组比较,si-TMPO-AS1组HCT116细胞迁移和侵袭数量显著性降低(P<0.05);与mimics NC组比较,miR-340-5p组HCT116细胞迁移和侵袭数量显著性降低(P<0.05);与si-TMPO-AS1组比较,si-TMPO-AS1+anti-miR-ctrl组HCT116细胞迁移和侵袭数量差异无统计学意义(P>0.05);与si-TMPO-AS1+anti-miR-ctrl组比较,si-TMPO-AS1+anti-miR-340-5p组HCT116细胞迁移和侵袭数量显著性升高(P<0.05)。见图2、3,表5。
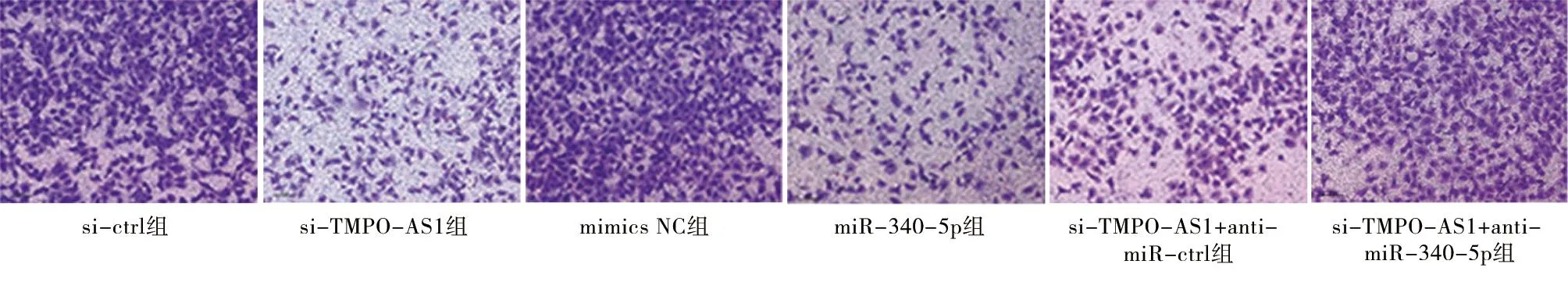
图2 Transwell检测6组HCT116细胞迁移(×200)

图3 Transwell检测6组HCT116细胞侵袭(×200)

表5 6组HCT116细胞迁移和侵袭能力比较 n=6,个,
2.6 6组HCT116细胞RUNX1、PCNA、MMP-2表达比较 与si-ctrl组比较,si-TMPO-AS1组HCT116细胞RUNX1、PCNA、MMP-2蛋白水平显著降低(P<0.05);与mimics NC组比较,miR-340-5p组HCT116细胞RUNX1、PCNA、MMP-2蛋白水平显著降低(P<0.05);与si-TMPO-AS1组比较,si-TMPO-AS1+anti-miR-ctrl组HCT116细胞RUNX1、PCNA、MMP-2蛋白水平差异无统计学意义(P>0.05);与si-TMPO-AS1+anti-miR-ctrl组比较,si-TMPO-AS1+anti-miR-340-5p组HCT116细胞RUNX1、PCNA、MMP-2蛋白水平显著性升高(P<0.05)。见表6,图4。

图4 6组HCT116细胞中RUNX1、PCNA、MMP-2蛋白表达比较;A si-ctrl组;B si-TMPO-AS1组;C mimics NC组;D miR-340-5p组;E si-TMPO-AS1+anti-miR-ctrl组;F si-TMPO-AS1+anti-miR-340-5p组

表6 6组HCT116细胞中RUNX1、PCNA、MMP-2蛋白表达比较 n=6,
2.7 双荧光素酶报告基因检测结果 软件分析发现LncRNA TMPO-AS1与miR-340-5p、miR-340-5p与RUNX1均有互补结合位点。双荧光素酶实验结果显示,与TMPO-AS1-WT+mimics NC组比较,TMPO-AS1-WT+miR-340-5p mimics组HCT116细胞荧光素酶活性降低(P<0.05);与RUNX1-WT+mimics NC组比较,RUNX1-WT+miR-340-5p mimics组HCT116细胞荧光素酶活性降低(P<0.05)。见图5、6,表7、8。

图5 TMPO-AS1与miR-340-5p的结合位点

图6 miR-340-5p与RUNX1的结合位点

表7 验证TMPO-AS1与miR-340-5p的靶向关系 n=6,

表8 验证miR-340-5p与RUNX1的靶向关系 n=6,
3 讨论
CRC是临床上常见的恶性肿瘤,常出现复发和转移[10],因此需要为CRC的诊断和治疗确定新的高效分子靶点。最近研究表明,LncRNA TMPO-AS1是一种癌基因,参与多种癌症的发展,比如在胃癌组织中TMPO-AS1高度表达,调节miR-140-5p/SOX4轴促进胃癌细胞迁移,侵袭[11];在宫颈癌细胞中TMPO-AS1过度表达,调节miR-143-3p和ZEB1轴促进宫颈癌细胞增殖、迁移和侵袭[12]。而笔者发现关于LncRNA TMPO-AS1在CRC中发挥作用尚无报道,因此本文首先检测LncRNA TMPO-AS1在CRC细胞中的表达水平,结果发现与正常结肠上皮细胞比较,多种CRC细胞中TMPO-AS1高度表达,且HCT116细胞TMPO-AS1水平更高,因此选择HCT116细胞进行后续实验。沉默TMPO-AS1后发现HCT116细胞增殖、迁移和侵袭均被抑制,表明TMPO-AS1促进HCT116细胞细胞增殖、迁移和侵袭。
miRNA是内源性转录后调节因子,通过与其靶mRNA的3’非翻译区结合来介导mRNA降解或翻译抑制[13]。近年来研究表明miR-340-5p与癌症进展密切相关,如过表达miR-340-5p后可逆转FGF23对骨髓瘤细胞的促进作用,表明miR-340-5p抑制骨髓瘤细胞增殖、迁移和侵袭[14];过表达miR-340-5p可抑制喉癌细胞的增殖和侵袭[15];在CRC一篇研究中表明,miR-340-5p在CRC中低表达,circN4BP2L2通过下调miR-340-5p水平,促进结直肠癌的生长和转移[16];miR-340-5p通过直接靶向ANXA3在结直肠癌中发挥抑瘤作用,推测可作为结直肠癌预后的标志物[7]。因此猜测miR-340-5p抑制CRC发展。
本文发现与正常结肠上皮细胞比较,CRC细胞中miR-340-5p表达下调,将HCT116细胞过表达miR-340-5p后发现,HCT116细胞增殖、迁移和侵袭均被抑制,表明miR-340-5p抑制HCT116细胞增殖、迁移和侵袭。接着软件分析发现LncRNA TMPO-AS1与miR-340-5p存在互补结合位点,双荧光素酶报告基因检测发现TMPO-AS1靶向负调控miR-340-5p表达,为了进一步验证此想法,将细胞沉默TMPO-AS1并且抑制miR-340-5p表达,结果表明抑制miR-340-5p后,可逆转沉默TMPO-AS1对HCT116细胞的增殖、迁移和侵袭抑制作用,上述研究表明沉默TMPO-AS1靶向上调miR-340-5p表达,从而抑制HCT116细胞增殖、迁移和侵袭。
有趣的是,本文观察到与正常结肠上皮细胞比较,RUNX1在CRC细胞中高表达,且与miR-340-5p表达呈负相关。RUNX1被证明在多种癌症中过表达,促进癌细胞的发展,与癌症患者预后密切相关,比如在食管癌中,RUNX1a促进肿瘤生长[17];在乳腺癌中,SNORA71C和RUNX1相互作用促进乳腺癌的发生发展[18];在CRC中也有相应的研究,如异常升高RUNX1有助于CRC癌变,有学者使用PrognoScan数据库观察到RUNX1的表达在CRC中起有害作用[19];RUNX1通过激活Hedgehog信号通路和ABCG2表达来促进CRC增殖和化学抗性[20],上述研究表明RUNX1促进CRC发展。
本文发现与正常结肠上皮细胞比较,多种CRC细胞中RUNX1表达上调,沉默TMPO-AS1或过表达miR-340-5p时,RUNX1 mRNA和蛋白水平均被抑制,从而抑制HCT116细胞增殖、迁移和侵袭,表明RUNX1促进HCT116细胞增殖、迁移和侵袭。接着本文软件分析发现miR-340-5p与RUNX1存在互补结合位点,根据上述结果综合分析猜测miR-340-5p靶向调控RUNX1表达,为进一步验证此猜想,通过双荧光素酶报告基因检测发现miR-340-5p靶向负调控RUNX1表达,即表明miR-340-5p通过靶向负调控RUNX1从而抑制HCT116细胞增殖、迁移和侵袭。
综合分析,沉默TMPO-AS1靶向上调miR-340-5p表达,从而下调RUNX1表达,抑制HCT116细胞增殖、迁移和侵袭。本研究尚存在不足之处,仅在细胞水平验证LncRNA TMPO-AS1调控miR-340-5p/RUNX1轴对HCT116细胞增殖、迁移和侵袭的影响,仍需动物实验进一步探索。

