骨肉瘤组织中GFRA1、FBN1表达水平及意义
张畅 李小双 廉凯 徐进 李晶
骨肉瘤是最常见的成骨性恶性肿瘤,多发生于儿童、青少年和青壮年中[1]。骨肉瘤的定义为恶性间充质细胞产生类骨或不成熟骨。骨肉瘤具有高度的局部侵袭和早期发生肺转移,致残率及致死率较高,严重危害人类的健康。骨肉瘤多发生于骨骼快速生长的长骨,包括股骨远端、胫骨近端、肱骨近端等,骨肉瘤的突出症状是肿瘤部位的疼痛和局部肿胀。骨肉瘤的复发率较高,预后较差,发生肺部转移的患者5年生存率不到20%[2]。胶质细胞系源性神经营养因子受体 1(glial cell line derived neurotrophic factor α1,GFRA1)是一种细胞表面膜受体,与配体(GDNF)结合后,可以促进神经元细胞的生长发育和迁移[3],还可以影响肾脏和肠道神经干细胞的运动迁移。GFRA1在某些癌症中被认为是一种致癌基因。研究表明,GFRA1在乳腺癌和胰腺癌等人类癌症的发展中发挥作用,促进了肿瘤的侵袭和迁移[4-5]。原纤维蛋白-1(Fibrillin-1,FBN1)是一种细胞外糖蛋白,是构成细胞外基质微纤维的主要成分,其作用是保持结缔组织的完整和功能正常[6]。据报道,FBN1可以在多种癌症中表达,参与肿瘤的发生发展过程[7-8]。而关于GFRA1、FBN1在骨肉瘤组织中的表达及其作用还不清楚,因此,本研究检测了GFRA1、FBN1在骨肉瘤组织中的表达,初步探讨二者在骨肉瘤发生发展中的作用及与临床病理的关系。
1 资料与方法
1.1 一般资料 收集武汉市黄陂区人民医院和襄阳市中心医院骨科2017年9月至2019年9月进行手术治疗精细切除的66例骨肉瘤患者的肿瘤标本及癌旁组织标本,收集整理骨肉瘤患者的临床资料。其中男38例,女28例;<10岁34例,≥10岁32例,平均年龄(18.24±4.28)岁;肿瘤直径<5 cm 31例,≥5 cm 35例;Enneking外科诊断分期:Ⅰ期20例,Ⅱa期19例,Ⅱb期17例,Ⅲ期10例;分化程度:低分化44例,中、高分化22例;发生肺转移38例;发生软组织浸润46例;肿瘤位置:股骨或胫骨45例,肱骨21例。
1.2 纳入与排除标准 (1)纳入标准:①经组织病理学确诊为骨肉瘤;②研究对象本人详知此项研究内容,并自愿签署同意书;③患者入院前未进行手术、放疗、化疗等治疗;④研究对象术中成功获取组织标本并保存完整,患者随访资料齐全。(2)排除标准:①合并其他肿瘤患者;②合并严重心血管疾病患者;③有自身免疫性疾病、全身感染性疾病者。
1.3 方法
1.3.1 免疫组织化学法检测骨肉瘤组织和癌旁组织GFRA1、FBN1蛋白表达:骨肉瘤组织和癌旁组织样本进行连续切片,之后严格按照免疫组织化学试剂盒(上海羽哚生物科技有限公司)说明书步骤检测GFRA1、FBN1蛋白表达。切片脱蜡至水后,微波加热法修复抗原3 min;自然冷却后PBS液洗涤3×3 min,加入3%过氧化氢进行封闭,柠檬酸缓冲液进行抗原修复5 min,之后选10%的山羊血清进行封闭,封闭10 min后加入GFRA1、FBN1第一抗体(上海酶联生物科技有限公司),4℃孵育过夜,次日PBS冲洗3×3 min;加入适量的生物标记素二抗,反应30 min,PBS缓冲液洗涤后,滴加DBA(北京百奥莱博科技有限公司)显色3 min,之后用蒸馏水冲洗,苏木素复染,酒精逐级脱水、二甲苯透明,中性树胶封片。
1.3.2 结果判定:免疫组织化学结果判定采用半定量方法,在显微镜下随机取5个高倍镜视野观察GFRA1、FBN1染色情况,最终评分<2分为阴性表达,≥2分为阳性表达[9]。
1.3.3 随访:所有患者出院后通过电话或门诊复查方式进行为期3年的随访,患者出现死亡时则随访结束,患者随访率为100%。生存时间为术后日期至患者死亡时间或最终随访截止时间,随访截至2022年9月。
1.4 统计学分析 应用SPSS 21.0统计软件,计数资料以百分率表示,GFRA1、FBN1与临床病理特征的相关性分析采用检验;骨肉瘤组织GFRA1、FBN1表达与患者预后的关系采用Kaplan-Meier法分析,多因素Logistic回归分析骨肉瘤患者预后的影响因素,P<0.05为差异有统计学意义。
2 结果
2.1 骨肉瘤组织和癌旁组织GFRA1、FBN1表达比较 与癌旁组织相比,骨肉瘤组织中GFRA1、FBN1阳性表达率明显较高,差异有统计学意义(P<0.05)。见表1、图1。
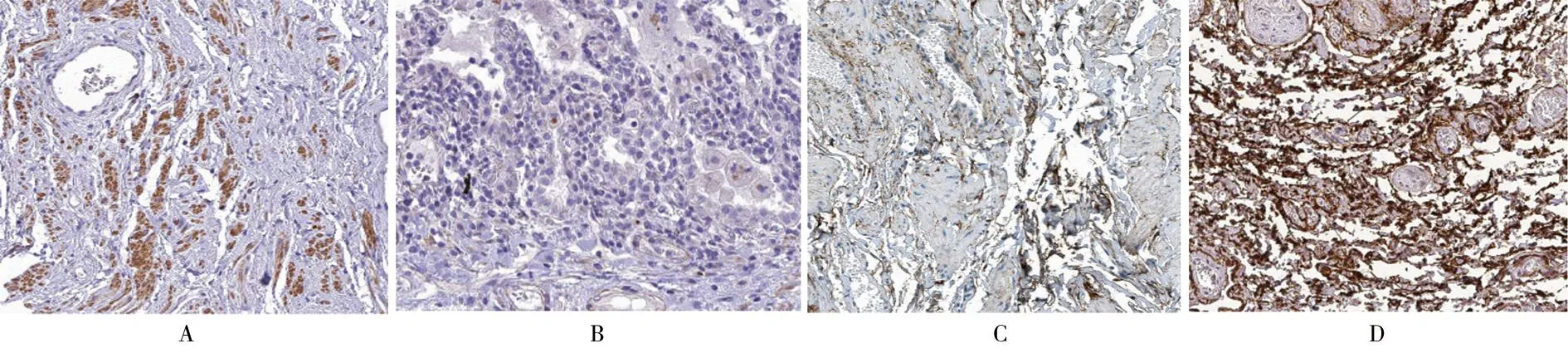
图1 免疫组织化学检测GFRA1、FBN1在骨肉瘤组织及癌旁组织中的表达(×400);A 骨肉瘤组织中GFRA1蛋白阳性表达;B 癌旁组织中GFRA1蛋白阳性表达;C 癌旁组织中FBN1蛋白阳性表达;D 骨肉瘤组织中FBN1蛋白阳性表达
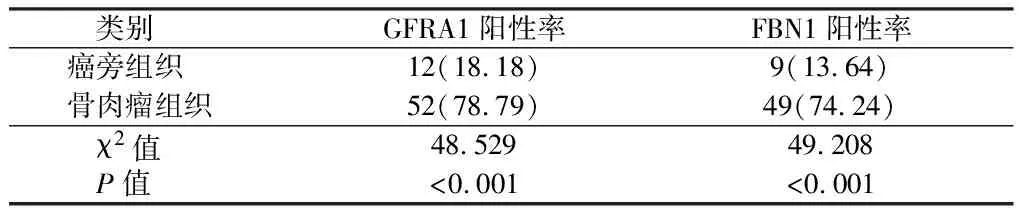
表1 骨肉瘤组织和癌旁组织GFRA1、FBN1表达比较 n=66,例(%)
2.2 骨肉瘤组织GFRA1、FBN1表达与患者临床病理特征的关系 GFRA1、FBN1的阳性表达与骨肉瘤患者的性别、年龄、肿瘤直径、肿瘤位置无关,差异无统计学意义(P>0.05),与临床分期、分化程度、是否发生肺转移、软组织是否浸润有关,差异有统计学意义(P<0.05)。见表2。
2.3 骨肉瘤组织GFRA1、FBN1表达与患者预后的关系 随访结束,经统计66例患者中死亡的有26例,生存40例。采用Kaplan-Meier法分析骨肉瘤组织GFRA1、FBN1表达与患者预后的关系,结果显示,骨肉瘤组织GFRA1阳性表达患者3年生存率(29/54)低于GFRA1阴性表达患者(11/12,91.67%)(χ2=4.443,P<0.05);骨肉瘤组织FBN1阳性表达患者3年生存率(26/49,53.06%)低于FBN1阴性表达患者(14/17,82.35%)(χ2=4.536,P<0.05)。见图2、3。
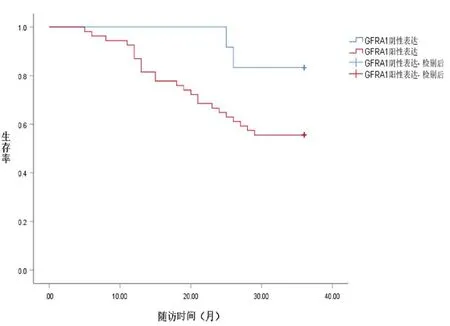
图2 骨肉瘤组织GFRA1表达与患者3年总生存率的关系
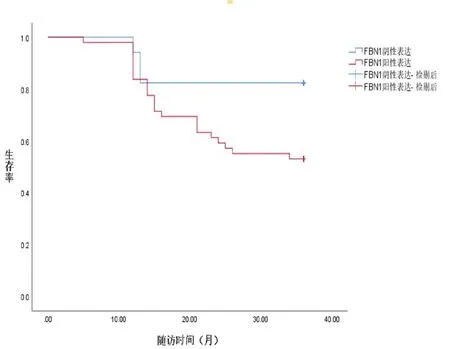
图3 骨肉瘤组织FBN1表达与患者3年总生存率的关系
2.4 多因素Logistic回归分析骨肉瘤患者预后的影响因素 以骨肉瘤患者3年内是否死亡为因变量,以GFRA1、FBN1、临床分期、分化程度、肿瘤转移、软组织浸润为自变量进行多因素Logistic回归分析,结果显示,GFRA1、FBN1、分化程度、肿瘤转移、软组织浸润是骨肉瘤患者预后的独立危险因素(OR=1.729,1.684,1.669,1.532,1.694,P<0.05)。见表3。
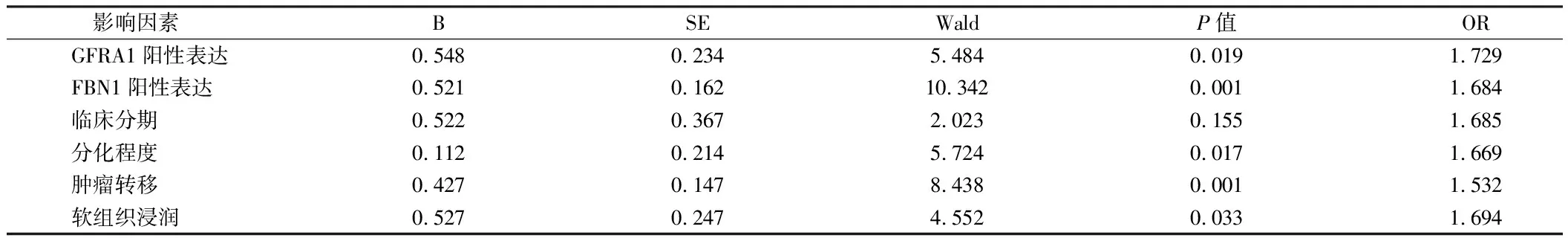
表3 多因素Logistic回归分析骨肉瘤患者预后的影响因素
3 讨论
骨肉瘤是原发性骨癌的主要形式,是一种高度恶性肿瘤。骨肉瘤在儿童癌症中占3%~6%,在成人癌症中占1%左右[10]。一般认为骨肉瘤的发生与骨骼的快速生长有关,起病较为隐匿,发展较快,多数患者临床确诊时已是晚期,且发生肺转移,患者的预后效果不佳[11-12]。
研究发现,骨肉瘤的发生发展是多因素的原因,与多种基因的异常表达有关[10]。因此,研究骨肉瘤中差异表达的基因,可能对预测预后、改善预后有重要意义。GFRA1是GDNF家族受体a的一种形式,GFRA1或GDNF的异常表达经常在各种癌症中被发现,与肿瘤的发生、发展有关[13]。谢萍芳等[14]研究显示,GFRA1在乳腺癌中高表达,但在不同类型乳腺癌中的表达存在差异,其表达水平可以作为乳腺癌筛选、预后预测的标志物之一。环状GFRA1 RNA (circGFRA1)通过海绵miR-34a调节GFRA1表达,在三阴性乳腺癌中发挥调节功能[15]。本研究中发现骨肉瘤组织中GFRA1阳性表达显著高于癌旁组织,提示GFRA1在骨肉瘤的发展过程中,可能发挥着致癌基因作用;其表达与骨肉瘤的临床分期、分化程度、肺转移、软组织浸润有关,而与年龄、性别、肿瘤直径、肿瘤位置无关,提示GFRA1与骨肉瘤的恶性程度相关。
FBN1是FBN家族的成员之一,主要分布于结缔组织中。研究表明,FBN1与膀胱癌的进展和预后相关,在膀胱癌患者中表达升高,且与较差的总生存率相关[16]。FBN1参与胃癌细胞的增殖和分化,其表达水平与胃癌患者的病理T分期和组织学分级相关,同时也影响胃癌患者的总生存期[17]。FBN1主要是通过 Wnt/β-catenin信号通路及MMPs家族介导上皮间质转换途径来对胃癌发生发展影响的[18]。本研究中结果显示,FBN1在骨肉瘤组织中的阳性表达率高于癌旁组织,提示FBN1在骨肉瘤细胞恶变的过程中可能发挥一定作用,且有可能作为诊断骨肉瘤的生物标志物。通过分析FBN1表达与临床病理特征表达的关系,发现FBN1与骨肉瘤的临床分期、分化程度、是否发生肺转移、软组织是否浸润有关,提示FBN1的表达可能与骨肉瘤侵袭和迁移有关。本研究进一步分析了66例骨肉瘤患者3年的随访资料,结果显示GFRA1、FBN1阴性表达的患者3年生存率较高。同时多因素Logistic回归分析,结果显示GFRA1、FBN1蛋白阳性表达、肿瘤转移、软组织浸润是影响骨肉瘤患者预后的独立危险因素,以上结果均提示GFRA1、FBN1阳性表达预示着预后不良,二者可能分别作为促癌因子在骨肉瘤的发生发展中起作用。
综上所述,骨肉瘤组织中GFRA1、FBN1阳性表达显著升高,可作为影响骨肉瘤患者预后的敏感指标。

