miRNA调控claudin-2表达对溃疡性结肠炎小鼠巨噬细胞极化的机制
朱卫 曾婷婷
溃疡性结肠炎是一种慢性结肠炎,临床出现反复症状,还会出现腹痛、腹泻和大便内或表面黏液,并夹杂血液[1]。研究证实,溃疡性结肠炎与肠炎系列结直肠癌之间相互联系,持续的炎性刺激会导致出现黏膜发生慢性炎性反应,连续损伤肠道黏膜,最后使癌变发生[2]。随着溃疡性结肠炎发病率的逐渐升高,炎症性肠病恶化癌变肠炎相关性结直肠癌及患者死亡风险明显增加[3]。巨噬细胞具有可塑性和异质性,可极化能分泌有利于炎症免疫调节巨噬细胞以及能分泌抗炎因子巨噬细胞[4]。通常情况下,巨噬细胞分泌促炎细胞因子,主要对应宿主防御、病毒等和肿瘤免疫反应;巨噬细胞主要有抗炎作用,介导调节黏膜损伤修复以及纤维化病变[5]。miRNA是一类非编码RNA,对免疫细胞的发育凋亡、以至炎症及肿瘤相关疾病都有重要作用[6]。有研究证明,miRNA参与了肿瘤生长等过程[7]。miRNA已逐渐成为多种诊断癌症和识别患有相关疾病发生临床事件、疾病复发和进展的生物标准分子,在多种恶性肿瘤疾病的发生发展中均为异常,与结直肠癌等多种癌症疾病关系密切。miRNA能够明显改善溃疡性结肠炎小鼠的炎症环境,减少结肠炎性细胞浸润和充血水肿,改善结肠组织结构损伤。基于此,本研究探讨并分析miRNA调控claudin-2表达对溃疡性结肠炎小鼠巨噬细胞极化机制分析。
1 材料与方法
1.1 材料 选取SPF级BALB/c雌性小鼠60只,体重20~22 g,由上海美迪西生物医药股份有限公司提供,动物许可证:SYXK(沪)2020-0038。在相对湿度为45%~55%、饲养温度为(23.5±1.3)℃条件下喂养,光照12 h/d,动物自由食用标准饲料和饮用蒸馏水,喂养7 d。本研究获得医院伦理会批准。
1.2 主要试剂、仪器 IL-6(迪信泰检测科技(北京)有限公司);IL-8(上海广锐生物科技有限公司);TNF-α(上海酶研生物科技有限公司);CD4+、CD8+(上海华邦生物科技有限);iNOS抗体(武汉伊莱瑞特生物科技有限公司);CD206抗体(艾美捷科技有限公司);HP300型组织脱水机(奥华科技有限公司);Elx808型全波长多功能酶标仪(广州吉源生物科技有限公司);ES30型组织包埋机(华速科技有限公司);ZE5型流式细胞仪(美国Bio-Rad生物科技有限公司);GAPDH(美国CST公司);RIPA裂解液(北京伊塔生物科技有限公司);光学显微镜(日本OLympus公司)。
1.3 方法
1.3.1 造模及分组:选取6-8周雌性BALB/c小鼠60只,适应性饲养7 d,其中对照组15只,其余共45只小鼠,建模期间,对照组小鼠给予蒸馏水自由饮用,其他3组小鼠给予3.5% DSS溶液自由饮用,制作溃疡性肠炎模板,造模小鼠出现严重的稀便、便血、体重量下降为造模成功。7 d后,所有小鼠造模成功,无死亡小鼠,随机分为模型组、上调组、下调组,每组15只。
1.3.2 HE染色:小鼠腹腔注射麻醉后,经腹部主动脉采血3 mL,4 μL石蜡切片脱蜡至水洗,苏木精染色,进行清洗,1%盐酸酒精分化20 s,接着清洗1 min反蓝30 s,进行清洗,伊红染色,再接着水洗,80%乙醇脱水20 s,90%乙醇脱水20 s,95%乙醇脱水1 min,无色透明液体2 min,封片固定,光学显微镜观察。
1.4 观察指标
1.4.1 溃疡性结肠炎评分:观察小鼠活动性、进食情况、毛色变化、体重变化,记录小鼠排便次数、粪便形状、并进行潜血检测。根据体重、大便形状和便血情况评分[8]。小鼠体重下降评分:体重不变为0,1~5 g为1分,6~10 g为2分,11~15 g为3分,>15 g为4分;大便形状评分:正常为0分,粪便成形但较软为1分,没有成形为2分,拉稀水为4分;血便情况:未出现出血症状为0分,出现出血症状为2分。
1.4.2 炎性因子水平检测:将小鼠结肠组织加入适量0.9%氯化钠溶液捣碎,加入磷酸盐缓冲液500 μL的离心管中,搅拌使浓度发生改变,3 500 r/min离心10 min取上清液。酶联免疫吸附法检测小鼠血清和结肠清液中的IL-6、IL-8、TNF-α水平。
1.4.3 巨噬细胞检测:新鲜的小肠分离用冰冷的磷酸缓冲盐溶液冲洗,切成2 mm长的小块,放置于磷酸缓冲盐溶液在冰上孵育90 min,30 min晃动1次。之后晃动样本,收集上清。换新鲜的磷酸缓冲盐溶液,继续孵育,每30分钟收集1次上清。最终收集清洗2次,3 000 r/min,于37℃处理1 min,过40 μm滤筛,制得单细胞悬浮液。将准备的结肠单细胞悬液收集于流式管中,加入CD206抗体1 μL、进行混匀,37℃避光孵育25 min。等待表明抗体孵育完成之后,使用冷的磷酸缓冲盐溶液洗涤1次,洗涤之后每份流式管加入流式破膜固定液1 mL并脉冲涡旋,室温孵育60 min。每份流式管添加透化液2 mL,室温条件下800 r/min,离心5 min,弃上清。每份流式样品重复悬后添加iNOS聚乙烯管抗体3.5 μL,室温避光孵育30 min。每份流式管添加透化液2 mL,室温条件下,进行离心处理800 r/min,离心5 min,丢弃清液,洗涤1次。最后将样品重悬与PBS 300 μL中,使用流式细胞仪分析。
1.4.4 miRNA表达检测:采用qRT-PCR定量检测,提取RNA:将适量细胞溶于1 mL RNA提取试剂TRIzol中,组织则需要在研钵中加入液氮和TRIzol研磨成粉末状;每管加入200 μL三氯甲烷,进行混匀,室温静置5 min;在4℃,5 000 r/min,离心15 min,收集上清放在离心管中,加入同体积的异丙醇,混匀,室温静置10 min;4℃,5 000 r/min,离心10 min,倒掉上清,在管中加入1 mL 75%DEPC-乙醇,4℃、12 000 g离心5 min;晾干沉淀,加入适量的DEPC水溶解。应用mRNA逆转录试剂盒性逆转录获得cDNA,GAPDH为内参,提取细胞引物反应条件95℃ 5 min、95℃15 s、60℃退火30 s,72℃延伸32 s,40个循环,样本重复2次取平均值,每个miRNA相对标准内参表达量用方程2-ΔΔCt表示。
1.4.5 claudin-2表达水平:采用Western BIot法检测结肠组织claudin-2表达水平。将结肠组织剪碎后加50 μL细胞裂解液离心取上清,用0.9%氯化钠溶液洗涤3次,并切碎,加入裂解液进行溶解。离心处理1 500 r/min,离心20 min,4℃孵育膜过夜,清洗之后,加入一抗标记大鼠于室温封闭1 h,内参为GAPDEH,对蛋白表达进行定量分析。

2 结果
2.1 组织学观察:4组小鼠交通病理特征比较 对照组小鼠结肠黏膜整齐,腺体排列整齐,没有出现炎性细胞浸润;模型组结肠黏膜缺损不均,溃疡形成,隐窝脓肿,黏膜下层大量炎性性细胞浸润;上调组结肠黏膜比较完整,出血点消失,但存在部分黏膜缺损,隐窝脓肿,少量炎性细胞浸润;下调组表面出现脱落坏死,溃疡形成,隐窝消失、存在脓肿,杯状细胞增多。见图1。
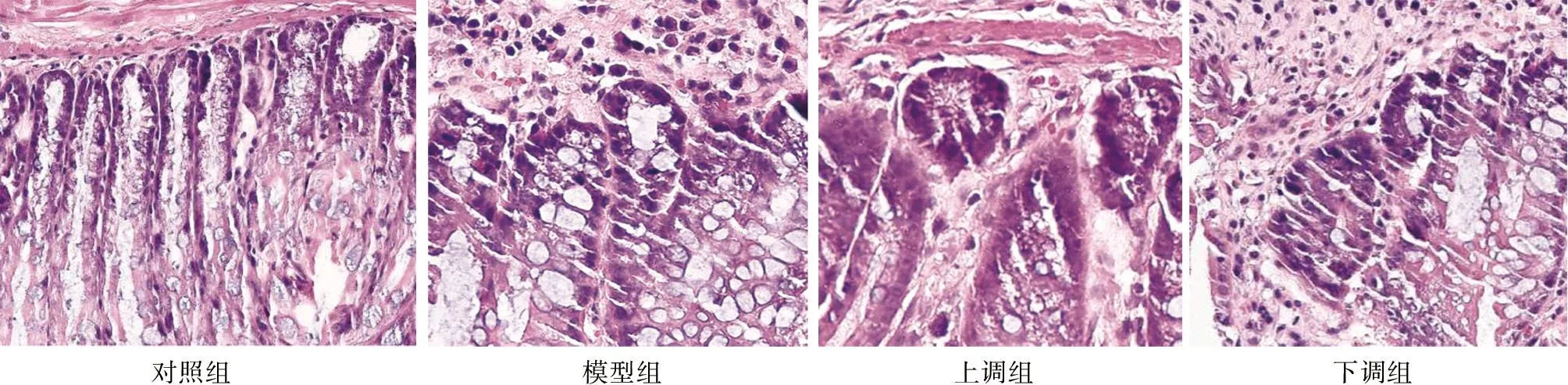
图1 4组病理特征(HE×100)
2.2 4组溃疡性结肠炎小鼠评分比较 与模型组比较,上调组3 d、5 d、7 d评分降低、下调组3 d、5 d、7 d评分升高,差异有统计学意义(P<0.05);与上调组比较,下调组3 d、5 d、7 d评分升高(P<0.05)。见表1。
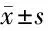
表1 4组溃疡性结肠炎小鼠评分比较 n=15,分,
2.3 4组小鼠转染效率比较 与对照组比较,模型组、上调组、下调组miRNA表达量升高(P<0.05);与模型组比较,上调组miRNA表达量下降,下调组miRNA表达量升高(P<0.05);与上调组比较,下调组miRNA表达量升高(P<0.05)。见表2。
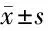
表2 4组小鼠转染效率鉴定 n=15,
2.4 4组小鼠CD4+、CD8+免疫细胞比较 与对照组比较,模型组、上调组、下调组CD4+、CD8+免疫细胞升高,差异有统计学意义(P<0.05);与模型组比较,上调组CD4+、CD8+免疫细胞降低,下调组CD4+、CD8+免疫细胞升高(P<0.05)。见表3。
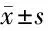
表3 4组免疫细胞功能比较 n=15,%,
2.5 4组小鼠炎性因子水平比较 与对照组比较,模型组、上调组、下调组TNF-α、IL-6、IL-8水平升高(P<0.05);与模型组比较,上调组TNF-α、IL-6、IL-8水平降低、下调组TNF-α、IL-6、IL-8水平升高,(P<0.05);与上调组比较,下调组TNF-α、IL-6、IL-8水平明显升高(P<0.05)。见表4。
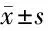
表4 4组小鼠血清炎性因子水平比较 n=15,
2.6 4组小鼠巨噬细胞功能比较 与对照组比较,模型组、上调组、下调组iNOS水平升高、CD206水平降低(P<0.05);与模型组比较,上调组iNOS水平降低、CD206水平升高(P<0.05);与上调组比较,下调组iNOS水平明显升高、CD206水平明显下降(P<0.05)。见表5。
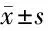
表5 4组小鼠巨噬细胞功能比较 n=15,
2.7 4组小鼠claudin-2蛋白表达比较 与对照组比较,模型组、上调组、下调组claudin-2蛋白表达升高(P<0.05);与模型组比较,上调组claudin-2蛋白表达下降、下调组claudin-2蛋白表达水平升高(P<0.05);与上调组比较,下调组水平明显升高(P<0.05)。见表6,图2。
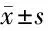
表6 4组claudin-2蛋白表达比较 n=15,ng/mL,

图2 claudin-2蛋白表达WB图
3 讨论
溃疡性结肠炎临床表现为长期慢性频繁腹泻伴有严重腹痛,还会出现黏液脓血便的症状,长期的炎症会致癌,还可能会导致结肠穿孔、坏死等[9-10]。溃疡性结肠炎症作为一类非特异性炎症性肠病,其发生发展与肠道炎症变化有密不可分的联系,对炎症有着调节作用。由于溃疡性结肠炎症反复发病,还会出现结直肠痛、黏液血便等症状。
miRNA属于一种内源性非编码小分子RNA,在许多生命中起到了重要的作用,具有调控的功能,并且参与机体内不同的生理、病理过程。还参与多种生物进程,包括早期细胞分化、增殖等,免疫应答和维持病毒感染机体后内环境平衡;miRNA基因存在于许多不同基因编码位置上,如细胞内或细胞外编码蛋白质基因和未编码RNAs上,能有效抑制相关蛋白质合成、降解靶基因miRNA;介于固有免疫在抵抗病源中发挥重要作用和miRNA在调控固有免疫进程中的重要性和作用的特殊性,作为一种重要调控物质参与其中可达到减少炎性因子的释放,从而缓解溃疡性结肠炎性反应,控制向癌变发展[11]。而研究结果发现,经不同时间点来进行观察小鼠溃疡性结肠炎情况,发现第3、5、7天在上调miRNA中小鼠溃疡性结肠炎中明显降低。
CD4+、CD8+作为一种重要的免疫细胞,CD4+细胞的异常失衡在疾病的发生中占据主导地位[12]。CD8+具有直接杀伤活性,通过消灭目标细胞而清除特殊抗体反应,从而调节免疫活性[13]。研究证明,小鼠溃疡性结肠炎中CD4+、CD8+细胞比例失衡,会导致相关细胞因子和炎症出现异常,从而导致肠道炎症及组织受损,形成溃疡[14]。而水平研究结果发现,经过上调miRNA对小鼠溃疡性结肠炎干预后,免疫细胞中CD4+、CD8+水平明显降低,说明调节了结肠黏膜免疫细胞功能,起到了调控炎性因子的作用,缓解了炎症。
TNP-α主要由单核细胞、巨噬细胞和T细胞产生,它不仅刺激巨噬细胞、平滑肌细胞、上皮细胞和细胞因子、催化蛋白质水解酶类,还能吞噬细胞产物的补体片段引起细胞坏死、和水肿的发生等,从而促进胃肠细胞组织损害。另外还可以诱导结肠上皮细胞凋亡,促进溃疡性结肠炎的发生[15]。IL-6在急性炎性反应中处于中心地位,主要表现为诱导产生C-反应蛋白和降钙素原生成[16]。IL-8作为一个溃疡性结肠炎发病过程中的炎性因子,是一种强而有力的中性粒细胞趋化和活化因子,并激活中性粒细胞,促进中性粒细胞的稳定以及溶解和吞噬作用,对白细胞血液中的一类细胞和T细胞也有一定的作用[17]。本研究结果发现,TNP-α、IL-6、IL-8在小鼠溃疡性结肠炎中明显升高;而经过上调miRNA对溃疡性结肠炎小鼠进行干预,能够降低TNP-α、IL-6、IL-8水平。说明通过上调miRNA,反映了溃疡性结肠炎发生,缓解了肠道受损和肠道炎症症状。
巨噬细胞在机体内起着重要的清除病原体和细胞垃圾的作用[18]。当机体受到感染损伤时,巨噬细胞会被激活,从而释放出一系列的细胞因子和化学物质,以引导其他细胞参与反应[19]。本研究结果发现,iNOS水平在小鼠溃疡性结肠炎中升高、CD206水平在小鼠溃疡性结肠炎中降低;而经过上调miRNA对溃疡性结肠炎小鼠进行干预,能够降低iNOS水平,升高CD206水平,说明调整了机体适应性免疫应答,恢复了肠黏膜屏障功能。
claudin-2在直肠癌细胞中过表达,与促进细胞增殖,维护肠黏膜损伤中有着重要作用,形成细胞膜水通道介导调节肠黏膜上皮细胞水通量[20]。本研究结果显示,claudin-2蛋白表达在小鼠溃疡性结肠炎中升高,经过上调miRNA对溃疡性结肠炎小鼠进行干预,降低了claudin-2蛋白表达,因为miRNA对claudin-2蛋白表达具有调控作用,能够对抑制细胞的增殖,调节免疫功能,减轻炎性因子,从而明显改善了溃疡性结肠炎病状。
综上所述,miRNA通过调控claudin-2蛋白表达,促使巨噬细胞极化,从而缓解了小鼠溃疡性结肠炎肠道的损伤和炎症,抑制了病症的发展。

