阿江榄仁酸由AMPK/mTOR/HO-1信号通路调控自噬对糖尿病视网膜病变影响
蒋晨 万新娟 王绍飞 王晓虹 丁琳
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病常见的严重微血管并发症,已成为工作年龄段(18~65岁)人群的主要失明原因之一[1]。流行病学研究显示,到2045年将有7亿成年人患有糖尿病,其中35%的患者将并发DR[2]。研究发现,糖尿病可通过抑制视网膜细胞自噬功能增加毛细血管和细胞的炎症、晚期糖基化终末产物积累和氧化应激,促进细胞凋亡并造成视网膜损伤[3]。因此,抑制视网膜细胞自噬可能是治疗DR的重要策略。根据中医理论,“湿”和“热”是糖尿病的主要病机[4]。阿江榄仁酸(arjunolic acid,AA)作为主要在青钱柳中发现的齐墩果酸类三萜化合物,在中国古代药典《中华本草》具有“清热解毒、生津止渴”的功效,发挥抗糖尿病、抗炎、抗氧化和抗凋亡活性的作用[5-6],提示AA可能是治疗DR的一种有前景的候选药物。本研究通过构建DR大鼠和细胞模型,评估AA对DR的疗效和潜在机制。
1 材料与方法
1.1 材料
1.1.1 试剂:阿江榄仁酸(批号:CAS:465-00-9,上海源叶生物科技有限公司);链脲佐菌素(STZ,货号:18883-66-4,美国Sigma公司);HE染色试剂盒(货号:C0105S,北京碧云天);二氢乙锭(DHE)染色试剂盒(货号:104821-25-2,美国Sigma公司);BCA蛋白定量试剂盒(货号:CW0014S-500T,中国康为世纪公司);抗LC3、p62、AMPK、p-AMPK、mTOR、p-mTOR、GAPDH抗体(货号:4108、23214、5831、2535、2983、5536、92310,美国CST公司);辣根过氧化物酶标记的羊抗兔二抗(货号:75920,美国CST公司)。
1.1.2 实验动物:60只健康SPF级雄性SD大鼠(体质量180~200 g)购自上海斯莱克实验动物公司,动物许可证号:SCXK(上海)2020-0005。实验动物均于新疆维吾尔自治区人民医院实验动物中心饲养,12 h光暗交替,室温(25±2)℃下自由标准进食水。
1.2 方法
1.2.1 动物模型构建及分组处理:所有大鼠随机分为对照组(Con)组、模型(STZ)组、阿江榄仁酸低剂量(AAL)组和阿江榄仁酸高剂量(AAH)组,每组15只。通过单次腹腔注射溶于柠檬酸钠缓冲液(pH值=4.5)的STZ(65 mg/kg)构建大鼠糖尿病模型,对照组仅给予等体积柠檬酸钠缓冲液。注射72 h后测量空腹血糖(FBG),以FBG>16.7 mmol/L为模型构建成功。之后,AAL组和AAH大鼠分别给予AA(10 mg/kg和30 mg/kg)灌胃处理,Con组和STZ组大鼠给予等量PBS溶剂灌胃,1次/d,维持10周。实验结束后,戊巴比妥钠(100 mg/kg)过量麻醉处死所有大鼠并收集眼球和血样,为后续实验做准备。
1.2.2 HE染色检测大鼠视网膜病理结构:将用于病理学检测的大鼠眼球在4%多聚甲醛中固定48 h,石蜡包埋并切片(5 μm)备用。利用苏木精-伊红(HE)染色试剂盒,按照说明书步骤,进行染色,400倍光学显微镜下拍照记录。
1.2.3 qRT-PCR检测视网膜组织炎症相关基因mRNA表达:使用Total RNA Isolating Kit试剂盒分离视网膜组织总RNA,然后根据OneStep RT-PCR Kit试剂盒说明书利用相关引物将其逆转录成cDNA。使用SYBR Green PCR试剂盒,按照制造商说明书进行RT-PCR反应以检测白细胞介素(IL)-1β、IL-6和线粒体丙酮酸转运载体(MPC)-1的相对mRNA表达。PCR反应进行40个循环(94℃,10 s; 60℃,20 s;和72℃,30 s)。按照2-ΔΔCt公式计算,以GAPDH为内参进行目标基因相对表达量标准化。引物序列如下:IL-1β引物F:5’-TTCAAATCTCACAGCAGCAT-3‘; R:5’-CACGGGCAAGACATAGGTAG-3‘; IL-6引物F:5’-AACTCCATCTGCCCTTCA-3’; R:5’-CTGTTGTGGGTGGTATCCTC-3’; MCP-1引物F:5’-TCGCTCAGCCAGATGCAATCAATG -3’; R:5’-CAGTTTGGGTTTGCTTGTCCAGGTG -3’;GAPDH引物F:5’-CGGCAAGTTCAACGGCACAG-3’; R:5’-CGCCAGTAGACTCC ACGACAT-3’。
1.2.4 二氢乙锭(DHE)染色评估视网膜组织ROS产生:参考先前文献研究方法[7],将视网膜组织切成10 μm厚的切片,使用DHE试剂盒并根据制造商说明书进行染色。将每个切片与DHE试剂在37 ℃黑暗环境中孵育30 min,PBS洗涤3次。超氧化物在DHE染料存在下显示红色荧光。用DAPI(40,6-二脒基-2-苯基吲哚,蓝色荧光)对细胞核进行复染。荧光显微镜下拍照记录,并使用Image J定量。
1.2.5 Western blot检测:视网膜组织在RIPA裂解液中匀浆裂解后,4℃下14 000 r/min离心30 min,获取上清总蛋白,并使用BCA蛋白质测定试剂盒定量。将等量(10~20 μg/泳道)的蛋白样品在8%~15% SDS-PAGE凝胶上分级分离,并转移到聚偏二氟乙烯(PVDF)膜上。将膜在室温下浸入5%(m/V)脱脂牛奶中1 h,随后在4℃下用以下稀释的一抗处理过夜:p62(1∶1 000)、LC3Ⅱ/Ⅰ(1∶1 000)、Beclin-1(1∶500)、HO-1(1∶500)、p-AMPK(1∶500)、AMPK(1∶500)、p-mTOR(1∶500)、mTOR(1∶400)和GAPDH(1∶10 000)。用TBST洗涤后,将膜与HRP标记的山羊抗兔IgG或山羊抗小鼠IgG(1∶3 000)二抗在37℃温育1 h。通过ECL系统对膜蛋白条带进行可视化。

2 结果
2.1 AA对大鼠视网膜组织结构的影响 Con大鼠视网膜组织结构完整,层次清晰规则,细胞排列规则有序;STZ组大鼠视网膜神经节细胞层出现肿胀和空泡样变化,中央视网膜ONL层厚度和细胞核计数明显降低(P<0.01);而AAL组和AAH组大鼠视网膜ONL厚度和细胞核计数逐渐升高,结构相对规整(P<0.05)。见表1,图1。
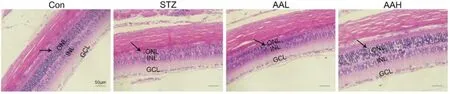
图1 AA对大鼠视网膜组织结构的影响(HE×400)

表1 4组大鼠ONL层厚度和细胞核计数比较 n=5,
2.2 AA对大鼠视网膜组织炎症的影响 qRT-PCR结果显示,与Con组比较,STZ组大鼠视网膜组织中IL-1β、IL-6和MCP-1的mRNA水平显著增高(P<0.05);与STZ组比较,AAH组IL-1β、IL-6和MCP-1的mRNA表达明显降低(P<0.05),而STZ组和AAL组之间3者表达差异无统计学意义(P>0.05)。见表2。

表2 4组大鼠视网膜组织炎性因子mRNA表达 n=5,
2.3 AA对大鼠视网膜组织氧化应激的影响 DHE染色结果显示,与Con组比较,STZ组大鼠视网膜外核层(ONL)、内核层(INL)和神经节细胞层(GCL)中ROS产生增加(P<0.01);与STZ组比较,AAL组和AAH组视网膜ONL、INL和GCL中ROS产生逐渐降低(P<0.01)。见图2,表3。
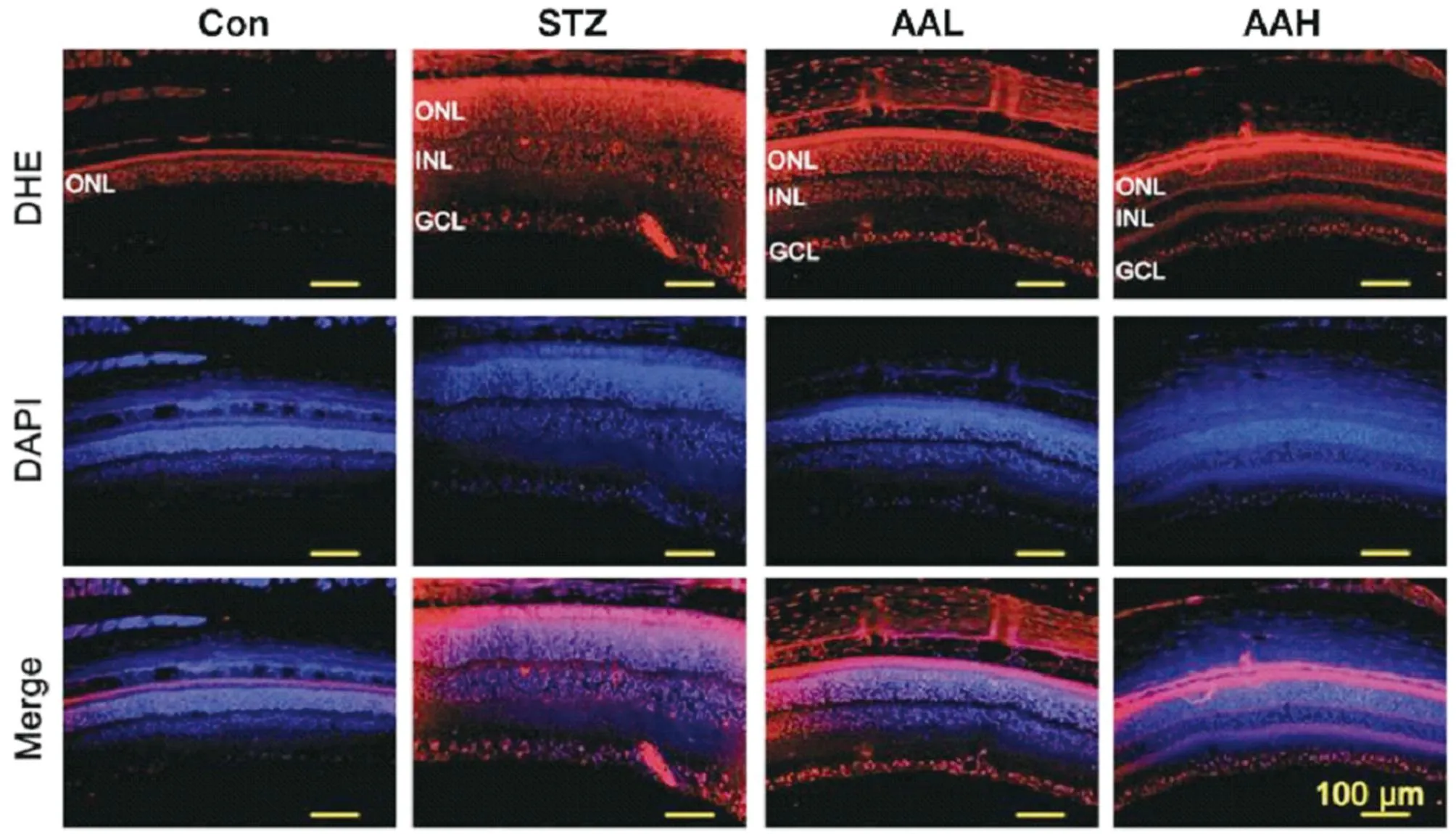
图2 DHE染色检测AA对大鼠视网膜组织氧化应激的影响

表3 4组大鼠视网膜组织氧化应激和自噬比较 n=5,
2.4 AA对大鼠视网膜自噬和氧化应激相关蛋白的影响 Western blot结果显示,与Con组比较,STZ组大鼠视网膜中LC3Ⅱ/Ⅰ比率和HO-1表达显著降低,p62表达升高(P<0.01);与STZ组比较,AAL和AAH组大鼠视网膜组织LC3Ⅱ/Ⅰ比率和HO-1表达逐渐升高,p62表达逐渐降低,具有浓度依赖性(P<0.01)。见图3,表3。
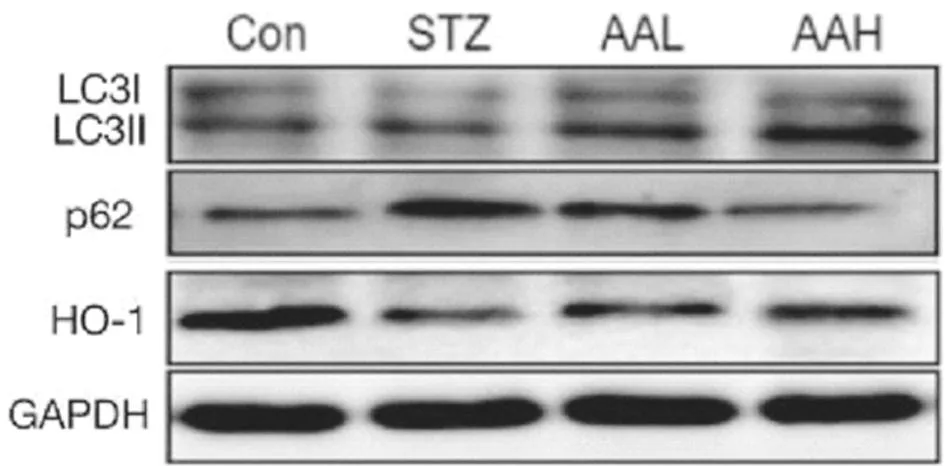
图3 Western blot检测AA对大鼠视网膜自噬和氧化应激相关蛋白的影响
2.5 AA对大鼠视网膜AMPK/mTOR信号通路蛋白表达的影响 与Con组比较,STZ组大鼠视网膜组织p-AMPK蛋白表达显著降低,p-mTOR表达明显升高(P<0.01);与STZ组比较,AAL和AAH组大鼠视网膜组织p-AMPK表达逐渐升高,p-mTOR表达逐渐降低,具有浓度依赖性(P<0.01)。而3组间AMPK和mTOR蛋白表达差异无统计学意义(P>0.05)。见图4,表4。
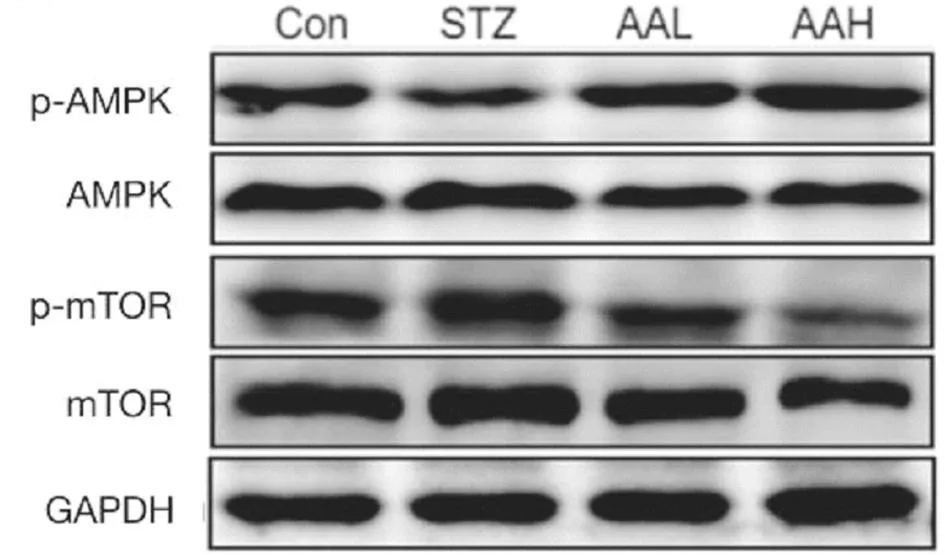
图4 Western blot检测AA对大鼠视网膜AMPK/mTOR相关蛋白的影响

表4 4组大鼠视网膜组织AMPK/mTOR相关蛋白表达 n=5,
3 讨论
AA是从青钱柳中分离得到的一种主要的活性三萜类化合物(C.paliurus triterpenoids,CPT),具有多种生物学效应,包括降糖、降血脂、抗氧化和抗炎等[8]。AA已被揭示为糖尿病和糖尿病肾病的潜在治疗药物,但其对DR的影响有待探索。据报道,自噬激活对DR具有有益作用[9],并且AA可以促进自噬[10]。因此,本研究探索了AA对糖尿病大鼠视网膜损伤中细胞自噬的影响。之前的研究表明,AA占青钱柳三萜类的(44.88±2.17)%,而CPT降低糖尿病大鼠血糖的有效剂量为40 mg/kg。因此本研究动物实验选择AA的浓度为10和30 mg/kg。
DR是一种病因复杂的多因素疾病,高血糖引起视网膜损伤的确切机制尚不清楚[11]。众所周知,由于视网膜中含有大量多不饱和脂肪酸,其氧耗和葡萄糖氧化水平较高。此外,高血糖可促进视网膜中晚期糖基化产物(AGE)的形成,从而促进ROS产生和毒性蛋白积累,对周细胞和内皮细胞造成直接损伤[3]。因此,近年来如何降低过量ROS,抑制氧化应激并改善DR病理损伤受到广泛关注。血红素加氧酶-1(HO-1)是一种抗氧化酶,不仅能催化血红素分解,还能清除活性氧和炎性因子,维持病理条件下的机体自稳态[12]。研究发现,姜黄素和蓝莓花色素苷可通过增加HO-1的蛋白表达水平,抑制氧化应激状态[13-14]。与我们的结果一致,AA治疗在减轻DR大鼠视网膜结构损伤的同时,可抑制ROS产生和HO-1蛋白表达,并呈剂量依赖性。以上结果提示,AA对DR患者氧化应激具有显著抑制作用。
通常认为炎症主要在DR早期阶段发生发展中的关键致病因素,多种促炎性细胞因子水平在DR患者和动物模型的玻璃体液和视网膜中增加[15]。这些发现强调了炎症在DR发生发展中的重要性。临床研究发现,DR患者的高血糖可增加ROS的产生,从而促进一些炎性细胞因子如IL-1β、TNF-α和IL-6的释放[16]。与上述研究相似,我们的数据显示AA治疗可以呈剂量依赖性地下调糖尿病大鼠IL-1β、TNF-α和IL-6的产生。先前的研究已经报道,自噬功能障碍是DR发病机制中存在的早期事件[17]。自噬途径的抑制使视网膜细胞对氧化应激和炎症更敏感,从而加重细胞损伤[18]。Shi等[19]研究发现,3-甲基腺嘌呤对自噬的抑制促进了视网膜中ROS的积累和DLRP3炎症小体活化,促进DR恶化。Taki等[20]发现,雷帕霉素诱导的自噬激活可有效抑制视网膜感光细胞中的超氧化物形成。由于LC3Ⅱ/Ⅰ比率和Beclin-1表达增加以及p62水平降低是自噬有效激活的标志[21]。这与我们的结果一致,说明AA治疗可增强糖尿病大鼠视网膜中的细胞自噬水平,其对炎症和氧化应激的抑制可能与自噬激活有关。因此,有必要进一步探索AA对DR自噬激活的具体作用机制。
ROS是重要的信号分子,通过细胞内多种信号通路参与信息的传递。研究发现,过量ROS可通过激活AMPK/mTOR等通路诱导癌细胞自噬和自噬性死亡,从而抑制肿瘤的发生发展[22]。Kim等[23]报道,盐霉素可通过增加ROS产生,激活PI3K/AKT/mTOR和ERK/p38 MAPK信号通路来促进前列腺癌细胞自噬性细胞死亡。李丹等[24]发现,DOCK1通过抑制AMPK/mTOR通路激活,抑制多发性骨髓瘤细胞的凋亡和自噬。苏俐丹等[25]发现,血根碱可能通过激活AMPK/mTOR通路诱导细胞自噬,从而抑制鼻咽癌5-8F细胞增殖。本研究发现,DR大鼠视网膜组织p-AMPK表达明显升高,p-mTOR表达显著降低;AA治疗可呈浓度依赖性逆转AMPK和mTOR的磷酸化水平,提示AA可能通过调控AMPK/mTOR通路进而调节DR视网膜组织细胞自噬。然而DR发生机制复杂,AA调控AMPK/mTOR信号通路对DR的治疗机制还需更进一步的研究去证实。
综上所述,AA可通过激活AMPK/mTOR/HO-1通路促进视网膜细胞自噬对STZ诱导的糖尿病大鼠视网膜病理损伤、氧化应激和炎性反应产生保护作用。因此,AA可能是早期DR治疗的理想策略。

