地佐辛靶向TLR4/NF-κB信号通路减轻瑞芬太尼诱导的痛觉过敏机制研究
陈钱正 黄宇捷 顾春淼
瑞芬太尼是一种强效的阿片受体激动剂,主要适用于手术期间的麻醉维持。但其诱导的痛觉过敏(remifentanil-induced hyperalgesia, RIH)已成为公众关注的临床问题[1]。越来越多的证据强调,RIH是一种矛盾现象,即在手术期间接受瑞芬太尼治疗疼痛的患者在术后可能会对某些疼痛刺激更敏感[2]。简而言之,术中给予瑞芬太尼干预能够引起术后痛觉敏感化,从而加剧术后疼痛并促进疼痛慢性化,而并没有起到预想中的阿片类药物的镇痛作用[3-4]。总之,瑞芬太尼能够剂量依赖地增加术后急性疼痛的发生率,极大地限制了阿片类药物的临床应用[5]。地佐辛(Dezocine)是一种具有强效镇痛作用的阿片受体部分激动剂/拮抗剂,目前已广泛用于慢性疼痛管理和术后疼痛。与吗啡相比,地佐辛镇痛效果更强且副作用较小[6]。既有的研究证明,地佐辛能够减轻术后疼痛,尤其是在RIH管理中发挥着重要的镇痛作用[7-9];然而,笔者发现地佐辛对术后疼痛的调节机制和治疗作用尚未完全阐明。因此,本研究旨在利用RIH大鼠模型确定地佐辛对术后痛觉过敏的镇痛效果及其分子机制。
1 材料与方法
1.1 实验动物 5~6周龄SPF级雄性SD大鼠,体重240~250 g,由中国科学院动物研究所提供,许可证号:SYXK(京)2017-0002。所有大鼠饮食饮水自由,均饲养于恒温(21±2)℃和湿度(55±15)%的条件下,光/暗循环12 h。所有动物在实验前至少3 d适应实验室环境。另外,这项研究获得了南通市海门区人民医院伦理委员会批准。实验动物的护理和动物福利相关工作均遵守《实验动物护理和使用指南》(1996版)。
1.2 试剂与仪器 瑞芬太尼购自山东罗欣药业集团股份有限公司公司;地佐辛购自扬子江药业集团有限公司;异氟醚购自北京百灵威科技有限公司;ELASA试剂盒[肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)、IL-10]购自上海酶联生物科技有限公司;TRIzol裂解液购自美国Invitrogen公司。用cDNA Reverse Transcription kit购自北京宝日医生物技术有限公司;SYBR Green和cocktail均购自美国Roche公司;anti-TLR4抗体、anti-NF-κB抗体、anti-TRPA1抗体、anti-GAPDH和辣根酶标记鼠抗山羊IgG(H+L)均购自Cell Signaling Technology公司;BCA蛋白定量试剂盒购自北京全式金科技有限公司;电子触觉测量仪和足底测试镇痛仪均购自上海欣软科技有限公司;多功能酶标仪购自美国Thermo公司,Bio-Rad凝胶成像分析仪购自美国伯乐公司。
1.3 构建切口痛大鼠模型 根据Gu等[10]研究,通过足底切口手术建立切口痛大鼠模型。首先,用7%异氟醚麻醉大鼠后,用75%乙醇擦洗大鼠的左后爪。然后,做一个1 cm长的切口,从脚跟处开始,延伸到脚趾,穿过左后爪的皮肤和脚底筋膜,分离足底肌肉,纵向切割。随后,将暴露的足底肌肉切口用无菌纱布止血,缝合切口,并用红霉素软膏覆盖伤口以防止感染。每天对大鼠的切口进行检查,将有伤口开裂或感染的大鼠排除在研究之外。
1.4 动物分组 40只SPF级雄性大鼠按照随机数字表法分为对照组(C组)、切口痛组(I组)、瑞芬太尼输注+切口痛组 (R+I组)、瑞芬太尼联合地佐辛输注+切口痛组(R+D+I组),每组10只。其中,C组不做任何处理。R+I组和R+D+I组于造模前静脉输注瑞芬太尼0.01 mg·kg-1·min-1,持续60 min,I组造模前仅输注等量0.9%氯化钠溶液,速度为0.01 mL/min,持续60 min。随后,基于左后足底切口术对I组、R+I组和R+D+I组大鼠建立切口痛模型。R+D+I组大鼠在瑞芬太尼输注前通过尾静脉注射给予0.5 mg/kg地佐辛预处理。给药处理后第7天,麻醉处死所有大鼠,进行大鼠行为学评价(n=10),检测大鼠脊髓背角组织中炎性因子表达(n=4),检测大鼠脊髓背角组织中TLR4、NF-κB和TRPA1 mRNA和蛋白表达(n=6)。
1.5 大鼠行为学评价 测量均在安静的温控室中进行,并于术前和首次给药后2、6、12、24 h进行行为学测试。
1.5.1 机械缩足反应阈(paw withdrawal threshold, PWT):评估大鼠的机械性痛觉超敏。采用电子触觉测量仪确定检测PWT。将大鼠单独放置在悬空倒置的透明箱中,箱内铺有钢网,测试前将大鼠暴露于测试箱中30 min以适应环境。Von Frey纤维丝由安装在手持式测力计上的塑料尖端组成,垂直地施加在右后爪的足底中部表面,力量逐渐增加。阳性反应是指刺激后抬起、摇晃或舔爪子。测试进行3次,间隔5 min,并计算平均阈值。
1.5.2 热缩足反应潜伏期(paw withdrawal latency, PWL):评估大鼠的热痛觉过敏。在足底测试镇痛仪的帮助下,评估确定3组大鼠在不同时间点的PWL。首先,将大鼠放置在一个可移动的透明塑料笼子里,置于悬空的透明玻璃板上,让其适应大约15 min。辐射热源(50 W的投影灯)安装在透明光滑的玻璃地板下的活动支架上,直接放在右后爪的足底表面下。PWL被定义为从红外热刺激开始到爪子从热源中撤出的时间。测试进行3次,间隔5 min,并计算平均潜伏期。
1.6 酶联免疫吸附(ELISA)检测大鼠脊髓背角炎性因子表达 在24 h的最后一次行为学测试后,麻醉处死大鼠,沿大鼠后腰中线切开,暴露脊髓组织,快速取出大鼠脊髓背角组织的L4~ L6段,并将其冷冻在-80℃保存。随后,根据ELISA试剂盒说明书,检测各组大鼠脊髓背角组织中相关炎性因子(TNF-α、IL-1β和IL-10)的蛋白表达。
1.7 实时荧光定量PCR检测大鼠脊髓背角TLR4、NF-κB和TRPA1 mRNA表达 以GAPDH mRNA为内参,利用实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)检测各组大鼠脊髓背角组织中TLR4、NF-κB和TRPA1 mRNA的表达。用TRIzol提取总RNA。用cDNA Reverse Transcription kit将RNA反转录成cDNA。使用SYBR Green染料按照说明书进行qRT-PCR。PCR反应条件为:50℃ 2 min,94℃ 15 min,94℃ 15 s,56℃ 30 s,72℃ 1min,40个循环。引物序列如下:GAPDH正向: 5’-CAAGGCTGAGAATGGGAAGC-3’;反向: 5’-GAAGACGCCAGTAGACTCCA-3’。TLR4正向: 5’-TAGCCATTGCTGCCAACATC-3’;反向: 5’-ACACCA ACGGCTCTGGAT AA-3’。p-NF-κB:正向: 5’-AATGCTGATGTGCCTACTCG-3’;反向: 5’-GTAGTCGTGATGCTGATGCT-3’。TRPA1:正向: 5’-CCACCCTGTGTGTAGGGA AT-3’;反向: 5’-AAGGCCATTCCAGGCTGT AT-3’。采用2-ΔΔCt法计算目的基因的相对mRNA表达量。
1.8 Westernblot检测大鼠脊髓背角TLR4、NF-κB和TRPA1蛋白表达 将4组大鼠脊髓背角L4~ L6段,在含有蛋白酶抑制剂cocktail的混合裂解缓冲液中制成匀浆。组织匀浆在4℃下以13 000 r/min离心20 min,收集上清液作为总蛋白。并经BCA处理后,确定蛋白浓度。将20 μg蛋白与1× loading bufer混合,100℃变性10 min后,通过8%~12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)凝胶分离,并进一步转移到经过无水甲醇活化的PVDF膜上。然后,封闭液室温封闭2 h,再与相应的一抗4℃过夜孵育。研究中采用的一抗主要包括针对TLR4(1∶1 000)、p-NF-κB (1∶500)、TRPA1 (1∶1 000)和GAPDH(1∶5 000)。之后,用辣根酶标记鼠抗山羊IgG(H+L)(1∶2 000)室温孵育2 h。加入超敏ECL化学发光试剂,检测膜上的蛋白信号。其中,蛋白的相对表达用Image J软件进行分析,以GAPDH作为内参蛋白。

2 结果
2.1 造模后4组大鼠不同时间点PWT值比较 造模前4组大鼠PWT在观察的时间点上变化不明显(P>0.05)。造模后,I组和I+R组大鼠的PWT随着造模时间的延长显著降低(P< 0.05),而R+D+I组大鼠的PWT随着造模时间的延长显著增加(P< 0.05)。与C组比较,I组和R+I组大鼠的PWT在术后不同时间点均显著降低(P< 0.05),而R+D+I组大鼠的PWT均显著增加(P< 0.05)。与I组比较,R+I组大鼠的PWT在术后不同时间点均显著降低 (P<0.05),而R+D+I组大鼠的PWT在术后不同时间点均显著增加(P<0.05)。此外,与R+I组比较,R+D+I组大鼠的PWT在术后不同时间点均显著增加(P< 0.05)。见表1。

表1 4组大鼠术前和造模后不同时间点PWT值比较 n=10,s,
2.2 造模后4组大鼠不同时间点的PWL值的比较 造模前4组大鼠PWL在观察的时间点差异无统计学意义 (P>0.05)。造模后,I组和R+I组大鼠的PWL随着造模时间的延长显著降低(P<0.05),而R+D+I组大鼠的PWL随着造模时间的延长降低不明显(P>0.05)。与C组比较,I组和R+I组大鼠的PWL在术后不同时间点均显著降低,差异有统计学意义(P<0.05),而R+D+I组大鼠的PWL均降低不明显(P>0.05)。与I组比较,R+I组大鼠的PWL在术后不同时间点均显著降低,差异有统计学意义 (P<0.05),而R+D+I组大鼠的PWL在术后不同时间点均降低不明显((P>0.05)。此外,与R+I组比较,R+D+I组大鼠的PWL在术后不同时间点均显著增加,差异有统计学意义(P<0.05)。见表2。

表2 4组大鼠术前和造模后不同时间点PWL值比较 n=10,s,
2.3 4组大鼠脊髓背角组织中炎性因子比较 I组大鼠脊髓背角促炎因子TNF-α、IL-1β水平均显著高于C组(P<0.05),而抗炎因子IL-10水平显著低于C组(P<0.05)。与I组比较,R+I组大鼠脊髓背角促炎因子TNF-α、IL-1β 水平均显著增加(P<0.05),而抗炎因子IL-10水平显著降低(P<0.05)。另外,和R+I组相比,R+D+I组大鼠脊髓背角促炎因子TNF-α、IL-1β 水平均显著降低(P<0.05),而抗炎因子IL-10水平显著增加(P<0.05)。见表3。

表3 4组大鼠脊髓背角炎性因子表达水平比较 n=4,pg/g,
2.4 4组大鼠脊髓背角中TLR4、p-NF-κB和TRPA1蛋白表达比较 与C组比较,在I组和R+I组中TLR4、p-NF-κB和TRPA1蛋白表达水平显著增加(P<0.05),而R+D+I组中三种蛋白的表达水平显著降低(P<0.05)。与I组比较, 在R+I组中TLR4、p-NF-κB和TRPA1蛋白表达水平显著增加,差异有统计学意义(P<0.01),而R+D+I组中三种蛋白的表达水平显著降低(P<0.01)。另外,与R+I组比较,R+D+I组, TLR4、p-NF-κB和TRPA1蛋白表达水平显著降低,差异有统计学意义(P<0.01)。见表4,图1。
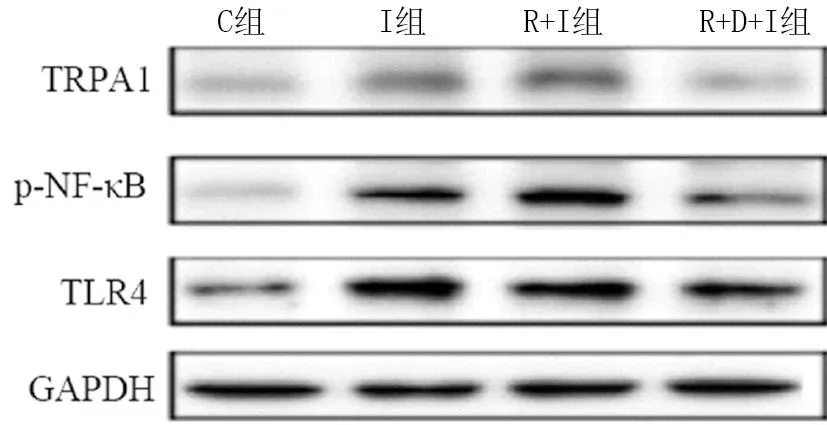
图1 4组大鼠脊髓背角蛋白相对表达量比较

表4 4组大鼠脊髓背角TLR4、p-NF-κB和TRPA1蛋白相对表达量比较 n=6,
2.5 4组大鼠脊髓背角TLR4、p-NF-κB和TRPA1 mRNA比较 随后,我们利用qRT-PCR检测各组大鼠脊髓背角TLR4、p-NF-κB和TRPA1 mRNA表达水平。结果显示,与C组相比,I组和R+I组中TLR4、p-NF-κB和TRPA1mRNA表达水平显著增加(P<0.01),而R+D+I组中三种mRNA的表达水平显著降低 (P<0.01)。与I组相比, R+I组中TLR4、p-NF-κB和TRPA1mRNA的表达水平增多,差异有统计学意义(P<0.01);R+D+I组中TLR4、p-NF-κB和TRPA1mRNA表达水平减少(P<0.01)。另外,与R+I组相比,经地佐辛处理后,TLR4、p-NF-κB和TRPA1mRNA表达水平显著降低,差异有统计学意义(P<0.01)。见表5。

表5 4组大鼠脊髓背角TLR4、p-NF-κB和TRPA1 mRNA相对表达量比较 n=4,
3 讨论
本研究数据显示,TLR4/NF-κB通路和TRPA1分子在RIH大鼠的脊髓背角中异常激活。另外,在RIH大鼠模型中脊髓背角炎症加剧。然而,经地佐辛处理后,RIH大鼠的PWT和PWL显著增加,痛觉敏感降低,脊髓背角TLR4/NF-κB通路及TRPA1的表达下调,炎性水平降低。总之,本研究发现表明,地佐辛能够通过抑制TLR4/NF-κB通路的过度激活,降下调TRPA1蛋白和mRNA活性,以及减少脊髓背角炎症发挥着减轻大鼠术后痛觉过敏的镇痛抗炎作用。
本研究通过检测PWT和PWL分别评价大鼠的机械痛觉超敏和热痛觉过敏,发现大鼠术后PWT和PWL均明显下降,这标志着RIH大鼠模型的成功建立。在基础研究方面,此前有研究报告称,地佐辛能够提高炎症性疼痛大鼠的PWT和PWL,从而对完全弗氏佐剂诱导的大鼠炎性疼痛产生镇痛作用[11]。与该研究类似,本研究通过评估RHI大鼠的PWT和PWL证实了地佐辛对RIH大鼠机械痛觉超敏和热痛觉过敏的促进作用,进一步佐证了地佐辛对大鼠术后痛觉过敏具有缓解作用,并且该结论与Zhou等[12]研究结果一致。然而,导致上述变化的分子机制需要进一步研究。脊髓背角是伤害性信息整合和传递的中枢,同时也是病理性疼痛过程中的主要组织损伤部位[13]。因此,本研究进一步探索了瑞芬太尼输注后脊髓疼痛传导的具体分子机制。Zhu等[14]研究证实,地佐辛可以保护人髓核细胞免受IL-1β诱导的炎症、氧化应激和细胞凋亡,能够有效降低神经性疼痛大鼠的炎性细胞因子IL-6和TNF-α的表达。因此,在当前的研究中,本研究收集大鼠脊髓背角L4~ L6段,以检测TNF-α、IL-1β和IL-10等炎性细胞因子的表达水平。研究发现,与C组比较,瑞芬太尼输注能够显著增加I组大鼠促炎细胞因子TNF-α、IL-1β蛋白表达,同时抑制抗炎细胞因子IL-10的蛋白表达。而地佐辛预处理逆转了这些因子的变化趋势。
研究证实,TLR4信号在组织损伤后的痛觉超敏中被激活,而抑制TLR4/NF-κB信号通路能够减轻术后疼痛[15-17]。TLR4及其下游信号在感觉神经元中的激活触发了神经炎性介质的产生如TNF-α和IL-6,这将进一步促进神经病理性疼痛[18]。因此,在上述研究的基础上,本研究通过qRT-PCR和Western blot实验分别检测了RIH大鼠脊髓背角TLR4/NF-κB信号通路的活性。结果显示,瑞芬太尼输注能够显著增加TLR4和p-NF-κB蛋白表达;然而,经地佐辛预处理后,RIH大鼠脊髓背角TLR4和p-NF-κB蛋白表达下调。这提示地佐辛能够下调脊髓背角TLR4及其下游信号从而减轻RIH大鼠的痛觉过敏。瞬时受体电位通道蛋白A1 (transient receptor potential ankyrin 1, TRPA1)在外周痛觉神经元中功能性表达,作为疼痛信号的转换器和放大器,介导神经病理性痛和炎性痛中的机械痛觉超敏和热痛觉过敏[19]。研究证实,感觉神经元中TRPA1的表达在各种疼痛条件下上调,包括炎症性和神经性疼痛[20-21]。TLR4信号通路的激活能够上调TRPA1的表达[22-23],而低表达TRPA1能够显著减轻RIH大鼠的机械性痛觉超敏[18]。这提示TRPA1表达在术后痛觉过敏中发挥着调控作用。因此,本研究进一步评估了地佐辛对TRPA1在RIH大鼠骨髓背角中的表达变化。结果显示,地佐辛能够下调RIH大鼠脊髓背角TRPA1的mRNA和蛋白表达。表明地佐辛诱导的TRPA1下调可能介导了RIH大鼠的痛觉过敏。
综上所述,本研究首次证了地佐辛能够通过抑制TLR4/NF-κB通路的过度激活,下调骨髓背角TRPA1 mRNA和蛋白表达,减少骨髓背角炎症从而发挥缓解大鼠术后RIH的抗炎镇痛作用,为RIH的疼痛症状提供一种新的潜在治疗策略,在一定程度上促进相关阿片类药物的适当临床应用。

