NUSAP1在肿瘤相关巨噬细胞中的表达及对非小细胞肺癌的影响
李晓敏 于哲 曹珊珊 槐梅 韩洪涌
肺癌分为小细胞肺癌(small-cell lung cancer,SCLC)和非小细胞肺癌(non-small-cell lung cancer,NSCLC),其中非小细胞肺癌确诊病例约占肺癌比例的80%~95%[1],在如此高的比例下,死亡率也使占据总死亡数的首位,所以在中国NSCLC可以说是首屈一指的肿瘤杀手。所以目前最紧要的任务时积极探索NSCLC发生发展的分子机制,对于改善肺癌患者生存率至关重要。M2型肿瘤相关巨噬细胞在非小细胞肺癌(NSCLC)肿瘤进展中与肿瘤生长呈正相关趋势。在NSCLC中,NUSAP1敲低增加了B细胞易位基因2(BTG2)的表达,降低了磷酸肌醇3-激酶(PI3K)和磷酸化丝氨酸/苏氨酸激酶(p-AKT)的表达水平,促进NSCLC细胞凋亡,抑制细胞增殖,细胞迁移和侵袭。肿瘤相关巨噬细胞(TAMs)是肿瘤微环境(TME)中含量最多的细胞对肿瘤生长中血管淋巴管的形成、降解血管基底膜以及细胞外基质、抑制肿瘤免疫等多方面作用,对肿瘤生长迁移发挥促进作用[2]。由于M2巨噬细胞的不同亚型表现出不同的功能,所以M2型巨噬细胞可以很灵活的适应不同肿瘤环境分泌炎性因子,促进肿瘤生长。肿瘤相关巨噬细胞可以通过分泌基质金属蛋白酶(MMPs)、纤溶酶、丝氨酸蛋白酶等降解血管基底膜和细胞外基质,促进肿瘤细胞的转移[3-5]。核仁纺锤体相关蛋白1(NUSAP1)是一种微管结合蛋白,它可以促进有丝分裂纺锤体微管的形成[6]。并且NUSAP1在许多恶性肿瘤中高表达,对有丝分裂早期和晚期起调节作用[7-9]。在此我们通过探究NUSAP1在肿瘤相关巨噬细胞中表达对非小细胞肺癌的影响以及分子机制。
1 材料与方法
1.1 材料与仪器 人来源非小细胞肺癌样本均有华北石油管理局总医院提供;C57BL/6雄性小鼠购自购自北京福贝斯公司;Lewis 肺癌(lewis lung carcinoma , LLC), 源于 C57 BL/6 小鼠,属鼠源性的非小细胞肺癌细胞株,购于医学科学院。试剂:pH值 6.0枸橼酸缓冲液购自上海碧云天生物技术有限公司;BSA购自上海酶联生物科技有限公司;DMEM培养基购自美国Gibco公司;DMEM:F12(C11330500BT)培养基购自美国Gibco公司;慢病毒及shRNA等生物制品均有生工生物工程(上海)股份有限公司合成;全营养培养基购自西班牙PharmaMar公司;RPMI-1640培养基购自美国Gibco公司;WB所用NUSAP1、p-PI3K、t-PI3K、MMP-9、GAPDH均购自美国Abcam公司。
1.2 方法
1.2.1 体外细胞共培养体系:共培养结束后分别收集小室上下腔M2和Lewis 细胞,进行后续蛋白质分析实验和细胞侵袭实验。
1.2.1.1 流式细胞分选:NSCLC新鲜人体组织样本采集后立即放入无血清培养基中,并在低温储存过的胰酶操作液中剪碎组织并经过反复吹打分离,得到NSCLC癌组织与癌周组织粗细胞悬液。经过100目、200目、600目不锈钢细胞滤网过滤细胞悬液并将滤过的单细胞接种于含5%胎牛血清的全能培养基中,调整细胞数目5×104个细胞/孔。常规细胞培养48 h后使用Coulter Epics XLTM流式细胞仪进行流式分选筛选出肿瘤相关巨噬细胞群,使用DMEM培养基(含10%FBS、100 U/mL青霉素、100 μg/mL链霉素),37℃二氧化碳恒温培养箱培养7 d,每48小时更换1次培养基。准备TAM细胞进行后续蛋白分析实验。
1.2.1.2 细胞培养:原代小鼠巨噬细胞分离方法[11]:从C57BL/6雄性小鼠股骨中分离骨髓细胞,并在DMEM中培养基中培养7 d,并添加10% FBS和50 U/mL青霉素、50 μg/mL链霉素。每48小时更换1次培养基,并清除污染或衰弱细胞。将培育获得的健康骨髓细胞添加10% FBS 和100 U/mL rhM-CSF的DMEM中培养7 d,以获得小鼠原代巨噬细胞。
1.2.1.3 细胞感染方法:巨噬细胞细胞接种于6孔细胞培养板,调整细胞浓度 1 × 105细胞/孔,常规细胞培养24 h。慢病毒载体包装shRNA-NUSAP1组及对照shRNA(sh-NC)组,过表达慢病毒(OV-NUSAP1)和阴性对照(OV-NC)组以及过表达MMP-9(OV-MMP-9)组及其阴性对照(OV-NC)组。慢病毒感染48 h后western blot分析验证慢病毒感染效率。
1.2.1.4 巨噬细胞细胞与Lewis 细胞系共培养:人非小细胞肺癌细胞系Lewis 于10%胎牛血清和1%青霉素/链霉素的RPMI-1640培养基中维持培养。极化M2细胞于10% FBS 和100 U/mL rhM-CSF的DMEM培养基中维持培养。所有细胞均处于的37℃,5% CO2培养箱中生长。使用孔径为0.4 μmol/L的聚对苯二甲酸乙二醇酯薄膜(Corning 3450)的Transwell腔室和24孔细胞培养板作为共培养系统。共培养M2和Lewis 细胞组,将shRNA-NUSAP1组、sh-NC组、ov-NUSAP1组、ov-NC组、sh-NC+OV-NC、shRNA-NUSAP1+OVMMP-9、shRNA-NUSAP1+OVNC以及Control组M2细胞置于小室上腔,Lewis 细胞置于小室下腔,每组每个腔室接种的细胞数量为5×104细胞。细胞培养使用全营养培养基,37℃,5%CO2全自动细胞培养箱培养,倒置显微镜随时观察细胞状态。
1.2.2 细胞划痕迁移测试:将共培育的各组Lewis 细胞进行重悬,并接种于6孔板中,常规培养至细胞融合达90%时使用200 μL移液枪头在各组孔板中央垂直划破全层细胞。注意要洗掉脱落的细胞,并于全自动细胞培养箱中孵育,拍照记录0 h、24 h细胞迁移情况。Image J软件测量5个随机位点的迁移距离,计算平均迁移率。迁移率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.2.3 Western blot检测:收集培养至对数期细胞(细胞生长至70%)经胰酶处理低温离心机分离细胞,冰镇环境添加RIPA裂解液分离获得样本总蛋白。经BCA试剂盒检测蛋白浓度,进行SDS-PAGE电泳分离等量的蛋白质样品并将蛋白凝胶电转至PVDF膜上。使用含5%脱脂奶粉的TBST封闭天然抗原。一抗NUSAP1、p-PI3K、t-PI3K、MMP-9、GAPDH 4℃孵育过夜,二抗稀释液室温孵育。ECL显色后Bio-Rad检测系统检(Bio-Rad V3 Western Workflow系统)测蛋白质信号。GAPDH作为内参蛋白,分析各组分蛋白相对灰度值得到蛋白表达信息。

2 结果
2.1 Western blot检测癌与癌周巨噬细胞中NUSAP1表达 在癌症组织中巨噬细胞内NUSAP1高表达(P<0.05);NUSAP1通过调控PI3K通路发挥作用,而PI3K通路活化是促进MMP家族蛋白表达的关键通路,故而进一步检测PI3K与MMP-9的表达情况,结果显示癌组织巨噬细胞内磷酸化(p)PI3K表达水平及MMP-9表达量相较于癌周组织巨噬细胞内相应蛋白表达量显著升高(P<0.05)。见表1、2,图1、2。
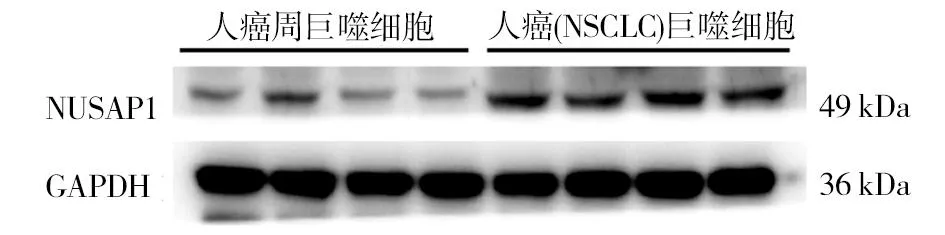
图1 非小细胞肺癌患者癌组织与癌周组织巨噬细胞中NUSAP1蛋白表达图
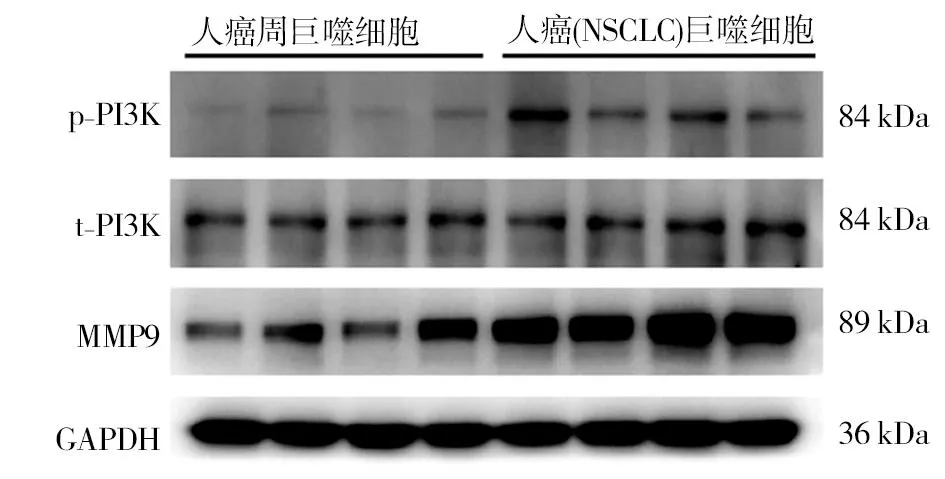
图2 非小细胞肺癌患者癌组织和癌周组织巨噬细胞中p-PI3K、t-PI3K、MMP-9蛋白表达图
表1 Western blot检测人癌周巨噬细胞和人癌(NSCLC)巨噬细胞中NUSAP1相对表达量
表2 Western blot检测人癌周巨噬细胞和人癌(NSCLC)巨噬细胞中p-PI3K和MMP-9相对表达量
2.2 与人非小细胞肺癌Lewis 细胞系共培养的巨噬细胞当中NUSAP1、p-PI3K和MMP-9的相对表达量 采用巨噬细胞感染shRNA-NUSAP1及OV-UNSAP1使其敲低或过表达NUSAP1,并与肺癌细胞Lewis 共培养以模拟体内肿瘤环境。结果显示:Western blot检测慢病转染敲低NUSAP1后p-PI3K与MMP-9均表达降低,相反上调NUSAP1后p-PI3K与MMP-9表达均升高。见表3,图3。
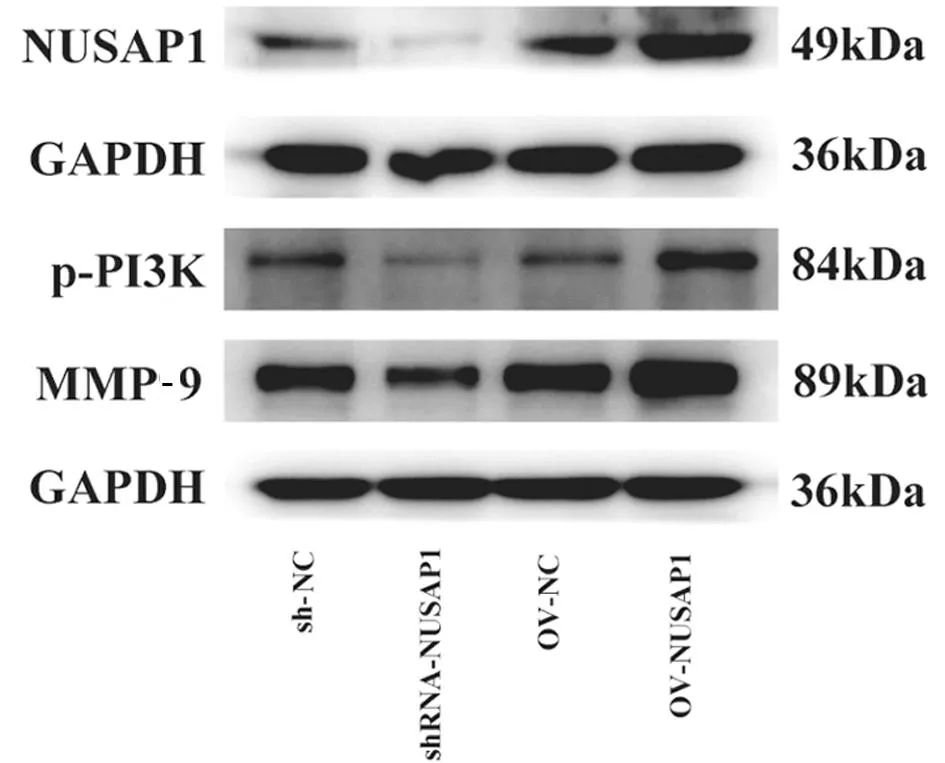
图3 NUSAP1敲低和过表达对与人非小细胞肺癌Lewis细胞系共培养的巨噬细胞表达NUSAP1、p-PI3K、MMP-9蛋白表达量的影响
表3 Western blot检测与人非小细胞肺癌Lewis 细胞系共培养的巨噬细胞当中NUSAP1、p-PI3K和MMP-9的相对表达量
2.3 Western blot检测MMP-9过表达纠正NUSAP1敲低与人非小细胞肺癌Lewis 细胞系共培养的巨噬细胞当中NUSAP1、p-PI3K和MMP-9的相对表达量 为了确定MMP-9的表达对Lewis 细胞的影响,我们设计实验在通过敲低NUSAP1的基础上进行OV-MMP-9纠正实验。Western blot结果证实MMP-9过表达(OV-MMP-9)抵消了由于敲低NUSAP1所造成的MMP-9表达水平降低。同时shRNA-NUSAP1+OV MMP-9组侵袭率明显高于shRNA-NUSAP1+OVNC(P<0.05)组。见表4,图4。
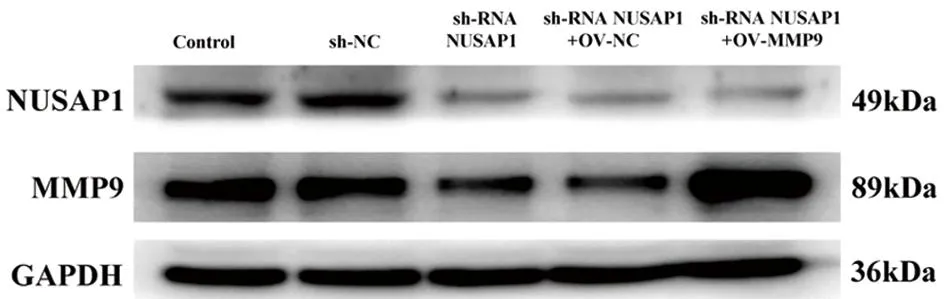
图4 MMP-9过表达纠正NUSAP1敲低对与人非小细胞肺癌Lewis 细胞系共培养的巨噬细胞表达NUSAP1、MMP-9的影响
表4 Western blot检测MMP-9过表达纠正NUSAP1敲低与人非小细胞肺癌Lewis 细胞系共培养的巨噬细胞当中NUSAP1、p-PI3K和MMP-9的相对表达量
2.4 细胞划痕实验检测MMP-9过表达纠正NUSAP1敲低巨噬细胞与人非小细胞肺癌Lewis 细胞系共培养中Lewis 细胞迁移能力 通过对比可见shRNA NUSAP1(NUSAP1敲低)组比sh NUSAP1组的迁移宽度明显增加,说明迁移能力受限;在敲低NUSAP1的基础尚过表达MMP-9(OV-MMP-9)后迁移能力明显变强,迁移宽度显著变小。见表5,图5。
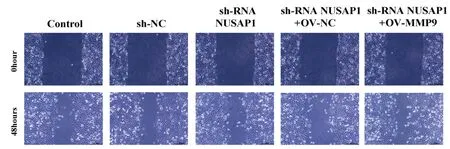
图5 MMP-9过表达纠正NUSAP1敲低巨噬细胞与人非小细胞肺癌Lewis 细胞系共培养中Lewis 细胞迁移能力的影响(×10)
表5 细胞划痕实验检测MMP-9过表达纠正NUSAP1敲低巨噬细胞与人非小细胞肺癌Lewis 细胞系共培养中Lewis 细胞迁移能力 μm,
3 讨论
在世界范围内,NSCLC是主要的癌症死亡原因,并呈逐年增长的趋势。目前对于NSCLC的常用治疗手段为手术治疗、放射治疗和化学治疗,根据病变范围,这些手段可以单独或联合应用,但这些治疗手段的不良反应也比较明显,所以寻找更加安全有效的治疗方法也日趋急迫。NUSAP1蛋白表达量升高与非小细胞癌的相关性也有相关报道[12]。在多文献中也可查询到NUSAP1蛋白与恶性肿瘤细胞的增殖和侵袭相关。例如上调NUSAP1通过PI3K/Akt信号通路促进肾母细胞瘤细胞的增殖、侵袭和迁移[13]、NUSAP1通过AMPK / PPARγ信号通路促进乳腺癌细胞的转移[14]、NUSAP1表达增加与膀胱尿路上皮癌淋巴结转移和生存预后相关[15]。在NSCLC中,NUSAP1的敲低也通过PI3K信号通路发挥促细胞凋亡作用[16]。PI3K信号通路是细胞内重要的信号转导通路,在细胞增殖和凋亡过程中发挥着重要的转导作用,以p-PI3K活化的形式存在,通过调控下游相关基因的表达参与细胞增殖和凋亡过程,在非小细胞肺癌细胞增殖、迁移中发挥作用[17]。TAMs具有促进肿瘤的侵袭转移和血管形成等作用,可以与肿瘤干细胞相互作用,促进肿瘤发生、转移和耐药。M2型TAMs与NSCLC的肿瘤分期、淋巴结转移及胸膜侵犯密切相关,肿瘤间质中高密度M2型TAMs浸润是肿瘤预后不良的重要因素。也有研究显示通过构建共培养模型验证了M2对非小细胞肺癌侵袭的起促进作用[18]。不过,目前对于NSCLC中M2型TAMs的研究仍不完善。MMP-9是MMPs家族重要成员可通过分解细胞外基质、影响细胞生长因子的激活、对新生血管的调节等,对肿瘤生长起促进作用[19]。据报道,MMPs中的多态性与非小细胞肺癌(NSCLC)具有相关性[20]。MMP-9在肿瘤样本和癌症患者血清中的上调表达与肿瘤分期呈正相关,且在多种癌症组织中均有高表达现象,这表明MMP-9甚至可以被认为是癌症患者的潜在预后标志物[21]。
在本实验中通过巨噬细胞M2极化后与Lewis 细胞共培养,构建体外模拟实验探索NUSAP1对Lewis 细胞侵袭和迁移的影响。然而本次实验也存在一定局限性,没有进一步的研究PI3K信号通路的详细机制,也需要进一步通过体内相关实验验证肿瘤相关巨噬细胞中NUSAP1的调节作用。因此,我们将在下一次的实验中增加体内相关实验,并进一步研究NUSAP1在NSCLC中作用机制。
综上所述,本实验结果表明TAM(肿瘤相关巨噬细胞)中的NUSAP1通过加速MMP-9的表达,促进非小细胞肺癌的迁移和侵袭。

