培养基添加剂对双特异性抗体产量和糖基化的影响
朱国梁,罗顺,张晓莹(1.安徽中医药大学药学院,合肥 20012;2.南通市海门长三角药物高等研究院,江苏 南通 2261;.澳斯康生物(南通)股份有限公司,江苏 南通 226100)
近年来治疗性抗体药物迅速发展,广泛应用于癌症、自身免疫性疾病、传染病等的治疗。大多数抗体药物是一类以γ型免疫球蛋白G(immunoglobulin G,IgG)形式存在的治疗性糖蛋白,通常在哺乳动物表达系统中表达。中国仓鼠卵巢(Chinese hamster ovary,CHO)细胞具有生长稳定、适合大规模培养、对人类病毒敏感以及对人类细胞的类似翻译后修饰的特性,是生产重组抗体的常用宿主细胞[1-2]。
提高CHO细胞培养性能,对降低抗体药物的生产成本至关重要,优化细胞株和工艺开发是提高抗体产量和质量的重点[3],可采用基因工程[4-5]、优化培养基、改进补料策略[6]、使用添加剂等。抗体药物的翻译后修饰对其质量和功能具有重要影响,糖基化是一种常见且复杂的修饰方式,被广泛认为是抗体药物关键质量属性(critical quality attributes,CQA)之一,与药效学特性、免疫原性、稳定性等具有密切联系[7]。
许多培养基添加剂可有效地提高CHO细胞培养中抗体的产量和质量,如短链脂肪酸丁酸钠(NaBu)可有效促进CHO细胞培养过程中抗体的生物合成[8-9];金属阳离子对CHO细胞的生长、抗体的表达及糖基化具有重要的影响,如添加0.25~1.0 µmol·L-1氯化锰(MnCl2)可以有效降低Man5水平,并维持G0F、G1F和G2F等主要糖型的含量[10];锌离子可增加mRNA稳定性并发挥抗凋亡和抗氧化作用,添加超过30 µmol·L-1的锌离子可以有效提高CHO细胞培养过程中的抗体表达[11-12]。本实验旨在探究NaBu、MnCl2和硫酸锌(ZnSO4)组合使用对CHO细胞的生长、抗体表达和糖基化的影响,以期提高抗体的产量和质量。
1 材料
1.1 细胞株
本实验采用可稳定表达CD40/PD-L1的IgG1型双特异性抗体的CHO细胞株,细胞株来源于澳斯康生物(南通)股份有限公司。
1.2 试药
Dynamis培养基、抗结团剂(Anti-Clumping Agent,ACA)(美国Gibco公司);Cell Boost 5、Cell Boost 7a、Cell Boost 7b补料(美国Hyclone公司);L-谷氨酰胺(美国Sigma公司);MnCl2(批号:C12791111,中国Macklin公司);ZnSO4(批号:JSB0483107)、NaBu溶液(批号:20007038BLM)(中国甘肃健顺生物科技有限公司);肽N-糖苷酶F(美国New England Biolabs公司);Glycoworks RapiFluor糖分析试剂盒(美国Waters公司)。所有溶液均按照说明书使用纯化水配制,纯化水由澳斯康生物(南通)股份有限公司制备。
1.3 仪器
无菌细胞培养管(美国TPP公司);摇瓶(美国Corning公司);Vanquish UPLC系统(美国Thermo Fisher公司);二氧化碳摇床(瑞士Kuhner公司);Vi-Cell XR细胞活力分析仪(美国Beckman Coulter公司);Bioprofile 400生化分析仪(美国Nova Biomedical公司);E2695 HPLC系统(美国Waters公司)。
2 方法
2.1 方案设计
利用JMP 13.0软件进行响应曲面设计-中心复合设计实验,锰离子(X1)、锌离子(X2)、丁酸钠(X3)作为X因子,收获时细胞活率(Y1)、抗体产量(Y2)、细胞特异性生产力(Y3)、Man5糖型含量(Y4)作为响应值,实验次数为16;每组实验重复3次。实验方案和结果如表1所示。

表1 响应面设计实验方案和结果Tab 1 Experimental scheme and results of response surface design
2.2 细胞培养
取适量处于对数生长期的细胞于50 mL TPP管中,在200 g离心力条件下离心5 min后去上清液,用含4 mmol·L-1谷氨酰胺、2.5% Cell Boost 5和0.5% ACA的Dynamis培养基将细胞重悬,使细胞密度为(0.5±0.2)×106cells·mL-1,工作体积为25 mL,并将其放置于二氧化碳摇床中进行悬浮培养。摇床条件为:37℃、湿度80%、5%CO2、200 r·min-1,振幅50 mm。培养至Day3(接种时为Day0)时隔日测样并将葡萄糖浓度补充至7 g·L-1,分别于Day 3、Day 5、Day 7、Day 9、Day 11流加4% Cell Boost 7a和0.4% Cell Boost 7b;MnCl2和ZnSO4于Day3时按照实验设计方案加入细胞液中;培养至Day5时,加入NaBu,并将培养温度从37℃降至33℃;培养至Day14时,将细胞液离心后,取上清液放至-80℃冰箱保存待用。
2.3 检测和抗体纯化
细胞密度和细胞活率利用Vi-Cell XR细胞活力分析仪分析;葡萄糖浓度、乳酸浓度、NH4+浓度等利用Bioprofile 400生化分析仪分析;上清液中抗体产量使用Protein A-HPLC亲和色谱法测定;抗体的纯化采用1 mL HiTrap Protein A HP(GE Healthcare)亲和层析柱;抗体糖基化检测采用Vanquish UPLC串联荧光检测器,色谱柱为ACQUITY UPLC Glycan BEH Amide Column(2.1 mm×150 mm,1.7 µm)。
2.4 数据分析
采用JMP 13.0软件对模型进行拟合分析,运行特质和重点分别为标准最小二乘法和效应筛选,通过均方根误差(RMSE)、决定系数(Rsq)和P值评估模型的预测性能、拟合程度以及统计学意义,RMSE越小表示模型的预测结果越接近实测值,Rsq越接近1表示模型拟合程度越好,P<0.05表示差异具有统计学意义;显著性差异分析利用SPSS 26.0软件单因素分析ANOVA检验计算;作图采用Origin2021软件。
3 结果
3.1 响应面-中心复合设计实验
3.1.1 培养基添加剂对收获时细胞活率的影响三种培养基添加剂对收获时细胞活率的影响结果见图1和表2。收获时细胞活率的预测值-实测值的拟合结果差异具有统计学意义(P<0.05)。根据拟合参数估计值对各个项进行分析,其中锌离子和丁酸钠对收获时细胞活率的影响差异具有统计意义(P<0.05),其余各项、交互项和二次项作用差异不具统计学意义(P>0.05)。从图2中可以看出锌离子和丁酸钠与收获时细胞活率都成负相关,丁酸钠浓度从250 µmol·L-1提高到1250 µmol·L-1时,细胞活率降低10%~15%;锌离子浓度从30 µmol·L-1提高到120µmol·L-1时,细胞活率降低7%左右。
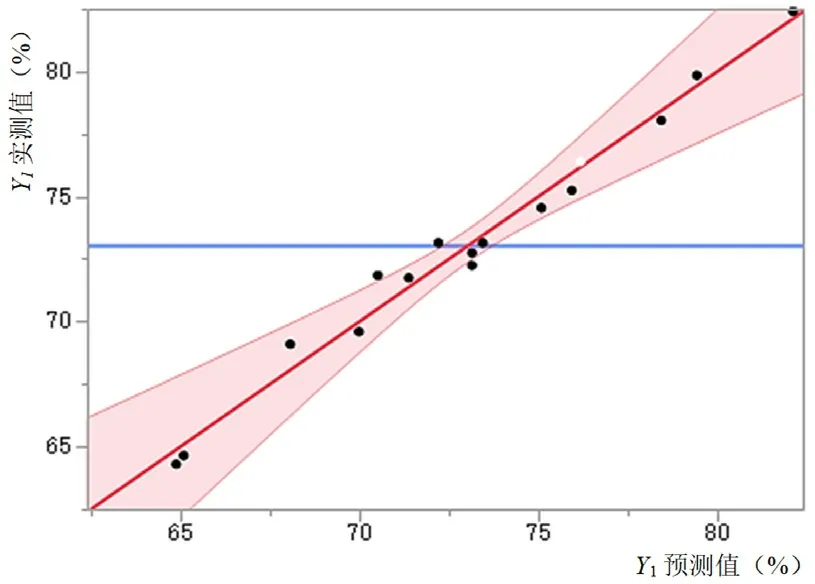
图1 收获时细胞活率预测值-实测值关系图Fig 1 Predicted value-measured value of cell viability at harvest
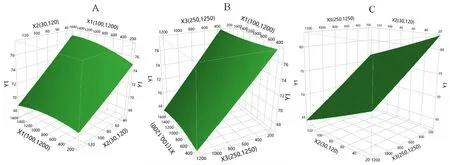
图2 收获时细胞活率响应曲面图Fig 2 Response surface plot of cell viability at harvest
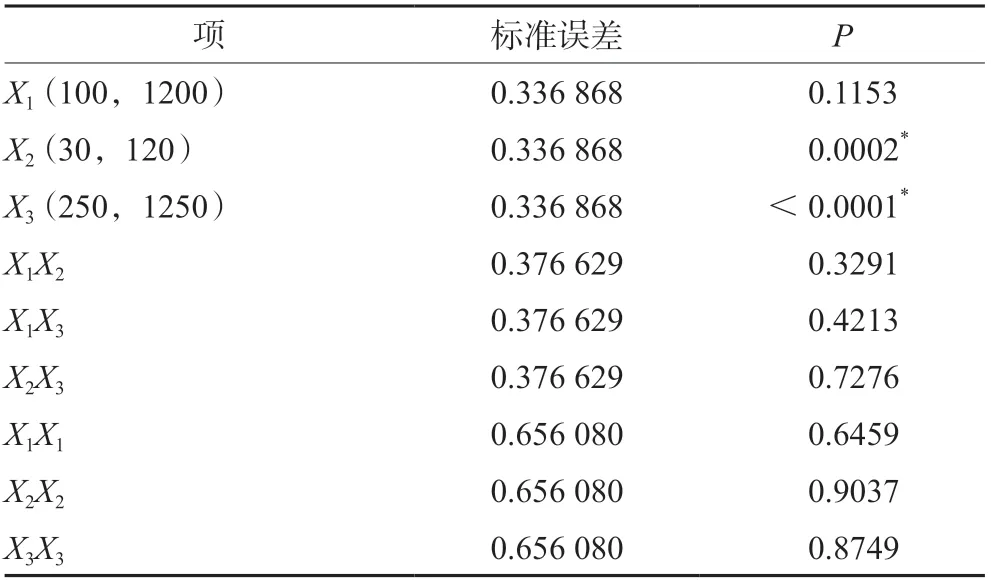
表2 收获时细胞活率参数估计值Tab 2 Estimates of fitting parameters for cell viability at harvest
3.1.2 培养基添加剂对抗体产量的影响 三种培养基添加剂对抗体产量的影响结果见图3和表3。抗体产量的预测值-实测值的拟合结果差异具有统计学意义(P<0.05)。根据拟合参数估计值对各个项进行分析,锰离子和丁酸钠对抗体产量的影响差异具有统计学意义(P<0.05),其余因子和因子之间不存在交互作用和二次项(P>0.05)。如图4显示,丁酸钠浓度从250 µmol·L-1增加到1250µmol·L-1时,抗体产量下降大约33%;将锰离子浓度从100 nmol·L-1提高到1200 nmol·L-1时,抗体产量呈先上升后略微下降的趋势,当浓度为1100 nmol·L-1时,抗体产量达到最高。

图3 抗体产量的预测值-实测值关系图Fig 3 Predicted value-measured value of antibody production

图4 抗体产量响应曲面图Fig 4 Response surface plot of antibody production
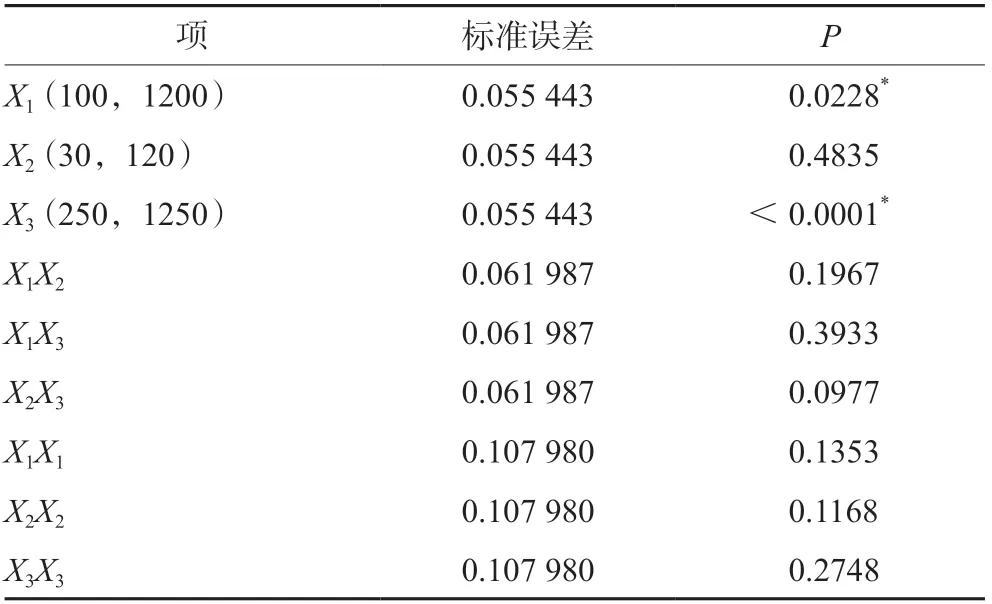
表3 抗体产量参数估计值Tab 3 Estimates of fitting parameters for antibody production
3.1.3 培养基添加剂对细胞特异性生产力的影响
三种培养基添加剂对细胞特异性生产力的影响结果如图5和表4所示。细胞特异性生产力的预测值-实测值的拟合结果差异具有统计学意义(P<0.05)。通过拟合参数估计值对各个项进行分析可知,锰离子和丁酸钠对细胞特异性生产力的影响差异具有统计学意义(P<0.05),锌离子及其他各交互项、二次项之间与细胞特异性生产力差异不具有统计学意义(P>0.05)。由图6可知,锰离子对细胞特异生产力影响呈曲线反应,当锰离子浓度为900 nmol·L-1左右时达到最大,细胞特异性生产力提高约14%;丁酸钠在250~1250 µmol·L-1内与细胞特异生产力成负相关,当丁酸钠浓度为1250 µmol·L-1时,细胞特异性生产力降低了25%;锌离子浓度在30~120 µmol·L-1时对细胞特异生产力的影响不明显。

图5 细胞特异性生产力的预测值-实测值关系图Fig 5 Predicted value-measured value of cell specific productivity
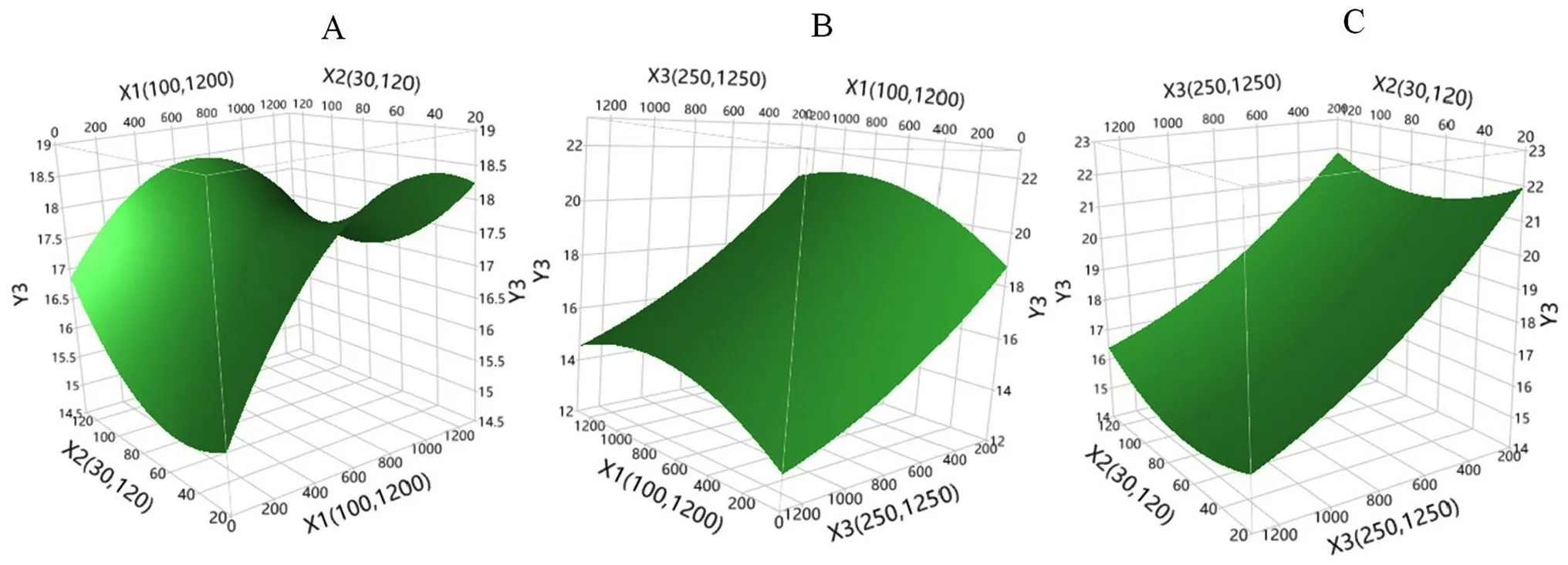
图6 细胞特异生产力响应曲面图Fig 6 Response surface plot of cell specific productivity
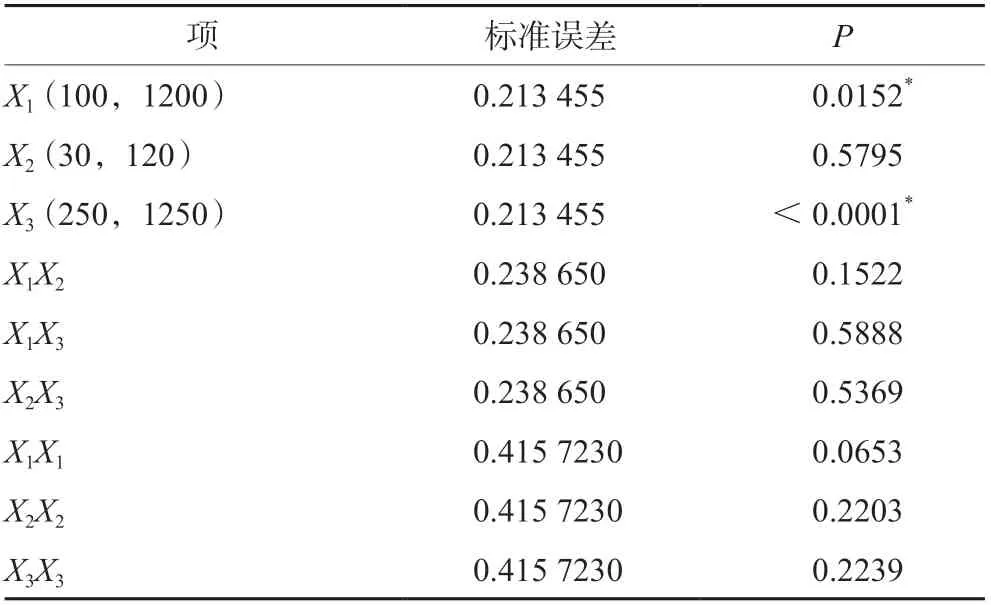
表4 细胞特异性生产力参数估计值Tab 4 Estimates of fitting parameters for cell specific productivity
3.1.4 培养基添加剂对Man5糖型含量的影响 三种培养基添加剂对Man5糖型含量的影响如图7和表5所示。Man5糖型含量的预测值-实测值的拟合结果表明该模型差异有统计学意义(P<0.05)。通过拟合参数估计值对各个项进行分析表明除了锰离子和丁酸钠对Man5糖型含量不存在交互作用外,其他单因子,双因子交互作用以及二次项都对Man5糖型含量影响均差异具有统计学意义(P<0.05)。从图8可知,锰离子浓度低于900 nmol·L-1,锌离子浓度低于100 µmol·L-1和丁酸钠浓度低于800 µmol·L-1时,与Man5糖型含量成负相关。但是大于这些浓度时,与Man5糖型含量成正相关。
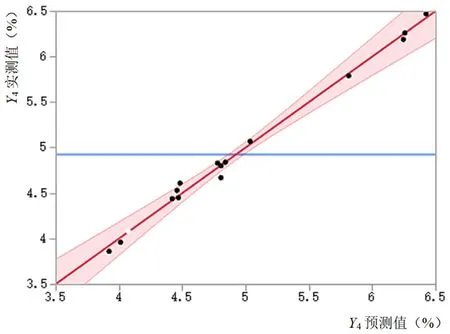
图7 Man5含量预测值-实测值关系图Fig 7 Predicted value-measured value of Man5 percent
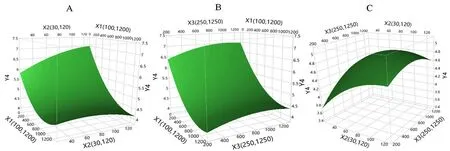
图8 Man5含量响应面图Fig 8 Response surface plot of Man5 percent
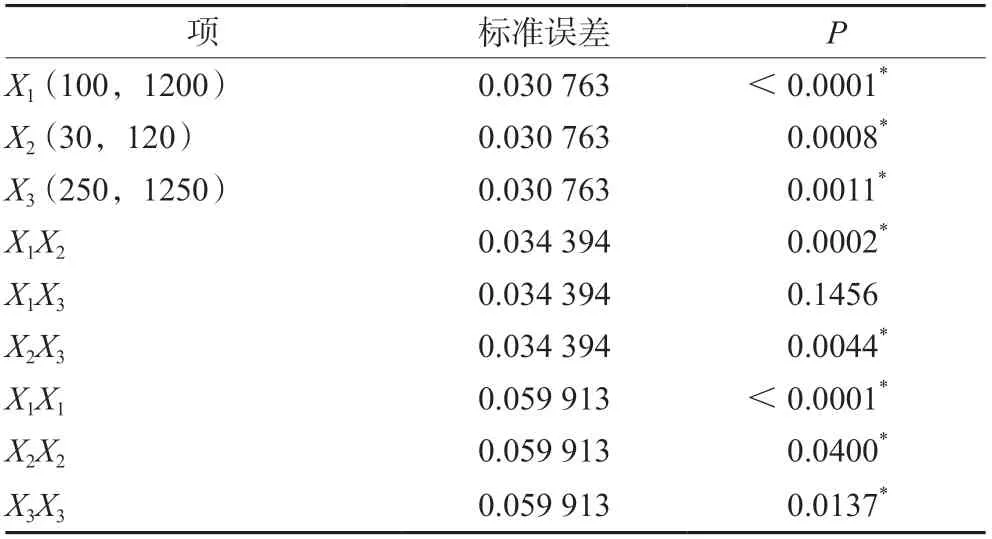
表5 Man5含量参数估计值Tab 5 Estimates of fitting parameters for Man5 percent
3.2 设计空间
丁酸钠的添加量越大活率下降越为明显,会降低抗体的产量,为了尽可能地提高抗体产量,因此选择设置丁酸钠的浓度为最小量250 µmol·L-1,目标抗体产量大于5.2 g·L-1,Man5糖型含量低于5%。通过使用JMP软件等高线刻画器功能对实验模型进行刻画,锌离子和锰离子的浓度设计空间如图9所示,图中空白部分即为可满足条件的添加量,当锰离子、锌离子和丁酸钠浓度分别为1000 nmol·L-1、30 µmol·L-1和250 µmol·L-1时抗体产量达到最大化,此时即为最佳添加量,在此条件下收获时细胞活率的预测值为81.8%,抗体产量的预测值为5.21 g·L-1,细胞特异性生产力的预测值为21.68 pg·d-1,Man5糖型含量的预测值为3.79%。

图9 设计空间模型Fig 9 Design space model
3.3 模型验证
根据上述设计空间参数,对最优添加条件进行验证,设置实验组(Test)和对照组(Control),对照组不含锰离子、锌离子和丁酸钠,每组实验重复3次。根据图10可知,培养后期实验组中细胞密度和活率都显著高于对照组,活细胞峰值密度达到了25.23×106cells·mL-1,比对照组提高了11.8%;在培养过程中乳酸的积累低于对照组,如图11,这更有利于细胞的生长和抗体的表达,最终抗体的产量达到5.21 g·L-1,比对照组提高了14.5%。抗体糖基化变化如图12所示,与对照组相比,Man5和G0F含量有所减少,其中Man5含量减少了28.9%,其余糖型含量均有所提升。实验组中的收获时细胞活率、抗体产量、细胞特异生产力和Man5糖型含量均与预测结果接近,表明模型真实有效。
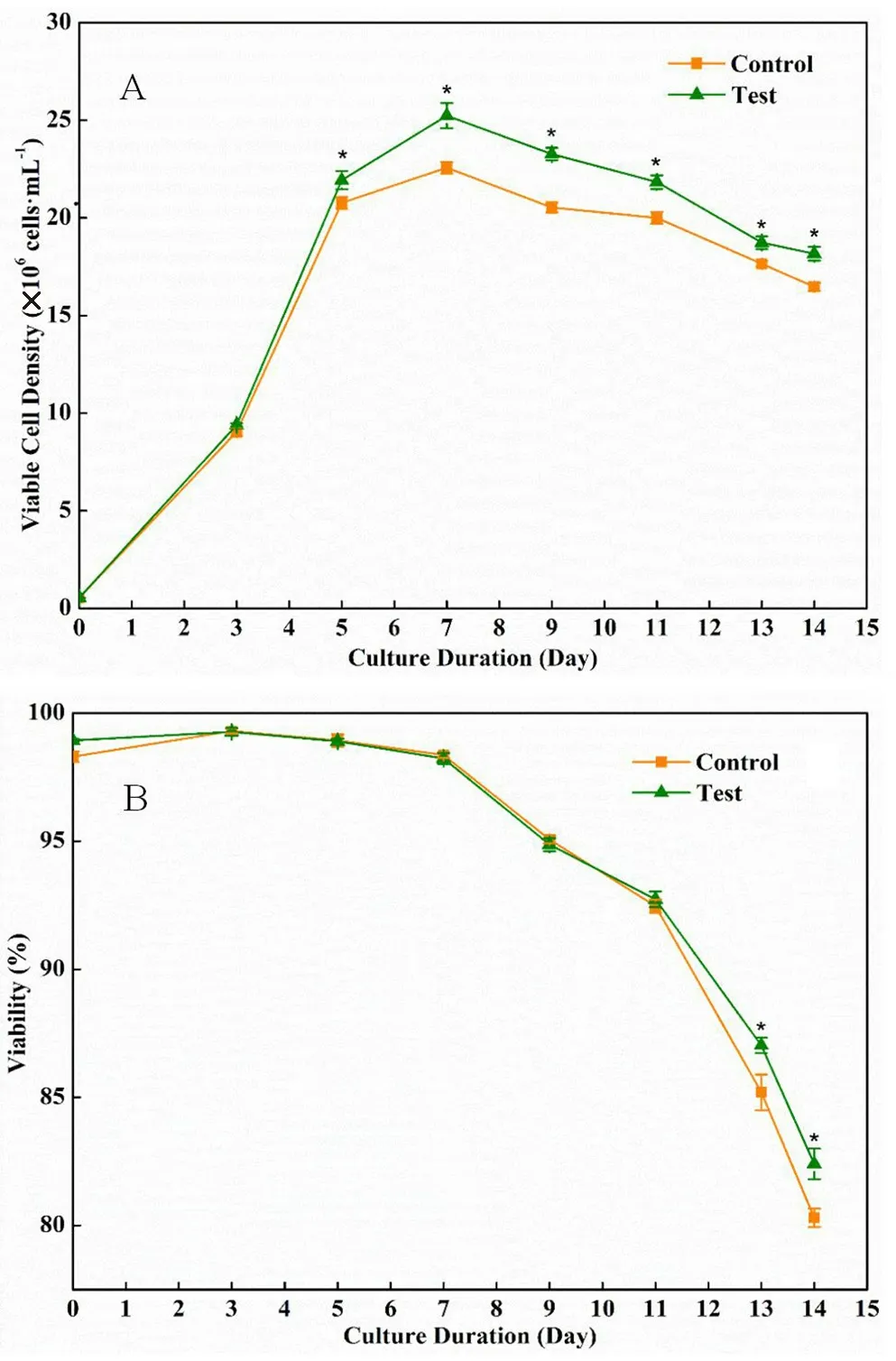
图10 细胞活力曲线Fig 10 Cell viability curve

图11 乳酸含量变化曲线Fig 11 Lactic acid content change curve

图12 抗体糖基化修饰Fig 12 Antibody glycosylation modification
4 讨论
在动物细胞培养过程中,培养基添加剂在抗体的表达和质量等方面起着不可或缺的作用,通过使用小分子添加剂来提高抗体的产量和质量,可大幅降低抗体药物的生产成本,本实验用表达双特异性抗体的CHO细胞作为研究对象,探究锰离子、锌离子和丁酸钠组合使用对细胞生长、抗体表达和Man5糖型含量的影响,通过响应面实验并建立回归模型,结果预测值与实际值相近,进一步验证了模型的有效性。
在流加培养的早期,细胞会迅速增殖,这种指数生长期通常会伴随着葡萄糖大量消耗、酵解并会导致乳酸积累[13],这种乳酸的积累会对细胞生长和生产力产生不利影响[14],本实验中,在添加30 µmol·L-1锌离子、250 µmol·L-1丁酸钠的条件下,锰离子浓度从100 nmol·L-1提高到1000 nmol·L-1时,不仅减少了乳酸的积累,细胞活率和细胞密度均有所提升,抗体表达量提高了10.6%,比对照组提高了14.5%,在保持相同培养周期的情况下,成功实现了抗体产量的提高,这一成果对于提高生物制药生产效率具有显著的意义,并在降低生产成本方面发挥着重要作用,这一研究成果不仅对于提升CHO细胞生产抗体的能力具有重要启示,同时也为其他生物制药相关的研究和应用提供了有价值的参考。锌离子和丁酸钠的加入均抑制了细胞的生长,也降低了细胞的活率,进而影响了抗体的表达,这与文献研究结果一致[15-16],然而并没有发现锌离子和丁酸钠对细胞特异性生产力有明显的提升,这可能与细胞株对这两种物质较为敏感和外源蛋白的特性有关,也可能是培养工艺、培养参数等对实验产生了不同的结果。
当糖蛋白通过内质网(endoplasmic reticulum,ER)时,高甘露寡糖的还原端被α-甘露糖苷酶-Ⅰ在内的多种酶剪切而形成Man5,ER修饰过程是糖蛋白正确折叠(包括正确的二硫键形成)的一种特殊而复杂的机制,聚糖结构在这过程被各种折叠蛋白和糖苷酶作为识别序列,并通过ER相关机制导致糖蛋白的再折叠或降解[17],而锰离子是参与N-链接聚糖合成的几种糖基转移酶的重要辅助因子,它的含量会影响各糖苷酶的活性从而影响细胞内糖基化通量[18]。在本研究中,添加1000 nmol·L-1锰离子,Man5糖型含量有较为明显地降低,这与Pacis等[10]的研究结果一致。也有研究表明,在CHO细胞培养过程中补充过量的锰离子时会表现出不同的糖链构象,如在CHO-K1细胞株培养过程中添加40 µmol·L-1锰盐时,G1F糖型含量增加,G0和G0F糖型减少[19],本研究中也观察到了G1F糖型含量的增加和G0F糖型含量的减少,但提高了G0糖型含量,同时G1F’和G2F糖型含量也有所提升,这可能是锌离子和丁酸钠共同影响了糖基化的结果,后续将继续研究这些物质对其他糖型的影响。
为优化培养性能,降低生产成本,商业培养基中添加微量金属离子、丁酸钠等培养基添加剂是必要的,这些添加剂的使用会影响细胞的生长状态、抗体产量及糖基化。在生物药行业,焦点聚集在如何最大限度地减少原料的可变性,从而提高治疗性蛋白的产量和保持各批次间产品质量的一致性。糖基化作为CQA之一,可以显著影响抗体的结构和功能,其评估贯穿于开发的早期阶段、产品表征和法规申报,因此研究培养基添加剂对抗体糖基化的影响具有重大意义。此外,培养时间、铵离子浓度、渗透压等都会对抗体产量和糖基化造成影响。在CHO细胞培养的早期阶段,细胞处于对营养物质的吸收和代谢的快速增长期,此时抗体产量可能较低,随着培养时间的增加,细胞数量增多,细胞代谢逐渐稳定,抗体的产量也会逐渐增加。然而,过长的培养时间可能会导致铵根离子堆积、渗透压升高和细胞死亡,并且可能影响糖基化酶的活性和细胞内的糖基化途径,从而降低抗体产量和改变糖基化结果,进一步深入研究这些因素的影响将极大地推动生物制药产业的进一步创新和发展。
5 结论
本研究运用JMP软件响应曲面设计-中心复合设计考察锰离子、锌离子和丁酸钠组合使用对CHO细胞的生长、抗体产量和Man5糖型含量的影响,结果表明,三种因子对CHO细胞的生长、抗体产量和Man5糖型含量的调控发挥着重要作用,控制三者间的添加浓度可有效提高抗体产量和优化抗体糖型。

