脂多糖对气道上皮细胞损伤后炎性因子的影响
支文冰,姜盛楠,孙婷婷,王春柳,宗时宇,陈静,李晔,刘洋*,张红*(.陕西省中医药研究院(陕西省中医医院),西安 7006;.陕西中医药大学药学院,陕西 咸阳 7446)
支气管哮喘简称哮喘,是由多种免疫细胞和细胞组分参与的以气道慢性炎症为特征异质性疾病,临床表现咳喘、呼吸短促、胸闷和呼吸困难等[1]。2022年《全球哮喘防治创议》GINA提出世界哮喘日的主题为“消除差距,实现哮喘的同质管理”,流行病学调研发现全球哮喘病患者已达3亿人,其中我国的哮喘病患者约有4570万[2]。哮喘历经气道上皮损伤、黏液高分泌、气道炎性浸润和气道平滑肌增生等病理进程,但哮喘作为一种多因素诱导的复杂性疾病,其发病机制目前尚未阐明[3]。
气道上皮细胞作为呼吸道的第一屏障,可视为哮喘病理改变的起点。过敏原和PM2.5等环境因子作用于气道上皮,气道上皮细胞在外界因子刺激下均可发生炎性病变,释放多种炎性因子,包括白细胞介素(IL)-13(IL-13)、IL-33和胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)等,大量的炎性因子累积加速了气道上皮细胞凋亡,打破了气道上皮屏障的完整性[4-5]。通过文献检索发现,脂多糖(lipopolysaccharide,LPS)作为气道上皮细胞损伤的刺激剂,可诱导气道上皮细胞发生炎症、自噬和凋亡等,进而构建多种体外细胞模型,模拟哮喘发病过程中的上皮损伤,揭示上皮损伤机制及药物作用机制[6-7]。但LPS作用于气道后,细胞因子的种类和水平如何变化,目前尚未有系统研究。此外,在文献检索过程中我们发现,LPS诱导的气道上皮细胞模型评估相对匮乏,且诱导时间不固定。因此,综合时间效应和LPS刺激后的多种因子效应,本课题进行了系统研究,以期为揭示上皮细胞受损后细胞因子水平的改变及哮喘机制研究提供更多的数据支撑。
1 材料
1.1 细胞
人气道上皮细胞(BEAS-2B,ACTT中国细胞资源库)。
1.2 试药与仪器
LPS(纯度≥98%,货号 551064,Sigma生物试剂公司);IL-1β、IL-8、IL-6、TSLP、IL-13、IL-33、IL-17和单核细胞趋化蛋白1(MCP-1) ELISA试剂盒(伊莱瑞特生物试剂有限公司);一氧化氮(NO)检测试剂盒(普利莱生物试剂有限公司)。
2 方法与结果
将细胞以1×105个/孔接种于24孔板中,细胞贴壁后将孔板分为8组,每组设置3个复孔,分为不同时间的空白组和LPS刺激组;吸弃24孔板培养上清液,空白组加入500 μL无血清培养基,LPS组加入500 μL LPS刺激剂(终质量浓度为10 μg·mL-1),于刺激后3、6、12和24 h分别收集细胞上清液。严格按照实验操作说明书,进行样品和标准品孵育、漂洗;生物化抗体孵育、漂洗;HRP酶孵育,漂洗和显色处理,于450 nm处采用全波长酶标仪检测每个孔的OD值,根据标准曲线计算样本的浓度。采用硝酸还原酶法测定细胞上清中NO的水平,按照试剂盒说明书配制标准品溶液,加入样品、标准品,而实验各孔加入Griess试剂,室温避光孵育5 min,于540 nm处测定OD值,建立标准曲线,根据标准曲线计算样本的浓度。
结果如图1所示,与空白组比较,LPS刺激气道上皮细胞中炎症因子IL-1β、TSLP、IL-13、IL-33和NO水平无显著差异;且LPS作用气道上皮细胞后3、6、12和24 h,细胞上清液中IL-1β、TSLP、IL-13、IL-33和NO的分泌始终与空白组相似,均维持在较低的水平。与空白组比较,LPS作用气道上皮细胞后3、6、12和24 h,气道上皮细胞中炎症因子IL-8、IL-6、IL-17和 MCP-1分泌均显著增加(P<0.01);且LPS刺激6 h,气道上皮细胞分泌的IL-8和MCP-1水平最高。此外,随着LPS刺激时间的增加,气道上皮细胞分泌的IL-6和IL-17水平也随之增加,24 h的刺激时间下,IL-6和IL-17的分泌增加最明显。
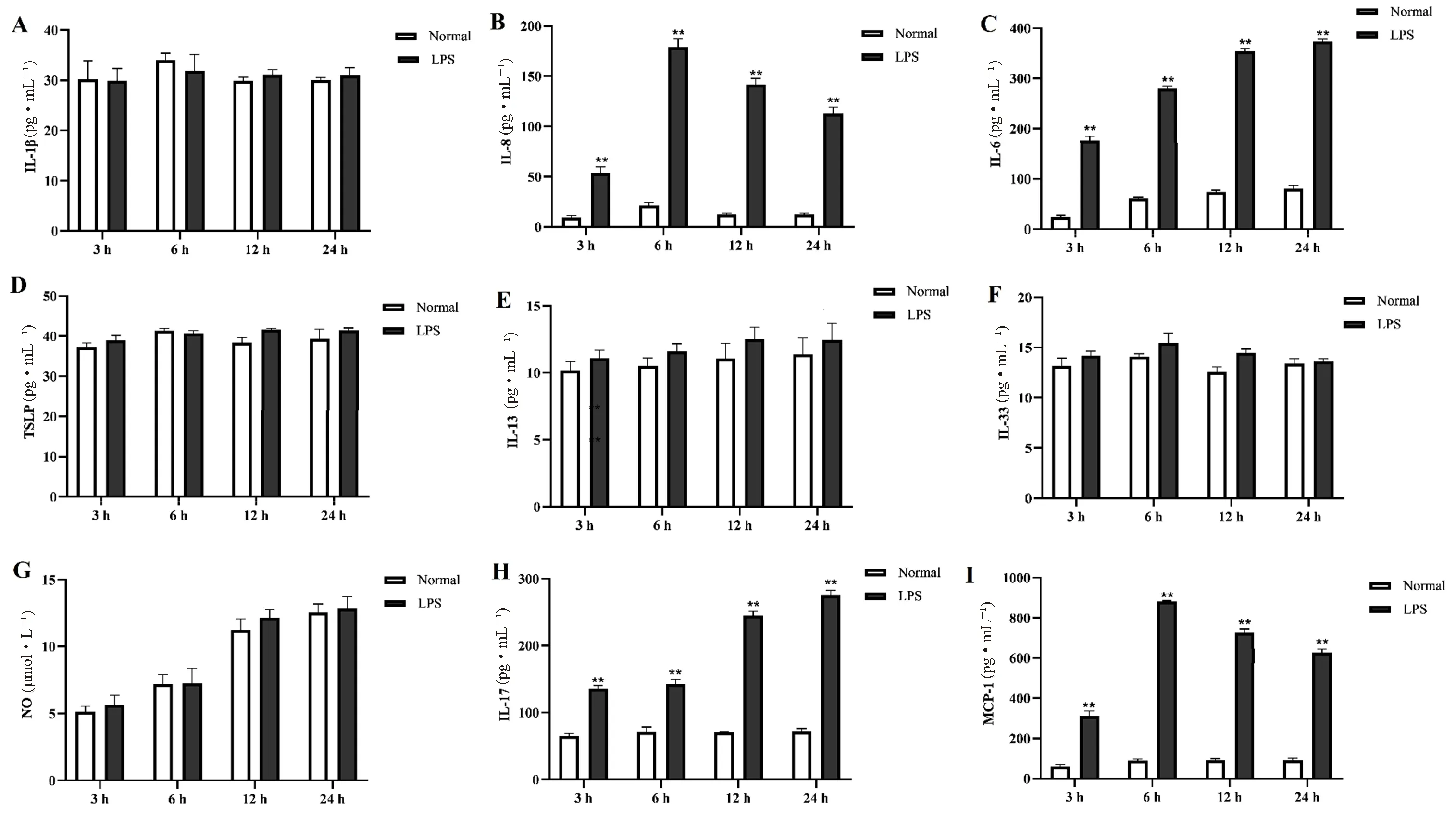
图1 LPS对气道上皮细胞IL-1β、TSLP、IL-13、IL-33、NO、IL-8、IL-6、IL-17和 MCP-1分泌的影响Fig 1 Effect of LPS on secretion of IL-1β,TSLP,IL-13,IL-33,NO,IL-8,IL-6,IL-17 and MCP-1 by airway epithelial cells
3 讨论
哮喘是一种慢性气道炎症性疾病,患者可发生间断的小气道阻塞,气道上皮细胞是气道炎症反应的起点,是肺部炎症-免疫调节的第一道防线[8]。屋尘螨、PM2.5、卵清蛋白、花粉和真菌均能引起气道的炎症反应,其中LPS作为一种内毒素,常作为免疫细胞和非免疫细胞炎性病变的诱导剂,可引起气道上皮细胞损伤,诱发炎症级联反应[9-10]。本实验采用LPS作用于人气道上皮细胞,发现LPS可促进BEAS-2B细胞中IL-8、IL-6、IL-17和MCP-1分泌,且刺激时间3、6、24 h均能使其水平显著增加;但对于IL-1β、TSLP、IL-13、IL-33和NO水平无刺激作用。
在气道上皮细胞中,LPS作为革兰氏阴性菌细胞壁中的一种成分,能够诱导宿主免疫应答并产生多种细胞因子,可通过激活细胞表面的Toll样受体4(Toll-like receptor 4,TLR4),核因子κB(nuclear factor kappa-B,NF-κB),丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和磷脂酰肌醇3-激酶(phosphoinositide 3 kinase,PI3K)等信号通路,促进多种炎性因子的释放[10-11]。IL-6和IL-8是常见的趋化因子,具有趋化中性粒细胞、级联扩大炎症反应的作用;在哮喘患者中,中性粒细胞型哮喘占比较大,由于产生过量的细胞外支架中性粒细胞胞外诱捕网,临床较难医治[12]。既往研究发现,C57BL/6哮喘小鼠BALF中炎症介质IL-6和IL-8分泌水平升高,且气道上皮细胞可能通过旁分泌方式释放IL-6和IL-8[13]。小白菊内酯通过调节NF-κB信号通路抑制气道上皮细胞中IL-8的分泌[14]。本研究发现,LPS可显著刺激BEAS-2B细胞中IL-6和IL-8的分泌,但LPS刺激达峰时间不一致;因此,在哮喘机制的研究中,可以通过LPS诱导的BEAS-2B细胞损伤模型探究与IL-6和IL-8相关的发病机制。
MCP-1是趋化因子亚家族成员之一,其水平在哮喘患者外周血中升高,且与哮喘合并呼吸道感染相关[15-16]。孟鲁司特联合复可托或酮替芬可减轻急性发病期哮喘患者血清中MCP-1水平,进而发挥抗哮喘作用[17-18]。本研究发现,LPS显著增加了气道上皮细胞MCP-1的分泌,且在刺激6 h后达峰,提示LPS刺激气道上皮细胞损伤早期可释放大量MCP-1类趋化因子,促进血液中粒细胞及单核细胞向气道内转移,加速气道炎症反应。IL-17与中性粒细胞性哮喘紧密相关,可促进杯状细胞增殖、分泌黏液和气道平滑肌增生,于多个环节加速哮喘病变[19]。以往IL-17与哮喘的关系研究多集中在患者血清水平、大鼠血清水平、中性粒细胞及平滑肌细胞水平,鲜少涉及气道上皮细胞,本研究发现LPS刺激气道上皮细胞后,IL-17的水平不断增加,在哮喘发病进程中,气道上皮细胞也是IL-17分泌的重要途径。
IL-13主要由Th2型细胞产生,可诱导单核细胞分化、B细胞增殖及合成IgE类抗体,从而促进炎症-免疫应答[20]。本研究发现LPS刺激BEAS-2B细胞3、6和24 h,细胞上清液中IL-13的分泌维持在较低的水平,无显著性改变,该结果提示BEAS-2B细胞鲜少分泌IL-13,但研究发现IL-13可诱导气道上皮细胞凋亡和黏液高分泌[21-22]。TSLP通过激活树突状细胞功能加快抗原传递,进而破坏Th1细胞和Th2细胞的分化平衡,调节因子IL-5和IL-10的水平。研究发现哮喘气道炎症的严重程度与TSLP的表达水平成正相关[23]。本研究发现LPS不能刺激BEAS-2B分泌大量的TSLP。高水平NO为气道炎症生物标志物,对于老年哮喘患者有辅助诊断价值[24]。本研究发现,LPS诱导的气道上皮细胞炎症损伤并不能使NO水平升高,针对呼出气NO较高的哮喘患者,在药物筛选和发病机制研究时,LPS刺激的BEAS-2B损伤模型可能不能作为细胞研究模型。
IL-1β和IL-33同属IL-1亚族,均属于促炎性细胞因子[25];IL-1β主要在炎性损伤中由单核细胞和巨噬细胞产生,少部分可通过上皮细胞分泌[26];IL-33是一种“双功能细胞因子”,主要由屏障组织的上皮细胞或内皮细胞及免疫细胞分泌,可有效驱动Th2细胞产生IL-4、IL-5和IL-13,刺激巨噬细胞的M2极化,加速粒细胞和肥大细胞募集,诱发过敏性哮喘[27]。研究发现,哮喘患者和哮喘小鼠血清中IL-33和IL-1β水平显著升高[28],但本研究发现LPS作用于气道上皮细胞BEAS-2B不同的时间均不能引起细胞上清液中IL-33和IL-1β水平增加,该研究结果说明针对LPS刺激的气道上皮细胞损伤模型可能不适用于IL-33和IL-1β分泌相关的哮喘机制研究。综上所述,LPS诱导的BEAS-2B细胞损伤模型,适用于IL-8、IL-6、IL-17和MCP-1分泌相关的调控机制研究,但对于IL-1β、TSLP、IL-13、IL-33和NO调节的反应性较差。

