葛根芩连汤联合益生菌对溃疡性结肠炎小鼠肠道菌群及相关炎症因子的影响
李子伊,李淋雨,张紫园,邱宇,赵飞,戴敏,常艳,4*(.安徽中医药大学药学院,合肥 300;.益诺思生物技术南通有限公司,江苏 南通 633;3.南通市海门长三角药物高等研究院,江苏 南通 633;4.上海益诺思生物技术股份有限公司,上海 003;5.江西中医药大学,南昌 330004)
溃疡性结肠炎(ulcerative colitis,UC)是一种造成结肠损伤的非特异性慢性炎症性疾病,在我国的发病率逐年升高,受到广泛的关注。目前,普遍认为其发病机制涉及遗传[1]、肠道屏障受损[2]、免疫系统失调[3]、肠内微生物等因素[4]。现代临床用药主要为氨基水杨酸制剂、糖皮质激素、免疫抑制剂[5]、生物制剂[6]等,但这些药物均存在不同程度的不良反应,导致患者依从性较差[7]。UC在中医上属“泄泻”的范畴,此外还有“腹痛”“肠病”“久痢”等说法,总体病机可概括为脾虚湿盛,肠腑湿热蕴结[8-11]。主治协热下利的经典名方葛根芩连汤(Gegen Qinlian decoction,GQD)越来越多地应用于肠道疾病的临床治疗中。该方由葛根、黄芩、黄连与炙甘草4味中药相互配伍组成,既清热化湿,又补气益脾[12]。现代药理研究表明,GQD具有抗炎和抑菌作用,其多种活性成分如黄芩苷、甘草黄酮、小檗碱等,能显著减轻炎症和氧化应激[13-16]。该方对UC的治疗作用主要体现在控制疾病活动度、减轻相关炎症因子的表达、调节肠道菌群失衡等方面[17-19]。研究发现,肠道菌群的变化也是UC的疾病表现之一,表现为菌群多样性及丰富度及有益菌水平降低,条件致病菌水平增加,进而导致肠道炎症反应加剧[20-23]。因此在用药的基础上合理地补充肠道有益菌,调节肠道菌群的平衡,也逐渐成为治疗UC的新思路。
临床研究表明,GQD结合益生菌进一步控制UC患者的临床症状,在促进肠道黏膜愈合、逆转炎症反应、调节肠道菌群失衡等方面有一定的优势[24-26]。本文应用GQD联合益生菌对UC小鼠模型相关炎症因子的表达以及肠道菌群的变化进行研究,揭示联合用药对肠道的保护作用,以期为后续的疾病治疗及药物研究提供参考。
1 材料
1.1 动物
45只6~8周龄SPF级健康雄性C57BL/6小鼠,体重(20±2)g [浙江维通利华实验动物技术有限公司,实验动物生产许可证号SCXK(浙)2020-0002]。所有动物均在光暗循环的SPF级动物房中饲养,温度20~25℃,湿度40%~70%,自由摄食饮水。本研究经益诺思生物技术南通有限公司动物护理和使用委员会(IACUC)批准,批准号为IACUC-2023-m-135a。
1.2 试药
葛根、黄芩、炙甘草(广东汇群中药饮片股份有限公司),黄连(康美药业股份有限公司),以上中药饮片由安徽中医药大学方清影主任鉴定为正品,符合2022年版《中国药典》规定。美沙拉嗪肠溶片(德国Losan Pharmma GmbH);益生菌(上海信谊制药总厂);葡聚糖硫酸钠(美国MP Biomedicals);苏木精-伊红(HE)染色剂(武汉塞维尔生物科技有限公司);便隐血试剂盒(北京百奥莱博科技有限公司);白细胞介素(IL)-6、IL-10、肿瘤坏死因子α(TNF-α)ELISA试剂盒(南京建成生物工程研究所);MagPure Soil DNA LQ试剂盒(广州美基生物科技有限公司);Qubit dsDNA Assay试剂盒(美国Life Technologies);Tks Gflex DNA 聚合酶(日本Takara)。
1.3 仪器
高速冷冻离心机、分光光度计[赛默飞世尔科技(中国)有限公司];超纯水仪(美国默克公司);正置白光拍照显微镜(日本尼康公司);电子天平(上海天美天平仪器有限公司,精度:0.0001 g);酶标仪[美谷分子仪器(上海)有限公司];PCR仪(美国伯乐公司);电泳仪、凝胶成像仪(上海天能科技有限公司);生物分析仪(美国安捷伦公司)。
2 方法
2.1 模型建立、分组与给药
适应期结束后,除正常组外,余小鼠均采用反复周期性自由饮用3%的葡聚糖硫酸钠(DSS)溶液的方法进行造模[27]。即将3 g DSS以100 mL水溶解完全,得到3% DSS溶液使小鼠自由饮用连续7 d,每隔3日更换新的溶液,再换成正常饮用水饮用7 d,此为一个循环[28],依次进行4个循环共56 d,见图1。从给予DSS的前1日开始以及造模期间每周2次测量小鼠体重、观察粪便情况、参照粪便隐血试剂盒说明书检测隐血情况并进行疾病活动指数(DAI)评分[29]。

图1 造模及治疗周期Fig 1 Modeling and treatment cycle
造模第35日根据DAI评分,剔除掉造模失败小鼠,即评分低于1分的小鼠。整个实验共分为7组,正常组(Normal)、模型组(Model)、美沙拉嗪组(Mes)各5只,益生菌组(Probiotics)、益生菌联合GQD低剂量组(GQD L+Probiotics)、益生菌联合GQD中剂量组(GQD M+Probiotics)、益生菌联合GQD高剂量组(GQD H+Probiotics)各6只,于实验第36日灌胃给药。GQD依据原方及相关文献研究的煎煮方式[30],以5∶3∶3∶2的比例进行煎煮。所有药材均加入8倍量双蒸水浸泡,葛根先浸泡30 min,先武火煮沸后转小火继续煎煮20 min,再加入已浸泡30 min的剩余诸药,煮沸后继续煎煮30 min,三层纱布过滤后再加水复煎,合并两次所得滤液,浓缩成2.54、5.08、10.16 g·kg-1的低、中、高剂量的药液灌胃;益生菌用双蒸水配制成0.3 g·kg-1药液灌胃,联合给药组于中药方剂给药1 h后灌胃益生菌;美沙拉嗪肠溶片用双蒸水配制成0.6 g·kg-1药液灌胃。正常组及模型组灌胃等量生理盐水,各给药组均给药21 d。
2.2 结肠长度测量及HE染色
动物采血结束后立即沿肠系膜纵轴剪开肠腔,迅速剖取盲肠至肛门段的肠组织,用冰生理盐水冲洗污物,记录长度,收集肠道中的粪便置-80℃冰箱中备测,将肠组织置于10%中性福尔马林中固定,进行常规HE染色。将固定的结肠组织脱水、包埋、切4 μm厚片,随后依次放入二甲苯Ⅰ、二甲苯Ⅱ、无水乙醇Ⅰ、无水乙醇Ⅱ、75%酒精中脱蜡水化,经苏木素染液染3~5 min、分化、返蓝、流水冲洗,进行梯度酒精脱水后放入伊红染液中染色5 min,采用中性树胶封片,用显微镜观察并采集图像分析。依据结果进行结肠黏膜损伤指数(CMDI)评分[31]。
2.3 ELISA法检测血清中炎症因子IL-6、IL-10、TNF-α的表达情况
动物安乐死后,立刻心脏采血,静置1 h后4℃、3000 g离心5 min,收集血清。采用ELISA试剂盒说明书的方法配制标准曲线、加样、加入生物素抗原工作液、孵育、洗板、加入亲和素工作液、洗板、加入显色液及中止液最后采用酶标仪读取各样本OD值,检测各组血清炎症因子的表达情况。
2.4 肠道菌群16S rRNA测序
末次给药结束后收集小鼠粪便样品,对样本的基因组DNA进行提取。利用分光光度计和琼脂糖凝胶电泳检测DNA的浓度,将提取的DNA置于-20℃备测。以提取的基因组DNA为模板,选择16S rRNA基因的V3-V4区作为扩增和测序的目的区间,正向引物为343F:TACGGRAGGCAGCAG,反向引物为798R:AGGGTATCTAATCCT,进行PCR扩增,取纯化过的扩增产物进行Qubit定量,调整浓度进行测序。采用Illumina NovaSeq 6000测序平台,进行样本2×250 bp双端测序与分析,经过引物剪切、质量过滤、降噪、拼接、去嵌合体等质控分析后。使用QIIME2软件、R软件、q2-featureclassifier软件等对测序结果进行alpha多样性、beta多样性、菌群结构组成等分析。
2.5 统计学分析
数据均采用SPSS 26.0软件进行分析,以±s表示,多组间数据比较采用单因素方差分析ANOVA,组间两两比较采用LSD值进行检验,P<0.05表明差异有统计学意义。
3 结果
3.1 联合用药对UC模型小鼠体重、DAI评分及结肠长度的影响
随着给药天数的增加,与Model组相比,Mes组、Probiotics组和3个剂量的联合给药组体重均呈恢复趋势,Mes组及GQD H+Probiotics组体重恢复趋势最为显著;给药结束后,与Normal组相比,Model组DAI评分升高,结肠长度缩短(P<0.01);与Model组相比,各给药组DAI评分均降低;同时Mes组及联合给药各组均恢复了结肠长度(P<0.01)。Probiotics组有促进结肠长度恢复趋势,见图2。
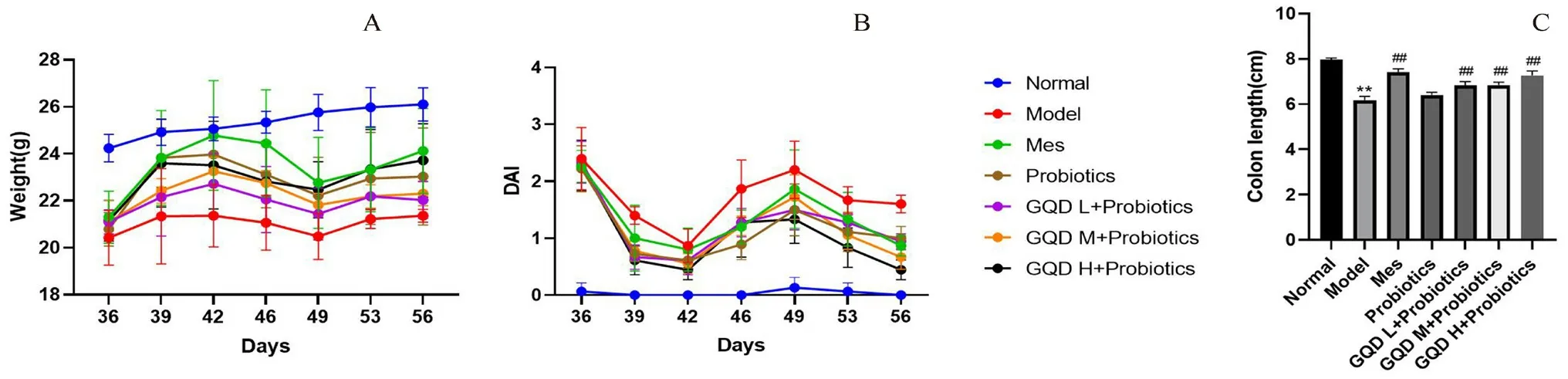
图2 给药期间小鼠体重(A)、DAI评分变化(B)及治疗后各组结肠长度(C)的比较Fig 2 Changes in body weight(A)and DAI score(B)during the administration and colon length(C)in each group
3.2 联合用药恢复UC模型小鼠组织病理学损伤
各组结肠HE染色结果显示,Normal组小鼠肠组织各层结构清晰,黏膜层上皮细胞形态正常,固有层肠腺数量丰富且排列紧密,肌层肌细胞排列规则、形态正常,未出现明显的炎性变化。与Normal组相比,Model组小鼠肠组织可见大面积糜烂,黏膜层结构消失,固有层肠腺坏死、结构消失并伴大量炎症细胞浸润(黑色箭头所示),肌层结构较为松散,CMDI评分升高。与Model组相比,Mes组及联合给药各组固有层肠腺结构恢复较好,仅有小面积炎性细胞浸润,偶见上皮细胞坏死脱落,肌层结构规则,GQD M+Probiotics组和GQD H+Probiotics组的恢复效果较为显著,CMDI评分降低;而Probiotics组肠腺结构有所恢复但仍存在中度炎性细胞浸润的情况,CMDI评分高于联合给药组,见图3。

图3 各组结肠HE染色(×200)(A)及结肠病理评分(B)Fig 3 Colon HE staining(×200)(A)and CMDI scoring(B)in each groups
3.3 联合用药降低UC模型小鼠促炎因子的表达、升高抑炎因子的表达
与Normal组相比,Model组小鼠促炎因子IL-6、TNF-α的表达升高,而抑炎因子IL-10表达水平下降。经治疗后,与Model组相比,各给药组均显著下调促炎因子IL-6、TNF-α的表达,上调抑炎因子IL-10的表达。GQD M+Probiotics组对抑炎因子IL-10的上调作用较其他联合给药组明显,此外,各联合给药组对其他炎症因子的表达情况均呈剂量依赖性,且与Probiotics组相比,GQD M+Probiotics组及GQD H+Probiotics组对炎症因子的调节程度更为显著,说明联合用药相较于单独补充益生菌更能显著调整炎症因子的表达情况,对免疫反应进行干预,见表1。
表1 各组IL-6、IL-10、TNF-α的表达情况(±s,ng·mL-1)Tab 1 Expression of IL-6,IL-10,and TNF-α in each group (±s,ng·mL-1)

表1 各组IL-6、IL-10、TNF-α的表达情况(±s,ng·mL-1)Tab 1 Expression of IL-6,IL-10,and TNF-α in each group (±s,ng·mL-1)
注:与Normal组相比,**P<0.01;与Model组相比,#P<0.05,##P<0.01;与Probiotics组相比,△P<0.05,△△P<0.01。Note:Compared with the Normal group,**P<0.01;compared with the Model group,#P<0.05,##P<0.01;compared with the Probiotics group,△P<0.05,△△P<0.01.
组别IL-6IL-10TNF-α Normal组47.77±1.80365.76±4.60365.36±4.56 Model组99.34±3.12**256.37±10.04**469.06±10.61**Mes组52.61±6.81##358.70±9.21##430.05±15.71#Probiotics组63.14±5.00##352.23±5.39##388.89±9.55##GQD L+Probiotics组54.95±3.08##375.75±8.54##366.47±9.86##GQD M+Probiotics组49.34±1.50##△407.07±12.14##△△358.35±9.53##GQD H+Probiotics组45.71±1.43##△△395.80±22.98##△340.55±15.81##△
3.4 联合用药调节UC模型小鼠肠道菌群的平衡
3.4.1 小鼠肠道菌群alpha多样性分析 alpha多样性结果基于Simpson指数和Chao1指数进行分析,两者分别侧重于群落多样性和群落丰富度。经Simpson指数稀释曲线分析得出,随着测序深度的增加,曲线逐渐趋于水平,说明测序深度已经基本覆盖到样品中绝大部分微生物信息,且Simpson指数越高,表明群落多样性越高,由此可见,Probiotics组的群落多样性较高。Chao1指数分析图反映了群落丰富度在组间的差异性,Chao1指数越大,表明群落的丰富度越高。与Normal组相比,Model组的群落丰富度降低,而与Model组相比,Probiotics组、Mes组和GQD M+Probiotics组的群落丰富度明显升高,见图4。

图4 各组小鼠肠道菌群Simpson指数稀释曲线图(A)及Chao1指数分析图(B)Fig 4 Simpson index dilution curve(A)and Chao1 index analysis(B)of the intestinal microbiota in each group
3.4.2 小鼠肠道菌群beta多样性分析 采用主成分分析(PCoA)考察小鼠肠道菌群beta多样性的差异,即群落组成越相似,反映在图中的距离越接近。采用unweighted unifrac距离算法进行分析,结果显示,Normal组和各给药组分布于完全不同的象限,说明菌群物种组成出现了显著变化;Probiotics组与Model组重叠度较大说明菌群物种组成有相似性;而其他给药组与Model组处于完全不同象限,说明群落物种组成已经发生了明显变化;GQD M+Probiotics组及GQD H+Probiotics组的群落结构分布较为接近且有部分重叠,说明群落物种组成有一定的相似性,见图5。

图5 各组小鼠肠道菌群主成分分析Fig 5 Principal component analysis of the intestinal microbiota in each group
3.4.3 门水平肠道菌群组成分析 基于门水平的肠道菌群Heatmap图分析,各组小鼠肠道差异菌群主要由拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、脱硫杆菌门(Desulfobacterota)、放线菌门(Actinobacteriota)、疣微菌门(Verrucomicrobiota)、弯曲杆菌门(Campilobacterota)、脱铁杆菌门(Deferribacterota)等组成,见图6。与UC最具有相关性的两个菌门为Firmicutes和Bacteroidota,两者的比值(F/B)变化被认为与UC疾病活动度相关[32],与Normal组比较,Model组的Firmicutes的相对丰度降低,而Bacteroidota的相对丰度升高,Model组F/B下降,表明处于疾病活动期,肠道菌群失衡;与Model组相比,GQD M+Probiotics组及GQD H+Probiotics组的Firmicutes的相对丰度升高,而Bacteroidota的相对丰度降低,F/B显著升高,表明联合给药后促进了肠道菌群恢复稳态,以上差异均有统计学意义。

图6 各组小鼠肠道菌群基于门水平分析Heatmap图(A)、肠道中Firmicutes相对丰度(B)、Bacteroidota相对丰度(C)及两者比值(F/B)分析图(D)Fig 6 Heatmap of gut microbiota based on phylum level(A),analysis of Firmicutes relative abundance(B)and Bacteroidota relative abundance(C),and F/B ratio in the intestines of mice in each group(D)
3.4.4 属水平肠道菌群组成分析 基于属水平的肠道菌群Bar图分析发现,各组菌群所包括的菌属主要为Muribaculaceae、拟杆菌属(Bacteroides)、毛螺菌属NK4A136(Lachnospiraceae_NK4A136_group)、另枝菌属(Alistipes)、普雷沃氏菌属UCG-001(Prevotellaceae_UCG-001)、梭状芽孢杆菌属UGG-014(Clostridia_UCG-014)、Clostridia_vadinBB60_group、Muribaculum、拟普雷沃氏菌属(Alloprevotella)、罗氏菌属(Roseburia)、大肠埃希菌属(Colidextribacter)、乳酸杆菌属(Lactobacillus)、Lachnoclostridium、沙门氏菌属(Parasutterella)、颤螺菌属(Oscillibacter)等,见图7。根据群落相对丰度表达量分析,与Normal组相比,Model组下调了Muribaculaceae、Lachnospiraceae_NK4A136_group、Alistipes、Roseburia、Lactobacillus等有益菌属丰度,上调了Bacteroides、Colidextribacter、Clostridia_UCG-014等条件致病菌属丰度,说明肠道菌群组成结构发生变化。经给药治疗后,与Model组相比,GQD M+Probiotics组回调了Lachnospiraceae_NK4A136_group、Alistipes、Roseburia、Lactobacillus等有益菌属的丰度,而下调条件致病菌属Bacteroides、Colidextribacter、Clostridia_UCG-014等,促进肠道菌群结构恢复。GQD H+Probiotics组主要上调Muribaculaceae,两组均促使肠道菌群恢复稳态,见表2。
表2 各组属水平肠道菌群的相对丰度(±s,%)Tab 2 Relative abundance of gut microbiota at the genus level in each group (±s,%)

表2 各组属水平肠道菌群的相对丰度(±s,%)Tab 2 Relative abundance of gut microbiota at the genus level in each group (±s,%)
注:与Normal组相比,*P<0.05,**P<0.01;与Model组相比,#P<0.05,##P<0.01;与Probiotics组相比,△P<0.05,△△P<0.01。Note:Compared with the Normal group,*P<0.05,**P<0.01;compared with the Model group,#P<0.05,##P<0.01;compared with the Probiotics group,△P<0.05,△△P<0.01.
NK4A136_groupAlistipesRoseburiaLactobacillusBacteroidesColidextribacterClostridia_UCG-014 Normal53.35±0.8516.14±2.32 6.63±0.280.85±0.060.84±0.03 2.45±0.260.63±0.011.03±0.06 Model组37.79±0.20** 9.53±1.76* 1.98±0.30**0.18±0.03**0.65±0.02*27.24±3.93**1.37±0.05**1.59±0.09**Mes组34.83±1.9012.69±2.82 3.02±0.330.04±0.030.35±0.03##24.52±2.391.20±0.05##0.40±0.06##Probiotics组35.82±2.22 9.96±0.71 9.42±1.69##0.51±0.010.92±0.08##12.48±0.26##1.28±0.030.93±0.20##GQD L+Probiotics组41.58±0.81 3.48±0.68# 8.60±0.55##0.03±0.000.61±0.0510.87±0.19##0.75±0.01##△△1.52±0.16 GQD M+Probiotics组26.74±0.5934.52±2.32##△△13.01±1.40##△1.90±0.33##△△0.84±0.07# 6.89±0.07##0.49±0.05##△△0.61±0.19##GQD H+Probiotics组48.00±1.28##△△ 9.28±1.56 9.62±1.30##0.50±0.090.81±0.06#10.36±0.53##0.54±0.03##△△1.09±0.06#组别MuribaculaceaeLachnospiraceae_

图7 各组小鼠属水平肠道群落组成Bar图Fig 7 Bar plot of the genus level of intestinal community composition in each group
4 讨论
UC作为一种免疫介导的消化系统疾病,该病的发生和发展对患者的身心将都造成一定影响,病情严重者最终会进展成结直肠癌。在临床和动物模型研究中,促炎细胞因子的分泌增加以及肠道菌群的紊乱都会对UC的发生发展造成一定的影响。本研究通过GQD与益生菌联合,从炎症因子表达及肠道菌群的平衡两个方面对UC进行干预。实验研究结果显示GQD联合益生菌可显著恢复模型小鼠体重,降低DAI评分,减轻结肠病理损伤,减少炎性细胞对肠黏膜的浸润,恢复结肠长度,调节炎症因子表达,调节肠道菌群平衡等,治疗效果优于单用益生菌及西药,联合用药对于UC的治疗更具优势性,同时为后续疾病研究及临床用药提供了思路和参考。
UC患者肠道菌群的失衡与炎症因子的表达是相互影响的,两者联系密切,共同促使UC的病程发展。研究显示,多数UC患者存在肠道内环境紊乱现象,进而引发的一系列反应表现为:肠道有害菌增加,侵袭肠道黏膜,肠道屏障完整性丧失,细菌抗原易位性增加,破坏肠道黏膜正常功能,刺激肠黏膜发生炎症反应,使促炎因子的表达增加,引发肠道炎症,而此时肠道加强免疫反应抵御有害菌侵袭又会加剧肠道菌群的紊乱,给肠道环境造成严重负担[33]。
在UC的发展过程中有众多炎症因子参与,其相互作用,介导细胞间的平衡而影响炎症的发展[34-36]。IL-6能介导炎性反应的发生,可作为UC疾病活动度的决定性影响因素并具有多重免疫调节功能[37]。TNF-α可作用于肠黏膜上皮细胞启动炎症反应[38]。IL-10可减弱炎症反应,并抑制由T细胞参与的有关免疫应答[39]。在本研究中,Model组小鼠血清促炎因子IL-6和TNF-α的表达升高而抑炎因子IL-10表达降低。在肠黏膜病理表现上也出现了大量的炎性细胞浸润且肠黏膜结构完整性丧失。而联合给药后可显著回调促炎因子的过度表达,提高抑炎因子的表达,同时显著修复肠黏膜病变,表现为炎性细胞浸润面积降低,恢复肠黏膜结构完整性。结果表明联合用药可通过改善肠黏膜病变以及炎症因子的表达保护肠道屏障,药理作用呈剂量相关。
从肠道菌群的变化来看,有研究表明,UC患者与正常人相比肠道菌群丰度降低且Firmicutes相对表达量降低而Bacteroidota相对表达量升高即表现为F/B比值降低,表明疾病处于活动期[40]。在本研究中,各组小鼠肠道差异菌门主要由Bacteroidota、Firmicutes、Proteobacteria、Desulfobacterota、Actinobacteriota等组成,Model组结果显示F/B比值降低而联合给药组F/B比值显著提高,调整了肠道菌群失衡的情况。通过肠道菌群alpha和beta多样性分析得出Model组小鼠肠道菌群结构发生显著变化,群落多样性降低,而联合给药组显著回调物种丰富度。从属水平肠道菌群组成来看,在联合给药后,Muribaculaceae、Lactobacillus、Lachnospiraceae_NK4A136_group、Alistipes、Roseburia丰度显著增多,而条件致病菌Bacteroides、Clostridia_UCG-014、Colidextribacter的丰度显著降低。有研究表明,TNF-α抑制剂治疗后能显著上调肠道菌群丰富度,增加Firmicutes、Lactobacillus和Roseburia的相对表达量,这些优势菌种能产生短链脂肪酸,影响结肠运动,减轻结肠炎症[41]。此外,也有研究证实,IL-6对于条件致病菌Colidextribacter的表达成正相关,与Lactobacillus的表达成负相关[42]。在本研究中,联合用药在下调TNF-α和IL-6的同时促进了上述优势菌群相对表达量的增加,下调了条件致病菌的表达水平,揭示了肠道菌群与炎症因子之间的相关性。
综上,GQD与益生菌联用可有效缓解DSS诱导的UC模型小鼠炎症反应及肠道菌群失调状态,从而修复肠道损伤,恢复肠道正常功能。本文只在炎症及肠道菌群层面进行研究,后续将继续对联合用药所触发的炎症通路及相关蛋白的表达情况进行扩展研究,更好地解释联合用药的药理机制,为疾病与药物治疗提供依据。

