鬼臼毒素脂质体的制备及其质量评价
张朗朗,戴粤湘,张涵,郭波红*,索绪斌*(.广东药科大学 药学院,广州 50006;.广东药科大学 中药学院,广州 50006)
鬼臼毒素(POD,结构式见图1)是从鬼臼属植物中分离出来的芳基四氢萘型木脂素,其具有抗肿瘤活性[1-2],抗肿瘤机制与阻断细胞的有丝分裂及抑制有丝分裂器中微管的组装有关[3]。研究表明,POD可用于治疗非小细胞肺癌、淋巴癌、白血病、前列腺癌等疾病[4-6]。但因POD难溶于水,生物利用度低且毒副作用较大,选择性较差,容易对健康组织产生影响,并且可能会导致一些严重不良反应,尤其是剧烈的胃肠道反应等,限制了其在抗肿瘤方面的应用。为克服这些缺陷,可将POD制备成纳米制剂[7-9]。脂质体可改善药物的生物利用度,减小对正常细胞的毒性,延长循环时间,并增强药物在肿瘤部位的靶向性以及对肿瘤细胞增殖和迁移的抑制作用[10]。脂质体能使药物集中于病灶部位并对病变细胞发挥治疗作用,还能提高药物的生物利用度以及降低药物的毒副作用。因此,本试验尝试制备鬼臼毒素脂质体(POD-Lps),并对其进行质量评价,为该药物的后续研究提供一定的依据。

图1 鬼臼毒素结构式Fig 1 Structure of podophyllotoxin
1 仪器与试药
1.1 仪器
SCL-10AVP型高效液相色谱仪(日本岛津公司);KQ5200B型超声波清洗器(昆山市超声仪器有限公司);DF-101S集热式恒温加热水浴锅、SHZ-D(Ⅲ)循环水式真空泵(巩义市予华仪器有限责任公司);JEM1230透射电镜(日本电子株式会社);TLEx-10脂质体挤出器(苏州艾特森制药设备有限公司);ME-204型电子分析天平(梅特勒-托利多仪器有限公司,d=0.01 mg);Winner802纳米粒度仪(济南微纳颗粒仪器股份有限公司);POWEREACH Zeta电位仪(上海中晨数字技术设备有限公司)。
1.2 试药
POD原料药(上海源叶生物科技有限公司,批号:S24887-5g,纯度≥98%);胆固醇(上海蓝季科技发展有限公司);卵磷脂(上海金伴药业有限公司);Sephadex G-50(Pharmacia公司,100~300 μm);甲醇为色谱纯;水为超纯水;其余试剂均为分析纯。
2 方法与结果
2.1 POD-Lps的制备
采用乙醇注入法制备POD-Lps:精密称取4.0 mg鬼臼毒素、8.0 mg胆固醇和120 mg卵磷脂于小烧杯中,加适量无水乙醇(约2 mL)并超声10 min至溶解完全后,将混合液缓慢匀速地注入水浴恒温55℃磁力搅拌的10 mL磷酸盐缓冲液(pH 5.8)中,再减压抽去无水乙醇后,经通有氮气的微孔滤膜(0.45 μm)挤出器挤出过滤2次,然后再更换0.2 μm微孔滤膜继续挤出2次,得乳白色的POD-Lps,于4℃中保存备用。
2.2 脂质体中鬼臼毒素的测定方法
2.2.1 色谱条件 色谱柱为Platisil-ODS(200 mm×4.6 mm,5 μm);流动相为甲醇-水=(70∶30);检测波长292 nm;流速1.0 mL·min-1;柱温为室温;进样量20 μL。
2.2.2 POD甲醇溶液的配制 精密称取POD原料药5.0 mg,置于25 mL量瓶中,加适量甲醇超声溶解完全后稀释并定容至刻度,摇匀,得POD储备液。精密量取2.0 mL储备液于10 mL量瓶中,加甲醇稀释至刻度,摇匀,即得POD甲醇溶液。
2.2.3 供试品溶液的配制 精密量取0.5 mL POD-Lps样品于10 mL量瓶中,加少量甲醇破乳后,缓冲液稀释并定容至刻度,摇匀,0.45 μm微孔滤膜过滤,即得。
2.2.4 空白脂质体溶液的配制 按“2.1”项下方法制备不含药物的空白脂质体。按“2.2.3”项下方法制备空白脂质体溶液。
2.3 方法学考察
2.3.1 专属性考察 分别取POD甲醇溶液、供试品溶液以及空白脂质体溶液20 μL,按“2.2.1”项下色谱条件进样分析,分别记录HPLC色谱图(见图2)。结果在该色谱条件下,空白脂质体对POD的测定没有干扰,专属性较好。
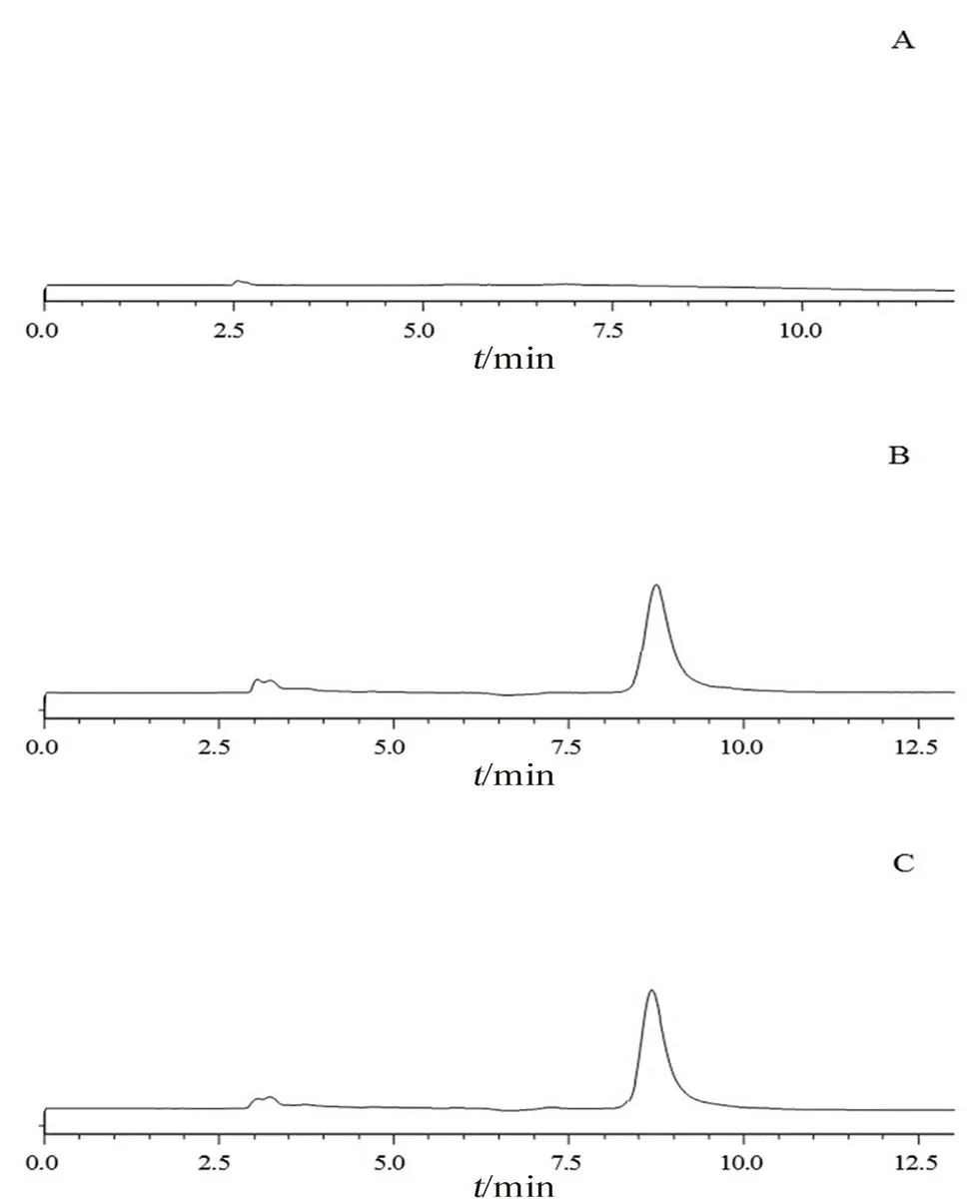
图2 POD-Lps的HPLC色谱图Fig 2 HPLC chromatogram of POD-Lps
2.3.2 线性关系考察 精密量取“2.2.2”项下POD储备液适量并依次稀释,制成4.0、10、20、40、60、80、100 μg·mL-1的系列浓度线性溶液,进样分析,测定峰面积,以质量浓度(x)为横坐标、峰面积(y)为纵坐标进行线性回归,得线性回归方程y=2.036×107x+1.263×104,r=0.9993(n=7)。结果表明,POD质量浓度在4~100 μg·mL-1与峰面积的线性关系良好。
2.3.3 精密度试验 取POD甲醇溶液,按“2.2.1”项下色谱条件连续进样6次,记录峰面积。结果峰面积RSD值为0.58%,说明仪器精密度良好。
2.3.4 稳定性试验 取同一批POD-Lps,按“2.2.3”项下方法制备供试品溶液,于室温下放置0、2、4、8、12、24 h后,进样分析,记录峰面积。计算的RSD值为0.70%,表明供试品溶液在24 h内稳定性良好。
2.3.5 重复性试验 取同一批POD-Lps,按“2.2.3”项下方法平行制备6份供试品溶液,进样测定,记录峰面积并计算样品浓度。结果样品的平均质量浓度为39.7 µg·mL-1,RSD为1.2%,表明本方法重复性良好。
2.3.6 加样回收试验 精密量取“2.2.2”项下POD储备液1.0、2.0、3.0 mL各3份,分别加入含0.5 mL空白脂质体溶液的10 mL量瓶中,配制成低、中、高(20、40、60 μg·mL-1)3种浓度的溶液,进样测定并计算。结果低、中、高浓度平均回收率分别为99.9%、98.4%、100.1%,RSD分别为0.38%、0.76%、1.1%,表明该方法准确度较好。
2.4 Sephadex G-50凝胶柱色谱法分离POD-Lps和游离POD
2.4.1 脂质体分离洗脱曲线
① 葡聚糖凝胶的处理:精密称取3.0 g Sephadex G-50,用煮沸的蒸馏水溶胀并放置过夜,使用前用洗脱液充分溶胀6 h,超声脱气后装柱,柱内径约1.5 cm,柱高15 cm。
② 洗脱曲线:用磷酸盐缓冲液(pH 5.8)以1.0 mL·min-1的流速冲洗平衡柱子1 h。然后对葡聚糖凝胶柱进行空白脂质体预饱和,即精密移取空白脂质体溶液0.5 mL上柱,用洗脱液洗脱,收集乳浊液并重复3次。取“2.2.2”项下POD甲醇溶液作为游离POD溶液,分别精密吸取POD-Lps 0.5 mL和游离POD溶液0.2 mL上柱,以磷酸盐缓冲液(pH 5.8)洗脱,收集流份,每管收集1 mL,测定峰面积。以收集的管数为横坐标,峰面积为纵坐标,绘制POD-Lps的洗脱曲线,结果见图3。由洗脱曲线可知,POD-Lps在4~10 mL被洗脱出来,而游离POD则在14~21 mL被洗脱出来,表明脂质体和游离药物能够被很好地分离。

图3 POD-Lps的洗脱曲线Fig 3 Elution curve of POD-Lps
2.4.2 POD-Lps包封率的测定 精密吸取0.5 mL POD-Lps溶液于10 mL量瓶中,加少量甲醇破乳后,用缓冲液稀释并定容至刻度,0.45 μm微孔滤膜过滤,取续滤液进样分析,计算脂质体中POD的总浓度Cb;精密吸取POD-Lps溶液0.5 mL上柱,收集洗脱液,加少量甲醇破乳后,用缓冲液稀释并定容至10 mL,摇匀,0.45 μm微孔滤膜过滤后,取续滤液进样,计算包于脂质体中的POD浓度Ca,包封率(EE)根据以下公式计算:EE(%)=Ca/Cb×100%。
2.5 POD-Lps处方单因素考察
2.5.1 磷脂和胆固醇的质量比的考察 固定其他因素不变,精密称量4.0 mg POD和120 mg的卵磷脂,控制胆磷比分别为1∶5、1∶10、1∶15、1∶20、1∶25,按“2.1”项下方法制备脂质体,测定包封率和粒径,结果其对应包封率分别为27.84%、64.93%、83.47%、75.69%、58.76%,粒径分别为198.37、211.23、157.31、206.45、179.68 nm。综合考虑,选用1∶15的胆磷比进行后续处方优化。
2.5.2 药物和磷脂的质量比的考察 精密称取胆固醇8.0 mg和卵磷脂120 mg,固定其他因素不变,改变药物和磷脂的质量比分别为1∶10、1∶15、1∶20、1∶30、1∶40,测定包封率和粒径,结果其对应包封率分别为20.51%、45.86%、63.83%、87.57%、69.38%,粒径分别为237.46、211.69、197.52、142.71、131.23 nm。综合考虑,选择1∶30的质量比进行后续试验。
2.5.3 水相介质pH值考察 控制处方中其他因素不变,改变缓冲液的pH值,调节水相介质的pH值分别为4.0、5.0、5.8、7.0、7.6,考察pH值对包封率和粒径的影响,结果其对应包封率分别为29.43%、50.59%、85.76%、55.78%、37.35%,粒径测定结果相差不大。故选择pH值5.8的磷酸盐缓冲液作为水相介质。
2.5.4 水浴温度考察 控制处方中的其他因素不变,改变脂质体制备时的水浴温度(分别为35℃、45℃、50℃、55℃),并测定包封率和粒径。结果显示随着水浴温度的提高,包封率先下降后逐渐增大,55℃时达到85.25%;粒径逐渐减小,55℃时粒径减小至159.78 nm。故采用水浴温度55℃。
2.5.5 水相和油相的体积比考察 固定处方中其他因素不变,改变类脂溶液和缓冲液的体积比,分别为1∶2、1∶5、1∶8、1∶10,测定包封率和粒径,结果其对应包封率分别为81.24%、88.36%、79.69%、83.04%;粒径先减小后增大,1∶5时粒径达到最小,为141.25 nm。故选用水相和油相体积比1∶5的比例。
2.6 Box-Behnken响应面分析法
2.6.1 试验设计 根据单因素考察结果,选择对POD-Lps包封率影响较显著的3个因素作为考察对象,即胆磷比(A)、药脂比(B)、缓冲液pH值(C),以包封率为指标进行试验,Box-Behnken试验设计见表1。

表1 响应面因素水平表Tab 1 Factor and level of central response surface method
2.6.2 响应面数据分析结果 采用Design-ExpertV 10.0.4软件进行处理,结果见表2。以EE对A、B、C进行二次项式回归方程拟合。得到拟合方程:EE(%)=84.43-0.80A+3.72B-11.98C+0.09AB+2.09AC-1.03BC-5.71A2-8.27B2-34.57C2。结果表明,建立的模型P值小于0.01,失拟项水平不显著(P>0.05)。胆磷比(A)、药脂比(B)以及pH(C)对包封率的影响显著(P<0.05),各因素之间交互不显著(AB、BC、AC的P>0.05)。以包封率为评价指标的各因素交互作用响应图见图4。模型与实际情况拟合程度良好,对上述所建立的数学模型进行综合分析,保证包封率与拟合度均最高的前提下,最终确定了各因素的最佳取值:A=1∶14.49,B=1∶32.36,C=5.82。

表2 Box-Behnken响应面结果Tab 2 Results of Box-Behnken response surface analysis

图4 POD-Lps制备工艺各因素相互作用的响应面图Fig 4 Response surface of each factor for POD-Lps preparation
2.6.3 最优处方验证试验 按优化后处方,采用乙醇注入法以POD与磷脂质量比1∶32.36、胆固醇与磷脂质量比1∶14.49、缓冲液pH值5.82的条件制备3批POD-Lps。测得包封率分别为87.73%、85.49%、89.08%,接近模型预测值(85.92%),说明制备工艺可行且重复性良好。
2.7 POD-Lps的质量评价
2.7.1 POD-Lps包封率 取3批POD-Lps,按“2.4.2”项下方法测定包封率,结果其包封率为(87.43±1.8)%。
2.7.2 POD-Lps形态电镜观察 取适量最优制备条件制得的POD-Lps,蒸馏水稀释10倍后,将其滴于碳膜生物铜网表面,用滤纸吸掉多余混悬液,用1%磷钨酸负染30 s后晾干,干燥后在透射扫描电子显微镜(TEM)下观察并拍摄,结果如图5所示,POD-Lps呈球形或类球形,结构完整。

图5 POD-Lps电镜图Fig 5 Transmission electron micrograph of POD-Lps
2.7.3 粒径和Zeta电位 取POD-Lps,稀释10倍后取适量于样品池中,通过激光纳米粒度仪和Zeta电位仪对脂质体的粒径和Zeta电位进行测定,平行测定3次,见图6。结果显示,POD-Lps平均粒径为(139.12±9.81)nm,多分散系数(PDI)为(0.21±0.04),Zeta电位为(-26.37±0.36)mV。表明POD-Lps粒径分布均匀,且表面带负电。
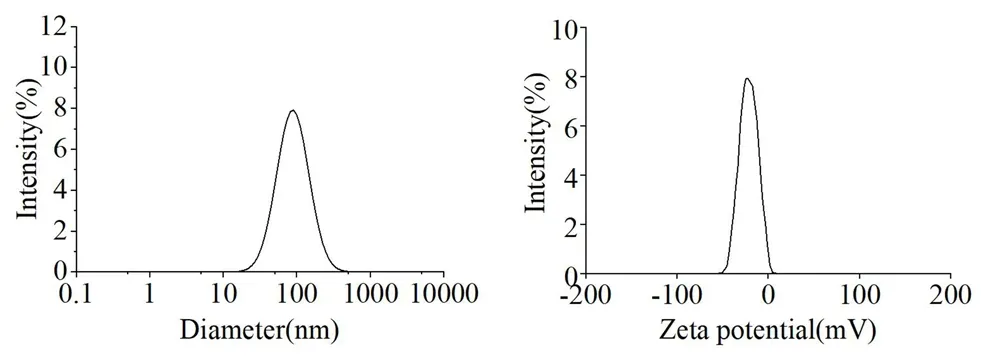
图6 POD-Lps的粒径分布和Zeta电位Fig 6 Particle size and Zeta potential of POD-Lps
2.7.4 体外释放试验 采用透析袋法测定体外释放度。取1 mg POD置于10 mL量瓶中,加无水乙醇溶解并稀释至刻度,作为POD溶液。分别取1 mL POD-Lps和1 mL POD溶液置预处理后的透析袋(MW=8000~14 000)中,夹紧两端,置于装有100 mL的含0.5%十二烷基硫酸钠(SDS)PBS缓冲液(pH 7.4)的烧杯中,然后于(37±2)℃水浴恒温振荡器中进行释放,转速为100 r·min-1,分别于0.5、1.0、2.0、4.0、6.0、8.0、12、24、36 h取出1 mL释放介质,同时补充1 mL新鲜释放介质。测定POD质量浓度并计算累计释放率(Q,%)。以Q对时间t绘制曲线并进行方程拟合,结果见表3,体外释放曲线见图7。结果表明游离POD溶液Q12h达到96%以上,POD-Lps释放缓慢,Q12h为60.73%;Q36h接近80%。拟合方程结果显示PODLps符合一级动力学模型(R2=0.979)。

表3 拟合方程Tab 3 Regression equation

图7 POD和POD-Lps的体外释放曲线Fig 7 In vitro release behaviors of POD and POD-Lps
2.7.5 脂质体稳定性考察 取2批POD-Lps,分别在25℃以及4℃条件下放置,再分别在0、15、30 d取样,观察外观性状,并测定包封率、粒径以及电位等参数,考察脂质体稳定性,结果见表4。POD-Lps在25℃条件下放置30 d后,可见样品有少量沉淀聚集,包封率明显下降,粒径及电位变化较大,PDI也明显升高。4℃条件下放置一个月的样品,包封率未有明显下降,粒径、Zeta电位以及PDI变化较小,观察外观没有沉淀聚集,说明4℃下的POD-Lps稳定性较好。

表4 POD-Lps稳定性考察结果Tab 4 Storage stability of POD-Lps
3 讨论
3.1 脂质体制备方法的考察
根据相关文献,POD-Lps的制备方法主要是薄膜水化超声分散法[11],暂无其他方法的报道。采用薄膜水化超声分散法制备POD-Lps时发现,旋转蒸发后成膜性较差且水化后所得脂质体的粒径较大,通过探头超声后,包封率显著降低。乙醇注入法是将磷脂溶解到有机溶剂中,并进一步将脂质分散到水相中。乙醇溶液在水相中立即被稀释,引起脂质分子析出并形成双层平面片段,进而转变为脂质体系统,可以直接得到粒径较小且均匀的脂质体[12]。该方法条件温和,试验过程中所用无水乙醇的量较少,可以减压挥发除去,避免了制剂中有机溶剂的残留。
分离脂质体和游离药物选择了葡聚糖凝胶柱色谱法。超滤法成本较高;微柱离心法操作较为麻烦且离心转速、时间以及温度都难以确定;透析法耗时长且操作难度较高[13]。本试验初期曾尝试采用离心法分离脂质体,但分离效果不佳,因此采用葡聚糖凝胶柱色谱法。葡聚糖凝胶G50有良好的亲水性、大网架结构以及无特异性吸附的特点,利用其分子筛原理可将脂质体和游离鬼臼毒素完全分离。在本试验中,通过用空白脂质体来预饱和凝胶,减少其对脂质体的吸附[14]。
3.2 脂质体包封率影响因素的考察
本试验中,药脂比以及缓冲液pH值对脂质体包封率的影响最为显著,随着药物浓度的升高,包封率先升高后下降。本试验通过摸索,发现磷酸盐缓冲液pH值在5.8时,可以得到包封率较高的POD-Lps。当pH值在5.0以下或6.0以上时,POD-Lps的包封率会显著降低,这可能是因为POD的结构中含有内酯环,在弱碱性和强酸性环境中不稳定,易发生开环水解[15],且磷脂最稳定的pH条件为6.5左右,太高或太低都容易使其水解。
综上所述,本试验成功以乙醇注入法将POD制备成脂质体,采用的处方与工艺简单可行、包封率较高、稳定性较好,可为后续POD-Lps的进一步研究提供参考。

