Nrf2调控的氧化应激在Adropin抑制低氧肺动脉平滑肌细胞增殖中的作用研究
陈昌贵,易春峰,王栋,余志华,贺立群(武汉市第一医院心血管内科,武汉 430022)
持续性低氧可导致肺血管重构,进而引起肺动脉血管阻力增加,过高的肺动脉阻力会导致肺动脉高压(PH)形成,长期过高的肺动脉压力会诱发患者出现难以控制的右心衰竭而死亡[1]。低氧肺动脉高压(HPH)是常见的PH类型。低氧导致的肺血管重构是HPH形成的基础,其病理改变主要表现为肺小动脉中膜及内膜增厚、细胞外基质沉积、管腔变窄甚至闭塞。氧化应激、炎症、内皮细胞功能障碍、肺动脉平滑肌细胞(PASMCs)过度增殖等促进低氧肺血管重构发生[2-3]。氧化应激能够通过促PASMCs过度增殖,导致肺血管重构发生,在HPH的发生发展中起至关重要的作用,通过抗氧化剂抑制氧化应激能够抑制PASMCs的增殖,从而抑制HPH形成[4-5]。核因子E2相关因子2(Nrf2)是一种参与氧化应激的关键转录因子,其在细胞核内与抗氧化响应元件结合促进下游抗氧化酶或蛋白的表达,发挥抗氧化作用[6]。Adropin是一种分泌蛋白,其由量动态平衡相关基因(Enho)编码,在人类、大鼠和小鼠中具有相同的氨基酸序列[7]。Adropin与细胞增殖、内皮细胞功能、氧化应激、炎症、能量代谢等密切相关[8-10]。研究发现Adropin可抑制主动脉平滑肌细胞(ASMCs)增殖及血管重构[8,11]。另有研究表明Adropin可激活Nrf2,抑制氧化应激,从而抑制非酒精性脂肪肝炎(NASH)[12]。而Adropin对低氧条件下PASMCs增殖及氧化应激的影响未见相关报道,因此本研究观察Adropin对低氧诱导的PASMCs增殖及氧化应激的影响,并探讨其可能的分子机制。
1 材料
1.1 实验动物
SPF级雄性SD大鼠,体重170~190 g [北京维通利华动物科技有限公司,动物生产许可证号:SCXK(京)2016-0006]。
1.2 仪器
Dmil Led倒置荧光显微镜(Leica公司);3131和311细胞培养箱 (Thermo公司);Synergy HT多功能酶标仪(Bio-tek公司);FACSCalibur型流式细胞仪(BD公司);Tanon-5200全自动化学发光分析仪(上海天能公司)。
1.3 试药
PBS(批号:P2272)、H2O2(批号:323381)、抗氧化剂N-乙酰半胱氨酸(NAC,批号:A0737)、Ⅰ型胶原酶(批号:SCR103)(Sigma公司);Nrf2激活剂富马酸二甲酯(DMF,批号:S2586)、Nrf2抑制剂ML385(批号:S8790)(Selleck公司);重组Adropin(菲尼克斯医药公司);CCK-8细胞增殖检测试剂盒(批号:CK04,Dojindo);活性氧(ROS,批号:S0033S)、超氧化物歧化酶(SOD,批号:S0101S)、谷胱甘肽过氧化物酶(GPx,批号:S0058)、过氧化氢酶(CAT,批号:S0051)、丙二醛(MDA,批号:S0131S)等检测试剂盒以及细胞核蛋白与细胞质蛋白抽提试剂盒(批号:P0028)(碧云天生物科技有限公司);DMEM/F12培养基(批号:SH30023)、胰蛋白酶(Trypsin,批号:SH30042)、胎牛血清(批号:SH30070)(Hyclone公司);细胞周期蛋白(Cyclin)D1(批号:55506)、Cyclin E(批号:20808)、Nrf2(批号:12721)、Lamin B1(批号:13435)、GADPH(批号:5174)等抗体(Cell Signaling Technology)。
2 方法
2.1 SD大鼠PASMCs原代培养
参考本研究课题组之前报道的方法[13],采用0.2%Ⅰ型胶原酶体外消化分离SD大鼠的PASMCs。用含10%胎牛血清DMEM/F12培养基培养PASMCs,当细胞传至第3~4代性状稳定后用于本研究。显微镜观察细胞为长梭形,显“峰-谷”状生长。通过免疫细胞化学法检测SM-α-actin鉴定PASMCs纯度[13](本研究细胞纯度>95%)。
2.2 实验分组
筛选Adropin抑制低氧诱导的PASMCs增殖及氧化应激最适浓度相关实验分为7组:对照组(PBS)、H2O2干预组(10 µmol·L-1H2O2)、低氧组(PBS+低氧)、NAC干预组(10 mmol·L-1NAC+低氧)、Adropin干预组[不同浓度的Adropin(100、300、1000 nmol·L-1)+低氧]。
Adropin抑制PASMCs增殖及氧化应激机制相关实验分为5组:对照组(PBS)、低氧组(PBS+低氧)、DMF干预组(75 µmol·L-1DMF +低氧)、Adropin干预组(1000 nmol·L-1Adropin+低氧)、Adropin+ML385干预组(1000 nmol·L-1Adropin+5 μmol·L-1ML385+低氧)。各组细胞在给予低氧刺激前用不含胎牛血清的DMEM/F12培养基培养24 h使细胞同步化。低氧模拟条件为1% O2、5% CO2和94% N2。常氧模拟条件为含5% CO2的空气。
2.3 CCK-8检测细胞增殖
PASMCs以5×103/孔接种于96孔板中,细胞经不同干预处理后,每孔加入10 μLCCK-8溶液后37℃继续孵育3 h,并设定空白组为对照(100 μLDMEM/F12培养基+10 μLCCK-8溶液),测定450 nm波长处吸光度(OD值),实验组细胞的相对增殖率(%)=[(OD实验组-OD空白组)/(OD对照组-OD空白组)×100%],每组重复6次。
2.4 细胞内ROS的检测
通过二乙酰二氯氢化荧光素(DCFH-DA)探针联合荧光酶标仪测定细胞内ROS水平。细胞接种于24孔板,各组细胞经不同干预措施处理后,吸出培养基,加入10 μmol·L-1无血清培养基稀释的DCFH-DA,37℃孵育20 min之后将培养基吸出,PBS洗涤3次后,置于荧光酶标仪(激发波长488 nm,发射波长525 nm)下检测ROS水平,每组重复6次。
2.5 试剂盒检测SOD、GPx、CAT、MDA的水平
细胞接种于6孔板,各组细胞经不同干预措施处理后,细胞裂解液或样品制备液充分裂解细胞后测定SOD、GPx、CAT、MDA的相对水平,通过BCA法测定细胞总蛋白浓度标准化实验结果,每组重复6次。
2.6 流式细胞仪检测细胞周期
用含10%胎牛血清的DMEM/F12培养基将PASMCs制作成细胞悬液,以1.5×105/孔接种于6孔板,不同干预处理后,胰酶消化收集细胞,70%乙醇固定后4℃过夜。离心后加入预冷的PBS重悬细胞,再次离心后弃上清液,加入碘化丙啶染色液,37℃避光孵育30 min,后冰浴避光保存,24 h内通过流式细胞仪检测细胞周期,每组重复3次。
2.7 Western blot检测Nrf2、Cyclin D1和Cyclin E表达
PASMCs以1.5×105/孔接种于60 mm培养皿,各组细胞经不同干预处理后,使用细胞裂解液裂解细胞,提取细胞总蛋白;使用细胞核蛋白与细胞质蛋白抽提试剂盒提取细胞核蛋白与细胞质蛋白,通过BCA法测定蛋白浓度。将各组细胞蛋白稀释成相同浓度,取等量蛋白加样(约15 μg),通过10% SDS-PAGE凝胶电泳后转移至硝化纤维素膜中,采用5%脱脂奶粉室温封闭2 h,洗膜后加入一抗(Nrf2、Cyclin D1和Cyclin E的稀释倍数为1∶1000,Lamin B1与GAPDH稀释倍数1∶2000),4℃孵育过夜。洗膜后加入二抗室温下孵育1 h,采用ECL法检测蛋白的相对表达,通过Tanon GIS软件处理数据,每组重复3次。
2.8 统计学处理
本研究数据采用SPSS 20.0统计软件进行分析,计量数据采用均数±标准差 (±s)表示,多组之间的比较采用单因素方差分析,组间两两比较采用LSD检验;P<0.05认为差异具有统计学意义。
3 结果
3.1 Adropin对低氧诱导的PASMCs增殖及ROS产生的影响
ROS激活剂H2O2(10 µmol·L-1)和低氧刺激PASMCs 24 h后,其增殖增强(P<0.05),抗氧化剂NAC(10 mmol·L-1)及不同浓度的Adropin(100、300、1000 nmol·L-1)干预24 h后均能够显著抑制PASMCs增殖(P<0.05),且随着Adropin浓度升高,其抑制细胞增殖作用增强(见图1A)。H2O2和低氧刺激PASMCs 24 h后,细胞内ROS产生增加,抗氧化剂NAC及不同浓度的Adropin干预24 h后可抑制细胞内ROS产生(P<0.05),且随着Adropin浓度升高其抑制ROS产生作用增强(见图1B),说明Adropin抑制低氧诱导的PASMCs增殖与抑制ROS产生有关。

图1 Adropin对低氧诱导的PASMCs增殖及ROS产生的影响(n=6)Fig 1 Effect of Adropin on the proliferation and ROS production in hypoxia-induced PASMCs(n=6)
3.2 Adropin对氧化应激的影响
低氧孵育PASMCs 24 h后,细胞核与细胞质Nrf2的表达均下调(P<0.05),Nrf2激活剂DMF(75 µmol·L-1)及Adropin干预均能促进细胞核及细胞质中Nrf2的表达(P<0.05),Nrf2抑制剂ML385能够逆转Adropin上调细胞核及细胞质中Nrf2表达的作用(P<0.05)(见图2)。低氧孵育PASMCs 24 h后,细胞内SOD、GPx和CAT的活性下降,MDA和ROS水平升高(P<0.05);DMF及Adropin干预后,细胞内SOD、GPx、CAT活性升高,MDA和ROS水平下降(P<0.05);而ML385(5 μmol·L-1)能够逆转Adropin抑制氧化应激的作用(P<0.05)(见图3)。
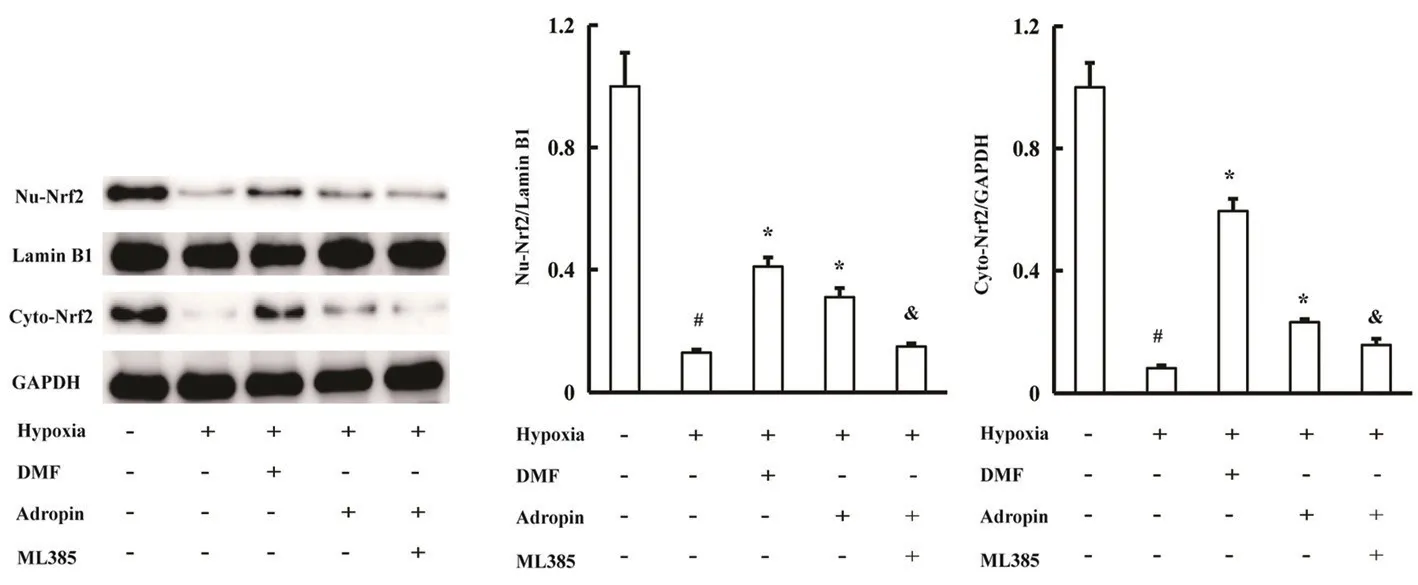
图2 Adropin对低氧诱导的PASMCs中Nrf2表达的影响(n=3)Fig 2 Effect of Adropin on the expression of Nrf2 in hypoxia-induced PASMCs(n=3)
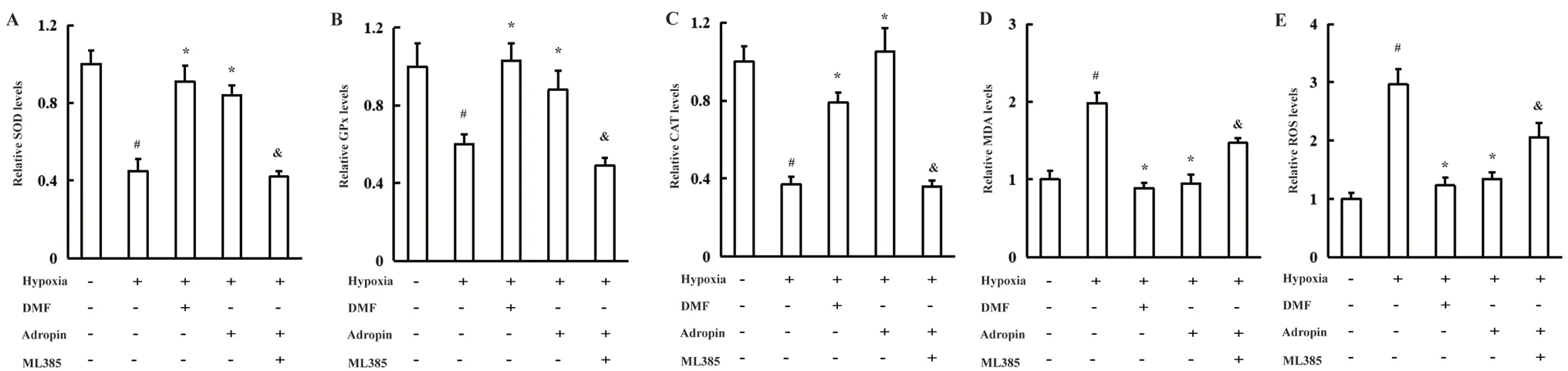
图3 Adropin对低氧诱导的PASMCs中氧化应激的影响(n=6)Fig 3 Effect of Adropin on the oxidative stress in hypoxia-induced PASMCs(n=6)
3.3 Adropin对细胞周期的影响
低氧孵育PASMCs 24 h,G0/G1期的PASMCs减少,S期+G2/M期的比例增多(P<0.05);DMF及Adropin干预后G0/G1期细胞比例增加,S期+G2/M期细胞比例减少(P<0.05);而ML385能够逆转Adropin阻滞细胞周期的作用(P<0.05)(见图4)。

图4 Adropinn对低氧诱导的PASMCs中细胞周期的影响(n=3)Fig 4 Effect of Adropin on the cell cycle progression in hypoxia-induced PASMCs(n=3)
3.4 Adropin对Cyclin D1和Cyclin E表达的影响
低氧刺激PASMCs 24 h后,Cyclin D1和Cyclin E的表达上调(P<0.05);DMF及Adropin干预后,Cyclin D1和Cyclin E的表达下调(P<0.05);而ML385能够逆转Adropin抑制Cyclin D1和Cyclin E表达的作用(P<0.05)(见图5)。

图5 Adropin对低氧诱导的PASMCs中Cyclin D1和Cyclin E表达的影响(n=3)Fig 5 Effect of Adropin on the expression of Cyclin D1 and Cyclin E in hypoxia-induced PASMCs(n=3)
3.5 Adropin对PASMCs增殖的影响
DMF及Adropin干预后能够抑制低氧诱导的PASMCs增殖,而ML385能够逆转Adropin抑制PASMCs增殖的作用(见图6)。
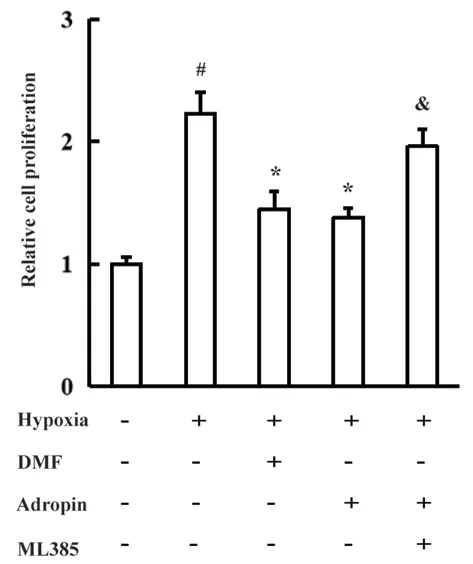
图6 Adropin对低氧诱导的PASMCs增殖的影响(n=6)Fig 6 Effect of Adropin on the proliferation in hypoxia-induced PASMCs(n=6)
4 讨论
本研究发现H2O2及低氧均能够诱导PASMCs增殖及ROS生成,不同浓度的Adropin(100、300、1000 nmol·L-1)及抗氧化剂NAC均可抑制低氧诱导PASMCs的增殖及ROS产生,且Adropin抑制PASMCs增殖及ROS产生的作用具有浓度依赖性。本研究还发现,Adropin和Nrf2激活剂DMF干预均可通过激活Nrf2上调PASMCs内SOD、GPx和CAT的活性,降低MDA与ROS水平,而Nrf2抑制剂ML385能够逆转Adropin上述作用。进一步研究表明,DMF和Adropin能够通过抑制Cyclin D1与Cyclin E的表达,阻滞细胞周期于G0/G1期,从而抑制PASMCs增殖,而ML385能够逆转Adropin上述作用。这说明Adropin通过抑制氧化应激,阻滞细胞周期,从而抑制低氧诱导的PASMCs增殖,其机制可能与激活Nrf2有关。
持续低氧可诱导PASMCs异常增殖,导致肺血管重构及HPH形成。体外研究发现,不同浓度的低氧(1%~10%)刺激PASMCs后,其增殖率与氧浓度成负相关[14],因此本研究采用1% O2诱导PASMCs增殖,建立细胞模型。细胞实验中发现Adropin可通过抑制ERK1/2活化抑制人ASMCs的增殖和迁移。动物实验发现,向Apoe-/-小鼠腹腔注射Adropin可抑制主动脉粥样硬化的发展,并减少斑块内单核细胞/巨噬细胞浸润和平滑肌细胞数量,抑制血管重构[8]。研究发现Adropin与冠心病患者冠状动脉内新生内膜面积成负相关,体外培养大鼠ASMCs发现,Adropin能够抑制血管紧张素Ⅱ(AngⅡ)诱导的ASMCs增殖[11]。本研究发现不同浓度的Adropin(100、300、1000 nmol·L-1)可抑制低氧诱导的PASMCs增殖,且具有浓度依赖性。
细胞增殖与细胞能否顺利通过细胞周期的各个阶段密切相关。G1期能否进入S期是决定细胞增殖的关键。一旦G1期细胞进入S期,细胞周期可正常进行,且不再受有丝分裂原调控。本研究表明,低氧能够诱导PASMCs有丝分裂增强,减少G0/G1期细胞比例,同时增加S+G2/M期的细胞比例,而Adropin干预后能够逆转低氧诱导PASMCs有丝分裂的作用,增加G0/G1期细胞比例,同时减少S+G2/M期的细胞比例。研究发现,Adropin能够通过阻滞细胞周期于G0/G1期,抑制AngⅡ诱导的RASMCs增殖[11]。Cyclin是细胞周期调控系统的关键蛋白。Cyclin E和Cyclin D1与细胞周期蛋白依赖蛋白(CDK)2和CDK4/6结合形成复合物促进G1期细胞进入S期,进而促进有丝分裂[15-16]。本研究发现Adropin可抑制Cyclin D1和Cyclin E的表达。因此推测,Adropin通过抑制Cyclin D1和Cyclin E的表达,抑制细胞周期进程,从而抑制低氧PASMCs增殖。
大量研究表明,氧化应激在PAH的发生发展中起着至关重要的作用。无论是PAH患者,还是野百合碱或低氧诱导的PH动物模型,均发现氧化应激明显增加[17]。ROS是参与氧化应激的主要分子之一,包括超氧阴离子(O2-)、羟基(OH-)、H2O2和次氯酸(HOCl)[18]。低氧能够通过下调抗氧化相关酶活性(SOD、GPx和SOD等)和上调NADPH氧化酶 (NOXs)活性,导致PASMCs产生过量的ROS,从而诱导氧化应激[19]。ROS是重要的细胞内信号分子,低水平ROS对维持细胞正常生理功能极为重要,病理条件下可使ROS的生成增强,诱导细胞增殖、凋亡抵抗。氧化应激能够通过促进炎症反应,损伤内皮细胞,促进PASMCs异常增殖,导致低氧肺血管重构发生,从而诱导HPH发生发展,通过抗氧化剂降低ROS水平后可抑制PASMCs增殖以及HPH形成[19-20]。此外,ROS可通过活化细胞内信号通路如ERK1/2和P38,促进PASMCs增殖[21-22]。SOD可将超氧化自由基分解为H2O2,GPx可以催化GSH与H2O2或其他有机过氧化物的反应,生成氧化型谷胱甘肽和H2O,CAT是H2O2酶,能够催化H2O2产生H2O与O2[18]。SOD缺乏时,PASMCs增殖增强,恢复SOD活性能够减轻肺动脉重塑[23-24]。氧化应激时能导致细胞脂质过氧化,而MDA是脂质过氧化的产物,其与氧化应激相关,PAH患者血清中MDA水平升高[25]。低氧能够诱导PASMCs内SOD、GPx和CAT活性下降,ROS和MDA水平升高,促进氧化应激,而通过药物抑制氧化应激能够抑制低氧诱导的PASMCs增殖[24,26]。本研究发现ROS激活剂H2O2及低氧均能够促进PASMCs的增殖及ROS生成,不同浓度的Adropin及抗氧化剂NAC均可抑制低氧诱导的PASMCs增殖及ROS产生,且Adropin抑制PASMCs增殖及ROS产生的作用具有浓度依赖性。进一步研究发现Adropin能够增强SOD、GPx和CAT活性,降低MDA水平。有研究表明Adropin可减轻棕榈酸诱导肝细胞和库普弗细胞内ROS产生,从而抑制NASH[10]。在糖尿病肾病小鼠模型研究中发现Adropin可抑制肾脏的氧化应激,改善肾功能[27]。在NASH小鼠模型中研究发现,敲除Adropin显著加剧了肝脏脂肪变性及氧化应激,而腹腔注射外源性Adropin可减轻肝细胞的氧化应激,抑制NASH的进展[12]。
Nfr2是参与氧化应激的关键转录因子。Keap1是Nrf2的抑制剂,在Nrf2活性的调节中起着关键作用。在细胞质内Nrf2与Keap1蛋白结合,活性受到抑制,并被降解。当Nrf2与Keap1解离后会进入细胞核,与抗氧化响应元件结合促进SOD、GPx和CAT等抗氧化蛋白的表达[6]。缺氧诱导PASMC内ROS产生,而ROS能够抑制Keap1与Nrf2在细胞质内解离,从而抑制Nrf2的激活[26,28]。使用siRNA敲除Nrf能显著促进PASMCs内ROS的产生,诱导PASMCs增殖[29]。在低氧诱导的PASMCs氧化应激模型中发现,Nrf2特异性抑制ML385能够抑制SOD、GPx和CAT活性,促进MDA及ROS产生[26]。在NASH模型研究中发现,Adropin可通过激活Nrf2,抑制氧化应激[12]。本研究发现Adropin或Nrf2激活剂DMF干预能够通过激活Nrf2,增强SOD、GPx和CAT活性,抑制氧化应激,并抑制Cyclin D1与Cyclin E的表达,进而阻滞细胞周期,抑制低氧条件下PASMCs的增殖,而Nrf2抑制剂ML385能够逆转Adropin上述作用。这说明Adropin可通过抑制氧化应激,抑制低氧诱导的PASMCs增殖,其机制可能与激活Nrf2有关。
综上,本研究首次发现Adropin可通过抑制氧化应激抑制低氧诱导的PASMCs增殖,其机制可能与激活Nrf2有关。Adropin可能是治疗和预防低氧肺血管重构新的药物。本研究单从细胞水平探讨Adropin对低氧肺血管重构的影响,下一步将在动物实验中验证Adropin对低氧诱导的HPH大鼠肺血管重构的影响,在动物水平探讨Adropin对低氧肺血管重构及氧化应激的影响。

