防控花生白绢病的根际放线菌分离鉴定及防效评价
职永玺, 何海荣, 周 琳, 高 飞, 何磊鸣, 赵 特, 杜鹏强*,
(1.河南农业大学 植物保护学院,郑州 450046;2.河南中医药大学 药学院,郑州 450046)
近年来,由齐整小核菌Sclerotium rolfsiiSacc.引起的花生白绢病危害严重,严重制约花生的生产,对花生产业造成巨大经济损失[1-2]。在我国,花生种植区域均有白绢病的发生,一般发病率在10%~30%,减产50%左右,温暖地区发病更为严重,甚至可导致绝收[3]。
当前防治花生白绢病主要依靠化学防治,但化学防治存在病菌抗药性、农药残留、污染环境等问题[4-5]。生物防治因具有安全、生态环保、可持续发展的特点成为了研究防治白绢病的重要方向[6-7]。根际微生物因受到根际分泌物的影响,与非根际微生物相比,其群落结构更加复杂,物种数量更加丰富,且在防治病害发生和增加植物抗病方面具有重要作用[8-9]。链霉菌是根际微生物的重要类群,通过分泌抗生素、细胞壁降解酶、诱导植物系统抗性等途径来防控植物病害[10-12]。例如,罗文建等从Streptomycessp.Strain LC-7 中发现一种氨基糖苷类抗生素,其对引起烟草青枯病的青枯雷尔氏菌有抑制活性[13];Palaniyandi 等研究证明,菌株StreptomycesphaeopurpureusExPro138产生的蛋白酶制剂具有抗真菌活性[14]。
药用植物能够产生多种活性化合物,根际微生物可以通过多种方式参与药用植物的生长发育、代谢过程以及活性成分的积累,对于药用植物的养分吸收和利用、土传病害防治、非生物胁迫应激等方面具有至关重要的作用[15]。因此,药用植物根际可作为分离筛选拮抗微生物的来源。怀牛膝Achyranthes bidentata属于苋科多年生草本植物,又称作山苋菜、对节菜,广泛种植于河南武陟、博爱、修武、沁阳等地,是中国“四大怀药”之一[16]。怀牛膝以根部入药,具有多种药用活性成分,包括皂苷类、多糖类和甾酮类等[17]。
目前,尽管关于花生白绢病的生物防治有一定的研究报道[18-21]。但是,关于从药用植物,特别是从怀牛膝的根际土壤中分离的拮抗放线菌对花生白绢病的防治效果研究还未见报道。鉴于此,本研究从河南中医药大学采集了怀牛膝的根际土壤,从中分离筛选出对花生白绢病病原菌有显著抑制作用的放线菌,通过16S rRNA 基因序列、形态学和生理生化特征确定其分类学地位,并研究其发酵液对白绢病菌菌丝和菌核的抑制作用,最后通过盆栽试验研究其对花生白绢病的防治效果及其对花生的促进生长效果,以期获得可用于花生白绢病生物防治的优良菌株。
1 材料与方法
1.1 供试材料
1.1.1 病原菌 齐整小核菌Sclerotium rolfsiiSacc.、禾谷镰孢菌Fusarium graminearum、假禾谷镰孢菌Fusarium pseudograminearum、尖孢镰刀菌Fusarium oxysporum、辣椒疫霉Phytophthora capsici、葡萄座腔菌Botryosphaeria dothidea和禾谷角担菌Ceratobasidium graminearum,均由河南农业大学植物保护学院新型农药创制和应用重点实验室提供。
1.1.2 植物材料 怀牛膝Achyranthes bidentata,采自河南中医药大学药用植物园 (34°32' N, 113°46'E)。花生品种为豫花22,由河南省农业科学院提供。
1.1.3 主要仪器和试剂 细菌基因组DNA 提取试剂盒,天根生化科技 (北京) 有限公司;PCR 扩增引物,生工生物工程 (上海) 股份有限公司;SW-CJ-2FD型无菌净化工作台,苏州安泰空气技术有限公司;DYY-6C 型PCR 扩增仪,迪图 (上海) 生物科技有限公司;GXZ 型智能光照培养箱,宁波江南仪器厂;QYC-200 型全温培养摇床,宁波江南仪器厂;5424R型冷冻离心机,北京宏达恒业科技有限公司。
99%萘啶酮酸(nalidixic acid),上海源叶生物科技有限公司提供,用1 mol/L 氢氧化钠溶液将其配制为质量浓度为20 mg/L 的溶液供试;94%放线菌酮(cycloheximide),北京索莱宝科技有限公司提供,用无水乙醇配制其质量浓度为50 mg/L的溶液供试;100 mg/mL 的溶菌酶(lysozyme),北京索莱宝科技有限公司;20 mg/mL溶菌酶缓冲液(lysozyme buffer),生工生物工程(上海)股份有限公司; 10%井冈霉素(jingangmycin)水剂,浙江桐庐汇丰生物科技有限公司。
1.1.4 培养基的配制 高氏一号、马铃薯葡萄糖固体培养基 (PDA)、马铃薯葡萄糖液体培养基(PDB)、腐殖酸培养基 (HV)、ISP 2、燕麦培养基(ISP 3)、ISP 4、ISP 5、发酵、马丁和查氏培养基参考文献方法[22-23]配制。
1.2 试验方法
1.2.1 放线菌的分离纯化 采用稀释涂布法分离放线菌株。称取1 g 怀牛膝根际土壤,与9 mL 无菌水混合,获得浓度为10-1的土壤溶液,用无菌水稀释至10-5、10-6和10-7倍。分别吸取土壤稀释液200 μL,涂布于含有萘啶酮酸 (20 mg/L) 和放线菌酮 (50 mg/L) 的高氏一号和HV 培养基上,28 ℃培养7~14 d。挑取单菌落在ISP 3 培养基上纯化。纯化后的放线菌用高氏一号液体培养基振荡培养后,与40%甘油按照体积比1 : 1 混合于试管中,置于 -20 ℃保存。
1.2.2 拮抗放线菌筛选 将齐整小核菌接种于PDA 平板并活化。使用灭菌牙签刮取放线菌,接种在距PDA 平板中央2 cm 处,28 ℃培养至菌落长出后,接种5 mm 齐整小核菌菌饼,以未接种放线菌的平板为对照,设置3 个重复,28 ℃黑暗培养3 d,观察病原菌菌丝生长情况,测量并按(1) 式计算抑制率 (I1)。
其中:DC为对照组菌落直径,cm;DT为处理组菌落直径,cm。
1.2.3 拮抗放线菌的鉴定
形态学观察和培养特征:将拮抗菌株划线接种于ISP 3 培养基上,将盖玻片倾斜插入培养基中,28 ℃培养7~10 d。待菌株长至盖玻片上,取出盖玻片,显微观察孢子链形态特征[24],并将拮抗放线菌分别接种至高氏一号和ISP 系列培养基上,28 ℃培养7~10 d,观察记录菌株生长情况、气生菌丝产生情况、气生菌丝与基内菌丝的颜色特征。
生理生化试验:碳氮源利用、过氧化氢酶测定、甲基红 (MR) 测定、乙酰甲基甲醇 (V-P) 测定、淀粉水解、明胶液化、硝酸盐还原、纤维素分解及牛奶凝固与胨化参照《常见细菌系统鉴定手册》[25]进行。
分子鉴定:使用细菌基因组DNA 提取试剂盒提取拮抗菌株的基因组DNA,使用16S rRNA 通用引物27F (5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′) 扩增目的片段。参考黄家锐等[26]的方法设置PCR 扩增体系和程序。将PCR 产物纯化后连接到pMD-19T 载体上,送到上海生工生物工程有限公司进行一代测序,将测序结果在EzBioCloud (https://www.ezbiocloud.net/identify)网站上进行相似性比对,选取其相似性较高的典型菌株利用MEGA 11软件通过Neighbor-Joining 法构建系统进化发育树。
1.2.4 拮抗放线菌对齐整小核菌的拮抗作用
1.2.4.1 拮抗放线菌发酵培养基的筛选 向长满孢子的放线菌斜面加入无菌水,将孢子刮入灭菌试管中,振荡,制备孢子悬液。取3 mL 孢子悬液分别加入到100 mL 高氏一号 (液体)、查氏、PDB、发酵和马丁培养基中,28 ℃、180 r/min 下培养7 d,得到发酵液。于12 000 r/min 下离心10 min,收集上清液,用0.22 μm 灭菌微孔过滤膜过滤,得到无菌发酵滤液。以V(无菌发酵滤液) :V(PDA) =1 : 4 混合倒板,以等量无菌水为对照,在平板中央接种齐整小核菌菌饼,28 ℃培养3 d 后测量抑菌直径,各处理重复3 次。选取抑菌活性最佳的培养基进行后续试验。
1.2.4.2 拮抗放线菌无菌发酵滤液对齐整小核菌菌丝生长与菌核萌发的抑制
对菌丝生长的抑制作用:采用菌丝生长速率法[27]测定。将发酵后的无菌发酵滤液原液、2 倍及4 倍稀释液,以V(无菌发酵滤液) :V(PDA) =1:4 混合倒板,于平板中央接种5 mm 齐整小核菌菌饼。每个发酵滤液浓度重复3 次,以等体积无菌水代替无菌发酵滤液为对照。于28 ℃黑暗培养72 h 后观察无菌发酵滤液对齐整小核菌的抑菌作用,十字交叉法测量菌落直径,并按 (2) 式计算抑制率 (I2)。
其中:D0为对照菌落直径,cm;Dt为处理菌落直径,cm。
对菌核形成的抑制作用:将上述测量过菌落直径的平板,放置于28 ℃继续培养30 d 后,记录不同处理产菌核个数,菌核烘干后称其干重[27-28],分别按照 (3)、 (4) 式计算无菌发酵滤液对菌核数量和干重的抑制率。
其中:R1为菌核数量抑制率;N0为对照菌核数量;Nt为处理菌核数量。
其中:R2为菌核干重抑制率;m0为对照菌核干重,mg;mt为处理菌核干重,mg。
1.2.4.3 拮抗放线菌无菌发酵滤液对齐整小核菌菌核萌发的影响 参照1.2.4.1 节制备抑菌活性最佳的无菌发酵滤液。以V(无菌发酵滤液) :V(PDA)=1 : 4 混合倒板,将菌核接种到平板上,以等体积无菌水为对照。每皿接种20 粒菌核,于28℃黑暗培养3 d,每24 h 观察一次菌核萌发情况,观察拮抗菌株无菌发酵滤液对菌核萌发的影响[28]。
1.2.5 拮抗放线菌无菌发酵滤液抗菌谱研究 参照1.2.4.1 节制备抑菌活性最佳的无菌发酵滤液。以V(无菌发酵滤液) :V(PDA)=1:4 混合倒板,将活化好的病原菌禾谷镰孢菌、假禾谷镰孢菌、尖孢镰刀菌、辣椒疫霉菌、葡萄座腔菌和禾谷角担菌制成5 mm 菌饼,接种于平板中央。以无菌水代替无菌发酵滤液为对照,每处理3 个重复。于28℃黑暗培养,待对照长满平板时,采用十字交叉法测量菌丝直径,按 (1) 式计算无菌发酵滤液对不同病原菌的抑制率。
1.2.6 拮抗放线菌发酵液对花生白绢病的防治效果及对花生生长的促进作用
1.2.6.1 防治效果测定 采用盆栽试验法。选取饱满度一致的花生种子,用75% 酒精消毒2 min,无菌水冲洗3~5 次,播种于装有基质土的小盆中,每盆两粒种子,待花生出芽生长2 d 后,选取长势一致的花生植株,做后续处理。按照1.2.4.1节方法制备拮抗菌株抑菌活性最佳的发酵液。将3 mL 菌株Soil-1-5 的孢子悬液加入到100 mL PDB 中,同时将3 mL 菌株Soil-3-28 的孢子悬液加入到100 mL 高氏一号液体培养基中,于28 ℃、180 r/min 下培养7 d。通过稀释涂布平板计数法,计算出菌株Soil-1-5 和Soil-3-28 发酵液的原始浓度分别为1013和1011cfu/mL,再使用无菌发酵培养基将两株拮抗菌发酵液浓度调约为108cfu/mL。试验共设置4 个处理,处理1 (CK):接种病原菌 +灌根无菌水,每株10 mL;处理2:接种病原菌 +灌根10%井冈霉素水剂 (200 mg/L),每株10 mL;处理3:接种病原菌 + 灌根浓度为108cfu/mL 的Soil-1-5 发酵液,每株10 mL;处理4:接种病原菌 + 灌根浓度为108cfu/mL 的Soil-3-28 发酵液,每株10 mL。每株花生植株茎基部接种齐整小核菌菌饼,定殖侵染2 d 后,浇灌无菌水、井冈霉素和拮抗菌株发酵液。每处理3 个重复,每个重复10 株花生。7 d 后观察花生发病情况,记录发病等级,分别按公式 (5) 和公式 (6) 计算病情指数和防治效果。
参考董炜博等[29]的病害分级标准并稍加更改:0 级,植株无症状;1 级,仅在茎基部产生病斑;3 级,茎基部产生缢缩症状,最后1/3 以下的植株表现系统症状 (枯萎、死亡、萎蔫等);5 级,最终2/3 以下的植株表现系统症状 (枯萎、死亡、萎蔫等);7 级,最终2/3 以上的植株表现系统症状 (枯萎、死亡、萎蔫等);9 级,最终整株枯死。
其中:M为病情指数 (M0为对照,Mt为处理);N为调查总株数;n为各级病株数;L为最高级代表值;l为各级代表值;E为防治效果。
1.2.6.2 对花生生长的促进作用测定 按照
1.2.6.1 节的方法种植花生,并浇灌浓度为108cfu/mL 的拮抗菌发酵液,每株10 mL。以等体积无菌水为对照。培养7 d 后,测定花生的生长指标,包括株高、根长、地上部鲜重、地下鲜重以及地上部干重和地下部干重 (75 ℃烘干至恒重)[30]。
1.2.7 拮抗放线菌促生功能测定 参照甘霖[31]方法配制Salkowski 比色液,采用Salkowski 比色法测定拮抗放线菌分泌吲哚乙酸 (IAA) 的能力;参照白娟娈的方法[32]进行拮抗放线菌解磷能力和产氨能力测定。
1.3 数据分析
所得结果采用SPSS 20.0 软件进行差异显著性检验,计算方法是最小显著性差异法 (Least Significant Difference, LSD)。
2 结果与分析
2.1 拮抗放线菌的分离及筛选
从怀牛膝根际土壤中分离纯化得到116 株放线菌,通过与齐整小核菌的平板对峙试验,得到两株抑菌活性较好且稳定的菌株Soil-1-5 和Soil-3-28,抑制率分别为80.43%和92.34% (图1),且两株放线菌对其他供试病原菌也有较好拮抗作用 (图2)。
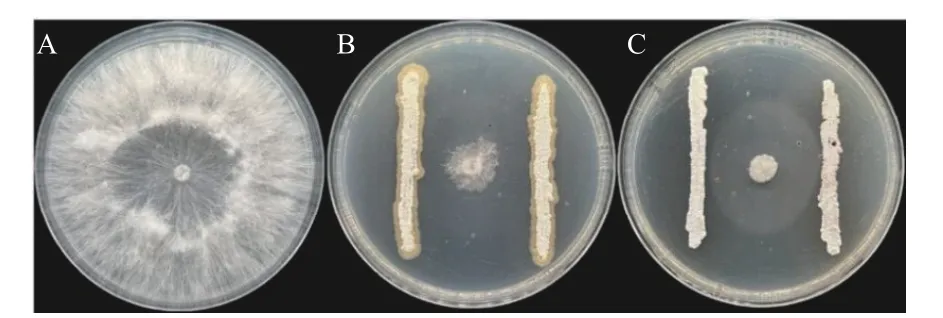
图1 菌株Soil-1-5 和Soil-3-28 对齐整小核菌的抑制效果(PDA 培养基)Fig.1 Inhibitory effect of Soil-1-5 and Soil-3-28 strains on Sclerotium rolfsii Sacc.(PDA medium)
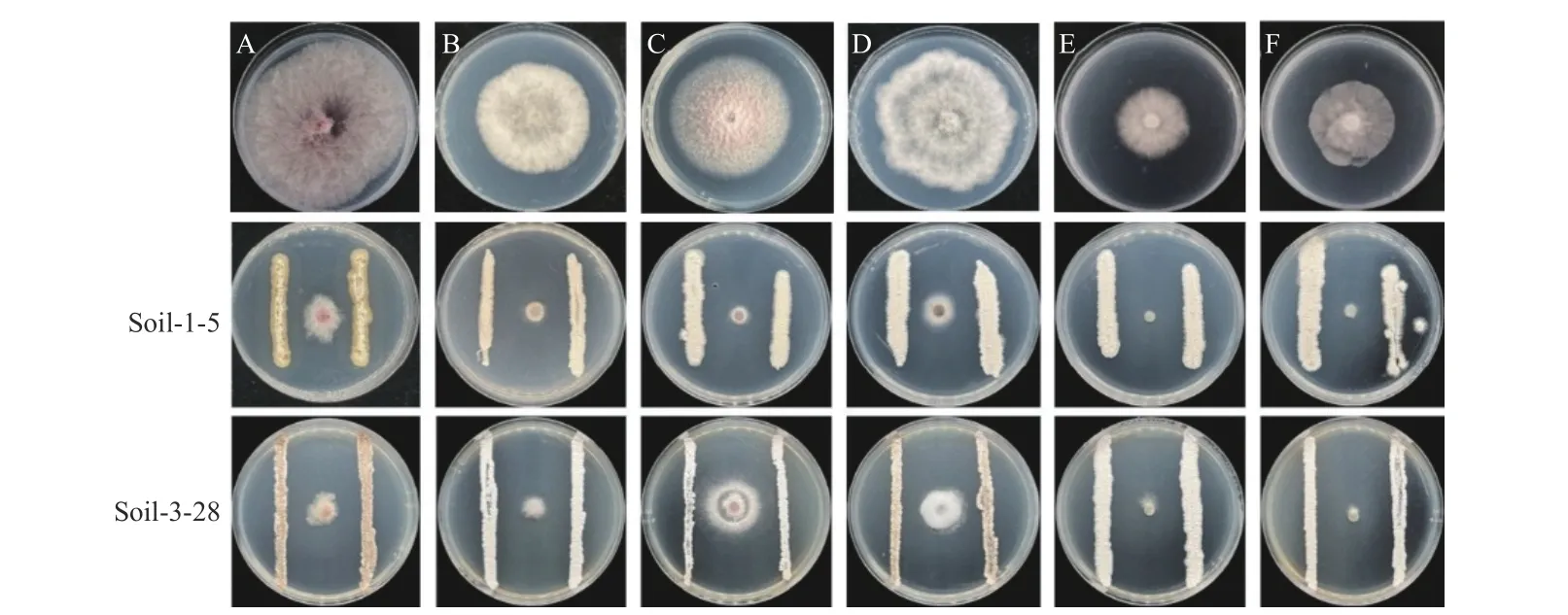
图2 菌株Soil-1-5 和Soil-3-28 对其他植物病原菌的抑制效果 (PDA 培养基)Fig.2 Inhibitory effect of strain Soil-1-5 and Soil-3-28 on other plant pathogens (PDA medium)
2.2 形态学观察和培养特征
菌株Soil-1-5 在ISP 3 培养基上生长状态良好,菌落表面褶皱干燥,气生菌丝灰白,基内菌丝呈棕色,孢子丝呈半螺旋状态;菌株Soil-3-28 在高氏一号培养基上生长状态良好,气生菌丝白色,基内菌丝为砖红色,孢子丝呈螺旋和半螺旋状态 (图3)。两株放线菌在其他培养基培养特征见表1。
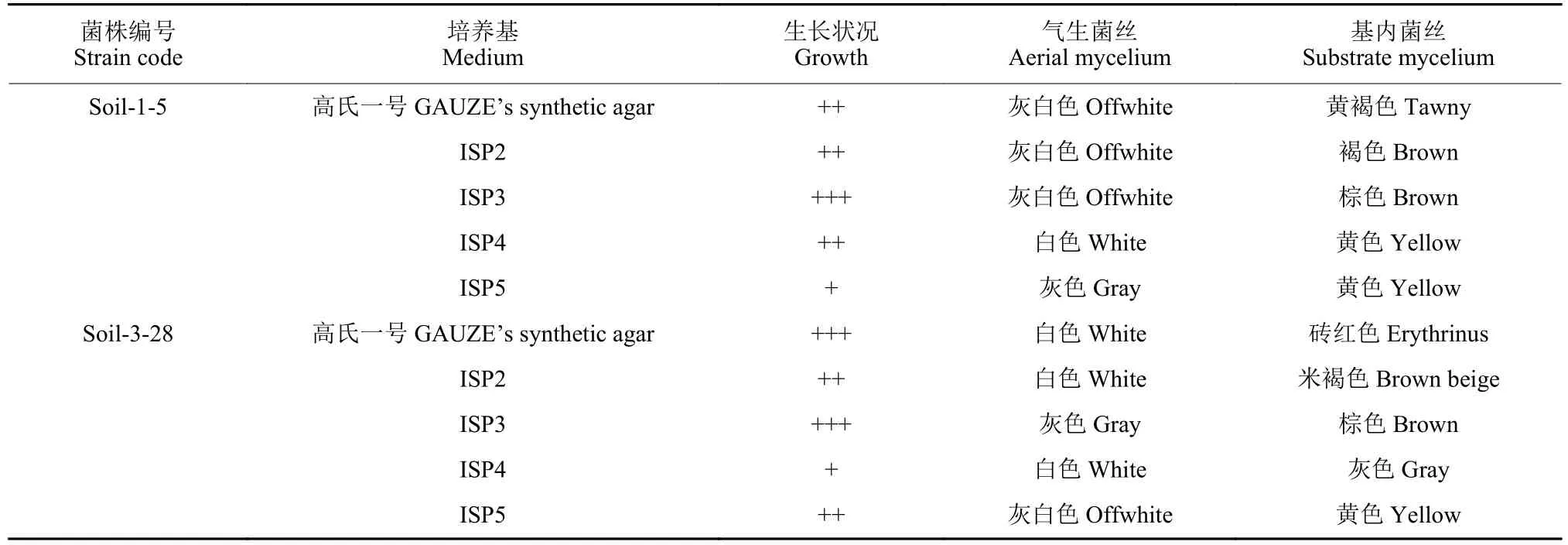
表1 拮抗放线菌的培养特征观察Table 1 Observation of culture characteristics of antagonistic actinomycetes

图3 菌株Soil-1-5 and Soil-3-28 的形态特征Fig.3 Morphological characteristics of strain Soil-1-5 and Soil-3-28
2.3 生理生化试验特征
菌株Soil-3-28 利用葡萄糖、阿拉伯糖、木糖、果糖、蔗糖、鼠李糖、肌醇、甘露醇、半乳糖、乳糖、麦芽糖,不能利用纤维素和山梨醇作为唯一的碳源;能够利用蛋白胨、肌酸、硝酸钾和精氨酸作为唯一的氮源。菌株Soil-1-5 利用葡萄糖、木糖、蔗糖、麦芽糖、鼠李糖、甘露醇、乳糖、半乳糖、肌醇和纤维素,不能利用阿拉伯糖和果糖为唯一碳源;利用蛋白胨、硝酸钾和精氨酸,不能利用肌酸作为唯一氮源。菌株Soil-1-5和Soil-3-28 其他生理生化指标特征结果见表2。

表2 菌株Soil-1-5 和Soil-3-28 的生理生化特征Table 2 Physiological and biochemical characteristics of strain Soil-1-5 and Soil-3-28
2.4 基于16S rRNA 基因的进化发育分析
对拮抗放线菌Soil-1-5 和Soil-3-28 进行16S rRNA 基因测序,其在NCBI 上的GenBank 序列编号分别为OP679872 和OP679795。将拮抗放线菌Soil-3-28 和Soil-1-5 的16S rRNA 基因序列分别在EzBioCloud (https://www.ezbiocloud.net/identify)上进行比对,发现Soil-3-28 的最高相似性菌株为Streptomyces luteogriseusNBRC 13402 (99.65%);Soil-1-5 的最高相似性菌株为Streptomyces scabieiNRRL B-16523 (99.30%)。分别对菌株Soil-1-5 和Soil-3-28 进行系统发育分析 (图4,图5),发现Soil-1-5 与相似性最高的Streptomyces scabieiNRRL B-16523 在同一个分支上;菌株Soil-3-28 与其相似性最高的菌株S.luteogriseusNBRC 13402 以及相似性较高菌株Streptomyces tibetensisXZ 46 (98.87%)在同一个分支上,且与S.luteogriseusNBRC 13402 距离最近。结合形态特征,生理生化特征以及分子特征,初步将菌株Soil-1-5 鉴定为疮痂链霉菌Streptomyces scabiei,菌株Soil-3-28 鉴定为藤黄灰链霉菌Streptomyces luteogriseus。
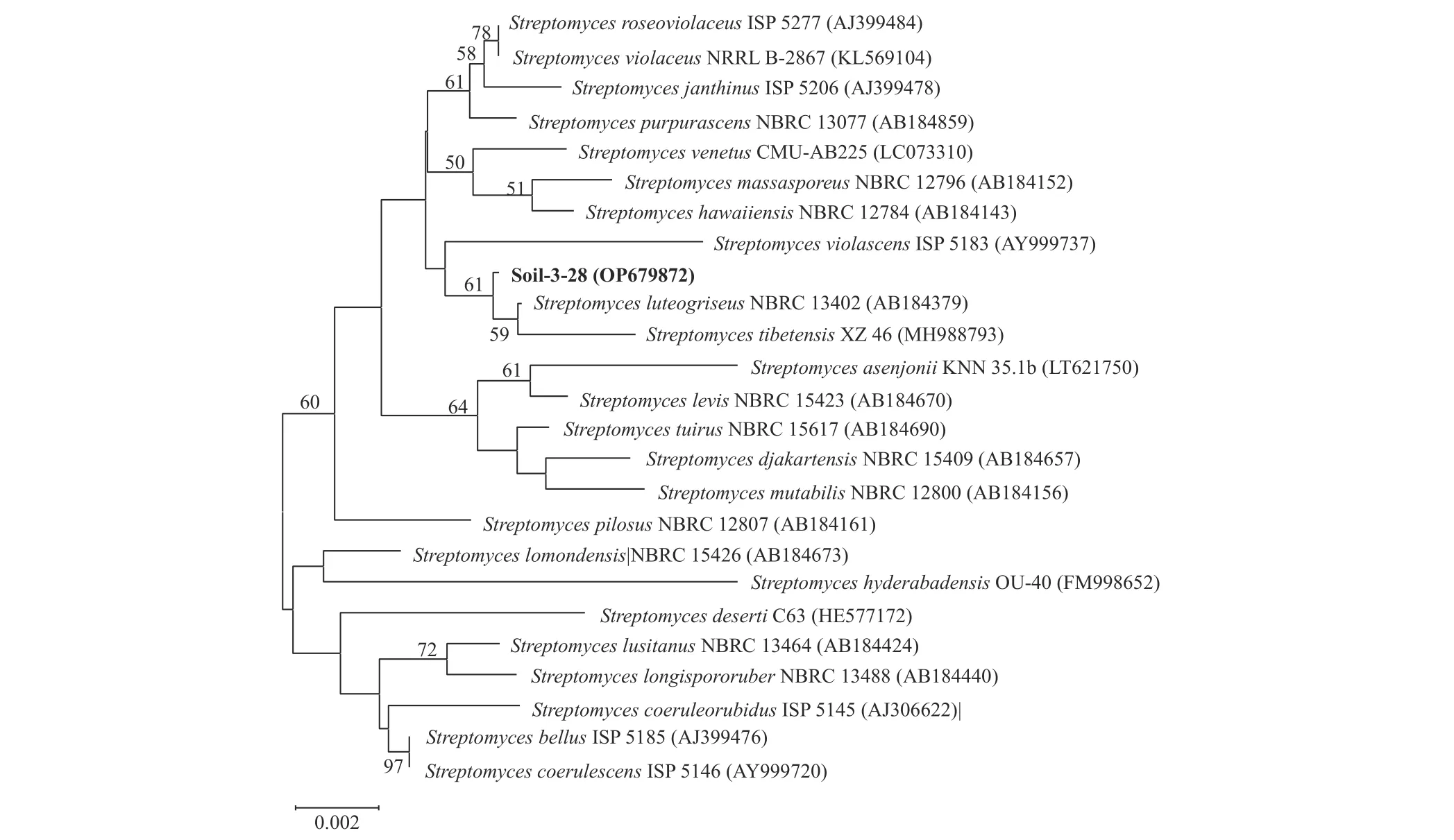
图4 基于菌株Soil-3-28 的16S rRNA 序列用邻近法构建系统发育树Fig.4 Neighbour-joining tree showing the phylogenetic position of strain Soil-3-28 and related taxa based on 16S rRNA gene sequences

图5 基于菌株Soil-1-5 的16S rRNA 序列用邻近法构建系统发育树Fig.5 Neighbour-joining tree showing the phylogenetic position of strain Soil-1-5 and related taxa based on 16S rRNA gene sequences
2.5 拮抗放线菌发酵培养基筛选
将花生白绢病病菌接种到不同发酵培养基的平板上,两株拮抗放线菌在5 种培养基中均可产生抑制花生白绢病病原菌生长的活性代谢产物,不同发酵培养基对齐整小核菌的抑制效果的统计结果见图6。菌株Soil-1-5 在PDB 培养基中无菌发酵滤液的抑菌活性最佳,抑菌直径为5.98 cm;菌株Soil-3-28 在高氏一号液体培养基中无菌发酵滤液的抑菌活性最佳,抑菌直径为4.60 cm。
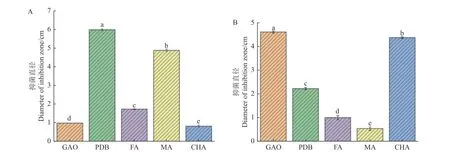
图6 不同培养基的无菌发酵滤液抑菌活性Fig.6 Inhibition of aseptic fermentation filtrate in different mediums
2.6 拮抗放线菌无菌发酵滤液对齐整小核菌菌丝生长的抑制
把无菌发酵滤液原液及2、4 倍稀释液与PDA按体积比1 : 4 混合倒板后,得到最终稀释为5、10、20 倍发酵液平板,将白绢病菌接种在平板上观察不同稀释倍数发酵液对白绢病的抑制效果。结果(表3) 显示:菌株Soil-1-5 无菌发酵滤液在稀释5、10、20 倍时,对齐整小核菌菌丝生长的抑制率分别为73.67%、51.80%、38.00%;菌株Soil-3-28 无菌发酵滤液的抑制率分别为57.11%、42.25%和30.79%。两株拮抗菌发酵液均呈现随稀释倍数增加抑菌率降低的趋势。图7 为拮抗菌株稀释5 倍发酵液平板对花生白绢病菌菌丝生长的影响。

表3 无菌发酵滤液不同稀释液对齐整小核菌菌丝生长的抑制率Table 3 Inhibition rate of aseptic fermentation filtrate to mycelial growth of Sclerotium rolfsii Sacc.
2.7 拮抗放线菌无菌发酵滤液对齐整小核菌菌核产生的抑制
将观察过无菌发酵滤液对菌丝生长抑制的齐整小核菌继续培养30 d,记录拮抗菌不同浓度的无菌发酵滤液对菌核形成的影响。结果表明:拮抗菌各浓度发酵滤液均对菌核形成产生了抑制作用,抑制菌核形成的能力随着稀释倍数的升高而降低 (图8 A)。在稀释5 倍时,菌株Soil-1-5 和菌株Soil-3-28 对菌核数量的抑制率最大,分别为78.08%和50.68% (图8 B),对菌核干重的抑制率为41.86%和34.68% (图8 C)。
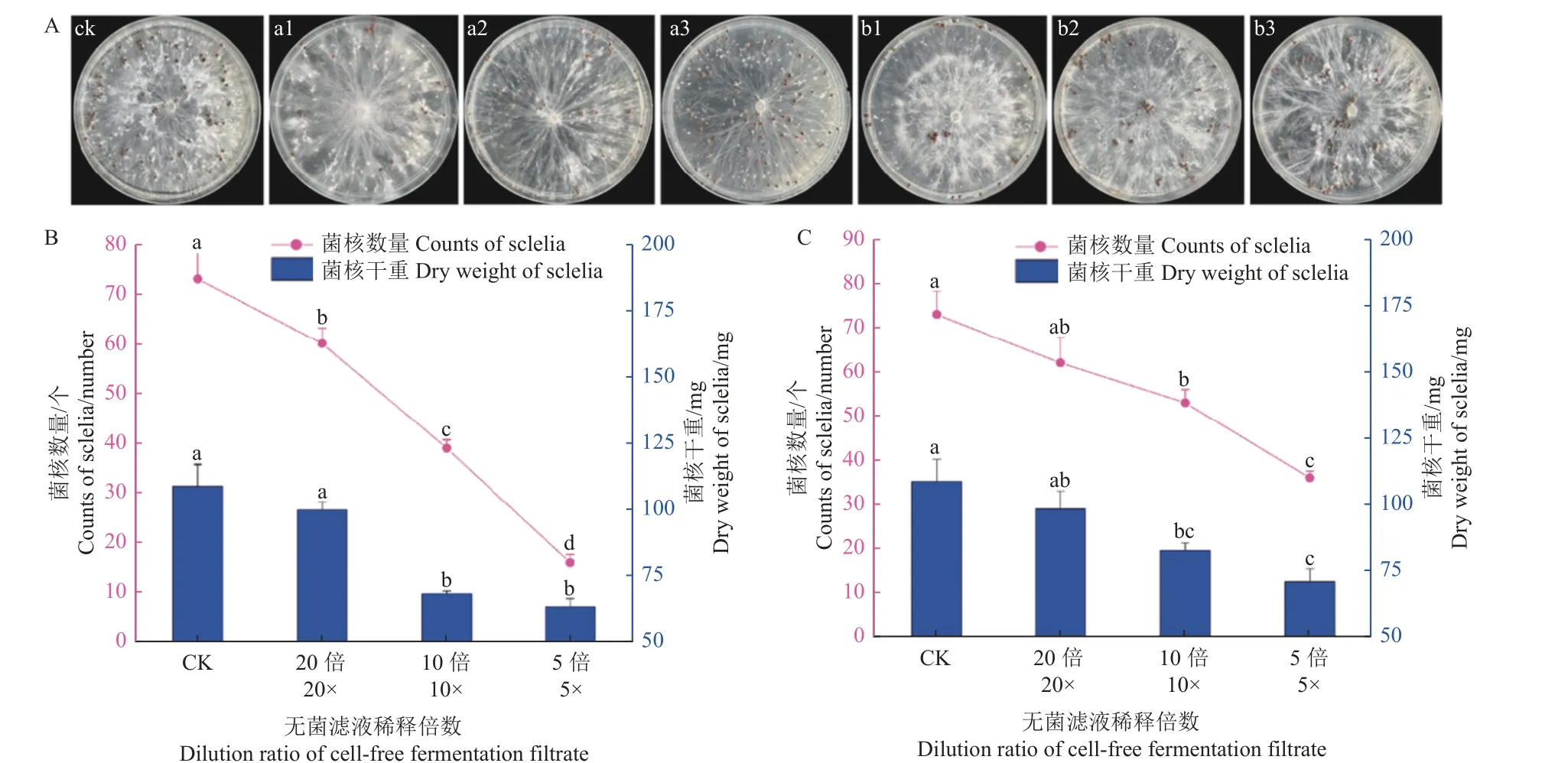
图8 无菌发酵滤液对齐整小核菌菌核形成的抑制Fig.8 Inhibition of the filtrate of aseptic fermentation on the formation of S. rolfsii
2.8 拮抗放线菌无菌发酵滤液对齐整小核菌菌核萌发的影响
由表4 和图9 可知,两株拮抗放线菌无菌发酵滤液对齐整小核菌菌核萌发均有抑制作用。在菌核培养48 h 时,菌株Soil-1-5 对菌核萌发的抑制率为41.67%,Soil-3-28 的抑制率为51.67%;随着培养时间的延长,两株拮抗放线菌对菌核萌发抑制率均先升高后降低。

表4 无菌发酵滤液对齐整小核菌菌核萌发的抑制Table 4 Inhibition of the filtrate of aseptic fermentation on the germination of sclerotium of S. rolfsii
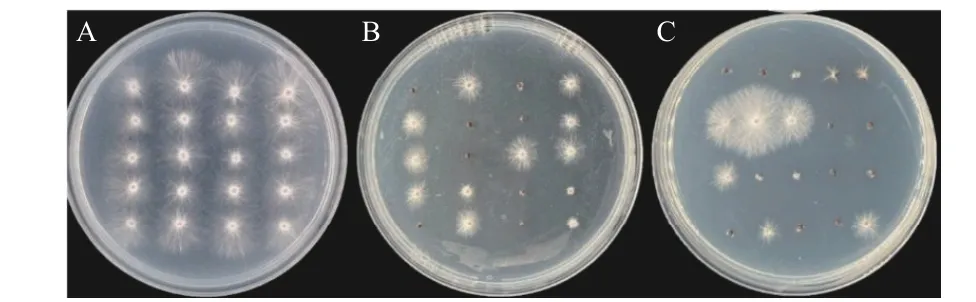
图9 无菌发酵滤液对齐整小核菌菌核萌发的影响(48 h)Fig.9 Effect of aseptic fermentation filtrate on the germination of sclerotium of Sclerotium rolfsii(48 h)
2.9 拮抗放线菌无菌发酵滤液抑菌广谱性研究
以V(无菌发酵滤液) :V(PDA) = 1 : 4 混合倒板,将6 种植物病原菌分别接种到平板上。经培养后发现,两株拮抗菌株对6 株病原菌均具有抑制作用 (表5),说明两株拮抗放线菌有抗菌广谱性,具有开发应用为生防菌的价值,其中菌株Soil-1-5 对禾谷镰孢菌、假禾谷镰孢菌、禾谷角担菌和葡萄座腔菌4 株病原菌的抑菌率在50% 以上,其中对禾谷角担菌的抑制率最佳,达84.24%。

表5 两株拮抗菌无菌发酵滤液对植物病原菌的抑制作用Table 5 Inhibition of sterile filtrate of two strains of antagonistic bacteria on plant pathogens after fermentation
2.10 拮抗放线菌发酵液对花生白绢病盆栽防控效果
盆栽试验结果 (图10 和表6) 显示:对照组花生发病严重,病情指数高达77.04。施用10 mL/株有效成分含量为10%的井冈霉素和10 mL/株浓度为108cfu/mL 的拮抗放线菌发酵液均对花生白绢病有防治效果。其中井冈霉素的防治效果为59.62%;菌株Soil-1-5 的防治效果为51.92%,菌株Soil-3-28 的防治效果为31.74%。

表6 拮抗放线菌防控花生白绢病盆栽试验效果Table 6 Pot experiment effect of antagonistic actinomycetes on control of peanut southern blight
2.11 拮抗放线菌发酵液对花生的促生效果
经放线菌发酵液灌根处理后,测量花生的根长、茎长、根鲜重、茎鲜重、根干重与茎干重,结果如表7 所示。菌株Soil-3-28 对花生促生效果较显著,所有测量指标均有所增长,而菌株Soil-1-5 发酵液处理无明显的促生效果。

表7 拮抗放线菌发酵液对花生植株的促生效果Table 7 Growth promotion effect of actinomycetes fermentation broth on peanut plants
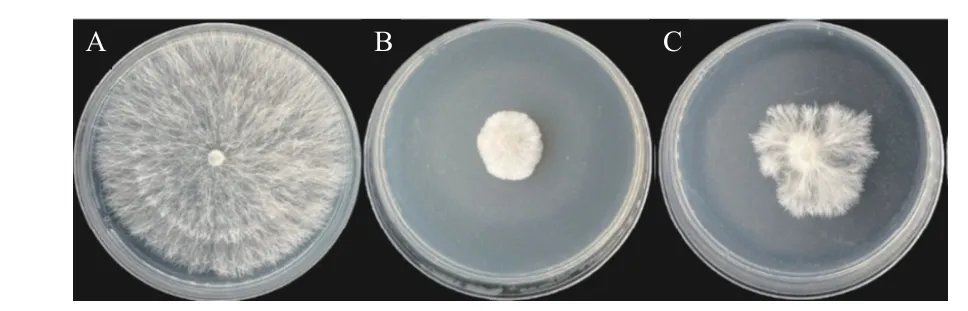
注:A 为对照,B 为菌株Soil-1-5,C 为菌株Soil-3-28。Note: A was the control, B was strain Soil-1-5, and C was strain Soil-3-28.
2.12 拮抗放线菌的促生功能
在产氨定性试验中,向Soil-3-28 培养物中加入Nesseler 试剂后,出现了阳性特征,处理组溶液变为棕黄色,表明菌株Soil-3-28 具有产氨能力(图11 A)。

图11 菌株Soil-3-28 促生潜在活性检测Fig.11 Detection of growth promoting potential activity of strain Soil-3-28
解磷定性试验中,菌株Soil-3-28 培养基中出现透明圈,说明其具有解磷活性,结果如图11 B所示。
试验发现,菌株Soil-3-28 具有产IAA 能力(图11C),故对其进行IAA 定量测定。根据IAA标准曲线图11D) 计算IAA 产量,其中x为OD530值,y为IAA 标准品质量浓度 (μg/mL),计算得菌株Soil-3-28 产IAA 量为 (18.29 ± 0.31) μg/mL。
3 结论与讨论
生防菌的应用是防治白绢病的重要途径之一[33]。植物根际微生物在促进植物生长、帮助植物获取养分、抵御植物病虫害以及增产等方面有十分重要的作用[34]。其中,根际放线菌能够产生抗菌抗虫等丰富的次级代谢产物,是生防菌的重要来源[35]。从罂粟、菊花、荨麻和珊瑚草等的根际土壤中也分离到多株能够产生抗菌活性物质的放线菌[36];其中菌株JT-2F、DT-3F 和JJ-3F 对引起珊瑚草叶片发病的炭疽菌具有较强的生物活性,且菌株JT-2F 被鉴定为Streptomyces tsukiyonensis,JT-2F 具有广谱的抗植物病原菌活性,其中抑制率最高可达86.75%[37]。因此,分离植物根际微生物,特别是根际放线菌对挖掘生防菌资源至关重要。
中药材是我国的特色药材,在中医药领域应用十分广泛,近年来,越来越多研究者将目光转移到中药材根际微生物的研究中。本研究从药用植物怀牛膝根际土壤中分离获得两株对花生白绢病菌有较强抑制活性的菌株Soil-1-5 和Soil-3-28,表现出较好的生防潜力。花生白绢病菌在田间主要靠菌核进行远距离传播和越冬,且菌核在土壤中存活时间长,但现有的研究多数为利用拮抗细菌抑制菌丝生长从而减少花生发病,少有测定拮抗细菌对菌核萌发和产生的抑制测定。结果发现,两株拮抗链霉菌无菌发酵滤液对花生白绢病菌丝生长有明显影响,能显著降低菌丝生长速率而且能够显著抑制菌核的形成。通过菌核萌发试验,也证明了两株拮抗菌株能够延缓菌核萌发。采用温室盆栽试验探究了两株拮抗菌株对花生白绢病的防治效果。结果表明,菌株Soil-1-5 发酵液的防治效果 (51.92%) 与井冈霉素的防治效果(59.62%) 接近,说明其具有极大的开发为生防菌的应用潜力。此外,根际微生物能够通过产生植物生长素、固氮作用、溶磷作用等方式促进植物的生长[38]。本研究通过盆栽促生试验,发现菌株Soil-3-28 能够显著促进花生植株的生长。通过对其促生因子进行探索,发现菌株Soil-3-28 具有解磷、产氨、产IAA 等促生潜在活性。因此,菌株Soil-1-5 和Soil-3-28 可作为防治花生白绢病和促进花生生长等方面的候选菌株。
近年来,根际链霉菌因能够产生抗生素,铁载体或诱导植物产生系统抗性而受到研究学者的关注[39]。本研究中对两株拮抗菌株进行了生理生化试验、形态学特征观察和16S rRNA 序列分析,初步鉴定两株菌为链霉菌,其中菌株Soil-1-5 为疮痂链霉菌S.scabiei,菌株Soil-3-28 为藤黄灰链霉菌S.luteogriseus。据报道,根际链霉菌具有抑菌广谱性,可同时对多种植物病原菌产生拮抗作用。如张建峰等从水稻根际土中分离出的StreptomycesTL-007 可抑制人参锈腐病菌、大豆灰霉病菌等6 种植物病原菌的生长[40];赖宝春等从辣椒根际土中分离出的菌株StreptomycesFX81,对草莓根腐病菌、黄瓜枯萎病菌等14 种植物病原菌也具有拮抗活性[41]。本研究中菌株Soil-1-5 和Soil-3-28 对禾谷镰孢菌、辣椒疫霉病菌等6 株供试菌株也有较好抑菌活性。证明两株链霉菌有较强的生防潜力,具有广谱的抑菌活性。
综上,本研究中所分离得到的放线菌菌株Soil-1-5 和Soil-3-28 对花生白绢病等多种植物病原菌具有较强拮抗作用,具有极大的开发潜力。但是,菌株对不同病原菌的田间防治效果、发酵条件的优化、次生代谢产物的抑菌活性以及抑菌机理等问题还待进一步研究。

