齐整小核菌SCL2010产小核菌多糖培养基优化的研究
张永刚,王 伟,张艳敏,董学前*
(山东省食品发酵工业研究设计院,山东 济南 250013)
齐整小核菌SCL2010产小核菌多糖培养基优化的研究
张永刚,王 伟,张艳敏,董学前*
(山东省食品发酵工业研究设计院,山东 济南 250013)
采用单因素和正交试验对小核菌多糖高产菌株齐整小核菌(Sclerotium rolfsii)SCL2010的培养基成分进行了深入地筛选与优化。结果表明,最佳培养基配方为葡萄糖45.0 g/L,玉米浆1.5 g/L,NaNO32.0 g/L,K2HPO4·3H2O 2.0 g/L,柠檬酸0.7 g/L,MgSO4·7H2O 1.5 g/L,KCl 2.0 g/L。在此优化条件下,小核菌多糖的产量为31.81 g/L,碳源转化率为70.69%。采用发酵罐进行小试放大试验,小核菌多糖的产量达到31.86 g/L,碳源转化率为70.80%,发酵液表观黏度达到4 500 mPa·s,并将发酵时间缩短至60 h左右,具有显著效果。
小核菌多糖;齐整小核菌;高产菌株;培养基;优化
小核菌多糖(scleroglucan)又称硬葡聚糖,小核菌胶是由丝状真菌齐整小核菌产生的非离子水溶性多糖,其分子是由含有β-D-(1,6)-葡萄糖残基侧链的线性β-D-(1,3)-葡萄糖残基链组成。小核菌多糖的显著特性是良好的流变性与稳定性,在广泛的pH(1~12)、矿化度(0~200 000 g/L)和温度(130℃)均具有良好的稳定性[1-3]。小核菌多糖在石油工业具有潜在的应用价值。在当前油田普遍进入三次、四次采用的趋势下,小核菌多糖在用于提高原油采收率的助剂方面具有广阔的市场前景[4-8]。但是,目前限制小核菌多糖应用的最主要因素是因为产量不高使其价格居高不下,这严重限制了其市场的开发拓展。因此,研究提高小核菌多糖的产率是相关研究的主要关注点。截止目前,已有通过高产菌株筛选诱变、培养基与发酵条件优化、发酵罐设计等提高小核菌多糖产量的相关研究[4,9-12]。
目前关于小核菌多糖发酵生产的相关研究所采用的菌株主要有齐整小核菌(Sclerotium rolfsii)ATCC 201126、ATCC 15205、MTCC 2156[12-14],发酵培养基成分基本相同,发酵碳源为蔗糖,有机氮源为酵母膏发酵产率多在20 g/L左右[15-17]。为提高小核菌多糖的发酵产率,筛选得一株显著高产小核菌多糖的丝状真菌,通过18SrDNA测序比对,该菌株属于齐整小核菌,命名为齐整小核菌(Sclerotium rolfsii)SCL2010。经初步发酵研究表明齐整小核菌SCL2010合成小核菌多糖的发酵过程与现有报道具有显著区别。在已有研究报道中,发酵液的pH变化基本一致,由4.5逐渐下降至2.0左右,而菌株SCL2010发酵过程中pH由初始的4.5迅速下降至2.8左右后缓慢回升至3.8,其高产特性可能与其独特的pH变化有关。本研究采用齐整小核菌SCL2010作为生产菌株,通过对发酵培养基的优化提出了适合于高产菌株齐整小核菌SCL2010发酵产小核菌多糖的培养基组成及其比例,为后续工业化制备奠定了良好的基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
齐整小核菌(Sclerotium rolfsii)SCL2010:已保藏于中国典型培养物保藏中心(China center for type culture collection,CCTCC),保藏编号:NO.M2014325。
1.1.2 化学试剂
葡萄糖、NaNO3、K2HPO4·3H2O、柠檬酸、MgSO4·7H2O、KCl、蔗糖、果糖等(均为分析纯):国药集团化学试剂有限公司;玉米淀粉、马铃薯淀粉、可溶性淀粉、玉米浆:西王集团有限公司;酵母膏、蛋白胨(均为生化试剂):安琪酵母股份有限公司。
1.1.3 培养基
发酵培养基:葡萄糖50.0 g/L,酵母膏2.0 g/L,NaNO32.0 g/L,K2HPO4·3H2O 1.0 g/L,柠檬酸0.7 g/L,MgSO4·7H2O 0.5 g/L,KCl 0.5 g/L,pH 4.5,115℃灭菌20 min。
1.2 仪器与设备
CF16RN台式高速离心机:日本日立公司;ZQWY-200振荡培养箱:上海知楚仪器有限公司;10 L自动生物反应器:上海百仑生物科技有限公司;FM200高剪切均质机:上海弗鲁克流体机械制造有限公司;GZX-9030MBE电热鼓风干燥箱:上海博迅实业有限公司;DV2T型黏度计:美国Brookfield公司。
1.3 方法
1.3.1 小核菌多糖摇瓶及发酵罐培养条件[4,11,16]
摇瓶发酵培养条件:摇瓶装液量80 mL/500 mL,接种量10%,发酵温度28℃,摇床转速300 r/min,发酵时间72 h。
发酵罐发酵培养条件:装液量60%,接种量10%,发酵温度28℃,搅拌转速350 r/min,发酵时间72 h。
1.3.2 小核菌多糖产量和生物量[16]
取10 mL发酵液中和后用蒸馏水稀释3~4倍,80℃水浴30 min,均质1~2 min后8 000×g离心30 min。上清液加两倍体积分数为95%的乙醇沉淀小核菌多糖,过滤后再用体积分数为95%的乙醇洗涤一次后所得沉淀在85℃条件下干燥,称质量测定小核菌多糖产量。离心所得沉淀用蒸馏水溶解洗涤后8 000×g离心30 min,所得沉淀在80℃条件下干燥至恒质量,称质量即为生物量。

1.3.3 分析测定
发酵液表观黏度采用DV2T型黏度计测定:64号转子,60 r/min、25℃。
1.0 %多糖溶液黏度采用DV2T型黏度计测定:63号转子,60 r/min、25℃。
采用斐林试剂法测定发酵液中的残糖量[18]。
1.3.4 小核菌多糖发酵培养基配方优化单因素试验
单因素试验采用摇瓶发酵条件,以小核菌多糖产量作为主要考察指标,根据不同实验要求选择增加其他辅助考察指标如生物量、1%多糖溶液黏度、残糖、碳源转化率、发酵液表观黏度等,考察不同的碳源(玉米淀粉、马铃薯淀粉、木薯淀粉、蔗糖、葡萄糖、麦芽糖、乳糖、可溶性淀粉、果糖)、葡萄糖添加量(35 g/L、40 g/L、45 g/L、50 g/L、55 g/L、60 g/L、65 g/L)、有机氮源(酵母膏、玉米浆、蛋白胨、大豆蛋白胨、水解豆粉)、玉米浆添加量(0.5 g/L、1.0 g/L、1.5 g/L、2.0 g/L、2.5 g/L、3.0 g/L)、无机盐添加量(NaNO3、K2HPO4、MgSO4、KCl)对小核菌多糖发酵的影响。
1.3.5 小核菌多糖发酵培养基配方优化正交试验
在单因素试验基础上,以多糖产量作为考察指标,以葡萄糖、玉米浆、K2HPO4和MgSO4添加量作为影响因素,采用4因素3水平正交试验设计进行培养基配方的进一步优化,正交试验因素与水平见表1。

表1 小核菌多糖发酵培养基配方优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for medium formula optimization of scleroglucan fermentation
2 结果与分析
2.1 碳源对发酵产小核菌多糖的影响
选择玉米淀粉、马铃薯淀粉、木薯淀粉、蔗糖、葡萄糖、麦芽糖、乳糖、可溶性淀粉、果糖等作为碳源,添加量均为30 g/L,发酵时间为72 h,考察不同碳源对发酵产小核菌多糖的影响,结果见图1。

图1 不同碳源对产小核菌多糖的影响Fig.1 Effects of different carbon sources on scleroglucan production
由图1可知,以玉米淀粉、马铃薯淀粉和葡萄糖作为碳源时,小核菌多糖的产量相对较高,蔗糖和木薯淀粉次之,其他碳源则不利于多糖的合成;蔗糖与葡萄糖作为碳源时,1.0%小核菌多糖溶液的黏度较高;玉米淀粉、马铃薯淀粉和木薯淀粉作为碳源时,菌体生物量较高。综合考虑小核菌多糖的产量与产品品质,选择葡萄糖作为菌株SCL2010发酵生产小核菌多糖的碳源。
2.2 葡萄糖添加量对发酵产小核菌多糖的影响
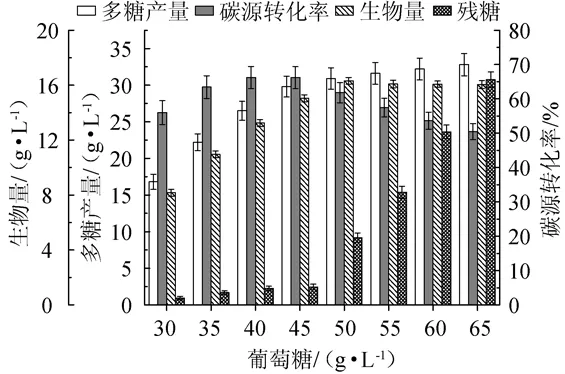
图2 不同的葡萄糖添加量对产小核菌多糖的影响Fig.2 Effects of different glucose addition on scleroglucan production
由图2可知,随着葡萄糖添加量的增加,小核菌多糖产量呈上升趋势;当葡萄糖添加量为45 g/L时,小核菌多糖产量达到29.80 g/L,生物量为15.04 g/L,碳源转化率达到66.2%;但当葡萄糖添加量>45 g/L后,多糖产量增加放缓,碳源转化率开始显著下降,残糖量急剧上升。因此,该菌株发酵生产小核菌多糖适宜葡萄糖添加量为45 g/L。
2.3 有机氮源对发酵产小核菌多糖的影响

图3 不同有机氮源对产小核菌多糖的影响Fig.3 Effects of different organic nitrogen sources on scleroglucan production
由图3可知,当以玉米浆为有机氮源时,小核菌多糖产量和菌体生物量分别达到28.51 g/L和10.72 g/L,都高于其他4种有机氮源,因此菌株SCL2010适合的有机氮源为玉米浆。氮源的种类对1.0%多糖产品的黏度影响不大。综合考虑小核菌多糖的产量与产品品质,选择玉米浆作为菌株SCL2010发酵生产小核菌多糖的有机氮源。
2.4 玉米浆添加量对发酵产小核菌多糖的影响
由图4可知,随着玉米浆添加量的增加,菌体生物量呈上升趋势;当玉米浆添加量为1.5 g/L时,多糖产量最大,为28.23 g/L;小核菌多糖产量在玉米浆添加量>2.0 g/L时变化不大,小核菌多糖的合成量开始下降。因此,玉米浆适宜添加量为1.5 g/L。

图4 不同玉米浆添加量对产小核菌多糖的影响Fig.4 Effects of different corn steep liquor addition on scleroglucan production
2.5 无机盐对发酵产小核菌多糖的影响

图5 无机盐对小核菌多糖产量的影响Fig.5 Effects of inorganic salt on scleroglucan production
由图5可知,K2HPO4和MgSO4在一定范围内对小核菌多糖的产量影响显著,因此选择作为后续正交试验优化的培养基组分;其他两种无机盐NaNO3和KCl则分别选择2.0 g/L、2.0g/L作为优化后培养基中的添加量。
2.6 培养基配方优化正交试验
在单因素试验基础上,对影响较显著的葡萄糖添加量(A)、玉米浆添加量(B)、K2HPO4添加量(C)、和MgSO4添加量(D)进行了4因素3水平的正交试验优化,结果与分析见表2、方差分析见表3。
由表2可知,各因素对小核菌多糖产量影响由大到小依次为A>B>D>C,即葡萄糖>玉米浆>MgSO4>K2HPO4。由极差分析得出正交试验优化后培养基组成为A3B2C3D1,即葡萄糖50.0 g/L;玉米浆1.5 g/L;K2HPO42.0 g/L和MgSO41.5g/L。在此优化培养基条件下进行验证试验,多糖产量为32.15 g/L,碳源转化率达到64.30%。在正交试验中最优配方组合A2B2C3D1,即葡萄糖45.0 g/L;玉米浆1.5 g/L;K2HPO42.0g/L和MgSO41.5g/L条件下,小核菌多糖的产量为31.81g/L;碳源转化率为70.69%。在以多糖产量为主要参考指标综合考虑碳源转化率后,选择小核菌多糖的最佳发酵培养基配方为A2B2C3D1,即葡萄糖45.0 g/L;玉米浆1.5 g/L;K2HPO42.0 g/L和MgSO41.5 g/L。
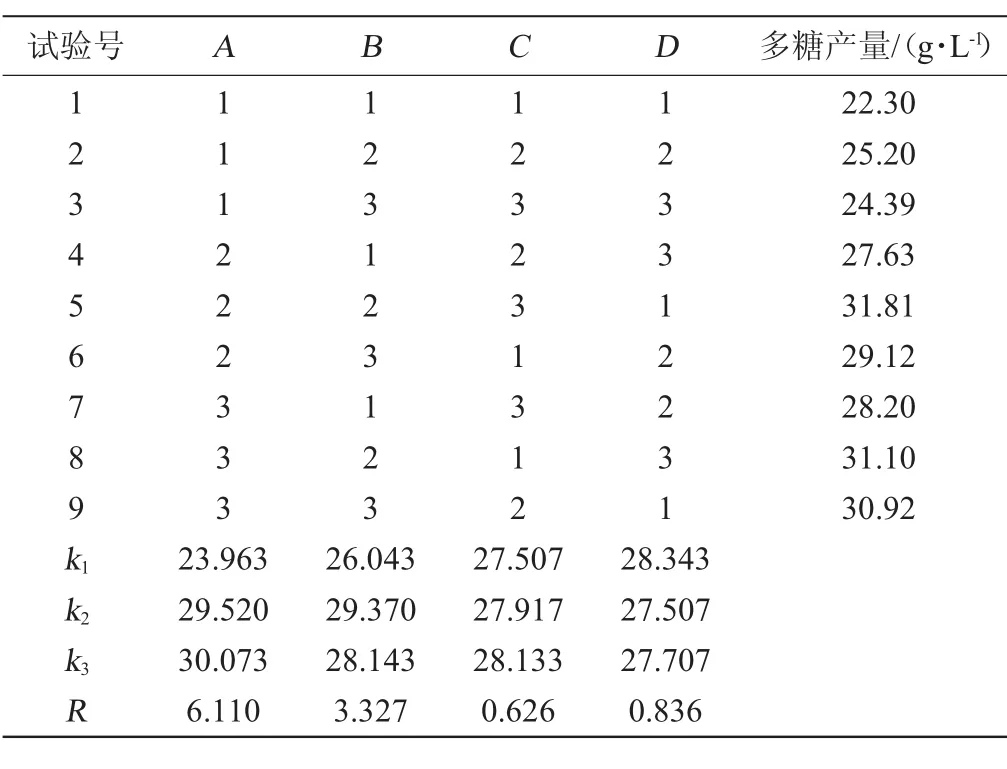
表2 小核菌多糖培养基配方优化正交试验优化结果与分析Table 2 Results and analysis of orthogonal experiments for medium formula optimization of scleroglucan fermentation

表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal experiments results
由表3可知,葡萄糖和玉米浆添加量对小核菌多糖产量的影响显著(P<0.05),其他因素对小核菌多糖产量影响不显著(P>0.05)。
2.7 发酵罐放大实验

图6 小核菌多糖发酵罐发酵曲线Fig.6 Fermentation curve of scleroglucan in fermentor
以小核菌多糖高产菌株齐整小核菌SCL2010为生产菌株,采用优化后的发酵培养基在10 L自动发酵罐进行放大试验,其发酵过程如图6所示。由图6可知,小核菌多糖的产量达到31.86 g/L,碳源转化率为70.80%,与摇瓶验证试验结果基本符合;发酵液表观黏度达到4 500 mPa·s,显著高于现有研究报道[9-17];多糖产量达到最高点在发酵60 h左右比摇瓶发酵速度快。
3 结论
对小核菌多糖高产菌株齐整小核菌SCL2010的培养基成分进行了筛选与优化,通过单因素和正交试验优化,获得了小核菌多糖的高产优化培养基,其组成为葡萄糖45.0g/L;玉米浆1.5g/L;NaNO32.0g/L;K2HPO4·3H2O2.0g/L;柠檬酸0.7 g/L;MgSO4·7H2O 1.5 g/L;KCl 2.0 g/L。在此最佳发酵培养基配方条件下,小核菌多糖的产量为31.81 g/L;碳源转化率为70.69%,达到了小核菌多糖的高产目的。最后采用10 L发酵罐进行小试放大试验,小核菌多糖的产量达到31.86 g/L,碳源转化率为70.80%,发酵液表观黏度达到4 500 mPa·s,显著高于现有研究报道[9-17],并将发酵时间缩短至60 h左右。研究结果对于小核菌多糖的工业化生产具有显著促进作用。
[1]FARIÑA J I,SIÑERIZ F,MOLINA O E,et al.Isolation and physicochemical characterization of soluble scleroglucan fromSclerotium rolfsii.Rheological properties,molecular weight and conformational characteristics[J].Carbohyd Polym,2001,44(1):41-50.
[2]FARIÑA J I,VIÑARTA S C,CATTANEO M,et al.Structural stability of Sclerotium rolfsiiATCC 201126 β-glucan with fermentation time:a chemical,infrared spectroscopic and enzymatic approach[J].J Appl Microbiol,2009,106(1):221-232.
[3]VIÑARTA S C,DELGADO O D,FIGUEROA L I C,et al.Effects of thermal,alkaline and ultrasonic treatments on scleroglucan stability and flow behavior[J].Carbohyd Polym,2013,94(1):496-504.
[4]SCHMID J,MEYER V,SIEBER V.Scleroglucan:biosynthesis,production and application of a versatile hydrocolloid[J].Appl Microbiol Biotechnol,2011,91(4):937-947.
[5]天津市工业微生物研究所.小核菌硬葡聚糖发酵液作为油田钻井液处理剂的应用,CN201210587334.4[P].2013-05-08.
[6]李 冰,张建法,蒋鹏举.真菌硬葡聚糖的生产及在油田上的应用[J].微生物学通报,2003,30(5):99-102.
[7]杜冠乐,段 凡.天然高分子在油田钻井液的应用研究[J].石油化工应用,2013,32(8):1-4.
[8]HALLIBURTON ENERGY SERVICES,INC.Inhibiting salting out of diutan or scleroglucan in well treatment:US,20140378353 A1[P].2014-12-25.
[9]天津市工业微生物研究所.小核菌硬葡聚糖在线发酵提取方法及系统,CN201110006769.0[P].2013-06-05.
[10]TASKINM,ERDALS,CANLIO.Utilizationofwasteloquat(Eriobotrya JaponicaLindley)kernels as substrate for scleroglucan production by locally isolatedSclerotium rolfsii[J].Food Sci Biotechnol,2010,19(4):1069-1075.
[11]SURVASE S A,SAUDAGAR P S,SINGHAL R S.Production of scleroglucan fromSclerotium rolfsiiMTCC 2156[J].Bioresour Technol,2006,97(8):989-993.
[12]WANG Y,MCNEIL B.Scleroglucan and oxalic acid formation bySclerotium glucanicumin sucrose supplemented fermentations[J].Biotechnol Lett,1994,16(6):605-610.
[13]FARIÑA J I,SANTOS V E,PEROTTI N I,et al.Influence of the nitrogen source on the production and rheological properties of scleroglucan produced bySclerotium rolfsiiATCC 201126[J].World J Microbiol Biotechnol,1999,15(2):309-316.
[14]SCHILLING B M,RAU U,MAIER T,et al.Modeling and scale-up of the unsterile scleroglucan production process withSclerotium rolfsii ATCC 15205[J].Bioprocess Eng,1999,20(3):195-201.
[15]SURVASESA,SAUDAGARPS,SINGHALRS.Useofcomplexmedia for the production of scleroglucan bySclerotium rolfsiiMTCC 2156[J].Bioresource Technol,2007,98(7):1509-1512.
[16]FARIÑA J I,SIÑERIZ F,MOLINA O E,et al.High scleroglucan production bySclerotium rolfsii:influence of medium composition[J].Biotechnol Lett,1998,20(9):825-831.
[17]SCHILLINGBM.Sclerotium rolfsiiATCC 15205 in continuous culture:Economical aspects of scleroglucan production[J].Bioprocess Eng,2000,22(1):57-61.
[18]杨林娥,彭晓光,杨庆文,等.斐林试剂法测定还原糖方法的改进[J].中国酿造,2010,29(5):160-161.

ZHANG Yonggang,WANG Wei,ZHANG Yanmin,DONG Xueqian*
(Shandong Food Ferment Industry Research&Design Institute,Jinan 250013,China)
Q93-335
0254-5071(2017)11-0049-05
10.11882/j.issn.0254-5071.2017.11.011
2017-09-01
山东省重点研发计划项目(2015GGX102015)
张永刚(1985-),男,工程师,硕士,研究方向为微生物聚合物发酵生产技术与产业化应用。
*通讯作者:董学前(1978-),男,研究员,硕士,研究方向为微生物聚合物及资源化利用。

