新型脱甲基酶抑制剂氯氟醚菌唑对水稻恶苗病致病菌藤仓镰孢菌的抑菌活性
陈 星, 杨家伟, KOKLANNOU Damalk Saint Claire Senakpon,孙 扬, 陈 雨*,
(1.安徽农业大学 植物保护学院,合肥 230036;2.作物有害生物综合治理安徽省重点实验室,合肥 230036)
水稻是世界上重要的粮食作物,是全球一半以上人口的主粮[1]。然而,水稻的产量和品质受到多种病原物的威胁。由藤仓赤霉复合种Gibberella fujikuroispecies complex 侵染引起的水稻恶苗病,是水稻生产中的重要种传病害。该病害最早于1828年在日本首次发现,随后在北美、欧洲、非洲等全球各水稻种植区均有发生[2-4]。水稻恶苗病在我国分布广泛,主要集中于江西、湖南、广东及长江中下游地区,可造成水稻产量损失10%~30%,严重时减产超过50%[5]。
藤仓赤霉复合种包括藤仓镰孢Fusarium fujikuroi、层出镰孢F.proliferatum、拟轮枝镰孢F.verticilliodes及F.andiyazi,其中藤仓镰孢菌是我国引起水稻恶苗病的主要致病菌,可造成幼苗徒长、叶片呈淡黄绿色,在成株期造成茎基部腐烂、分蘖减少,严重时整株枯死[6-8]。由于抗病品种的缺乏,防治水稻恶苗病仍以化学防治为主。目前,国内外用于防治水稻恶苗病的药剂主要有苯并咪唑类 (多菌灵、甲基硫菌灵)、甾醇合成抑制剂类 (咪鲜胺、戊唑醇)、2-氰基丙烯酸酯类杀菌剂 (氰烯菌酯) 等[9-10]。但由于杀菌剂的长期单一及不合理使用,水稻恶苗病病原菌对常用杀菌剂产生了抗药性[11-12]。此外,水稻恶苗病病原菌还会产生一些毒素,如伏马菌素 (FBs)、赤霉酸 (GAs)、串珠镰刀菌素等,这些真菌毒素具有神经毒性、细胞毒性及免疫毒性,严重威胁人类和其他动物的生命健康[5-6]。因此,水稻恶苗病的田间有效防控及抗性治理极为迫切。
氯氟醚菌唑 (mefentrifluconazole) 是巴斯夫公司于2018 年上市的第一个异丙醇三唑类杀菌剂,属于新型脱甲基酶抑制剂(demethylase inhibitors,DMIs),主要作用细胞膜麦角甾醇生物合成过程中的C14-脱甲基酶,破坏病原菌细胞膜的结构[13-14]。氯氟醚菌唑可有效防治多种作物上的真菌病害,如黄瓜白粉病、番茄早疫病、芒果炭疽病等,并已在欧洲、美国等多个国家和地区登记使用[13,15-16]。据报道,氯氟醚菌唑对多种镰孢菌属病原菌具有不同的抑制效果。氯氟醚菌唑对西红花球茎腐烂病菌尖孢镰孢具有显著的抑制效果[17],但对腐皮镰刀菌抑制效果最差[15]。为明确氯氟醚菌唑对水稻恶苗病病原菌藤仓镰孢菌的生物学活性,本研究明确了安徽省藤仓镰孢菌对氯氟醚菌唑的敏感性分布,分析了氯氟醚菌唑对病原菌菌丝形态、孢子形态、细胞膜完整性和通透性的影响,同时测定了氯氟醚菌唑对藤仓镰孢菌麦角甾醇和毒素生物合成的影响,以期为水稻恶苗病的田间防控及氯氟醚菌唑的科学合理使用提供理论依据。
1 材料与方法
1.1 供试材料
1.1.1 供试菌株 从安徽省不同地理区域采集的发病水稻幼苗和种子中共分离得到102 株水稻恶苗病致病菌 (表1),通过单孢分离纯化,再经形态特征和分子生物学序列比对后鉴定为藤仓镰孢菌F.fujikuroi[18],将菌株转接至PDA 斜面培养基中于4 ℃保存,备用。2 株拟轮枝镰孢菌F.verticillioides和1 株层出镰孢菌F.proliferatum,由江苏省农业科学院农产品质量安全与营养研究所提供。
表1 藤仓镰孢菌菌株采集信息Table 1 Information of F. fujikuroi strains collected
1.1.2 供试药剂 氯氟醚菌唑 (mefentrifluconazole)原药和400 g/L 氯氟醚菌唑悬浮剂 (mefentrifluconazole 400 g/L SC),由巴斯夫股份公司提供,其中氯氟醚菌唑原药用甲醇溶解。450 g/L 咪鲜胺水乳剂 (prochloraz 450 g/L EW) 和25%氰烯菌酯悬浮剂 (phenamacril 25% SC),分别由青岛海纳科技有限公司和江苏省农药研究所股份有限公司提供。
1.1.3 供试培养基 马铃薯葡萄糖琼脂 (PDA) 培养基:称取去皮马铃薯200 g,煮沸后过滤,随后加入20 g 葡萄糖和20 g 琼脂,搅拌溶解后加水定容至1 L;不添加琼脂为PDB 液体培养基。水琼脂 (WA) 培养基:称取20 g 琼脂,无菌水定容至1 L。酵母浸出粉胨葡萄糖 (YEPD) 培养基:10 g/L酵母提取物,20 g/L 蛋白胨,20 g/L 葡萄糖,加水定容至1 L。上述所有培养基均进行121 ℃高压灭菌锅灭菌20 min 后备用。
1.1.4 供试仪器设备 SW-CJ-2FD 超净工作台,上海博迅医疗生物仪器股份有限公司;Motic M150光学显微镜,合肥南达科学仪器有限公司;HITACHI S-4800 扫描电子显微镜,日本日立公司;LC-20AD XR 高效液相色谱仪,中国岛津企业管理有限公司;OHAUS ST3100C 电导率仪,上海奥豪斯仪器有限公司。
1.2 试验方法
1.2.1 藤仓镰孢菌对氯氟醚菌唑的敏感性测定
分别采用菌丝生长速率法和孢子萌发法[5]测定。
1.2.1.1 菌丝生长速率法 在灭菌的PDA 培养基中加入氯氟醚菌唑,使其终浓度分别为0.05、0.1、0.2、0.4、和0.8 μg/mL。将藤仓镰孢菌在PDA 平板上培养5 d 后,从菌落边缘打取直径为5 mm 的菌饼,转接至上述含不同质量浓度氯氟醚菌唑的PDA 平板中央。以仅添加有同样体积溶剂的PDA平板作为对照,每处理重复3 次。于25 ℃黑暗培养6 d 后,采用十字交叉法测量各处理的菌落直径,按公式 (1) 计算各浓度药剂处理对菌丝生长的抑制率(Im)。
式中:DC为对照组菌落生长直径,cm;DT为处理组菌落生长直径,cm;D0为菌饼直径,cm。
1.2.1.2 孢子萌发抑制试验 将藤仓镰孢菌在PDA 平板上培养5 d 后,从菌落边缘打取直径为5 mm 的菌饼,转接至100 mL PDB 液体培养基中,于25 ℃、175 r/min 摇培3 d。离心收集分生孢子,使用无菌水调整分生孢子浓度至105个/mL。取100 μL 孢子悬浮液涂布于含不同浓度氯氟醚菌唑的WA 平板上,于25 ℃黑暗培养8 h 后,镜检观察孢子萌发情况。以芽管长度达到孢子直径的1/2 及以上视为萌发,记录孢子萌发数,以不含药剂的WA 平板为空白对照,每板记录300 个分生孢子萌发情况,每处理重复3 次。按公式 (2) 计算各浓度药剂处理对孢子萌发的抑制率 (Is)。
式中:Sc为对照组菌株的产孢量;Ss为处理组菌株的产孢量。
利用DPS 软件,计算得出药剂质量浓度的lg 值 (x) 及抑制率的几率值 (y) 之间的线性回归方程和相关系数,求出EC50值。
1.2.2 氯氟醚菌唑对藤仓镰孢菌菌丝和孢子形态的影响 采用扫描电子显微镜[19]观察氯氟醚菌唑对藤仓镰孢菌菌丝和孢子形态的影响。随机选取3 株藤仓镰孢菌,分别接种至含有0.05 μg/mL 氯氟醚菌唑的PDA 平板中央,于25 ℃黑暗培养5 d后,切取菌落边缘大小为5 mm、厚度为1 mm 的菌块,置于5%戊二醛溶液中固定过夜。按1.2.1.2节的方法收集藤仓镰孢菌分生孢子,使用生理盐水调整浓度至105个/mL,分别加入终浓度为相应EC50及EC90值的氯氟醚菌唑药液,处理6 h 后,离心收集孢子于5%戊二醛溶液中固定过夜。随后使用0.1 mol/L 的磷酸缓冲液冲洗3 次,相继通过体积分数为30%、50%、70%、80%、95%、100%乙醇和丙酮进行洗脱,临界点干燥后使用扫描电子显微镜进行观察。
1.2.3 氯氟醚菌唑对藤仓镰孢菌细胞膜通透性的影响 选取3 株藤仓镰孢菌,在PDA 上培养5 d后,在菌落边缘打取10 个直径为5 mm 的菌饼,接种至100 mL YEPD 液体培养基中,于25 ℃、175 r/min 摇培48 h,每个菌株接种6 瓶。摇培48 h后,向其中3 瓶中加入终浓度为0.05 μg/mL 的氯氟醚菌唑药液。以3 瓶不加药剂的处理作为空白对照。继续摇培48 h 后使用3 层纱布过滤、冲洗收集菌丝,风干。称取0.3 g 菌丝,放入盛有20 mL蒸馏水的离心管中,分别在0、5、10、20、40、60、80、100、120、140、160 和180 min 时,使用电导率仪测定电导率。180 min 后将菌丝煮沸5 min,冷却后测定最终电导率,计算出各时间点的相对电导率 (电导率/最终电导率)[20]。
1.2.4 氯氟醚菌唑对藤仓镰孢菌细胞壁和细胞膜完整性的影响 选取3 株藤仓镰孢菌,将其转接至含有刚果红 (congo red, CR) 质量浓度分别为0、0.05、0.1、0.2、0.4、0.8、1.2 和1.6 mg/mL 的加药及不加药的PDA 平板上,氯氟醚菌唑终浓度为0.05 μg/mL,以不含有刚果红和氯氟醚菌唑的处理为对照组,评估氯氟醚菌唑对藤仓镰孢菌细胞壁完整性的影响[20-21]。同样,为测定氯氟醚菌唑对藤仓镰孢菌细胞膜完整性的影响,将藤仓镰孢菌接种至含有十二烷基硫酸钠 (SDS) 质量浓度分别为0、0.05、0.1、0.2、0.4 和0.8 mg/mL 的加药及不加药的PDA 平板上,以不含有氯氟醚菌唑和SDS的处理为空白对照组,每处理重复3 次。于25 ℃黑暗培养6 d 后,用十字交叉法测定各处理的菌落直径,按照公式 (1) 计算刚果红及SDS 的实际抑制率。理论抑制率 (Ih) 按照公式 (3) 计算。
式中:RM为氯氟醚菌唑抑制率;RT为刚果红/SDS 抑制率。
1.2.5 氯氟醚菌唑对藤仓镰孢菌麦角甾醇含量的影响 随机选取3 株藤仓镰孢菌,分别接种至氯氟醚菌唑终浓度为0.05 μg/mL 的PDB 液体培养基中,于25 ℃、175 r/min 摇培5 d。收集菌丝,冷冻干燥后研磨成粉。取0.1 g 样品于2 mL 无水乙醇中浸提过夜,随后超声处理40 min。静置分层后,取1 mL 上清液过0.45 μm 有机滤膜,采用高效液相色谱 (HPLC) 法检测麦角甾醇含量,流动相为100%甲醇,流速为1 mL/min。麦角甾醇保留时间以麦角甾醇标准品进行鉴定分析。试验重复3 次。
1.2.6 氯氟醚菌唑对水稻恶苗病菌毒素含量的影响 将2 株拟轮枝镰孢菌、1 株层出镰孢菌[18]和3 株藤仓镰孢菌分别接种至含有其对应EC50浓度氯氟醚菌唑的PDA 平板上培养7 d,以不加药的处理为对照。将培养基粉碎后,称取4 g 置于30 mL质量分数为80%的乙腈中,于180 r/min 摇培2 h,随后将上清液过滤至离心管中。吸取4 mL 上清液氮吹至近干,用1 mL 质量分数为50%的乙腈复溶后过0.45 μm 滤膜,用于后续毒素检测。按照仇剑波等[18]报道的方法对2 株拟轮枝镰孢菌、1 株层出镰孢菌和3 株藤仓镰孢菌分别进行赤霉酸和伏马菌素的检测。
2 结果与分析
2.1 藤仓镰孢菌对氯氟醚菌唑的敏感性
如图1 所示,氯氟醚菌唑对藤仓镰孢菌的菌丝生长和孢子萌发都具有良好的抑制效果,其对供试的102 株藤仓镰孢菌菌丝生长的EC50值分布在0.0305~0.7579 μg/mL 之间,平均EC50值为(0.2469 ±0.0167) μg/mL,变异系数 (最高EC50值/最低EC50值) 为24.84。氯氟醚菌唑对供试84 株藤仓镰孢菌孢子萌发的EC50值分布在0.1091~1.6870 μg/mL之间,平均EC50值为(0.6397 ± 0.0324) μg/mL。均未检测到对氯氟醚菌唑具有抗性的藤仓镰孢菌菌株。

图1 藤仓镰孢菌菌丝 (A) 和孢子 (B) 对氯氟醚菌唑的敏感性分布Fig.1 Distribution of sensitivity of mycelia (A) and spores (B) of F. fujikurori to mefentrifluconazole
2.2 氯氟醚菌唑对藤仓镰孢菌菌丝和孢子形态的影响
扫描电子显微镜观察结果显示,在0.05 μg/mL氯氟醚菌唑处理条件下,藤仓镰孢菌菌丝形态出现不正常的扭曲变形,菌丝皱缩破裂,对照组呈现正常的菌丝形态 (图2A)。氯氟醚菌唑处理组的孢子形态也出现皱缩的现象,且随着药剂质量浓度的增加,皱缩现象加剧。在EC90浓度的氯氟醚菌唑处理下,孢子变得扁平破裂,不再呈典型的孢子形态特征 (图2B)。

图2 氯氟醚菌唑对3 株藤仓镰孢菌(XY-4, XY-17 和XY-21)菌丝 (A) 和孢子 (B) 形态的影响Fig.2 Effect of mefentrifluconazole on the mycelial morphology (A) and spore morphology (B) of three F. fujikuroi strains (XY-4, XY-17 and XY-21)
2.3 氯氟醚菌唑对藤仓镰孢菌细胞膜通透性的影响
氯氟醚菌唑处理下供试3 株藤仓镰孢菌细胞膜透性的变化结果如图3 所示:在0.05 μg/mL 氯氟醚菌唑处理条件下,XY-4、XY-17 和 XY-21 的电导率明显高于未处理对照组,且随着时间的延长,电导率均表现上升趋势。表明氯氟醚菌唑可破坏藤仓镰孢菌的细胞膜,导致胞内电解质的外渗,从而造成缓冲液中电导率增加。
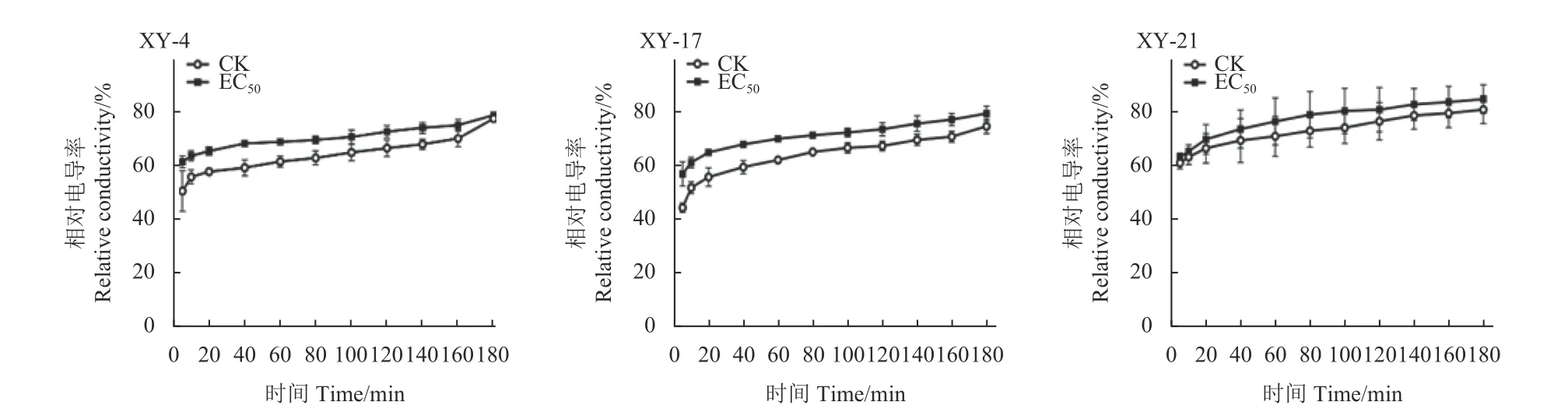
图3 氯氟醚菌唑对3 株藤仓镰孢菌细胞膜通透性的影响Fig.3 Effect of mefentrifluconazole on the membrane permeability of three F. fujikuroi strains (XY-4, XY-17 and XY-21)
2.4 氯氟醚菌唑对藤仓镰孢菌细胞壁和细胞膜完整性的影响
测定结果表明,0.05 μg/mL 氯氟醚菌唑和0.05~1.6 mg/mL 刚果红混合处理对藤仓镰孢菌的菌丝生长抑制率高于其理论值,且随着刚果红质量浓度的增加,抑制率增加幅度显著高于其理论抑制率 (图4A)。而SDS 作为一种离子表面活性剂,可破坏细胞膜的完整性。氯氟醚菌唑与0.05~0.8 mg/mL SDS 混合处理对藤仓镰孢菌菌丝生长抑制率明显高于理论抑制率 (图4B)。表明氯氟醚菌唑对藤仓镰孢菌细胞壁和细胞膜的完整性具有破坏作用。
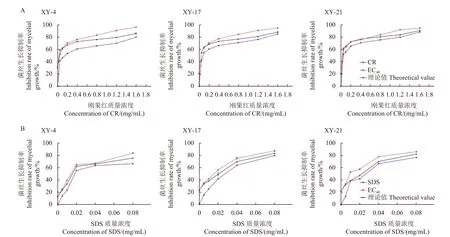
图4 氯氟醚菌唑对3 株藤仓镰孢菌细胞壁 (A) 和细胞膜 (B) 完整性的影响Fig.4 Effect of mefentrifluconazole on the cell wall (A) and the cell membrane (B) integrity of three F. fujikuroi strains
2.5 氯氟醚菌唑对藤仓镰孢菌麦角甾醇生物合成的影响
测定结果如图5 所示,氯氟醚菌唑可显著抑制藤仓镰孢菌麦角甾醇的生物合成。在0.05 μg/mL氯氟醚菌唑处理条件下,XY-4、XY-17 和XY-21 3 株藤仓镰孢菌的麦角甾醇含量均显著低于未处理组。
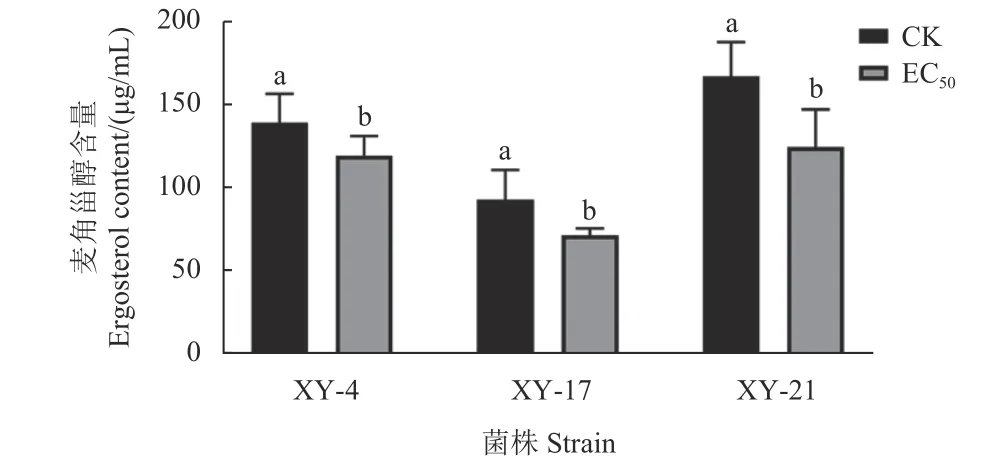
图5 氯氟醚菌唑对3 株藤仓镰孢菌麦角甾醇含量的影响Fig.5 Effect of mefentrifluconazole on the ergosterol content of three F. fujikuroi strains
2.6 氯氟醚菌唑对水稻恶苗病菌毒素合成的影响
为明确氯氟醚菌唑对水稻恶苗病菌毒素生物合成的影响,测定了在氯氟醚菌唑处理下3 株F.fujikuroi、2 株F.verticillioides和1 株F.proliferatum毒素含量的变化。结果如表2 所示,在F.fujikuroi中仅检测到赤霉酸,而由于F.verticillioides和F.proliferatum不合成赤霉酸[18],故仅检测到伏马菌素。经氯氟醚菌唑处理后,虽然处理组F.fujikuroi中赤霉酸含量稍有下降,但与对照组相比无显著差异,而氯氟醚菌唑处理可显著降低F.verticillioides和F.proliferatum伏马菌素 (FB1、FB2、FB3) 含量。
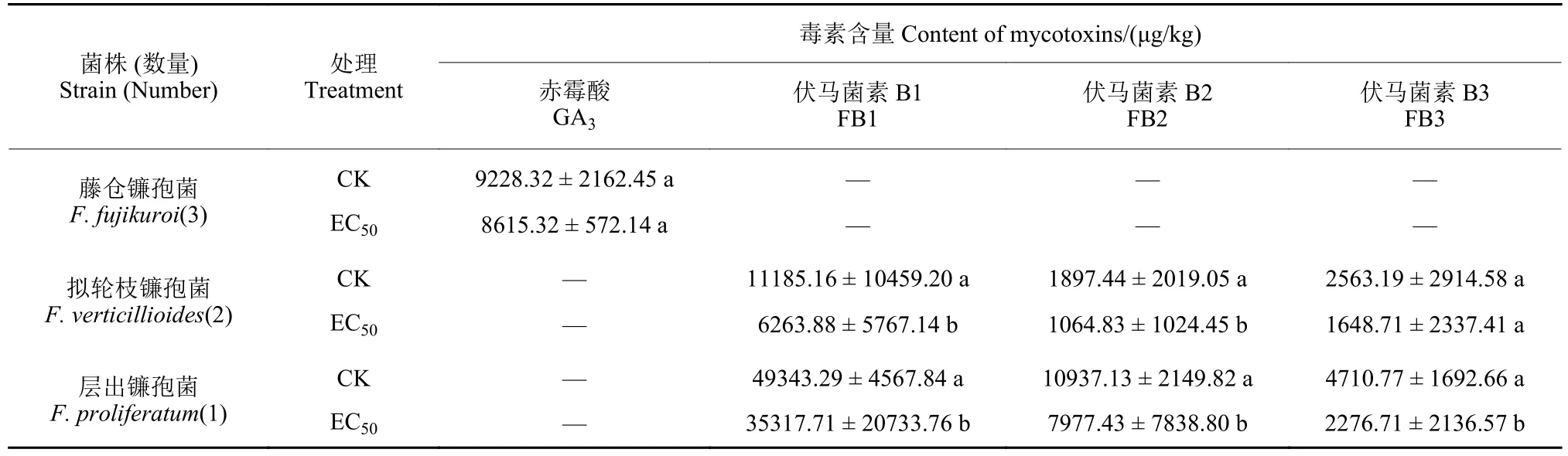
表2 氯氟醚菌唑对3 种水稻恶苗病菌毒素产生的影响Table 2 Effect of mefentrifluconazole on the production of several toxins of Fusarium spp.
3 结论与讨论
氯氟醚菌唑其分子结构中的异丙醇基团能够使其与麦角甾醇生物合成酶更紧密地结合[22-23]。在我国,氯氟醚菌唑已被登记用于防治柑橘等果树炭疽病、番茄早疫病、苹果褐斑病、香蕉叶斑病、马铃薯早疫病、黄瓜靶斑病和黄瓜白粉病等(http://www.chinapesticide.org.cn/zwb/dataCenter)。此外,已有文献报道氯氟醚菌唑对桃褐腐病菌、小麦叶枯病菌等都具有很好的抑制效果[14]。相较于其他DMI 杀菌剂,氯氟醚菌唑活性更高,安全性更强[24]。文献报道氯氟醚菌唑对水稻纹枯病菌Rhizoctonia solani的室内抑菌活性优于氟环唑、丙硫菌唑和丙环唑等三唑类杀菌剂,且其对水稻纹枯病具有良好的保护和治疗活性[25]。有研究表明,氯氟醚菌唑对多种镰孢菌属病原菌抑制效果不尽相同[15]。
本文探究了氯氟醚菌唑对藤仓镰孢菌孢子和菌丝的抑菌活性,并研究了其抑菌作用方式及对镰刀菌毒素的影响。结果表明,氯氟醚菌唑对藤仓镰孢菌菌丝生长和孢子萌发的EC50值分别分布在0.0305~0.7579 μg/mL 和0.1091~1.6870 μg/mL之间,平均EC50值分别为(0.2469 ± 0.0167) μg/mL和(0.6397 ± 0.0324) μg/mL,优于同类型杀菌剂丙硫菌唑、丙环唑对藤仓镰孢菌的抑制活性[25],由此说明氯氟醚菌唑可以有效抑制藤仓镰孢菌生长,且对菌丝生长的抑制作用优于对孢子萌发的抑制,同时未发现抗性菌株。刘亚慧等研究表明,氯氟醚菌唑对藤仓镰孢菌的EC50值 < 0.172 μg/mL,本研究结果与其结果一致[15],但也有文献报道,氯氟醚菌唑不能抑制尖孢镰孢菌和灰葡萄孢菌的分生孢子萌发[16-17]。真菌细胞壁中几丁质成分含量和菌丝对刚果红的敏感性直接相关,而SDS 主要破坏细胞膜的完整性,在刚果红或SDS 存在的情况下,氯氟醚菌唑对藤仓镰孢菌的抑制效果高于理论抑制值,由此推断氯氟醚菌唑可能通过降低藤仓镰孢菌细胞壁中几丁质含量,从而破坏细胞壁和细胞膜的完整性[20-21]。另外,氯氟醚菌唑作为一类广谱三唑类杀菌剂,能够降低细胞中麦角甾醇含量,破坏病原真菌细胞膜,引起细胞膜通透性的改变,从而导致细胞内容物泄漏[26-27]。在本研究中,氯氟醚菌唑可显著降低藤仓镰孢菌细胞膜中麦角甾醇含量,在0.05 μg/mL 氯氟醚菌唑处理条件下,不同菌株麦角甾醇含量均降低了25%以上,相对电导率显著增加,菌丝和孢子形态发生改变,研究结果进一步证实了氯氟醚菌唑破坏病菌细胞膜的作用方式。
水稻恶苗病菌可产生包括赤霉酸、伏马菌素、镰刀菌酸等在内的多种毒素,这些毒素会污染粮食作物,造成人和动物急性或慢性中毒[18]。本研究结果表明,拟轮枝镰孢和层出镰孢菌主要产生伏马菌素,而主要致病菌藤仓镰孢产生的毒素以赤霉酸为主,这点与文献报道[28-29]一致。同时本研究发现,氯氟醚菌唑可显著降低拟轮枝镰孢和层出镰孢体外伏马菌素的产生,但并不影响藤仓镰孢菌中赤霉酸的合成,由此说明氯氟醚菌唑主要抑制伏马菌素的生物合成。有研究结果表明,高浓度戊唑醇、苯醚甲环唑等杀菌剂会抑制毒素的生物合成,而低浓度会刺激毒素的生物合成[30-31],后续可考虑评估不同氯氟醚菌唑浓度对水稻恶苗病菌毒素生物合成的影响。
在农业生产中,使用杀菌剂进行种子处理是防治水稻恶苗病这类种传病害最有效的措施。目前用于水稻恶苗病防治的杀菌剂主要有咯菌腈、咪鲜胺、戊唑醇等,但由于连年大量使用,抗药性发生日趋严重,亟需筛选获得用于水稻恶苗病防治的新型杀菌剂。氯氟醚菌唑杀菌谱广,其分子中含有的异丙醇基团使其空间结构多变,可有效延缓田间抗药性的发生,是用于病害防治的优异候选药剂[32]。已有文献报道,氯氟醚菌唑对灰霉病、辣椒炭疽病、西红花球茎腐烂病等的保护活性优于治疗活性[16-17,22],后续可进一步评价氯氟醚菌唑对水稻恶苗病的防治效果,为氯氟醚菌唑的田间合理使用提供理论依据。

