黄连解毒汤对脂多糖诱导的小鼠急性肾损伤治疗作用及机制
熊致立,王 瑞,朱晓云,付彤飞,李成银,吴俊松,王林群,沈银峰,巴元明*
1. 湖北中医药大学中医临床学院,湖北 武汉 430000
2. 湖北省中医院,湖北中医药大学附属医院,湖北省中医药研究院,湖北 武汉 430000
脓毒症是一种危及生命的临床综合征,是危重患者死亡的主要原因,而肾脏是最易受影响的器官之一。脓毒症患者的急性肾损伤(acute kidney injury,AKI)发生率为54%[1]。脓毒血症通常由细菌感染引起,进而产生毒素进入血液循环并释放多种炎症介质,这些炎症介质在一定程度上会扩张血管、增加血管通透性,进而可能影响肾小球的滤过和肾小管的功能[2]。相关研究认为缺血再灌注损伤、氧化应激、炎症反应等均可以导致肾组织内细胞凋亡的增加[3]。合理控制细胞凋亡成为有效干预AKI一种重要的治疗策略。中医药在保护肾功能、缓解炎症方面有巨大潜力。但当前针对脓毒症相关性AKI 的中医药研究存在机制不明确等问题。黄连解毒汤最早记载于东晋葛洪《肘后备急方》[4],为清热剂代表方,并且在临床应用中取得了一定的疗效[5]。本研究考察了黄连解毒汤治疗脓毒症相关性AKI的作用及潜在机制,为研究治疗脓毒症相关性AKI的药物提供新的策略。
1 材料
1.1 动物
SPF 级雄性C57BL/6 小鼠,6 周龄,体质量(20±2)g,购自河南省斯克贝斯生物科技股份有限公司,许可证号SCXK(豫)2020-0005。小鼠饲养于12 h 光照/黑暗循环的环境中,温度(23±2)℃,相对湿度(55±5)%,适应性喂养1 周,自由进食饮水。动物实验经湖北中医药大学伦理委员会批准(批准号HUCMS-202302007)。
1.2 药材
黄连解毒汤及其制备工艺源于《肘后备急方》,由黄连9 g、黄芩6 g、黄柏6 g、栀子9 g 4 味药组成,黄连(批号 2323080122)和黄芩(批号2323090105)购自湖北辰美中药有限公司,黄柏(批号232309025)购自天济药业有限公司,栀子(批号230801)购自湖北润康药业有限公司。经湖北中医药大学生药研究院杜鸿志副教授分别鉴定为毛茛科植物黄连CoptischinensisFranch. 的干燥根茎、唇形科植物黄芩ScutellariabaicalensisGeorgi. 的干燥根、芸香科植物黄檗PhellodendronamurenseRupr.的干燥树皮、茜草科植物栀子GardeniajasminoidesEllis. 的干燥果实。
1.3 药品与试剂
肌酐比色测定试剂盒(批号E-BC-K188-M)、尿素氮比色测定试剂盒(批号E-BC-K183-M)均购自武汉伊莱瑞特生物科技股份有限公司;BCA 蛋白定量试剂盒(批号P0010)购自武汉碧云天生物技术研究所;脂多糖(lipopolysaccharide,LPS,批号GC205009)、AB-PAS 染液套装(批号G1049)、苏木素-伊红(HE)染液套装(批号GB23303)、牛血清白蛋白(bovine serum albumin,BSA,批号GC305010)、组化试剂盒 DAB 显色剂(批号G1212)、重组β-actin 抗体(批号GB15003-100)、抗兔蛋白激酶B(protein kinase B,Akt)抗体(批号GB111114)、HRP 标记的山羊抗小鼠二抗(批号GB23301)、HRP 标记的山羊抗兔二抗(批号GB23303)均购自武汉塞维尔生物科技公司;B 淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)单克隆抗体(批号13-8800)、Bcl-2 相关X 蛋白(Bcl-2 associated X protein,Bax)单克隆抗体(批号MA5-14003)、色谱纯甲醇均购自美国Thermo Fisher Scientific 公司; 磷脂酰肌醇 3- 激酶(phosphatidylinositol 3-kinase,PI3K)单克隆抗体(批号60225-1-Ig)购自武汉三鹰生物科技有限公司;p-Akt 抗体(批号AF0832)、磷酸酯酶与张力蛋白同源物(phosphatase and tensin homolog,PTEN)抗体(批号af6351)均购自美国亲科生物科技公司;p-PI3K 抗体(批号BS-5570R)购自北京博奥森生物技术有限公司;色谱纯甲酸购自上海阿拉丁生化科技股份有限公司;去离子水由湖北中医药大学科技中心提供。
1.4 仪器
D3024R 型台式高速冷冻离心机(北京大龙公司);Epoch 酶标检测仪(美国Bio-Tek 公司);垂直电泳仪、转印电泳仪(武汉塞维尔生物科技公司);RM2016 型病理切片机(德国Leica 公司);UltiMate 3000 RS 型色谱仪、Q Exactive 高分辨质谱仪(美国Thermo Fisher Scientific 公司)。
2 方法
2.1 黄连解毒汤的制备及成分分析
2.1.1 黄连解毒汤的制备 按处方比例称取黄连、黄芩、黄柏、栀子,加6 倍量水,浸泡30 min,煎煮45 min;再加6 倍量水,煎煮30 min,合并滤液,减压浓缩(60 ℃)至相对密度1.08~1.10 的浸膏,喷雾干燥得干膏粉。采用真空干燥法测定其出膏率为17.61%,并将干膏于-20 ℃保存。
2.1.2 样品处理 取黄连解毒汤水煎液100 µL,加入300 µL 甲醇,涡旋10 min。4 ℃、20 000×g离心10 min,取上清液上机分析。
2.1.3 色谱条件 Welch AQ-C18色谱柱(150 mm×2.1 mm,1.8 µm),流动相为0.1%甲酸水溶液(A)-甲醇(B),梯度洗脱:1~5 min,98%~80% A;5~10 min,80%~50% A;10~15 min,50%~20% A;15~20 min,20%~5% A;20~27 min,5% A;27~28 min,5%~98% A;28~30 min,98% A。柱温35 ℃;自动进样器温度10.0 ℃;进样体积5.00 µL;体积流量0.30 mL/min。
2.1.4 质谱条件 电喷雾离子源(ESI);正负离子切换扫描;检测方式为Full MS/dd-MS2,Full MS 分辨率为70 000,dd-MS2分辨率为17 500;扫描范围m/z100~1 500;电喷雾电压为±3.2 kV;毛细管温度 300 ℃;碰撞气为高纯氩气(体积分数≥99.999%);碰撞能为30、40、60 eV;鞘气为氮气(体积分数≥99.999%),体积流量800 L/h;辅助气为氮气(体积分数≥99.999%),体积流量300 L/h,温度350 ℃;数据采集时间30.0 min。
2.2 动物分组、造模及给药
将小鼠随机分为对照组、模型组和黄连解毒汤低、中、高剂量(50、100、150 mg/kg)[6]组,每组8 只。各给药组ig 相应药物,对照组和模型组ig 等体积生理盐水,1 次/d,连续3 d。末次给药2 h 后,模型组和各给药组ip LPS(10 mg/kg),对照组ip 等体积生理盐水。造模24 h 后,所有小鼠安乐死,收集肾脏和血清。将小鼠左肾固定于4%多聚甲醛溶液中,乙醇洗脱后,石蜡包埋,并将剩余样品储存在-80 ℃下用于后续实验。
2.3 试剂盒检测血清中肌酐和尿素氮水平
按照试剂盒说明书分别测定各组小鼠血清中肌酐和尿素氮水平。
2.4 HE 和PAS 染色检测肾组织病理变化
各组肾组织石蜡切片放入环保型脱蜡液后,自来水洗,HE 或PAS 染色,中性树胶封片固定,于显微镜下观察并拍照。
2.5 免疫组化检测肾组织Bax 和Bcl-2 表达
取各组肾组织石蜡切片,根据免疫组化试剂盒说明书,采用SP 两步法进行抗原修复,封闭内源性过氧化物酶,孵育抗体,于显微镜下观察并拍照。
2.6 TUNEL 检测肾组织细胞凋亡情况
取各组肾组织石蜡切片,根据TUNEL 试剂盒说明书进行标记染色,于显微镜下观察并拍照。
2.7 Western blotting 检测肾组织PTEN、PI3K、p-PI3K、Akt 和p-Akt 蛋白表达
取各组肾组织,加入含蛋白酶抑制剂的RIPA 裂解液提取蛋白,使用BCA 蛋白定量试剂盒测定蛋白浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,于5%脱脂牛奶中封闭1 h,分别加入一抗,4 ℃孵育过夜;TBST 洗涤后,加入二抗,孵育1.5 h,加入化学发光试剂显影,并分析条带灰度值。
2.8 统计学分析
利用GraphPad Prism 9.0 软件对数据进行统计分析,数据用x±s表示。数据满足正态分布且方差齐时采用单因素方差分析。
3 结果
3.1 黄连解毒汤主要成分分析
HPLC-MS 采集的数据通过CD 3.3(Compound Discoverer 3.3)完成数据初步整理后进行数据库(mzCloud)检索比对。HPLC/MS 总离子流图见图1,鉴定出的31 个主要活性成分见表1。黄连解毒汤主要成分有咖啡酸、小檗碱以及黄芩素等。
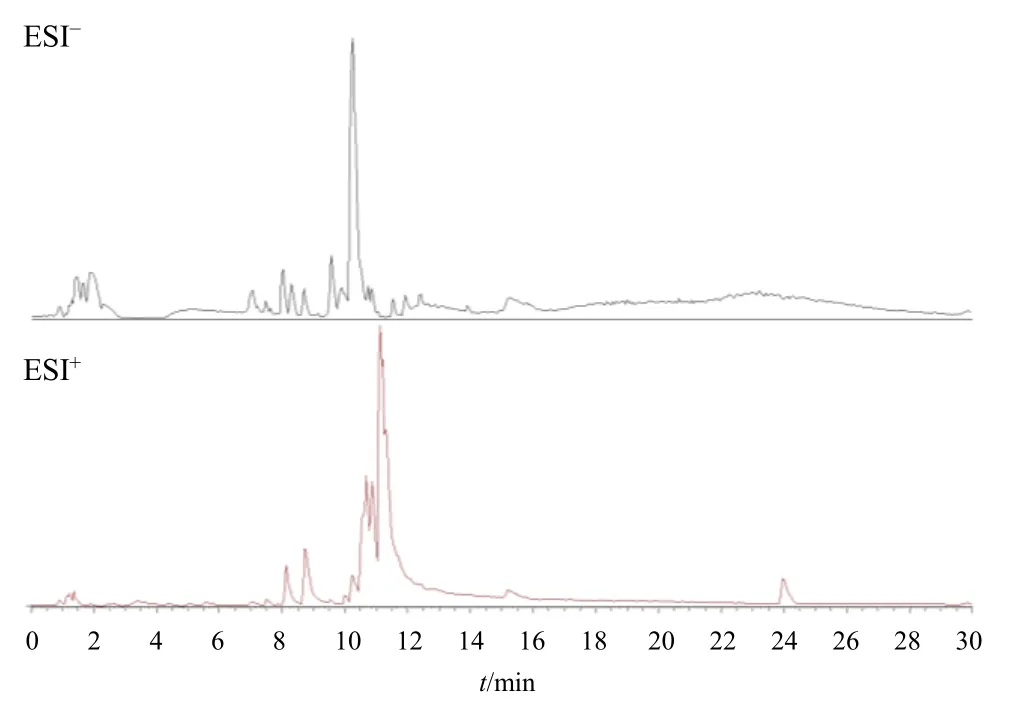
图1 负、正离子模式下的总离子流图Fig.1 Total ion flow chart under negative and positive ion modes
3.2 黄连解毒汤对脓毒症相关性AKI 小鼠血清中尿素氮和肌酐水平的影响
如图2 所示,与对照组比较,模型组小鼠血清尿素氮和血肌酐水平均明显升高(P<0.001);与模型组比较,各给药组血肌酐水平均显著降低,黄连解毒汤中、高剂量组血清尿素氮水平显著降低(P<0.01、0.001)。提示黄连解毒汤可能在缓解脓毒血症导致的急性肾损伤过程中起到了保护作用。
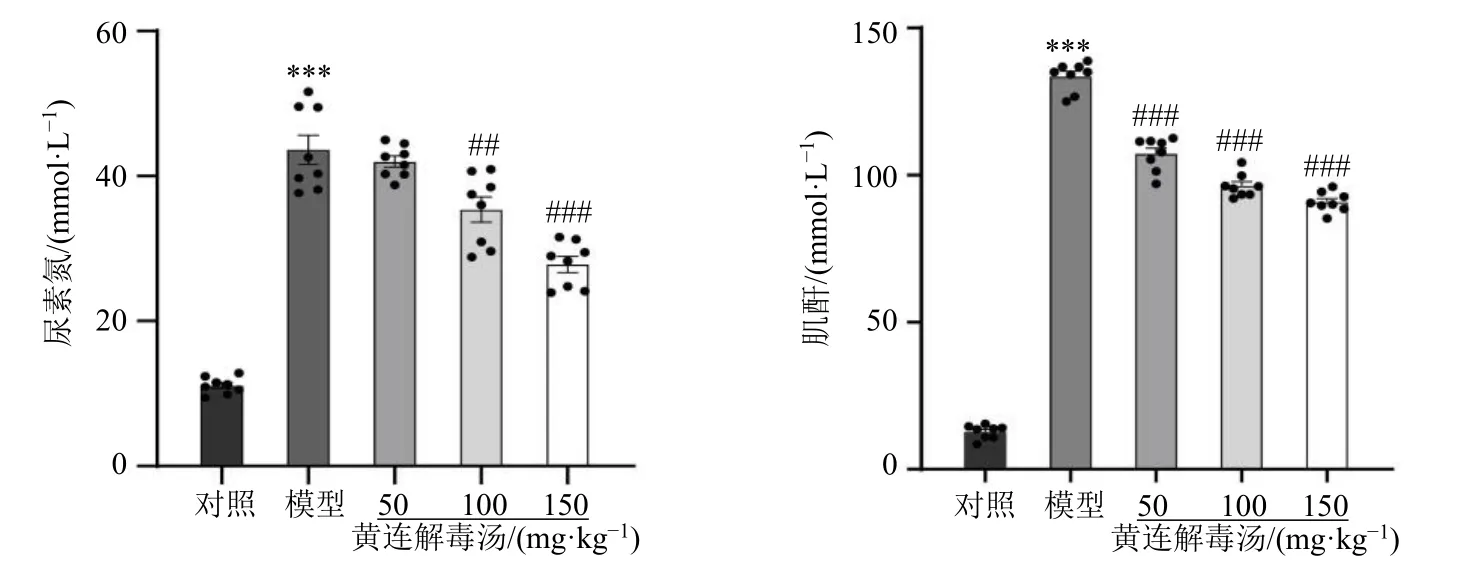
图2 黄连解毒汤对脓毒症相关性AKI 小鼠血清中尿素氮和肌酐水平的影响 (±s, n = 5)Fig.2 Effect of Huanglian Jiedu Decoction on levels of urea nitrogen and creatinine in serum of sepsis related-AKI mice(±s, n = 5)
3.3 黄连解毒汤对脓毒症相关性AKI 小鼠肾脏组织病理变化的影响
如图3 所示,HE 染色可见对照组小鼠肾脏组织形态正常,无明显病变。模型组小鼠肾脏组织肾小管结构失常,可见管型,肾小管上皮细胞脱落,细胞核轮廓不清晰,说明在LPS 诱导下发生小管凝固性坏死。与模型组比较,各给药组不同程度减轻了脓毒血症对肾脏组织的损伤,肾小管坏死情况明显改善。
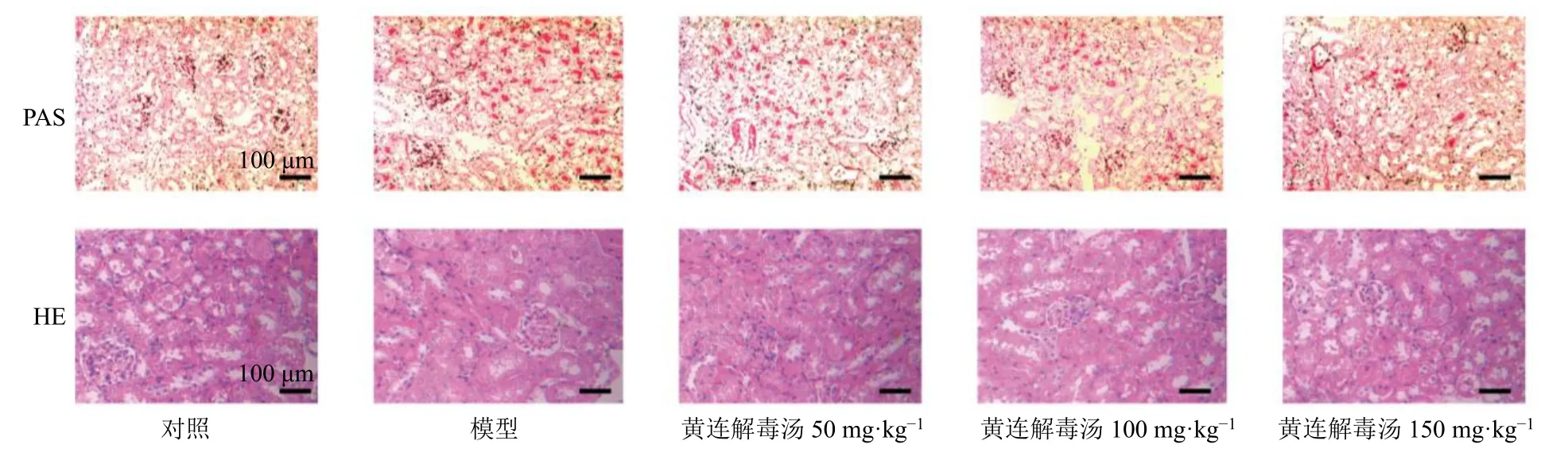
图3 黄连解毒汤对脓毒症相关性AKI 小鼠肾脏组织病理变化的影响 (×200)Fig.3 Effect of Huanglian Jiedu Decoction on pathological changes of renal tissue in sepsis related-AKI mice (× 200)
PAS 染色通常用于测定微绒毛、基底膜和主要在组织中的多糖积累[7]。对照组小鼠中观察到广泛的PAS 染色区域的管状微绒毛和基底层,表明肾组织的结构相对完整。模型组小鼠肾脏中结构完整区域显著减少,可见轻微扩张的肾小管和肿胀的肾小管细胞[8]。给予黄连解毒汤干预后,结构失常的肾小管和肾小管细胞显著恢复。
3.4 黄连解毒汤对脓毒症相关性AKI 小鼠肾组织Bax 和Bcl-2 表达的影响
Bax 和Bcl-2 是调控细胞凋亡的2 个关键蛋白,Bax 和Bcl-2 间的平衡决定了细胞是否进入凋亡[9]。为了验证在小鼠脓毒症相关性AKI 过程中是否存在细胞损伤和凋亡,通过免疫组化技术检测Bax/Bcl-2 在模型小鼠肾组织中的蛋白表达和分布情况。如图4 所示,模型组小鼠肾组织中观察到强烈的Bax 信号,Bcl-2 表达微弱。与模型组比较,各给药组小鼠肾组织Bax 表达降低,说明黄连解毒汤在一定程度上能够延缓和减轻细胞凋亡的进程,进而发挥治疗作用。
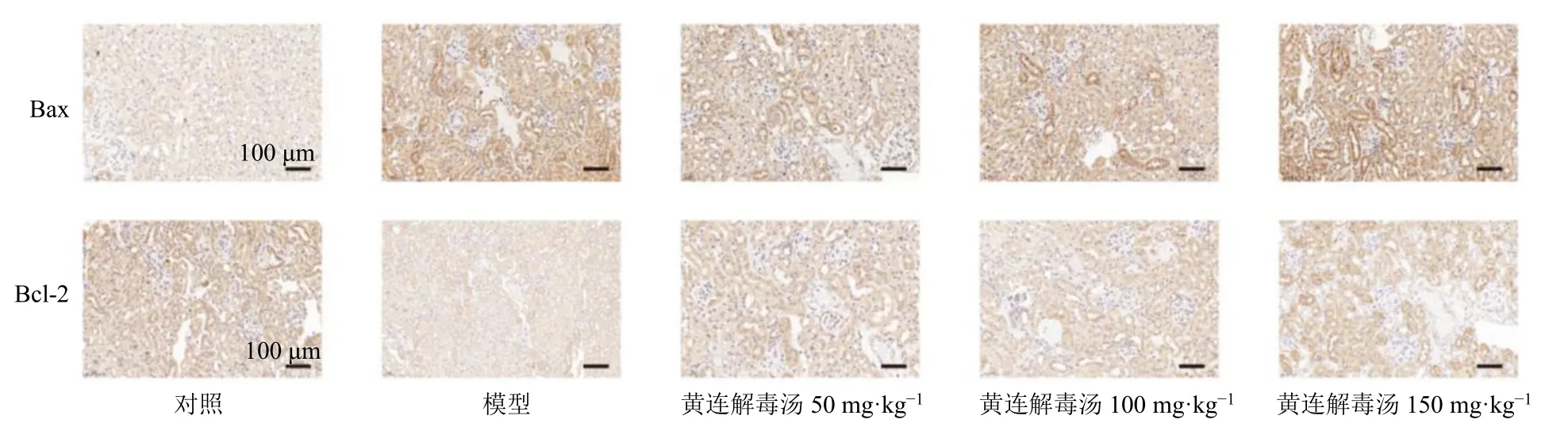
图4 黄连解毒汤对脓毒症相关性AKI 小鼠肾组织Bax 和Bcl-2 表达的影响 (×200)Fig.4 Effect of Huanglian Jiedu Decoction on Bax and Bcl-2 expressions in kidney tissue of sepsis related-AKI mice (× 200)
3.5 黄连解毒汤对脓毒症相关性AKI 小鼠肾组织细胞凋亡的影响
为了进一步探究黄连解毒汤对细胞凋亡的影响,采用TUNEL 染色法检测肾组织细胞凋亡情况。如图5 所示,细胞核复染后为蓝色,凋亡细胞核为绿色。模型组小鼠肾组织中TUNEL 阳性细胞数量增加,黄连解毒汤各剂量组小鼠肾组织凋亡细胞显著减少。

图5 黄连解毒汤对脓毒症相关性AKI 小鼠肾组织细胞凋亡的影响 (×400)Fig.5 Effect of Huanglian Jiedu Decoction on cell apoptosis in kidney tissue of sepsis related-AKI mice (× 400)
3.6 黄连解毒汤对脓毒症相关性AKI 小鼠肾组织PTEN/PI3K/Akt 通路相关蛋白表达的影响
如图6 所示,与对照组比较,模型组小鼠肾组织PI3K和Akt蛋白表达水平均显著降低(P<0.05),p-Akt、p-PI3K 和PTEN 蛋白表达水平均显著升高(P<0.05);与模型组比较,各给药组p-Akt 和p-PI3K 蛋白表达水平均显著降低(P<0.05);黄连解毒汤中、高剂量组Akt 蛋白表达水平显著升高(P<0.05);黄连解毒汤高剂量组PI3K 蛋白表达水平显著升高(P<0.05),PTEN 蛋白表达水平显著降低(P<0.05)。
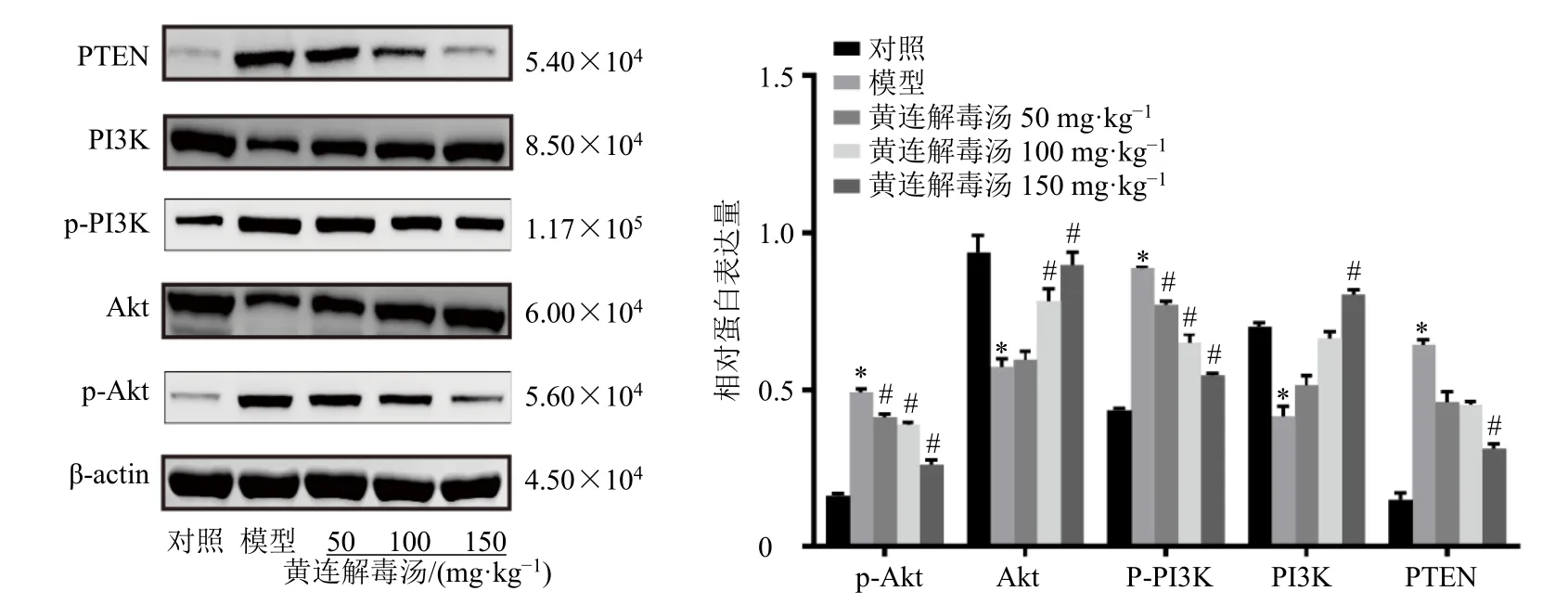
图6 黄连解毒汤对脓毒症相关性AKI 小鼠肾组织PTEN/PI3K/Akt 通路相关蛋白表达的影响 (±s, n = 5)Fig.6 Effect of Huanglian Jiedu Decoction on expressions of PTEN/PI3K/Akt pathway related-proteins in renal tissue of sepsis related-AKI mice (±s, n = 5)
4 讨论
本研究结果显示,LPS 诱导的小鼠肾组织出现肾小管上皮细胞坏死、变性,肾小管扩张等病理学损伤,这与先前相关研究报道基本一致[10]。经黄连解毒汤干预后,肾组织损伤出现不同程度减轻,表明黄连解毒汤对肾脏具有保护作用,并能够抑制肾细胞凋亡。细胞凋亡由多种因素诱导,其中炎症是脓毒症相关性AKI 中最显著的因素之一。免疫组化结果显示,黄连解毒汤能够调节肾脏组织中Bax/Bcl-2 的表达水平,表明黄连解毒汤可通过抑制炎症反应来减轻AKI 小鼠细胞凋亡。PI3K/Akt 通路由于肾细胞中的凋亡增加而被显著抑制,并伴随有PTEN 表达的激活。而黄连解毒汤干预后,可呈剂量相关性地激活PI3K/Akt,并且与二者的磷酸化水平密切相关,这表明抑制肾细胞凋亡可能是延迟脓毒症相关性AKI 进展的关键机制。
长期或过度的炎症反应可能会对组织造成损害,甚至导致疾病的发生和进展。这时,细胞凋亡就会介入其中。细胞凋亡是一种精确调控的程序性死亡方式,通常被认为是维持组织稳态和免疫平衡的关键机制之一[11]。在细胞凋亡中,受到损伤或异常的细胞会启动一系列信号通路,最终导致细胞的死亡[12]。因此在治疗过程中,合理调控炎症与细胞凋亡将会对脓毒症相关性AKI 的预后产生重要的作用。在前期研究中,PTEN/PI3K/Akt 通路在细胞凋亡过程中扮演着重要的角色[13]。特别是该通路涉及多个关键分子,包括PTEN、PI3K 和Akt,它们相互作用以调节细胞平衡。PTEN 是一个重要的信号分子,其主要功能是通过去磷酸化作用,将磷脂酰肌醇 3,4,5 三磷酸(phosphatidylinositol 3,4,5-trisphosphate,PIP3)转化为磷脂酰肌醇4,5 二磷酸(phosphatidylinositol 4,5-bisphosphate,PIP2)[14],从而降低PI3K/Akt 通路的活性。PI3K 被激活后会催化PIP2 转化为PIP3,进而促进Akt 的活化。Akt是重要的细胞生存信号传导分子,其活化可以通过磷酸化多个底物来促进细胞生存、增殖和抵抗凋亡[15]。正常情况下,PTEN 通过抑制PI3K/Akt 通路的活性,从而维持细胞的稳态。当细胞受到外界的凋亡信号,比如DNA 损伤或细胞环境的压力,通路的平衡遭到破坏,导致Akt 的活性下降。PTEN/PI3K/ Akt 通路的变化对多个凋亡调控因子的表达和活性产生影响,Bcl-2 家族蛋白是一个重要的例子,它们在细胞凋亡的调控中发挥着关键作用。通常,高活化的Akt 会抑制Bcl-2 家族凋亡抑制蛋白的表达,从而减少细胞凋亡的倾向[16]。然而,当PTEN 活性增加,导致Akt 活性降低时,细胞中的Bcl-2 家族凋亡促进蛋白的表达增加,进而促使细胞走向凋亡途径[17]。此外,Akt 在调节细胞凋亡中还通过调控其他通路和底物来发挥作用。例如,Akt 可以通过抑制Bad 蛋白的磷酸化来促进细胞生存,而磷酸化的Bad 可以与Bcl-2 蛋白家族相互作用以减少凋亡的倾向。同时,Akt 还可以通过调节FoxO 转录因子的活性[18],影响多个与细胞凋亡相关基因的表达。
中医认为脓毒症相关性AKI 可根据其疾病表现归于“关格”“癃闭”等范畴,《景岳全书》[19]云:“五脏之伤,穷必及肾。”肾乃先天之本,是全身脏腑阴阳之本,脓毒血症起病急迫,其病因病机多为湿热内蕴,毒扰心神[20]。湿热熏蒸于肾,肾气失于气化,或三焦决渎无权,通调水道失职或外感湿邪,郁而化热,湿热之邪循经下注,蕴结于肾,移于膀胱,水与热结,形成湿热内盛,致使膀胱气机不畅,故常见少尿、无尿[21];本病总属虚实夹杂、本虚标实。主要由于正气不足、热毒湿浊羁留,但如邪毒不除,瘀滞络脉,则脾不能升清降浊、化生气血,肾不能气化固摄,故精微不断流失而使正气愈虚、水湿浊毒羁留进一步损伤正气,病来汹涌,危及生命,形成恶性循环。在临床实践中,脓毒血症作为一种严重的全身性炎症反应,多见高热、口渴、烦躁以及神志不清等表现,根据温病学派“到气方可清气”的学术思想[22],此阶段多属于气分证邪正交争,由浅及深的关键阶段,可见阳明热盛、湿热中阻等临床表现,故当清解气分热毒。黄连解毒汤由黄连、黄芩、黄柏、栀子等组成,性苦寒直折,针对三焦热盛证,功能泻火解毒[23]。Zheng 等[24]研究认为黄连解毒汤在干预结肠炎小鼠的过程中可减轻DSS-V 小鼠的抑郁样行为,同时降低白细胞介素-6(interleukin-6,IL-6)、IL-10和DNAX 相关蛋白12(DNAX-associated protein 12,Dap12)mRNA 的表达,起到了抗炎、抗氧化作用。黄连解毒汤的现代药理学[25]研究证明其主要成分来源于黄芩、黄连、黄柏3 味药材,具体包括小檗碱、黄连碱、黄柏碱等,前期的研究已充分证实了其在炎症反应和细胞凋亡的抑制中具有显著疗效。而本研究意在进一步阐明黄连解毒汤作用于细胞凋亡的深层机制[26]。
本研究通过动物实验验证了黄连解毒汤能够减轻小鼠脓毒症相关性AKI 的进展并起到了肾脏保护作用。黄连解毒汤在缓解细胞凋亡中的治疗作用可能归因于PTEN/PI3K/Akt 信号通路的激活。这些发现将为黄连解毒汤的临床应用提供新的实验依据和理论支持,同时有助于更好地阐释中药复方在肾病防治中的科学内涵。在未来的研究中,将会聚焦细胞研究以及临床研究,深度挖掘黄连解毒汤对于脓毒症相关性AKI 的分子调控机制。
利益冲突所有作者均声明不存在利益冲突

