经典名方养胃汤基准样品UPLC 指纹图谱及含量测定研究
熊良益 ,高永坚,林碧珊,梁浩明,杨敏娟,张 蜀 *
1. 广东药科大学 新药研发中心,广东 广州 510006
2. 国药集团广东环球制药有限公司,广东 佛山 528305
3. 广东省药物新剂型重点实验室,广东 广州 510006
养胃汤出自《古代经典名方目录(第一批)》[1]中的第68 首,源自《证治准绳》(明·王肯堂)。处方记载“治外感风寒,内伤生冷,憎寒壮热,头目昏疼,不问风寒二证,夹食停痰,俱能治之。但感风邪,以微汗为好。”功能主治为外感风寒、内伤生冷、恶心呕吐等。由清半夏、姜厚朴、麸炒苍术、橘红、广藿香叶、草果仁、茯苓、人参、炒甘草、生姜、乌梅11 味药味组成,各药味之间相辅相成,共奏温中理气、燥湿和胃之功。临床上,养胃汤常用于治疗消化道[2]、慢性胃炎[3]等疾病。2021 年9月国家药品监督管理局发布《按古代经典名方目录管理的中药复方制剂药学研究技术指导原则(试行)》指出“基准样品”[4]是桥接古代经典名方和中药3.1 类制剂,是还原根据古籍记载制备汤剂的参比物质,对于经典名方制剂的开发至关重要。
关于养胃汤基准样品成分和质量控制研究相对较少,大多集中于单味药、药对化学成分或是化裁方的药效研究[5-10],较缺乏对养胃汤更为综合、全面的质量控制方法的研究。本研究采用UPLC 建立了养胃汤基准样品的指纹图谱与7 种成分的含量测定方法,从定性和定量2 个方面对养胃汤基准样品进行全面研究,为养胃汤后续药学研究及其相关制剂的开发提供参考。
1 仪器与材料
1.1 仪器
LC-40DXS 型岛津高效液相色谱仪,岛津企业管理(中国)有限公司;Waters H-Class 型超高效液相色谱仪,美国Waters 公司;ME204E 型万分之一电子分析天平,上海梅特勒-托利多仪器有限公司;PL203 型百万分之一电子分析天平,上海梅特勒-托利多公司;Unique-R202 型多功能超纯水系统,厦门锐思捷水纯化技术有限公司;KQ-500DE 型超声清洗仪,昆山市超声仪器有限公司;FD.1C.50 型冷冻干燥机,北京博医康实验仪器有限公司。
1.2 材料
对照品人参皂苷Rg1(Rg1,批号110703-202034,质量分数94.0%)、人参皂苷Re(Re,批号110754-202129,质量分数96.0%)、人参皂苷Rb1(Rb1,批号110704-202129,质量分数94.3%)、橙皮苷(批号110721-202019,质量分数95.3%)、厚朴酚(批号110729-202015,质量分数99.0%)、和厚朴酚(批号110730-201915,质量分数99.8%)、甘草酸(批号10731-202122,质量分数94.4%)、甘草苷(批号111610-201908,质量分数95.0%)、广藿香酮(批号111822-201904,质量分数99.0%)、绿原酸(批号110753-035,质量分数98.0%)、6-姜辣素(批号1118-2020070,质量分数99.3%)、奎宁酸(批号111717-20140,质量分数94.5%)、柚皮苷(批号110722-202116,质量分数93.5%)、毛蕊花糖苷(批号111530-201914,质量分数95.2%)、川陈皮素(批号112055-202102,质量分数99.7%)、橘皮素(批号112054-202102,质量分数99.7%)、腺苷(批号110879-201703,质量分数99.7%)、鸟苷(批号111977-201501,质量分数93.6%),均购自中国食品药品检定研究院;对照品苍术苷A(批号126054-77-1,质量分数98.0%)购自中科华检(北京)科技有限公司;对照品儿茶素(批号Lot5878,质量分数98.0%)、芹糖甘草苷(批号74639-14-8,质量分数98.0%)均购自上海诗丹德标准技术服务有限公司;对照品新绿原酸(批号DST180130-015,质量分数99.0%)、隐绿原酸(批号DST170210-035,质量分数98.0%)均购自成都德思特生物科技有限公司。色谱甲醇、色谱乙腈,购自Dikma 科技有限公司;色谱磷酸,购自上海阿拉丁生化科技股份有限公司;分析甲醇,购自广州化学试剂厂;超纯水,实验室自制。
11 味药材均购于其道地产地或主产区,经国药集团广东环球制药有限公司质量部刘国慧副主任中药师鉴定,各药材基原如下:人参为五加科人参属植物人参PanaxginsengC. A. Mey.的干燥根和根茎,半夏为天南星科半夏属植物半夏Pinelliaternata(Thunb.) Breit.的干燥块茎,厚朴为木兰科厚朴属植物厚朴MagnoliaofficinalisRehd. et Wils 的干燥干皮及枝皮,苍术为菊科苍术属植物茅苍术Atractylodes lancea(Thunb.) DC.的干燥根茎,橘红为芸香科柑橘属植物橘CitrusreticulataBlanco 及其栽培变种的干燥外层果皮,广藿香为唇形科刺蕊草属植物广藿香Pogostemoncablin(Blanco) Benth.的干燥叶,草果为姜科豆蔻属植物草果Amomumtsao-koCrevost et Lemaire 的干燥成熟果实,茯苓为多孔菌科茯苓属真菌茯苓Poriacocos(Schw.) Wolf 的干燥菌核,甘草为豆科甘草属植物甘草GlycyrrhizauralensisFisch.干燥根和根茎,生姜为姜科姜属多年生草本植物姜ZingiberofficinaleRoscoe 的新鲜根状茎,乌梅为蔷薇科李属木本植物梅Prunusmume(Sieb.) Sieb.et Zucc.的近成熟果实。各药材按《中国药典》2020年版一部项下检测均合格。本研究参考《中国药典》2020 年版药材项下炮制方法,对药材进行炮制及检测,在检测合格的基础上采用随机数表法将不同批次药材进行组合,药材批号及产地组合信息见表1。
2 方法与结果
2.1 基准样品的制备
原方记载:半夏(汤洗七次)、厚朴(去粗皮、姜汁炒)、苍术(米泔浸一宿,洗切,炒)各一两,橘红七钱半,藿香叶(洗去土)、草果(去皮膜)、茯苓(去黑皮)、人参(去芦)各半两,炙甘草二钱半。右㕮咀,每服四钱,水一盏半,姜七片,乌梅一个,煎六分,热服。按照《中国科学技术史·度量衡卷》[11]记载,明代衡量单位量值小于元代,1 斤量值在596.8 g。而1 斤为16 两,因此1 两折合为37.3 g;1 钱折合为3.73 g。《医学正传》[12]凡例:“凡云用水一盏,即今之白茶盏也,约计半斤之数,余仿此”。明朝1 斤重596.8 g[13],则所述“一盏水”重298.4 g,约300 g,即300 mL。因此,本实验采取1 盏等于300 mL 来折算,再看煎煮方法,本方为煮散剂,参考文献查阅[14],即得养胃汤处方为清半夏37.30 g,姜厚朴37.30 g,麸炒苍术37.30 g,橘红27.98 g,广藿香叶18.65 g,草果仁18.65 g,茯苓18.65 g,人参18.65 g,炒甘草9.33 g,粉碎成粗粉,生姜7 g,乌梅2.65 g,加水450 mL,武火煮沸后文火煎至270 mL,趁热滤过。分装至西林瓶,-50 ℃预冷冻3 h 后冷冻干燥72 h,压盖密塞,即得到养胃汤基准样品冻干粉。
2.2 溶液的制备
2.2.1 对照品溶液 取奎宁酸、腺苷、鸟苷、新绿原酸、苍术苷A、绿原酸、隐绿原酸、儿茶素、甘草苷、芹糖甘草苷、柚皮苷、橙皮苷对照品,精密称定,加甲醇制成质量浓度分别为21.3、25.6、24.0、22.1、28.7、25.2、29.8、20.5、23.1、20.3、21.0、22.3 μg/mL 的混合对照品溶液1。取毛蕊花糖苷、甘草酸、6-姜辣素、川陈皮素、橘皮素、和厚朴酚、广藿香酮、厚朴酚对照品,精密称定,加甲醇制成质量浓度分别为21.0、24.3、28.2、20.3、26.8、23.2、21.5、22.7 μg/mL 的混合对照品溶液2。
2.2.2 供试品溶液 取基准样品约0.5 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇10 mL,称定质量,超声处理(功率250 W、频率40 kHz)30 min,放冷,再称定质量,用50%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得供试品溶液。
2.2.3 阴性对照溶液 按“2.1”项下制备方法,分别制备缺清半夏、缺姜厚朴、缺麸炒苍术、缺橘红、缺广藿香叶、缺草果仁、缺茯苓、缺人参、缺炒甘草、缺生姜、缺乌梅的阴性基准样品。取阴性基准样品适量,按“2.2.2”项下制备方法分别制备各阴性供试品溶液,即得。
2.2.4 单味药对照溶液 按“2.1”项下制备方法,分别制备清半夏、姜厚朴、麸炒苍术、橘红、广藿香叶、草果仁、茯苓、人参、炒甘草、生姜、乌梅单味药基准样品。取单味药基准样品适量,按“2.2.2”项下制备方法分别制备各单味药供试品溶液。
2.3 养胃汤UPLC 指纹图谱研究
2.3.1 色谱条件
(1)指纹图谱I:色谱柱为Waters UPLC BEH C18柱(150 mm×2.1 mm,1.7 μm);流动相为乙腈-0.1%磷酸水溶液,梯度洗脱:0~15 min,8%乙腈;15~40 min,8%~15%乙腈;40~65 min,15%~21%乙腈;检测波长为300 nm;体积流量为0.30 mL/min;柱温35 ℃;进样量1 μL。
(2)指纹图谱II:色谱柱为Waters UPLC BEH C18柱(150 mm×2.1 mm,1.7 μm);流动相为乙腈-0.1%磷酸水溶液;梯度洗脱:0~5 min,25%乙腈;5~60 min,25%~50%乙腈;60~70 min,50%~75%乙腈;检测波长为203 nm;体积流量为0.30 mL/min;柱温35 ℃;进样量1 μL。
2.3.2 精密度试验 按“2.2.2”项下方法制备供试品溶液,按“2.3.1”项下色谱条件连续进样6 次,结果2 张指纹图谱各共有峰相对保留时间的RSD均<1.2%,相对峰面积的RSD 均<7.0%,结果表明该仪器精密度良好。
2.3.3 稳定性试验 按“2.2.2”项下方法制备供试品溶液,分别在0、3、6、9、12、15、18、21、24 h,按“2.3.1”项下色谱条件进样分析,结果2 张指纹图谱各共有峰相对保留时间的RSD 均<0.7%,相对峰面积的RSD 均<4.7%,结果表明供试品溶液在24 h 内稳定。
2.3.4 重复性试验 按“2.2.2”项下方法平行制备6 份供试品溶液,按“2.3.1”项下色谱条件进行测定,结果2 张指纹图谱各共有峰相对保留时间的RSD 均<1.0%,相对峰面积的RSD 均<4.8%,结果表明该方法重复性较好。
2.3.5 耐用性考察 按“2.2.2”项下方法制备供试品溶液,按“2.3.1”项下色谱条件测定,考察不同仪器Waters H-Class UPLC TUV、Waters H-Class UPLC PDA;不同色谱柱选择同一厂家不同生产批次的Waters UPLC BEH C18(150 mm×2.1 mm,1.7 μm)色谱柱;不同柱温33、35、37 ℃;不同体积流量0.27、0.30、0.33 mL/min 下,2 张指纹图谱各共有峰相对保留时间的RSD 均<3.0%,相对峰面积的RSD 均<5.0%,结果表明该指纹图谱方法在不同仪器、色谱柱、柱温、流动相体积流量下,该方法耐用性良好。
2.4 UPLC 指纹图谱的建立及相似度评价
取15 批基准样品(S1~S15)适量,按“2.2.2”项下方法制备供试品溶液,按“2.3.1”项下色谱条件进样测定。将上述数据结果导入“中药色谱指纹图谱相似度评价系统”软件(2012 版),以S1 为参照图谱,采用中位数法,时间窗宽度为0.1 min,进行峰多点校正和mark 峰匹配,其中指纹图谱I 匹配了24 个共有峰(图1),指纹图谱II 匹配了21 个共有峰(图1)。15 批基准样品(S1~S15)2 张指纹图谱相似度均>0.9(表2),结果表明,不同产地饮片制备所得养胃汤基准样品的物质基础成分组成较接近。
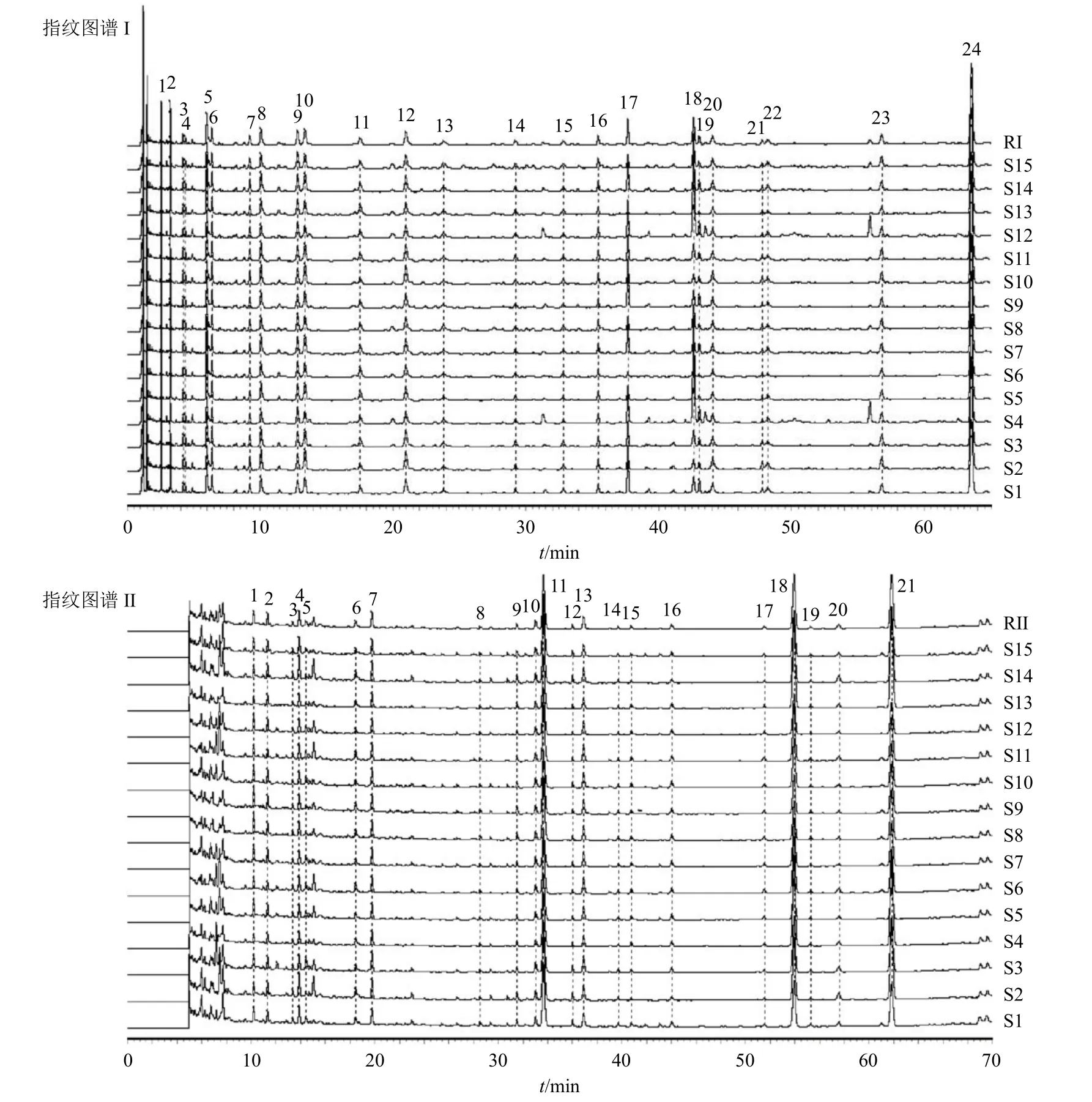
图1 15 批养胃汤基准样品 (S1~S15) 的UPLC 指纹图谱I、II 叠加图及其共有模式图谱 (RI、RII)Fig.1 UPLC fingerprint I, II overlays of 15 batches of Yangwei Decoction benchmark samples (S1-S15) and common pattern maps (RI, RII)
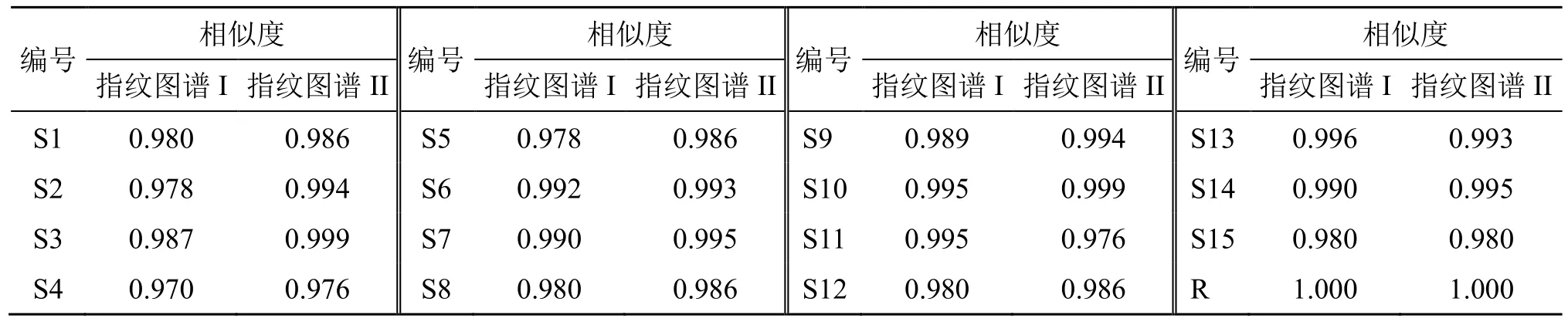
表2 15 批养胃汤基准样品 (S1~S15) 指纹图谱I、II 的相似度评价结果Table 2 Similarity evaluation results of fingerprints I, II of 15 batches of Yangwei Decoction benchmark samples (S1-S15)
2.5 共有峰归属
按“2.2.3”“2.2.4”项下方法制备阴性、单味药对照溶液,按“2.3.1”项下色谱条件进样测定,记录色谱图。根据2 套指纹图谱的相似度匹配结果对共有峰进行编号,经对照品、基准样品、单味药样品、各单味药阴性样品相关图谱色谱峰比对。
图谱结果显示:(1)指纹图谱I:1、2、5、9~11、14 号峰归属乌梅;2 号峰归属清半夏;1、2、6 号峰归属麸炒苍术;3、4 号峰归属茯苓;6~8、10、12、15、17、22~24 号峰归属橘红;13 号峰归属草果仁;14、16、18、19 号峰归属姜厚朴;20、21 号峰归属炒甘草(图2);(2)指纹图谱II:1、5、6、12、18、21 号峰归属姜厚朴;2、3、5、7、10、13~15 号峰归属橘红;8、9、12、17、19 号峰归属炒甘草;11 号峰归属生姜;15~17、20 号峰归属广藿香叶(图3)。其中,指纹图谱II 中11 号峰(6-姜辣素)在生姜、姜厚朴单味药中均具有明显色谱峰,但在厚朴单味药基准样品中未有响应,即姜厚朴单味药中6-姜辣素是因为厚朴与姜汁一起炮制而引入,所以生姜是6-姜辣素(11 号峰)的唯一来源[15]。
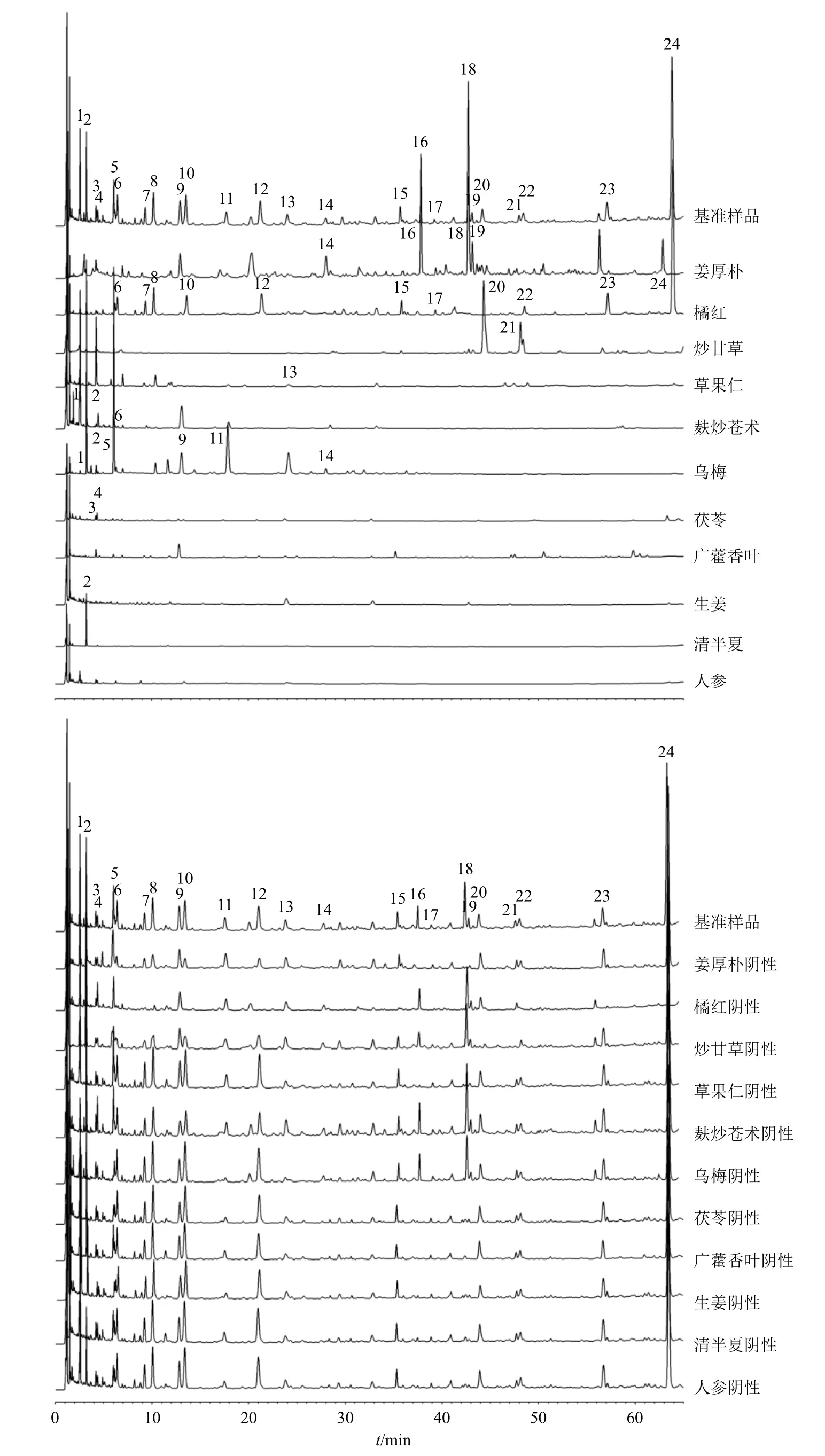
图2 养胃汤基准样品与单味饮片和阴性样品的UPLC 指纹图谱IFig.2 UPLC fingerprint I of Yangwei Decoction benchmark samples and single herbal pieces and negative samples
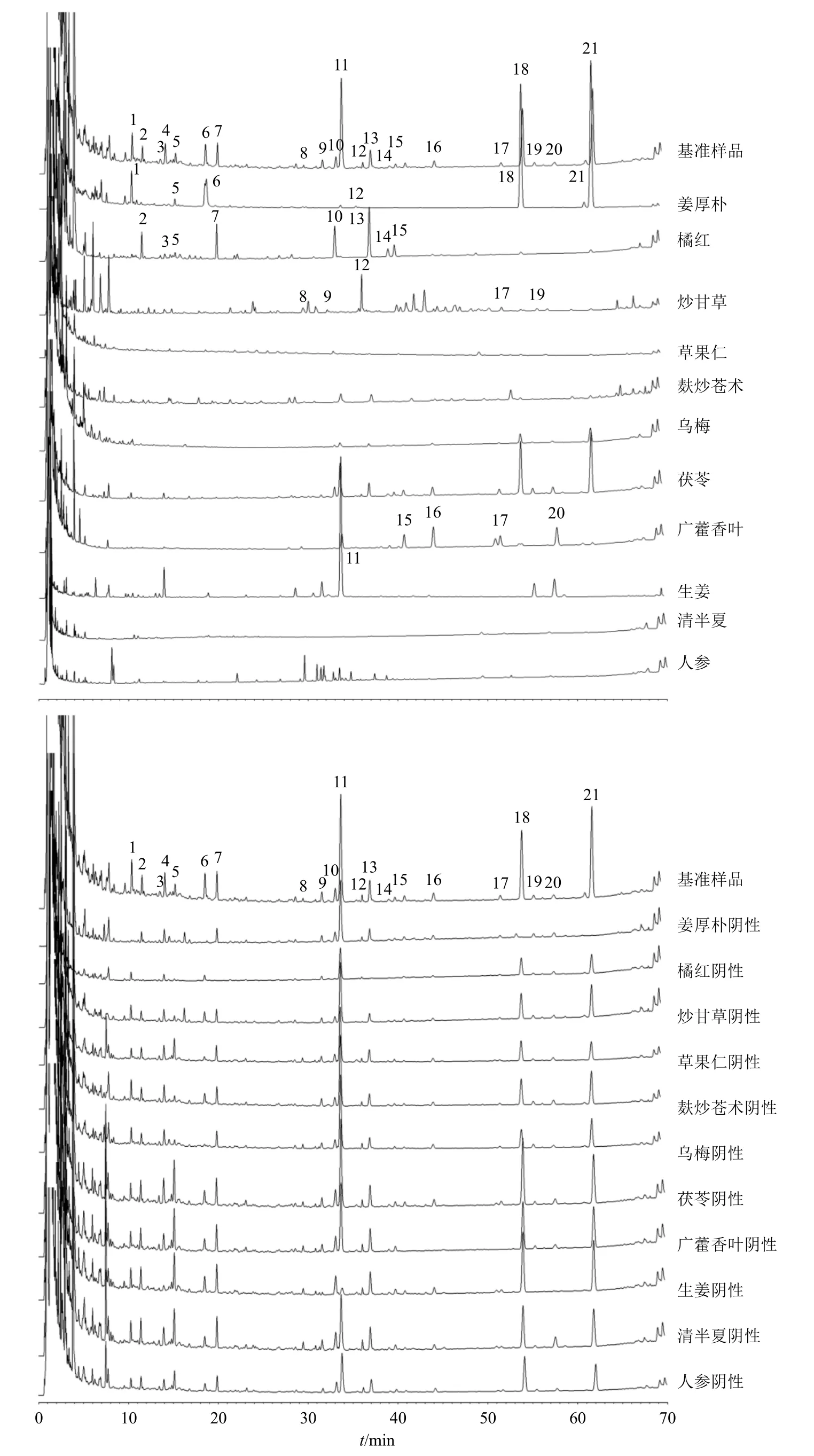
图3 养胃汤基准样品与单味饮片和阴性样品的UPLC 指纹图谱IIFig.3 UPLC fingerprint II of Yangwei Decoction benchmark samples and single herbal pieces and negative samples
2.6 色谱峰指认
养胃汤基准样品指纹图谱共标定了45 个特征峰,通过与对照品色谱峰进行比对指认出20 个色谱峰。其中,指纹图谱I 中1 号峰为奎宁酸、3 号峰为腺苷、4 号峰为鸟苷、5 号峰为新绿原酸、6 号峰为苍术苷A、9 号峰为绿原酸、11 号峰为隐绿原酸、13 号峰为儿茶素、20 号峰为甘草苷、21 号峰为芹糖甘草苷、23 号峰为柚皮苷、24 号峰为橙皮苷(图4);指纹图谱II 中4 号峰为毛蕊花糖苷、9 号峰为甘草酸、11 号峰为6-姜辣素、13 号峰为川陈皮素、15 号峰为橘皮素、18 号峰为和厚朴酚、20 号峰为广藿香酮、21 为号峰为厚朴酚(图5)。
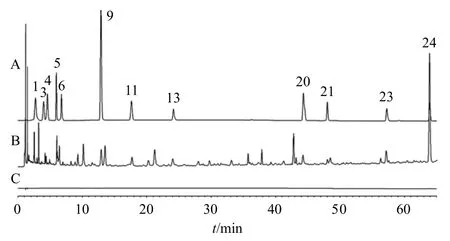
图4 混合对照品 (A)、养胃汤基准样品 (B) 和空白溶剂(C) 的UPLC 指纹图谱IFig.4 UPLC fingerprint I of mixed reference solution (A),Yangwei Decoction benchmark sample (B) and blank solution (C)
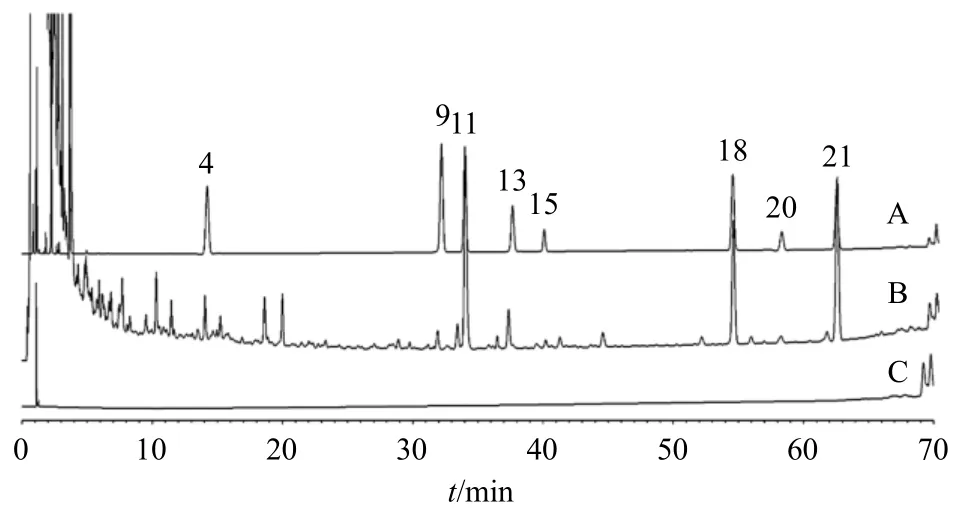
图5 混合对照品 (A)、养胃汤基准样品 (B) 和空白溶剂(C) 的UPLC 指纹图谱IIFig.5 UPLC fingerprint II of mixed reference solution (A),Yangwei Decoction benchmark sample (B) and blank solution (C)
2.7 养胃汤中多指标成分定量测定
2.7.1 色谱条件
(1)Rg1、Re、Rb1:色谱柱为Waters Cortecs C18柱(100 mm×2.1 mm,1.6 μm);流动相为乙腈-水;梯度洗脱:0~7.0 min,19%乙腈;7.0~10.5 min,19%~25%乙腈;10.5~22.0 min,25%~29%乙腈;22.0~31.0 min,29%~47%乙腈;31.0~39.0 min,47%~80%乙腈;体积流量0.30 mL/min;柱温为30 ℃;检测器:ELSD,漂移管温度85 ℃;气体体积流量1.5 L/min。理论塔板数按Rb1峰计算不低于5 000。
(2)橙皮苷:色谱柱为Waters HSS T3 C18柱(100 mm×2.1 mm,1.8 μm);流动相为甲醇-水(40∶60);等度洗脱;体积流量0.30 mL/min;柱温30 ℃;检测波长284 nm。理论塔板数按橙皮苷峰计算不低于4 000。
(3)和厚朴酚、厚朴酚:色谱柱为Waters HSS T3 C18柱(100 mm×2.1 mm,1.8 μm);流动相为甲醇-水(78∶22);等度洗脱;体积流量0.30 mL/min;柱温30 ℃;检测波长294 nm。理论塔板数按厚朴酚峰计算不低于10 000。
(4)甘草酸:色谱柱为Waters BEH C18柱(100 mm×2.1 mm,1.7 μm);流动相为乙腈-0.05%磷酸水溶液(31∶69);等度洗脱;体积流量0.30 mL/min;柱温30 ℃;检测波长254 nm。理论塔板数按甘草酸峰计算不低于6 000。
2.7.2 对照品溶液的制备 取Rg1、Re、Rb1对照品,精密称定,加甲醇制成质量浓度分别为98.5、97.0、99.8 μg/mL 的混合溶液,摇匀,即得混合对照品溶液。
取橙皮苷、厚朴酚、和厚朴酚、甘草酸对照品适量,精密称定,加80%甲醇分别制成含橙皮苷40.3 μg/mL 对照品溶液,含厚朴酚22.4 μg/mL、和厚朴酚22.5 μg/mL 的混合对照品溶液,含甘草酸20.2 μg/mL 的对照品溶液,即得。
2.7.3 供试品溶液的制备
(1)Rg1、Re、Rb1:精密称取基准样品1.0 g,加水20 mL 使溶解,用水饱和正丁醇振摇提取2 次,每次30 mL,合并正丁醇液,用氨试液洗涤2 次,每次40 mL,弃去水液,正丁醇液蒸干,残渣加甲醇溶解并转移至5 mL 量瓶中,加甲醇稀释至刻度,摇匀,滤过,取续滤液,即得。
(2)和厚朴酚、厚朴酚、橙皮苷和甘草酸:精密称取基准样品0.5 g,置具塞锥形瓶中,精密加入80%甲醇25 mL,密塞,称定质量,超声处理(功率250 W、频率40 Hz)30 min,放冷,再称定质量,用80%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.7.4 阴性、单味药供试品溶液的制备 按照“2.7.3”项下供试品溶液制备方法,分别制备缺人参、橘红、姜厚朴、炒甘草的阴性供试品溶液及单味药供试品溶液。
2.7.5 专属性考察 分别取供试品溶液、对照品溶液、阴性供试品溶液、单味药供试品溶液,按照“2.7.1”项下色谱条件测定。各指标成分在阴性下无干扰,分离度、理论板数均较好,专属性强,色谱图见图6~9。
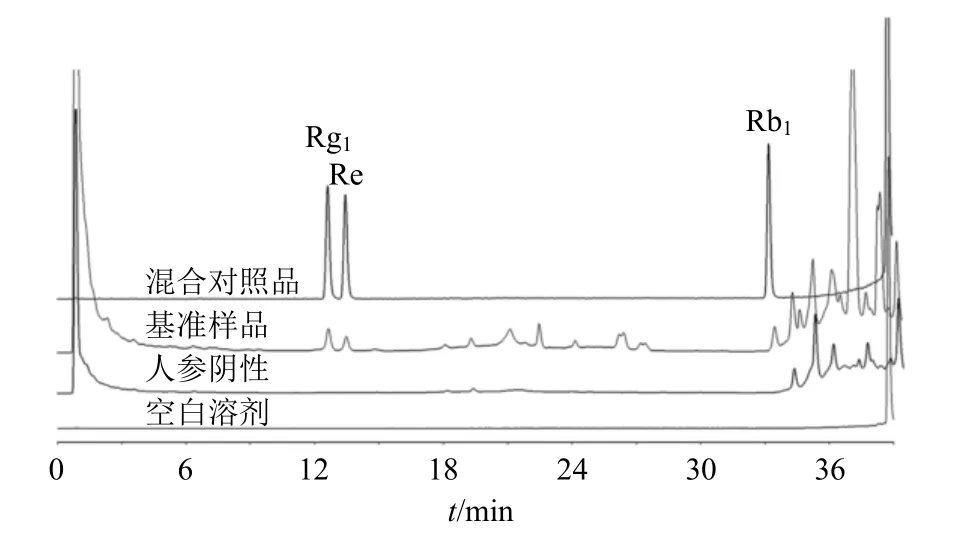
图6 养胃汤基准样品中Rg1、Re 及Rb1 含量测定色谱图Fig.6 Chromatogram of Rg1, Re and Rb1 content determination in Yangwei Decoction benchmark samples
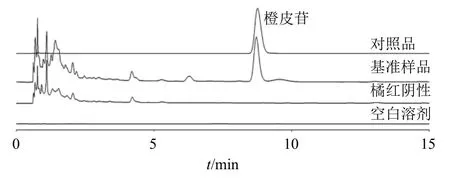
图7 养胃汤基准样品中橙皮苷含量测定色谱图Fig.7 Chromatogram of hesperidin content determination in Yangwei Decoction benchmark samples
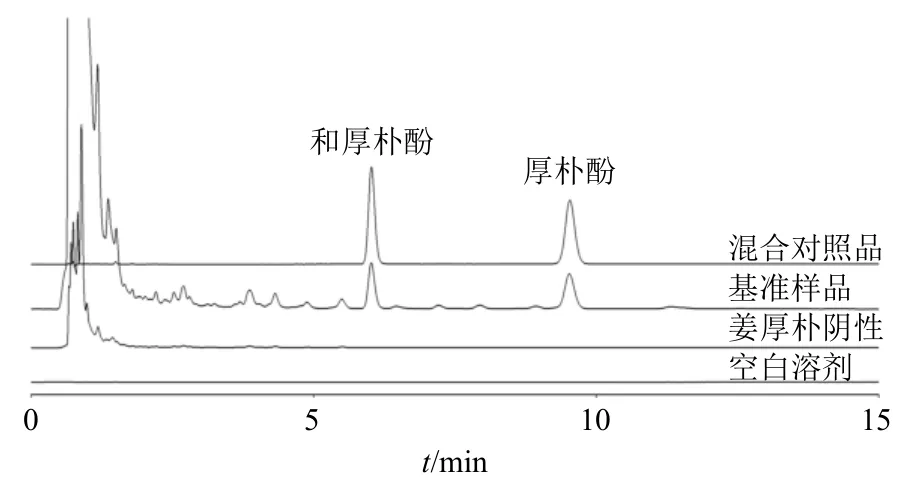
图8 养胃汤基准样品中和厚朴酚、厚朴酚含量测定色谱Fig.8 Chromatogram of honokiol and magnolol content determination in Yangwei Decoction benchmark samples
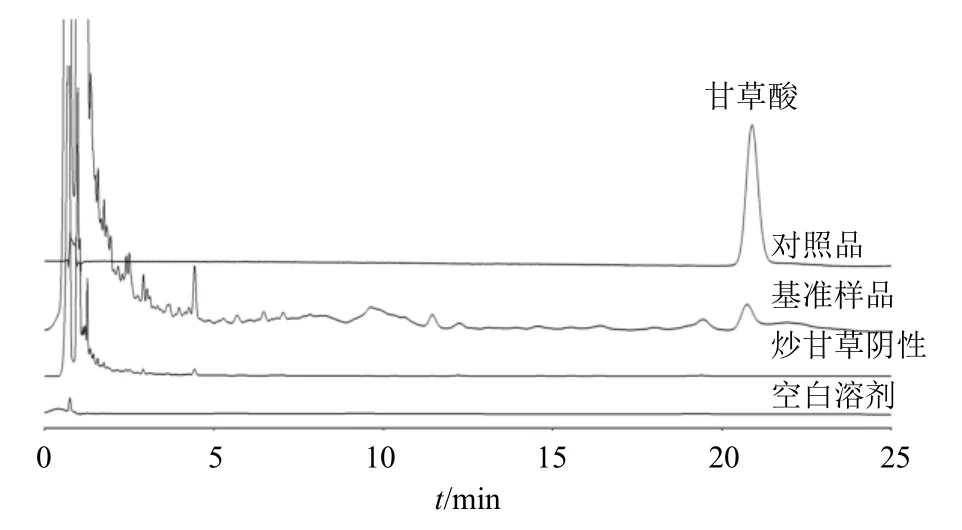
图9 养胃汤基准样品中甘草酸含量测定色谱图Fig.9 Chromatogram of glycyrrhizinic acid content determination in Yangwei Decoction benchmark samples
2.7.6 线性关系考察 分别精密吸取“2.7.2”项下混合对照品溶液适量,用相应溶剂分别稀释配制成7 个不同质量浓度的系列对照品溶液。按“2.7.1”项下色谱条件测定,以对照品溶液质量浓度或进样质量的对数为横坐标(X),测定的峰面积或其对数为纵坐标(Y),分别绘制各成分的标准曲线,进行线性回归,得回归方程及线性范围分别为Rg1Y=15 800X+67 900,r=0.999 2,线性范围24.21~484.23 μg/mL;ReY=15 700X+67 900,r=0.999 7,线性范围22.79~455.81 μg/mL;Rb1Y=15 700X+67 600,r=0.999 3,线性范围23.51~470.17 μg/mL;橙皮苷Y=60 900X-77 300,r=1.000 0,线性范围7.24~362.14 μg/mL;和厚朴酚Y=52 000X+33 000,r=0.999 8,线性范围2.52~252.25 μg/mL;厚朴酚Y=44 300X+33 800,r=0.999 8,线性范围2.20~220.16 μg/mL;甘草酸Y=5 810X+7 760,r=0.999 5,线性范围4.59~229.73 μg/mL。
2.7.7 精密度考察 按“2.7.3”项下方法制备供试品溶液1 份,按“2.7.1”项下色谱条件连续进样6次,Rg1、Re、Rb1、橙皮苷、和厚朴酚、厚朴酚、甘草酸峰面积的RSD 分别为2.2%、2.0%、1.8%、0.3%、0.5%、0.4%、1.1%,结果表明仪器精密度良好。
2.7.8 稳定性考察 按“2.7.3”项下方法制备供试品溶液1 份,分别于室温条件下放置0、2、4、6、8、10、12、24、36、48 h 后,按“2.7.1”项下色谱条件测定,记录色谱图,结果Rg1、Re、Rb1、橙皮苷、和厚朴酚、厚朴酚、甘草酸峰面积的RSD 分别为3.7%、4.5%、3.6%、1.2%、0.8%、1.1%、1.7%,结果表明该供试品溶液在48 h 内稳定。
2.7.9 重复性考察 按“2.7.3”项下方法制备6 份供试品溶液,按“2.7.1”项下色谱条件测定,Rg1、Re、Rb1、橙皮苷、和厚朴酚、厚朴酚、甘草酸的质量分数分别为0.099、0.081、0.094、0.691、0.047、0.057、0.093 mg/g,RSD 分别为3.3%、3.0%、2.9%、1.9%、3.9%、3.2%、1.8%,表明建立的方法重复性良好。
2.7.10 准确度考察 取养胃汤基准样品共9 份,按1∶0.5、1∶1、1∶1.5 比例加入对照品,按“2.7.3”项下方法制备供试品溶液,按“2.7.1”项下色谱条件测定,记录色谱图,结果Rg1、Re、Rb1、橙皮苷、和厚朴酚、厚朴酚、甘草酸的平均加样回收率分别为102.9%、101.3%、102.6%、94.8%、95.0%、107.0%、98.5%,RSD 依次为3.7%、3.4%、4.2%、3.2%、4.2%、2.1%、1.3%,结果表明建立的方法准确度良好。
2.7.11 耐用性考察 按“2.7.3”项下方法制备供试品溶液,按“2.7.1”项下色谱条件测定,考察不同液相仪器、不同色谱柱、柱温、体积流量对Rg1、Re、Rb1、橙皮苷、和厚朴酚、厚朴酚、甘草酸7 种指标成分含量的影响。
(1)不同仪器的影响:Waters H-Class UPLC TUV、Waters H-Class UPLC PDA、岛津UPLC-40 DXS 3 种仪器对7 种指标成分Rg1、Re、Rb1、橙皮苷、和厚朴酚、厚朴酚、甘草酸含量测定的RSD 分别为3.0%、2.3%、2.4%、2.9%、1.7%、1.9%、3.1%。
(2)不同色谱柱的影响:Waters HSS T3 柱(100 mm×2.1 mm,1.8 μm)、Waters Cortecs C18柱(100 mm×2.1 mm,1.6 μm)、Waters BEH C18柱(100 mm×2.1 mm,1.7 μm)对7 种指标成分Rg1、Re、Rb1、橙皮苷、和厚朴酚、厚朴酚、甘草酸含量测定的RSD 分别为3.6%、1.4%、4.2%、3.9%、2.4%、2.3%、3.7%。
(3)不同体积流量的影响:考察0.27、0.30、0.33 mL/min 3 种不同体积流量对7 种指标成分Rg1、Re、Rb1、橙皮苷、和厚朴酚、厚朴酚、甘草酸含量测定的RSD 分别为3.1%、3.4%、2.3%、3.2%、2.8%、3.0%、3.4%。
(4)不同柱温的影响:考察28、30、32 ℃ 3 种不同柱温对7 种指标成分Rg1、Re、Rb1、橙皮苷、和厚朴酚、厚朴酚、甘草酸含量测定的RSD 分别为3.6%、2.4%、1.9%、1.7%、1.6%、1.8%、2.2%。结果表明,以上考察因素测定的各指标成分含量的RSD 均小于5%,表明各考察因素对Rg1、Re、Rb1、橙皮苷、和厚朴酚、厚朴酚、甘草酸含量的测定影响较小。
2.7.12 样品测定 取15 批养胃汤基准样品(S1~S15),按“2.7.3”项下方法制备供试品溶液,按“2.7.1”项下色谱条件进样测定,以含量测定均值上下浮动30%规定出各指标成分的含量范围,结果见表3。结果表明:(1)Rg1的平均质量分数为0.120 mg/g,波动范围0.081~0.163 mg/g,均值的±30%为0.084~0.155 mg/g,S5、S8 不在范围内;Re 的平均质量分数为0.093 mg/g,波动范围0.053~0.175 mg/g,均值的±30%为0.065~0.120 mg/g,S5、S10不在范围内;Rb1的平均质量分数为0.352 mg/g,波动范围0.225~0.554 mg/g,均值的±30%为0.246~0.457 mg/g,S5、S8、S13 不在范围内;(2)橙皮苷的平均质量分数为7.015 mg/g,波动范围5.778~8.926 mg/g,均值的±30%为4.911~9.120 mg/g,均在范围内;(3)和厚朴酚+厚朴酚的平均质量分数为1.387 mg/g,波动范围0.834~2.865 mg/g,均值的±30%为0.971~1.804 mg/g,S1、S3、S5 不在范围内;(4)甘草酸的平均质量分数为1.414 mg/g,波动范围 1.060~1.825 mg/g,均值的±30%为0.990~1.838 mg/g。
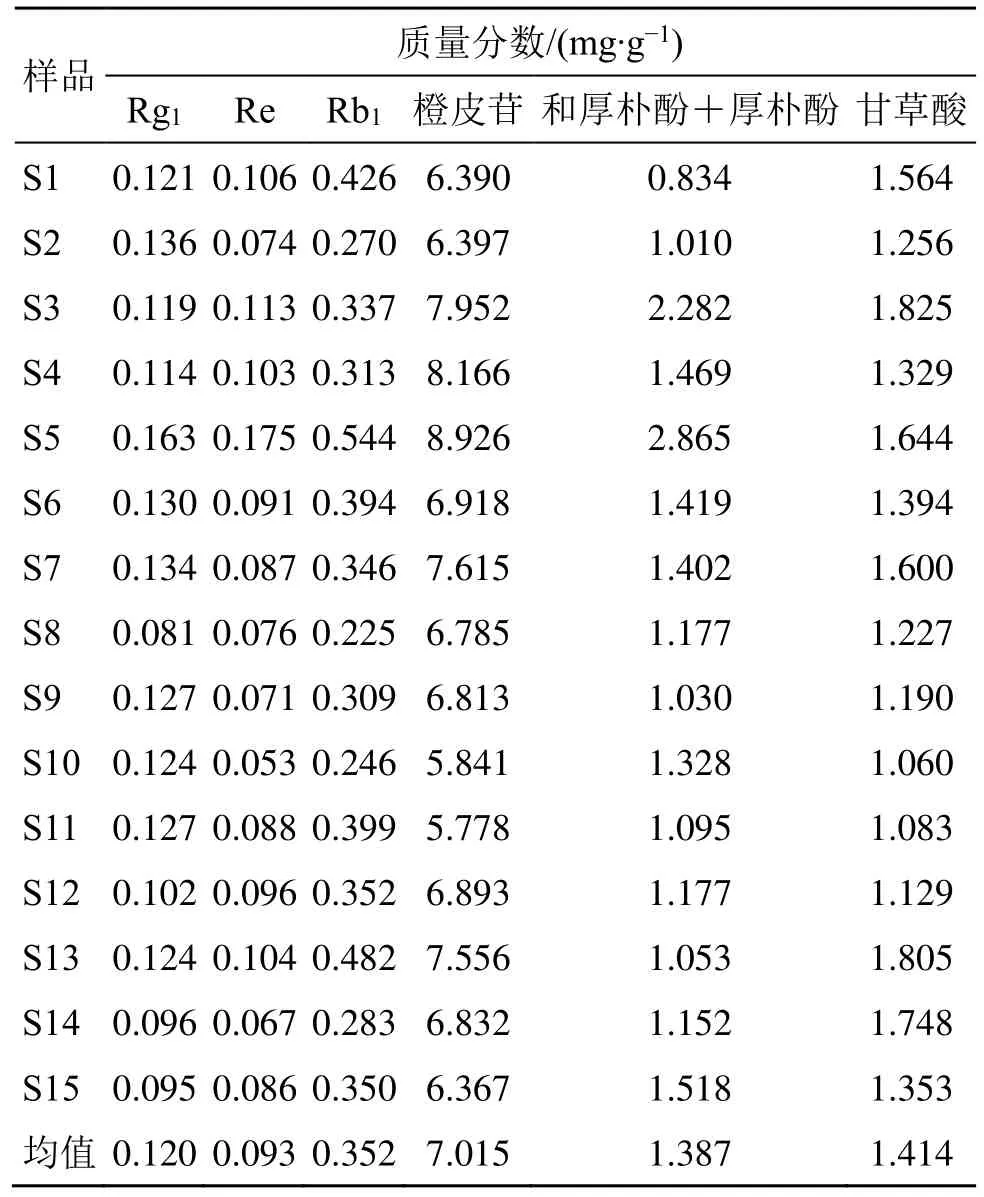
表3 15 批基准样品中7 种指标性成分含量测定Table 3 Determination of seven index components in 15 batches of benchmark samples
3 讨论
3.1 色谱条件的考察
本研究考察了不同流动相体系(乙腈-水、甲醇-水、乙腈-0.1%甲酸水溶液、乙腈-0.1%磷酸水溶液)对养胃汤色谱峰的影响,流动相为乙腈-0.1%磷酸水溶液体系时,各色谱峰响应良好,对称性好,分离度好。在上述色谱条件下,采用全波长(200~400 nm)扫描,在前期建立的一套指纹图谱方法中,由于各色谱峰分离度差、响应较低,因此根据化合物成分特点与极性大小[16],筛选2 种不同的色谱条件,其中指纹图谱I 波长为300 nm 时能够得到有机酸类、核苷类、酚酸类、黄酮类成分;指纹图谱II波长为203 nm 时能够得到苯乙醇类、糖苷类、黄酮苷元、酚类以及挥发性成分,建立的2 套指纹图谱分析方法,其色谱峰丰富,响应高,能较全面表征养胃汤基准样品内在质量。
在含量测定方法中考察了不同流动相(乙腈-水、乙腈-0.1%磷酸水溶液),不同漂移管温度(85、105 ℃)及不同载气流量(1.5、2.0 L/min)对养胃汤基准样品中人参皂苷类成分含量的影响,结果表明在流动相为乙腈-水,漂移管温度85 ℃,气体体积流量1.5 L/min 时各色谱峰响应良好,分离度好。
对建立的指纹图谱与7 种指标性成分含量测定方法进行方法学考察,均符合要求,表明所建立的方法稳定可行,可用于养胃汤基准样品的测定。
3.2 供试品溶液的考察
本研究考察了不同比例的甲醇(50%、70%、100%甲醇),不同提取方式(超声处理、加热回流)及不同提取时间(30、45、60 min)对指纹图谱色谱峰的影响,在提取溶剂为50%甲醇、超声处理30 min时色谱峰较丰富,各色谱峰响应良好。
本研究考察了不同提取溶剂(甲醇、水饱和正丁醇萃取),不同取样量(0.5、1.0、1.5 g)对养胃汤基准样品中人参皂苷类成分含量的影响,结果表明在取样量为1.0 g 采用水饱和正丁醇萃取时人参皂苷类成分提取率较高。
3.3 指纹图谱结果分析
15 批基准样品指纹图谱的相似度均大于0.9,表明15 批养胃汤基准样品物质基础组成较稳定。通过对照品比对共指认出20 个色谱峰。指纹图谱表征了10 味药,由于人参中主要皂苷类成分为紫外末端吸收[17],指纹图谱中无共有峰归属于人参,但建立了人参皂苷的含量测定方法,综合2 种方法,养胃汤中11 味药都得以表征。
3.4 定量指标成分的选择与限度范围
养胃汤所含药味众多,化学成分复杂。在前期研究中,臣药广藿香叶专属性成分百秋李醇、广藿香酮为挥发性成分且含量较低,不适宜作为含量测定指标[18];佐药草果仁主要化学成分包括挥发油、酚类等,在前期研究中,对草果仁药材中专属性成分儿茶素进行含量测定发现其含量较低,儿茶素为脂溶性成分,水溶性较差,不适宜作为含量测定指标[19];佐药乌梅专属性成分为新绿原酸、隐绿原酸、绿原酸,含量相对较高,但由于很多中药材均含有该3 种成分,专属性较差,故上述3 种成分不适宜作为含量测定指标[20-23];茯苓主要成分为多糖和三萜类成分[24],半夏中主要有效成分为氨基酸、生物碱、核苷等[25],含量较低,暂未建立质量分析方法,后续本课题组将做进一步研究。
养胃汤中人参为君药,人参皂苷是其主要活性成分[26],通过ELSD 建立了人参含量测定分析方法,其中Rg1的含量波动范围0.081~0.163 mg/g,均值的±30%为0.084~0.155 mg/g,S5、S8 的Rg1含量分别高于上限和低于下限;Re 含量波动范围0.053~0.175 mg/g,均值的±30%为0.065~0.120 mg/g,S5、S10 的Re 含量分别高于上限和低于下限;Rb1含量波动范围0.225~0.554 mg/g,均值的±30%为0.246~0.457 mg/g,S5、S8、S13 的Rb1含量分别高于上限和低于下限,可能是取样时参须和参身比例的差异使其离群[27-28]。佐药姜厚朴专属性成分和厚朴酚+厚朴酚总量波动范围 0.834~2.865 mg/g,均值的±30%为0.971~1.804 mg/g,S1、S3、S5 的和厚朴酚与厚朴酚总含量不在范围内,可能是饮片中有根皮、枝皮或2 个混合等用药部位的差异使其离群[29-30]。佐药橘红专属性成分橙皮苷波动范围5.778~8.926 mg/g,均值的±30%为4.911~9.120 mg/g,均在范围内;使药炒甘草专属性成分甘草酸波动范围1.060~1.825 mg/g,均值的±30%为0.990~1.838 mg/g,所有批次均在范围内。上述结果表明养胃汤基准样品各批次间指标性成分含量差异较小。
利益冲突所有作者均声明不存在利益冲突

