黄精对麦曲微生物群落结构及其功能基因的影响
张国泰,贺思桥,蒙倩倩,芦润青,唐菁雯,向 琴,耿敬章,田洪磊
(陕西理工大学生物科学与工程学院,陕西省资源生物重点实验室,陕南秦巴山区生物资源综合开发协同创新中心,秦巴生物资源与生态环境重点实验室,陕西汉中 723000)
黄酒是世界公认三大古酒之一,因其高营养、低酒精含量且多样化的保健功效等优势,而广受消费者欢迎,其主要由谷物经发酵剂通过糖化和发酵制成[1]。而麦曲是常用的发酵剂之一,其由小麦经熟化、成型等加工步骤,在开放环境下,达到一定培养时间后干燥制得。其对成品酒的感官及品质特性均有重要影响[2-3],在酿造过程中提供液化、糖化、蛋白水解和酯化酶,有效促进了酒体发酵和风味化合物的生成[4]。因而,以曲酿酒具有高度的不可替代性,品质优异的酒曲是酿造高品质黄酒的前提。
改良和优化制曲工艺是提高麦曲品质的重要方法,其中以药制曲为常用的手段之一,北魏《齐民要术》之神曲、元代之六神曲皆为药曲[5]。中药能够对酒曲中的有害菌起到较强的抑制作用,而对功能菌无害,还可促进某些酶代谢[6]。研究证明,添加红景天制作的药曲所酿紫薯酒比普通酒曲所酿紫薯酒具有更丰富的风味物质,其对香气物质的形成具有一定的促进作用[7],且红景天药曲所酿紫薯酒抗氧化能力高于普通米曲紫薯酒[8]。此外,制曲入药还能通过提升部分功能菌的胞外酶产量,而起到提升酒曲糖化、发酵能力作用[9]。如PENG 等[10]添加中药制曲后,上调了其Monascus ruber的mokA、mokB、mokF、mokH、mokI 和mpla 的转录水平,使其产酶量提升41.18%。但中药通常根据经验添加,并未形成统一的共识,其含有皂苷和生物碱等具有抑菌活性的物质,过量地添加,可能会抑制酒曲中微生物的生长繁殖[11]。黄精是我国四大中草药之一,为百合科植物,其主要活性成分黄精多糖可作为益生元,改善小鼠肠道菌群结构,使物种多样性得到提升[12],并提升有益菌丰度[13],为微生物提供必要的养分,因此可在一定范围内添加黄精制曲,以改善酒曲品质。黄酒的品质与微生物组成及功能基因有关[14],HONG 等[15]研究了黄酒品质与微生物的相关性,发现酒曲中的微生物与黄酒的最终品质有关,其影响着发酵过程中的生物素合成、苹果酸及乳酸代谢,且黄酒的酸败主要与高丰度的乳酸杆菌有关。因此,探究黄精制曲对其微生物结构及功能基因的影响十分重要。
然而,目前以黄精为原料作曲的研究尚未见报道,且黄精将对麦曲中的微生物群落结构及功能基因产生何种影响仍不明确。宏基因组测序技术能够在种水平上解释物种组成[16],是研究麦曲物种组成的有效手段。如XIE 等[17]以宏基因组学技术为手段,分析了绍兴黄酒在酿造过程中的微生物组成的动态变化。发现发酵前期的优势微生物为Actinobacteria(放线菌门),丰度占比高达87%,后期则下降至40.7%,而Firmicutes 则从6.2%增长至32.5%。
因此,本研究以未添加黄精粉的普通麦曲(PTMQ)、添加质量分数为2.5%及5%(黄精添加量为100 g 及200 g)[6]的黄精粉末制作的黄精麦曲(HJ100、HJ200)为研究对象,利用宏基因组测序技术阐述三者间微生物群落结构及功能基因的差异,从而判断黄精对麦曲微生物群落结构及功能基因的影响,以分析其对后续酿造过程及风味物质形成可能造成的影响,为后续黄精麦曲制备及黄精黄酒酿造提供理论支撑。
1 材料与方法
1.1 材料与仪器
酒曲:PTMQ、HJ100、HJ200 均于陕西长生酒业有限公司制作;样品 制作好的酒曲,粉碎后置于样品袋于-80 ℃冰箱保存;汉中香米 购于汉中桃心岛超市;无菌水 实验室自制;PBS 缓冲溶液 北京万家;DNA 提取试剂 Omega,M5635-2,美国;Hieff NGS® MaxUp 扩增试剂(12200ES96)、Hieff NGS™ DNA Selection Beads DNA 纯化试剂(12601 ES56)竖圣生物科技有限公司;苯酚、3.5-二硝基水杨酸、葡萄糖、亚硫酸钠 分析纯,天津市大茂化学试剂厂;重铬酸钾、氢氧化钠、无水乙醇、浓硫酸分析纯,天津市天力化学试剂有限公司;甲醛溶液分析纯,成都市科隆化学品有限公司;酒石酸钾钠分析纯,盛奥化学试剂有限公司。
SW-CJ-1FD 超净工作台 苏洁净化;P-III 通风橱 北京成威;WH-3 微型旋涡混合仪 上海沪西分析仪器厂有限公司;0.5~2.5 μL、1~10 μL、20~200 μL可调式微量移液器 Eppendorf;Thermo Scientific Sorvall Legend Micro21R 式高速低温离心机 Thermo;DYY-11 电泳仪 北京市六一仪器厂;FR-980A 生物电泳图像分析系统 复日科技;Qubit®荧光计核酸定量仪 Life Technologies;752N 紫外分光光度计 上海仪电;FW177 万能粉碎机 北京市勇光明医疗仪器厂;Covaris220 超声波破碎仪 上海土深视觉科技有限公司;多功能电磁炉 广东美的生活电器制造有限公司。
1.2 实验方法
1.2.1 酒曲制作 选取当年产优质小麦,小麦籽粒饱满,颗粒均匀,外皮薄;将小麦与黄精装入拌曲机中,加入19%~22%的水,搅拌均匀。拌曲时间不宜过长,否则吸水过多不易成型。成型后,将曲块于曲房依次排开,每块间隔5~8 cm 距离,关闭门窗,保温培养,前1~2 d 控制曲温在30~40 ℃,使真菌大量繁殖,后2~3 d 控制曲温在40~50 ℃,之后进入排潮生香期,水分蒸发,曲温逐渐下降。经过30~40 d 左右时间曲房培养得到成品酒曲。
1.2.2 样品预处理 称取200 mg 的样品,放入灭菌的2 mL 离心管中,加入1 mL 70%乙醇,振荡混匀,10000 r/min 室温离心3 min,弃置上层液体。加入1×PBS 溶液,振荡混匀,10000 r/min 室温离心3 min,弃置上层液体。倒置2 mL 离心管于吸水纸上1 min,直至没有液体流出。将样品管放入55 ℃烘箱10 min[18-19]。
1.2.3 DNA 提取 预处理完毕的样品,根据Omega说明书所述方法进行提取。
1.2.4 文库构建 使用Covaris220 超声波破碎仪将DNA 分解成约500 bp 的片段,并使用Hieff NGS™DNA Selection Beads DNA 试剂对其进行纯化,并采用Hieff NGS® MaxUp 对DNA 进行扩增[18-19]。
1.2.5 质量控制 通过Fastp(0.36 版)对DNA 质量进行评估:1.按顺序拆除适配器;2.去除3'到5'端的低质量碱基(Q<20),使用滑动窗口法去除DNA reads 尾部小于20 的碱基值(窗口大小为4 bp);3.找出DNA reads 重叠的部分,并适当纠正区间内不一致的碱基;4.去除长度小于35 nt 的DNA reads[18-19]。
1.2.6 组装和分箱 首先,使用Megahit(1.2.9 版)进行多样本混合拼接,获得初步拼接序列;然后用bowite2(2.1.0 版)来清除DNA reads 对照拼接后的结果,提取未拼接的DNA reads,然后用SPAdes(3.13 版)再次拼接,得到低丰度的等位基因组;并使用MetaWRAP(版本 1.3.2)依次对DNA reads 进行Bin 分类、Bin 纯化、Bin 定量、Bin 重组和Bin 识别等操作[18-19]。
1.2.7 基因预测和非冗余基因组构建 使用Prodigal(2.60 版)预测拼接结果的ORF,选择长度大于或等于100 bp 的基因,并将其翻译成核酸序列;对于每个样本的基因预测结果,采用CD-HIT(2.60 版)进行去重复,得到一个非冗余的基因集;使用Salmon(version1.5.0)构建非冗余基因组的具体指数,采用双相算法和构建偏倚模型的方法,准确量化每个样本中的基因丰度,并根据基因长度信息计算基因丰度[18-19]。
1.2.8 Illumina HiSeq 2000 平台测序 通过质量控制的DNA 进行上机测序(由生工生物工程(上海)有限公司Illumina HiSeq 2000 测序平台完成)。物种和功能注释:使用DIAMOND(版本0.8.20)将基因集与KEGG、CAZy 及SEED 数据库进行比较,以获得物种注释信息和基因的功能注释信息,筛选条件:E 值<10-5,分数>60。
1.2.9 黄酒酿造 3 个不同的酒曲均按照汉中香米100 g,酒曲添加量6%(以汉中香米质量为基准),1.4 倍的水及发酵7 d 为条件进行酿造。工艺流程为:洗米→泡米→蒸米→摊凉→拌曲→入坛→加水→发酵→压榨、过滤→灭菌→成品。
1.2.10 理化指标测定 分别对PTMQ、HJ100 及HJ200 所酿出的黄酒进行理化指标测定。总酸和氨基酸态氮及pH 的测定依GB/T 13662-2018 进行;总糖的测定参照郭雷等[20]的方法进行,建立葡萄糖标准曲线,样品于490 nm 处测定吸光度,并根据标准曲线计算样品总糖含量;酒精度的测定参照何川等[21]的方法进行,建立乙醇标准曲线,样品于600 nm 处测定吸光度,并根据标准曲线计算样品乙醇含量,最后根据乙醇的密度换算出其百分含量。
1.3 数据处理
宏基因和理化分析中每个样品设置3 个平行并重复测定3 次,以主成分分析(Principal Component Analysis,PCA)、堆叠柱状图/柱状图及热图,对所注释的微生物及功能基因进行可视化分析,PCA 分析于迈维代谢公司开发的公共生信分析平台(https://cloud.metware.cn/#/user/login)进行;属水平聚类热图使用Oringin 2021 进行绘制,堆叠柱状图及柱形图使用Excel 2016 进行绘制,理化指标的显著性分析使用IPM SPSS 27 进行单因素方差显著性检验及LSD 多重比较,以P<0.05 视为具有显著性差异,P<0.01 视为具有极显著性差异。
2 结果与分析
2.1 数据质量控制
如表1 所示,PTMQ、HJ100 和HJ200 经测序后,获得大量原始reads,经质量控制去掉宿主、环境等污染源后,原始数据中reads 和DNA 碱基数量均稍有下降,而纯净reads 的占比均大于99%,表明此次测序数据具有极高的合理性,可用于后续分析。
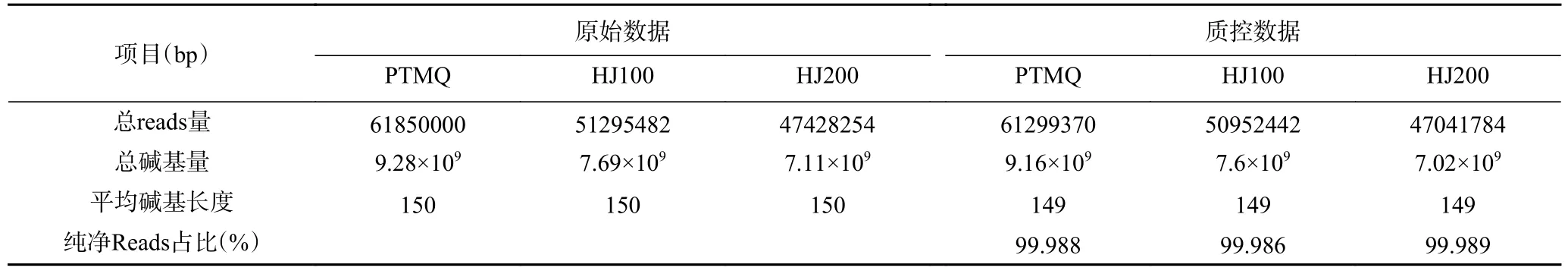
表1 不同麦曲的原始数据与质控数据Table 1 Raw and quality control data of different wheat Qu samples
2.2 物种Alpha 指数分析
Alpha 指数能够反映出样品中微生物物种的丰富度和均匀度[22],Chao1、ACE 指数越大,其物种丰度越高,Shannon、InvSimpson 指数越大,其物种均匀度越好。如表2 所示,Chao1、ACE、Shannon 及InvSimpson 指数均为HJ100>HJ200>PTMQ,表明物种丰富度及均匀度均为HJ100>HJ200>PTMQ。周恒刚[6]指出,添加中药制曲,对有害菌有较强的抑制作用,而对功能菌无害,还可促进某些功能菌生长与酶代谢。吴琼燕[9]以桑叶及辣蓼制曲,发现其能够促进根霉菌的生长,同时提升酒曲的糖化能力。黄精系药食同源物品,研究表明中药益生元能够促进肠道微生态平衡[23]。结合前人的研究分析,HJ100 的物种丰富度与均匀度更高,应是与黄精的引入抑制杂菌,同时促进了麦曲中多种功能微生物生长有关。
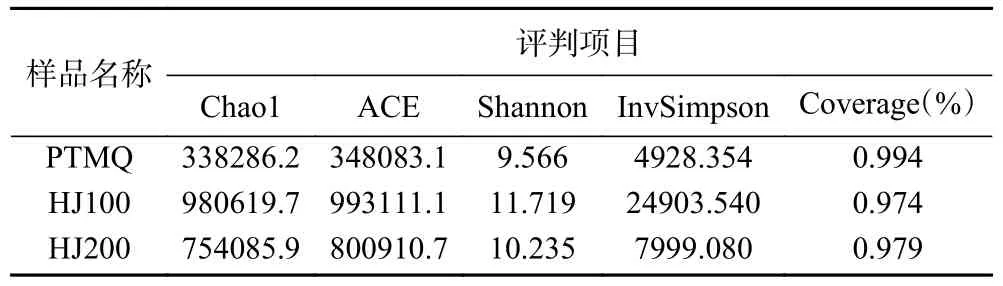
表2 不同麦曲样品的Alpha 指数表Table 2 Alpha index table of different wheat Qu samples
2.3 物种差异及组成分析
2.3.1 物种差异分析 主成分分析(Principal Component Analysis,PCA)通过保留对样品特征贡献最大的成分而形成降维效果,可以直观地展示样品间的差异[24]。以不同酒曲排名前十的属水平优势物种的相对丰度做PCA 分析如图1:第一和第二主坐标分别能够贡献样品信息量的82.1%及11.17%,能够有效地反映出样品间的差异。HJ100、PTMQ 及HJ200在PCA 分析中完全分离,其中HJ200 与PTMQ 相距较近,而HJ100 与PTMQ 及HJ200 分属于不同象限内,相距较远表明三个酒曲的优势微生物组成具有差异性,但HJ200 与PTMQ 差异较小。为了可视化PTMQ、HJ100 及HJ200 中属水平优势物种的丰度差异,作属水平聚类热图如图2 所示。每个方块代表一个优势属,颜色从橙色至蓝色丰度占比依次增大。整体的颜色分布表明,不同酒曲中的优势属的丰度占比具有较大的差异性,PTMQ 与HJ200 颜色分布趋于一致,表明二者物种丰度占比相似性较高,仅在Aspergillus间有一定差异性。而与PTMQ 和HJ200相比,HJ100 在Rhizopus、Puccinia、Pantoea、Klebsiella、Aspergillus、Limosilactobacillus、Rasamsonia、Paecilomyces中均有较大差异。因此将PTMQ 与HJ200 聚为一类,HJ100 单独聚为一类,与上述PCA分析结果一致。
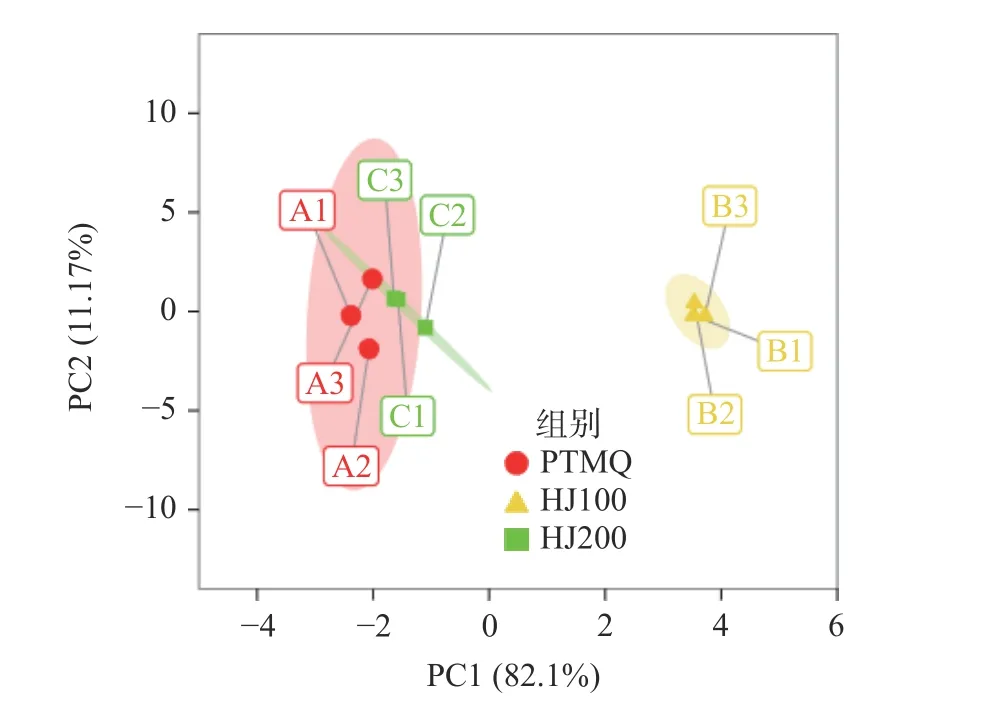
图1 不同麦曲的PCA 分析图Fig.1 PCA analysis of different wheat Qu
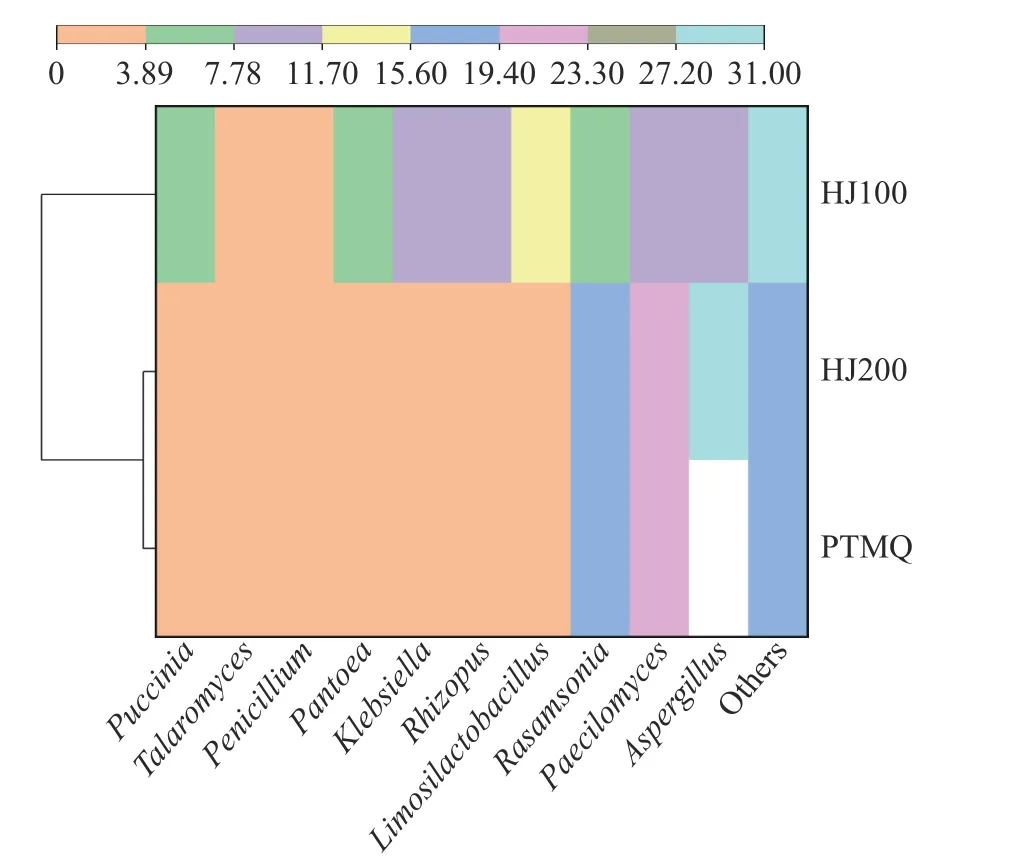
图2 属水平聚类热图Fig.2 Clustering heat map at genus level
2.3.2 物种组成分析 如图3 所示,种水平微生物物种注释中,PTMQ 共注释出961 种,HJ100 注释出1506 种,HJ200 注释出1110 种,进一步表明HJ100物种多样性最高。其中PTMQ、HJ100 及HJ200 共有种为695 个,分别占其注释物种总数的72.32%、46.15%及62.61%。从相似物种占比来看,HJ100 的物种组成依然与PTMQ 及HJ200 具有较大差异,而PTMQ 与HJ200 则具有较高相似程度的物种组成。
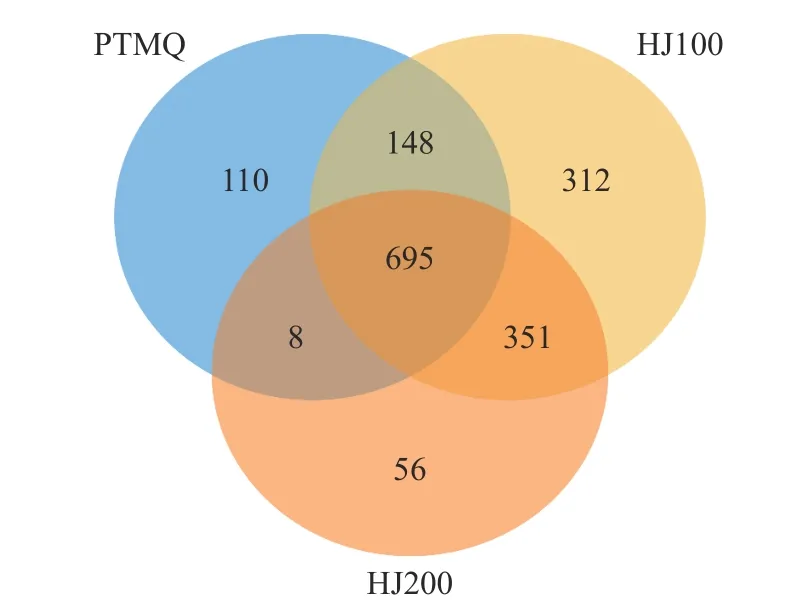
图3 种水平维恩图Fig.3 Venn diagram at species level
不同酒曲的属水平物种组成见图4。从整体上看HJ100 相较于PTMQ 与HJ200,各物种丰度占比较为均匀,具有更高的均匀度。其中,曲霉属(Aspergillus)、裂殖酵母属(Paecilomyces)、拉桑索尼亚菌属(Rasamsonia)均为PTMQ 与HJ200 占比前三的物种,青霉属(Penicillium)、塔拉菌属(Talaromyces)、柠檬酸乳杆菌属(Limosilactobacillus)次之,盘状菌属(Pantoea)和克雷伯氏菌属(Klebsiella)丰度占比最低。而HJ100 因物种均匀度高缘故,Aspergillus、Paecilomyces、Rasamsonia、Limosilactobacillus、Rhizopus、Klebsiella、Pantoea及Puccinia的占比均较高,仅Penicillium和Talaromyces占比最低。
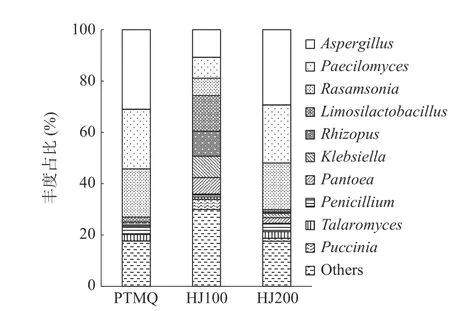
图4 属水平堆叠柱状图Fig.4 Stacked column at genus level
不同酒曲的种水平堆叠柱状图见图5。变形酵母菌(Paecilomyces varioti)和杆状拉桑索尼亚菌(Rasamsonia emersonii)在PTMQ 与HJ200 中占比最高,黑曲霉菌(Aspergillus hancockii)次之,庞氏柠檬乳杆菌(Limosilactobacillus pontis)、肺炎链球菌(Streptococcus pneumoniae)及聚合盘状菌(Pantoeaagglomerans)等占比较低。而Paecilomyces varioti、Rasamsonia emersonii、Limosilactobacillus pontis、Pantoea agglomerans、产孢根霉菌(Rhizopus microsporus)及纹状芽孢杆菌(Puccinia striiformis)在HJ100 中占比均较高,仅肺炎链球菌(Streptococcus pneumoniae)等丰度占比较低。
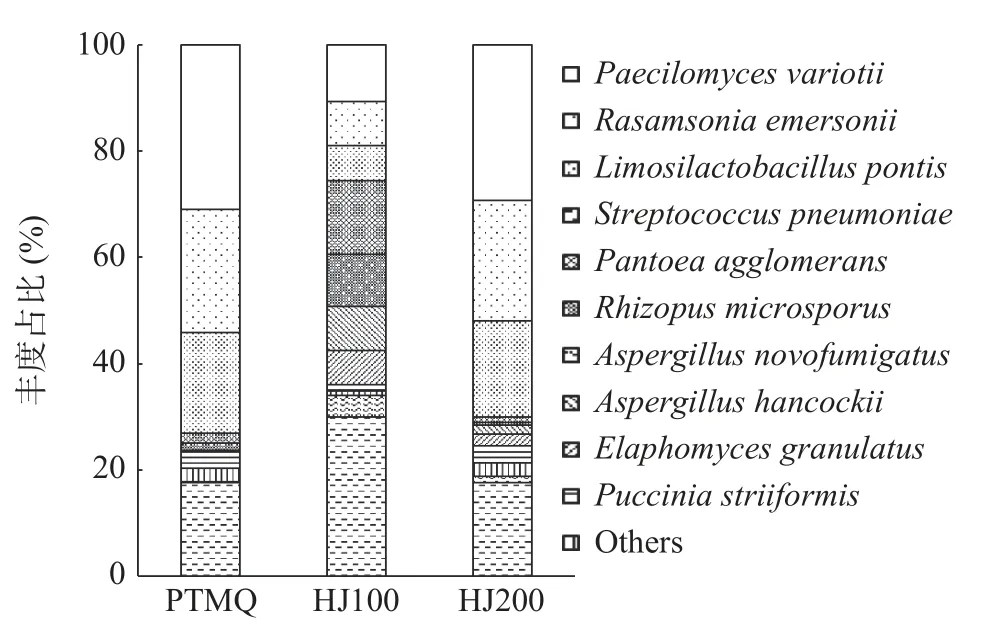
图5 种水平堆叠柱状图Fig.5 Stacked column at species level
值得注意的是,相较于PTMQ 与HJ200,HJ100具有更高丰度的Rhizopus及Rhizopus microsporus,达到了极显著差异的水平(P<0.01,见图6)。同时HJ100 还具有较高丰度的Aspergillus hancockii及Aspergillus novofumigatus,二者均属曲霉属。此前的部分研究在进行酒曲物种分析中也鉴定出了Pantoea、Aspergillus及Rhizopus等优势属[1,25],同时LIU 等[26]在红曲中也鉴定出了Rhizopus microsporus,属于根霉属,与本研究所鉴定出的物种有部分相同。据报道[27]Aspergillus(曲霉属)可产生各种胞外酶(淀粉酶、蛋白酶及果胶酶等),在发酵前期,其代谢的胞外酶将酿造原料中的淀粉及蛋白等大分子物质分解为可供微生物利用的小分子糖类和氨基酸,同时使酵母可利用分解生成的糖类物质生产酒精,保障了微生物的养分生长需求。Rhizopus(根霉属)也可产出类似的胞外酶,同时产出有机酸和酯类芳香物质,对黄酒的风味品质具有重要贡献[27],因此Rhizopus及Aspergillus属微生物是酒曲中极为重要的功能菌。从这一点来看,HJ100 可能将因物种均匀度高和具有高丰度的产胞外酶物种,而具有更为优秀的分解原料中淀粉及蛋白质等物质的能力。
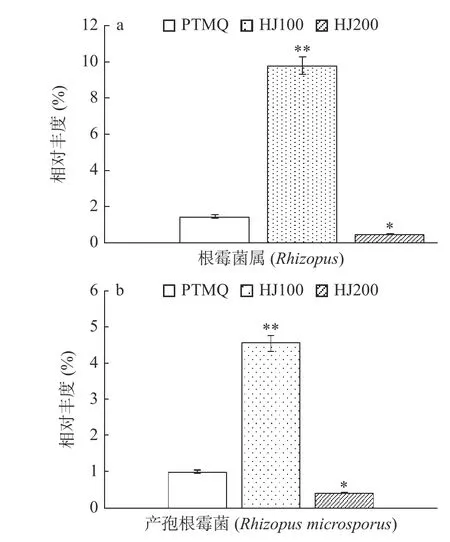
图6 不同麦曲根霉物种差异分析Fig.6 Analysis of the differences in the rhizoctonia species of the different wheat Qu
产生此种差异的原因可能是添加2.5%质量分数的黄精促进了根霉类微生物的生长,使其在酒曲中复杂的微生物群落组成中具有生长优势,进而能够竞争更多资源用于自身生长繁殖成为优势菌。但添加5%质量分数的黄精却使其丰度降低,可能是5%质量分数的黄精中含有更多的生物碱及酚类等物质,抑制了其生长,使其在酒曲成型后期未能生长为优势菌,而造成丰度降低。综上,以中药为原料制曲时,要在一定范围内添加才能起到促进酒曲中根霉类微生物的生长,进而提升酒曲中糖化酶等胞外酶的含量,达到提升酒曲品质的目的。
2.4 功能注释
2.4.1 KEGG 功能注释分析 KEGG(Kyoto Encyclopedia of Genes and Genomes)是一个有关生物系统较完善的数据库,整合了基因组、化学物质和系统功能信息。其包括:生物体系统(Organismal Systems)、代谢(Metabolism)、人类疾病(Human Diseases)、遗传信息处理(Genetic Information Processing)、环境信息处理(Environmental Information Processing)及细胞过程(Cellular Processes)6 个模块。如图7 所示,HJ100 与人类疾病相关的基因丰度占比最低,其次为HJ200,PTMQ 占比最高,此类基因丰度过高,可能会影响成品酒的安全性。三者均以代谢模块为绝对优势功能(丰度占比均>50%),表明酒曲内部微生物代谢活动较为旺盛,为黄酒风味的形成提供了基础。但HJ100 基因丰度在代谢功能模块占比稍低,而PTMQ 与HJ200 的相对丰度则基本一致,代谢功能是微生物生命活动的基础,包括脂质代谢和蛋白质代谢等,能够将原料中的营养物质分解消耗供自身生长繁殖,同时生产新的次级代谢产物,对成品黄酒的整体品质具有重要影响[28]。然而过度的代谢活动会进一步消耗酿造过程中的营养物质,使成品酒中的总糖、氨基酸及功能性多糖等物质含量降低,也因风味前体物质的减少而使风味化合物的多样性及丰富性降低,从而降低成品酒的整体品质[29]。因此,从这一点看,HJ100 中有关“代谢”的基因比PTMQ 及HJ200稍低,应该拥有平衡微生物生长和酒体品质的潜力。在生物体系统、遗传信息处理、环境信息处理和细胞过程基因模块中,HJ100 的相对含量相较于HJ200和PTMQ 具有更高的均匀度,有利于多菌种在发酵过程中形成稳定的微生物发酵体系,不易造成因某一物种丰度过高而抢占其他有益菌的生存空间及资源,从而造成一家独大,发酵不完全的局面[30]。
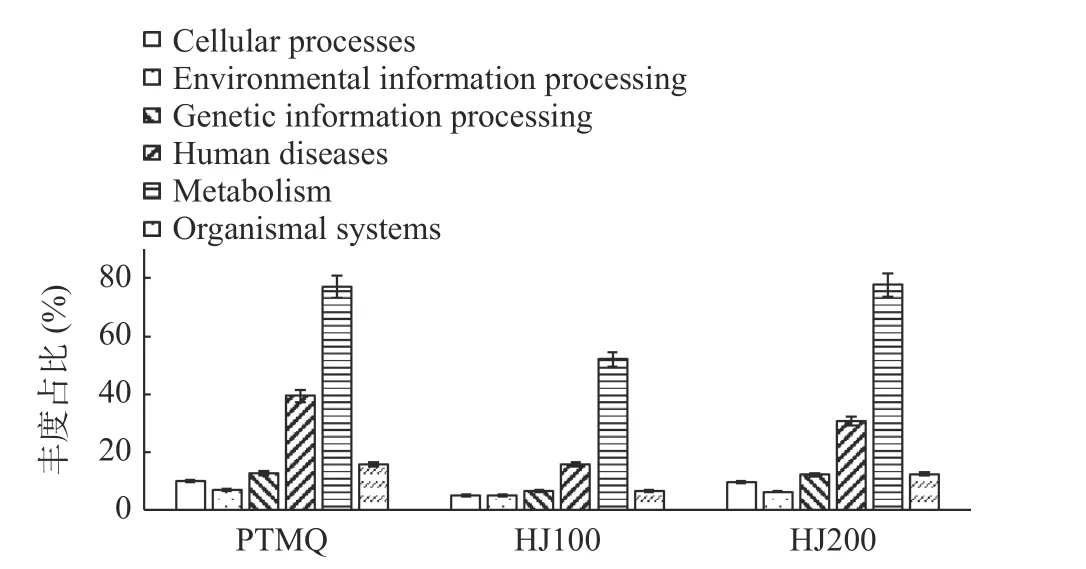
图7 KEGG 一级功能基因丰度图Fig.7 Abundance of functional genes about KEGG at level first
KEGG 二级功能包括碳水化合物代谢(Carbohydrate metabolism)、氨基酸代谢(Amino acid metabolism)及运输和分解代谢(Transport and catabolism)等多种模块。如图8 所示,PTMQ、HJ100 和HJ200 菌在“总览和全局(Global and overview maps)”基因模块中具有较高的丰度占比,此模块与淀粉及蔗糖代谢、果糖和甘露糖代谢及酸类代谢等有关,是发酵过程中重要的代谢途径。此外,在碳水化合物代谢、翻译及信号传导等基因模块中,HJ100 具有更高的均匀度。既能够保证碳水化合物代谢相关基因数量,又不会因缺少其他相关基因而造成酒体某一性质过强,导致酒体品质不协调的问题。唐鳗秋等[30]在8 种传统酒曲中也鉴定出了高丰度的碳水化合物代谢及氨基酸代谢优势功能,与本研究具有相似之处。可能是酒曲中的优势微生物通常为酵母、霉菌类,该类微生物在酒曲中进行活跃的生命代谢活动,产出酿造所需的淀粉酶、蛋白酶等与碳水化合物代谢及氨基酸代谢相关的胞外酶,因而酒曲中鉴定出的优势功能通常与代谢有关。
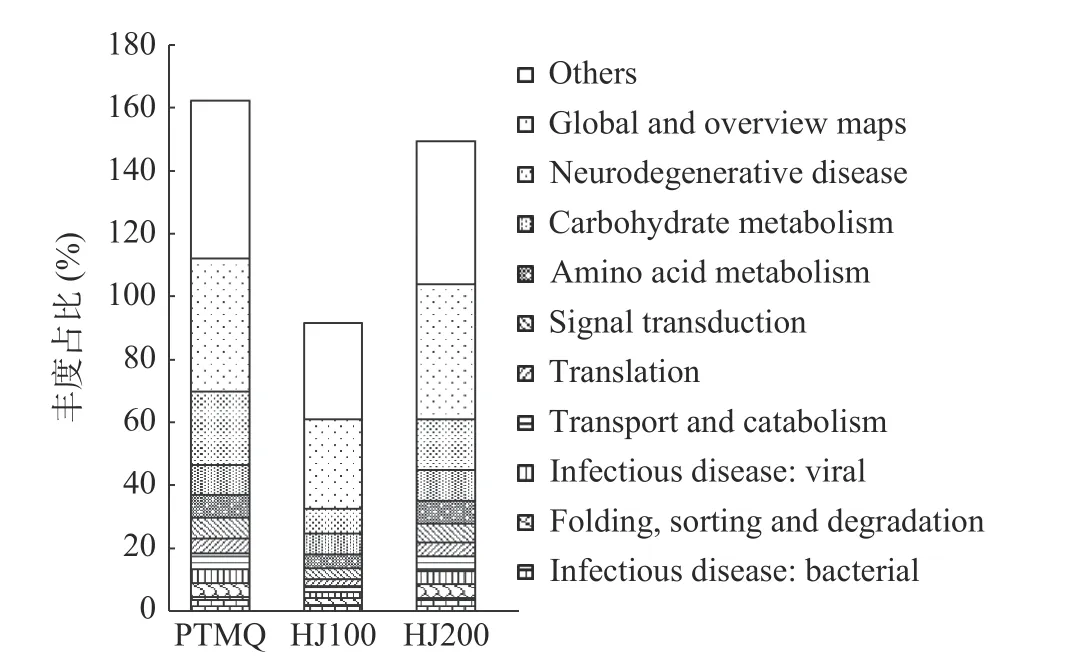
图8 KEGG 二级功能基因丰度图Fig.8 Abundance of functional genes about KEGG at level second
2.4.2 CAZy 功能注释分析 CAZy(Carbohydrate-Active enZYmes Database)是碳水化合物活性酶相关的专业数据库,内容包括能催化碳水化合物降解、修饰、以及生物合成的相关酶系家族。其包含五个主要分类:糖苷水解酶(GlycosideHydrolases,GHs)、糖基转移酶(GlycosylTransferases,GTs)、多糖裂解酶(Polysaccharide Lyases,PLs)和糖类酯解酶(Carbohydrate Esterases,CEs)、氧化还原酶(Auxiliary Activities,AAs)[31]。
如图9 所示,PTMQ、HJ100 和HJ200 在CAZy库中均注释出相当数量的与GHs、GTs、CEs 及AAs 相关的基因。基因数量较高的有GTs 和CEs,更高的为GHs,而最高的为AAs。
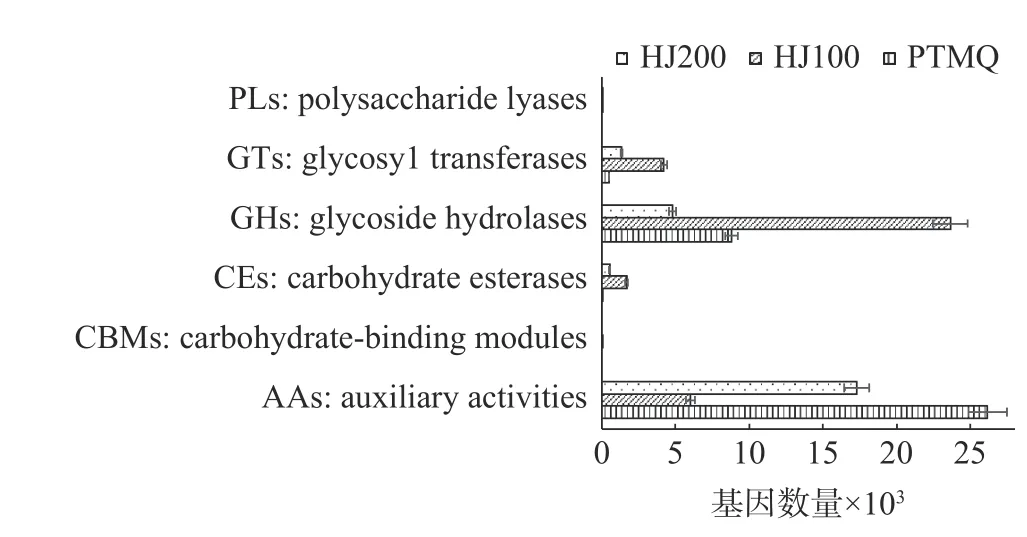
图9 CAZy 注释基因数量图Fig.9 Abundance of genes about CAZy noting
AAs 包括氧化酶和还原酶,能够催化物质间的氧化还原作用[32]。HJ100 在AAs 基因模块中数量最低,说明其氧化酶和还原酶的含量较低,从而推断其内好氧菌数量较少,在封闭的发酵体系内具有优势。
而GTs[33]能够催化糖类物质连接至不同的受体(蛋白、核酸等)上,糖基化后的产物具有一定的生物活性功能,如由糖基转移酶催化生产的糖苷类抗生素,被广泛用于抗菌和抗肿瘤[34]。HJ100 中GTs 的基因数量最高,其次为HJ200,PTMQ 数量最低,因而HJ100 中应该具有更高含量的糖基转移酶,保证了糖基化活性产物的生成,可能将促使成品黄酒中生成含量更为丰富且多样性的活性物质。
GHs 能够水解糖苷健,以内切或外切的方式水解糖类化合物[35-36],是微生物将淀粉等大分子糖类物质降解供自身生长繁殖的基础,同时通过此类酶的作用,将部分原料水解成具有生物活性的小分子糖等物质,是保证成品酒活性功能的重要物质。HJ100 的GHs 基因数量,远大于PTMQ 与HJ200,说明HJ100酒曲中应该具有更高含量的GHs,因而可能具有更强的分解淀粉及大分子糖类物质的能力。王国峥等[37]在三个不同轮次的大曲中,均鉴定出了高丰度的GHs,本研究中3 个麦曲的GHs 丰度为第二高,说明不同的类型的酒曲中优势功能基因是存在差异的,但主要优势功能还是与GHs 有关。可能是不同类型酒曲的生产均以高淀粉及蛋白含量原料为主,导致能够产GHs 利用淀粉供自身生长繁殖的微生物最终成为酒曲中的主要优势菌,因而不同类型的酒曲中与GHs 有关的功能基因基本处于绝对优势地位。
根霉属类微生物是酒曲中糖化酶的主要生产者之一,因此GHs 的数量与根霉、曲霉及可产出糖化酶的微生物高度相关。物种组成分析中HJ100 注释出了最高丰度的根霉属类微生物,其次为PTMQ,后为HJ200。因此,在HJ100 中GHs 的数量最高,PTMQ 次之,HJ200 最低。可能与2.5%质量分数的黄精促进了根霉属类微生物的生长繁殖,使其成为酒曲中的主要优势菌,而5%质量分数的黄精因含有过多的生物碱等抑菌成分而抑制了其生长,致其后期未能成为优势菌有关。
2.4.3 SEED 功能注释分析 SEED Subsystem 是国际上知名的功能分类数据库,为RAST(Rapid Annotation using Subsystem Technology)的默认数据库。如图10 所示,在SEED 一级功能中,分别为蛋白质代谢(Protein Metabolism)、碳水化合物(Carbohydrates)、氨基酸及其衍生物(Amino Acids and Derivatives)及细胞壁和细胞膜(Cell Wall and Capsule)等10 大模块。
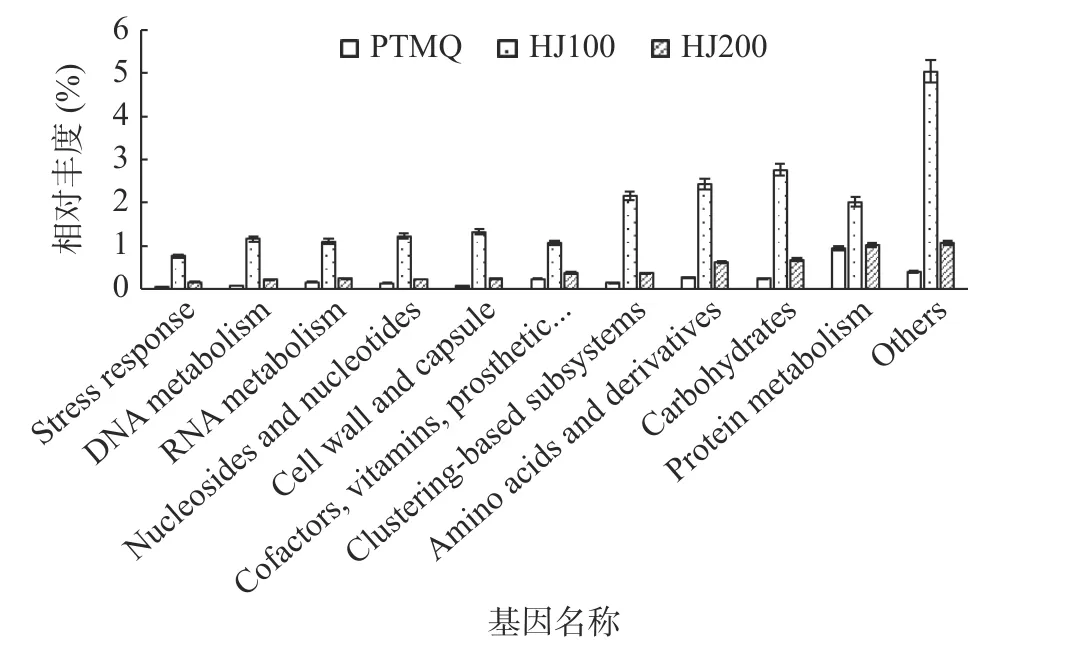
图10 SEED 一级功能基因丰度图Fig.10 Abundance of functional genes about SEED at level first
总体而言,HJ100 在10 个基因模块中,相对丰度占比之和最高,超过20%,远大于HJ200 与PTMQ之和,HJ200 次之,为PTMQ 的两倍。其中与蛋白质代谢、碳水化合物、氨基酸和衍生物有关的基因,在HJ100 中的数量最高,其与成品酒的品质直接相关,蛋白质和氨基酸代谢关乎成品酒的滋味、口感,碳水化合物代谢与酒精和小分子糖的生成有关。此外,HJ100 中还具有较高数量的与辅剂、维生素、修复组、色素,细胞壁和细胞膜等相关的功能基因,在微生物生长繁殖中发挥着重要作用,保障着发酵进程的顺利进行,而PTMQ 和HJ200 相关基因相对丰度占比较小,远低于HJ100。
可能是添加2.5%质量分数的黄精(HJ100)促进了与蛋白质代谢、碳水化合物、氨基酸和衍生物功能有关微生物的生长,使此类微生物快速生长为酒曲中的优势菌,因而相关基因数量相较于PTMQ 与HJ200 具有更大的优势。
2.5 酿造验证实验分析
如表3 所示,HJ100 所酿造的黄酒,在总糖、多糖及氨基酸态氮含量这3 个指标上均明显高于PTMQ 与HJ200 所酿的黄酒,此前的物种注释中,在HJ100 鉴定出最高丰度的Rhizopus(根霉属)及较高丰度的Aspergillus(曲霉属),此类微生物可产出大量对淀粉、蛋白质具有分解作用的淀粉酶及蛋白酶等胞外酶,因此HJ100 中可能存在更高含量的相应酶类物质,使得在酿造过程中原料中的淀粉及蛋白质等物质被分解得更为彻底,除了用于发酵外,则会剩余更多的多糖及氨基酸,这可能是HJ100 成品黄酒的总糖、多糖及氨基酸态氮含量均优于PTMQ 及HJ200 的主要原因。

表3 不同麦曲所酿造成品酒的指标Table 3 Indicators of the finished wine made from different wheat Qu
此外,功能注释中HJ100 展现出与蛋白质代谢、碳水化合物代谢、氨基酸及其衍生物代谢相关的最高丰度功能基因,可能其物种组成中有较多的优势微生物与淀粉及蛋白质分解代谢相关,进一步解释了上述结果。但在酒精含量上,三者并无显著差异(P>0.05),表明3 个麦曲的发酵能力相当,可能与黄精的添加对酵母类微生物无抑制作用有关,说明在5%质量分数范围内以黄精为原料制作麦曲,并未影响发酵进程,且能够促进麦曲中Rhizopus及Aspergillus功能菌的生长,提升其在麦曲中的丰度。
3 结论
本研究以质量分数分别为2.5%(HJ100)和5%(HJ200)的黄精为原料制作麦曲,与未添加黄精的麦曲相比,不同黄精添加量均能提升麦曲的物种丰富度和均匀度,但添加2.5%的效果更好。此外,添加2.5%质量分数的黄精促进了麦曲中曲霉属和根霉属类真菌的生长,使得麦曲中与碳水化合物代谢、蛋白质与氨基酸衍生物代谢有关的功能基因丰度得到提升,酿造实验中不同麦曲理化指标的差异性验证了此论点。综上,添加2.5%质量分数的黄精制曲可以提升麦曲的品质。
本研究为药食同源物质在酒曲中的使用量提供了理论支持,同时为黄精的开发提供了新的途径。但未对3 个不同麦曲酿造的黄酒进行风味分析,未来可通过风味代谢组学技术分析其风味组成,探究其对黄酒风味的影响。

