复合海藻酸钠益生菌微胶囊研究进展
常诗晗,武俊瑞,李紫晶,史玉东 ,乌日娜,
(1.沈阳农业大学食品学院,辽宁沈阳 110866;2.辽宁省食品发酵技术工程研究中心,辽宁沈阳 110161;3.沈阳市微生物发酵技术创新重点实验室,辽宁沈阳 110866;4.内蒙古蒙牛乳业(集团)股份有限公司研发中心,内蒙古呼和浩特 011500)
益生菌被称为“活微生物”,它通过降低肠道pH、抑制有害微生物的黏附以及分泌细菌素来拮抗致病菌,保护肠道免受病原体侵害,维持肠道生态平衡,调节免疫系统[1-2]。而要在宿主体内达到预期效果,益生菌的活菌数必须在106CFU/g 以上[3]。但益生菌对胃中低pH 和近端肠内高浓度胆盐环境都很敏感且在加工、储存过程中容易失活。因此,在益生菌菌株到达宿主肠道位点前,创造严格的生长环境以及开发有效保护益生菌活性的技术具有重要意义[4]。
微胶囊技术被广泛应用于提高益生菌在不同环境的生存能力,是提高菌体耐受性,保持菌体活性和稳定,发挥益生作用的有效方法[5]。在制备益生菌微胶囊过程中,不同壁材的使用是决定益生菌存活率高低及对外界不良环境抵抗能力高低的一个关键因素。随着对益生菌微胶囊化的研究越来越多,微胶囊化壁材的选择也更加广泛。
前人综述更关注某一种微胶囊壁材包埋递送的潜力,但随着新型材料的持续出现和益生菌包埋靶点的逐渐多样化,微胶囊改良的关键转向了能否组合不同的材料,以达到放大优点、弥补不足的目的。本文介绍了三种不同类型的壁材与海藻酸钠进行复合,对目前海藻酸钠微胶囊的复合改良思路以及不同壁材复合微胶囊对益生菌相关性能的影响进行归纳,最后对微胶囊化益生菌的前景进行展望。
1 海藻酸钠概述
海藻酸钠(SA)是微胶囊化的首选壁材,它能在多价阳离子的存在下立即形成颗粒。作为最常见的海藻酸盐,海藻酸钠具有无毒,可生物降解等特点[6]。近年来,海藻酸钠微胶囊的制备十分受关注,主要体现在微胶囊直径的控制,保护芯材性质、微生物包埋等方面[7],这些作用与海藻酸钠的结构和性质密切相关。
1.1 海藻酸钠结构与性质
海藻酸钠是一种安全、无毒、生物相容性良好的天然多糖,它由β-D-甘露糖酸(M)和α-L-月桂酸(G)组成。在制备微胶囊过程中,G 单元上的Na+与Ca2+交换,在海藻酸盐分子之间形成交联,构成一个类似于“蛋盒”的网络结构[8],这一稳定的结构能在酸、高胆盐、氧气等不利环境下保护芯材(图1、图2)。
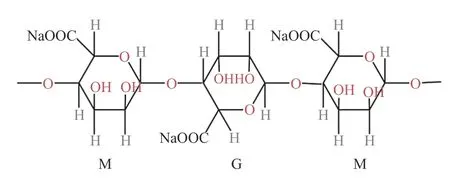
图1 海藻酸钠结构式Fig.1 Sodium alginate structural formula
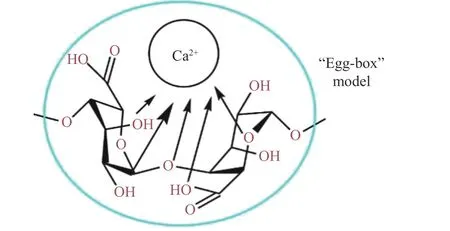
图2 海藻酸钠与Ca2+形成的“蛋盒”结构Fig.2 “Egg-box” model formed by sodium alginate and Ca2+
海藻酸钠的水溶液具有较强的黏性,溶液的粘度主要受聚合度和浓度的影响[9]。海藻酸钠微胶囊在胃酸中能够稳定生存,到达小肠溶解后[10],还能抑制消化酶,减少胆固醇和葡萄糖的吸收,并控制脂肪消化[11]。
1.2 海藻酸钠作为壁材的优点与局限性
海藻酸钠具有良好的生物相容性、无毒、低成本以及成胶机制简单等优点,是目前使用最广泛的包埋材料。但是单独的海藻酸钠微胶囊存在一些局限性,例如稳定性弱,在低酸环境下,其完整性易受离子和螯合剂的影响并且海藻酸钠微胶囊内的生物聚合网络相对多孔,存在生物分子渗漏严重、机械强度低等缺陷[12]。该问题可以通过将海藻酸钠与其他生物聚合物复合,利用无机或有机填料材料掺入生物聚合物网络内[13]或通过用生物聚合物层涂覆微凝胶来解决[14]。
2 不同类型壁材复合海藻酸钠
将不同生物聚合物材料复合海藻酸钠后对益生菌进行保护和递送是解决单独海藻酸钠包被所存在问题的首选方式[15]。主要的复合壁材有三种类型:a.添加益生元壁材刺激益生菌增长[16];b.添加纳米级粒子来降低孔隙率及提高机械性能;c.在海藻酸钠微粒外成膜,减少外部物质进入或内部芯材渗透[17]。表1 列出了制备海藻酸钠复合壁材益生菌微胶囊及其效果。
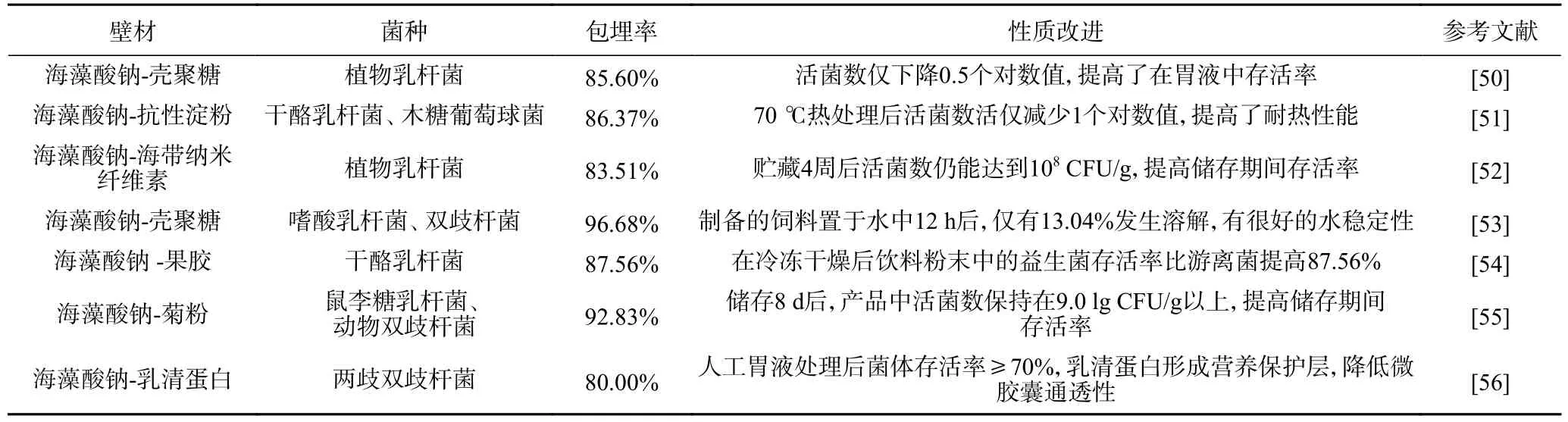
表1 复合海藻酸钠微胶囊的代表性研究Table 1 Representative study of composite sodium alginate microcapsules
2.1 益生元复合海藻酸钠
益生元是可发酵的碳水化合物,能够选择性刺激肠道中有益微生物的生长,以此来对宿主产生益生作用。菊粉和抗性淀粉是在微胶囊包埋中较常见的益生元,它们可以与益生菌协同,进而作为某些益生菌的增殖因子,维持优势菌的地位[18]。
2.1.1 菊粉复合SA 在益生菌包埋体系中,多糖和益生元的结合是较为常见的方法之一。海藻酸钠作为一种天然多糖可以提高包埋系统的稳定性,菊粉作为益生元存在促进微生物发酵并增加菌群数量。将菊粉添加到海藻酸钠微胶囊中,经过连续胃液处理2 h 和肠液处理3 h 后,未经包埋的鼠李糖乳杆菌活菌数下降了6.7 个对数值,而被包埋的菌体活菌数仅下降1.5 个对数值[19]。Fayed 等[20]将海藻酸盐负载的微胶囊与菊粉混合共同包埋动物双歧杆菌,发现模拟胃液中双歧杆菌的最大生存能力达到初始种群的88.29%,明显高于游离细菌的活菌数量。
此外,菊粉更是一类有良好应用前景的靶向递送载体。它的结构由β-(2-1)-连接的果糖单元组成,D-果糖基键以单个葡萄糖终止,其特点在于异头碳呈β构型,在胃中不被消化,这一特性使其具有靶向递送到肠道的潜力[21]。与海藻酸钠复合后形成的微胶囊具有良好的pH 敏感性,能很好地控制芯材的释放,同时缓解芯材的突释现象。Nami 等[22]将海藻酸钠与菊粉混合制备乳酸菌微囊,在模拟消化条件下微胶囊中益生菌存活率≥61%,同时其包埋成分中的菊粉是肠道定位释放的良性载体,促使益生菌在结肠2 h 后释放,并稳定长达12 h。菊粉也可充分应用到食品中,通常被用作可食性复合包装膜[23],延长食品货架期和保质期。利用菊粉复合海藻酸钠包埋动物双歧杆菌并将其添加到酸奶中,在贮藏30 d 后,复合菊粉的微胶囊比单独海藻酸钠微胶囊中的活菌数提高了1.2 个对数值,较未包埋菌株的存活率提高了75.44%[24]。说明选择适合的壁材能够在很大程度上增加益生菌产品在贮藏过程中的稳定性,极大地提高了其实用价值。
2.1.2 抗性淀粉复合SA 抗性淀粉作为自然界中的生物聚合物质具有许多优点,包括多样化的功能性,能有效保护益生菌活力的抗酶解特性,作为缓释载体为芯材提供稳定运载以及具有良好的成膜特性,同时也可作为宿主结肠微生物或被包埋益生菌的碳源,发挥益生元功效[25]。使用抗性淀粉和海藻酸钠来制备微胶囊可以改善益生菌的定植能力,提高益生菌的存活率[26]。这可能与淀粉结构和细菌之间的黏附能力相关,黏附作用能够通过利用碳源实现促进菌株定植的目的[27]。Ta 等[28]研究了海藻酸钠与多种益生元成分组合后对干酪乳杆菌生存能力的影响,发现使用抗性淀粉-海藻酸钠包封的微胶囊是最稳定的,在暴露于模拟胃液45 min 后,被包埋的活菌数仅下降了1 lg(CFU/g),保护了超过80%的初始活菌。
抗性淀粉的添加对冻干后微胶囊中的益生菌存活也是十分有利的,将含有抗性淀粉的嗜酸乳杆菌海藻酸钠微胶囊冻干粉在胃肠道液处理6 h 后活菌数仍可以保持在106CFU/g 以上[29]。抗性淀粉与海藻酸钠结合使用可以促进凝胶化的协同作用,为益生菌提供进一步的保护,但如果添加抗性淀粉过量也可能会导致海藻酸钠凝胶基质的破坏,增大酸性环境下细菌死亡的风险[30]。
益生元为益生菌提供营养,促进益生菌增殖,使得海藻酸钠基微胶囊中的活菌数量保持在较高水平。同时复合后的微胶囊具有更好的缓释靶向性,为益生菌的肠道靶向递送提供了新的途径,但是其对海藻酸钠的机械性能提升以及在减小孔隙率方面不如纳米材料。
2.2 纳米材料复合海藻酸钠
纳米包封是一项新兴的包埋技术,纳米材料不仅具有较高的生物相容性和生物利用度,而且能够有效促进包封物质向肠黏膜[31]的渗透。采用纳米材料改性海藻酸钠,所形成的复合材料具有三维空间网络结构,能有效提高海藻酸钠的机械强度和阻隔性[32]。
纤维素纳米微晶(CNC)是一种基于纤维素的纳米材料,由棒状纳米颗粒组成[33]。作为一种新型的无毒纳米材料,在食品工业中具有很大的应用潜力,Huq等[34]研究了CNC 对海藻酸钠基益生菌微胶囊的影响,发现CNC 对海藻酸钠微球的抗压强度提高了40%并且能够降低海藻酸盐基质在冷冻干燥期间的孔隙率。在通过胃肠道过程中,与单独海藻酸钠微球相比,添加CNC 的微胶囊中菌株的存活率提高了37%。这可能是因为CNC 填充到海藻酸钠结构中后会形成氢键使结构变得紧密,即使在冻干条件下微胶囊表面孔隙依旧很小,提高了对益生菌的保护作用。纳米微纤丝(CNF)作为另一种基于纤维素的纳米材料,能很好地改善海藻酸钠体系的氢键结合能力,促进海藻酸钠分子链与Ca2+间形成盐桥,强化凝胶体系的网络结构,提高海藻酸钠胶粒的机械强度,以此来避免海藻酸钠微胶囊在不利环境下崩解造成的菌体损失。陈秉彦等[35]制备的载菌海藻酸钠-纳米纤维素胶经胃肠液消化后活菌数下降1.51 lg CFU/g,显著低于单独海藻酸钠组2.99 lg CFU/g。可见纳米微纤丝作为强化海藻酸钠载体的优良壁材可以抵抗胃中的酸性环境,提高益生菌的胃肠道耐受性,进而使活菌数量得到提升。
使用纳米材料共混复合海藻酸钠,可降低微胶囊的孔隙率,提升海藻酸钠的稳定性和机械性能,但是也会存在分散困难、易聚集,影响产物均一性等问题。这是因为物理共混改性并未改变海藻酸钠的化学结构,不能从根源上有效解决海藻酸钠亲水性强的问题,利用化学方法对海藻酸钠的结构进行修饰可以赋予其更强的理化性能[36]。
2.3 涂层成膜材料复合海藻酸钠
除了上述两种方法外,使用成膜材料(如壳聚糖、乳清蛋白)构建外部涂层使其形成保护膜[37],也是提高微胶囊益生菌在胃肠消化过程中稳定性的方法。这些涂层材料与微胶囊的表面相互作用,在微胶囊上产生额外的膜(层),这种结构能降低微胶囊的渗透性,减少在储存期间益生菌暴露于氧气,并改善其在低pH 和高温下的稳定性,在很大程度上提高了对益生菌的保护,而且能够提高粘附性能以及保证活性物质的受控释放[38]。
2.3.1 壳聚糖复合SA 壳聚糖作为一种天然多糖,具有良好的吸湿性、透气性、成膜性、可降解性、抑菌活性等优点,是外部涂层的常用材料之一。海藻酸钠与壳聚糖均为天然的高分子材料,安全性好,无毒副作用,在动物机体内能够自然降解。二者作为聚电解质材料,在对活性物质进行包封时不仅能够减小孔隙且在缓释过程中起重要作用[39]。其原理在于海藻酸钠是一种聚阴离子物质[40],壳聚糖是一种聚阳离子物质,可与海藻酸钠形成聚合电解质络合物,离子凝胶中的钠离子在氯化钙中被钙离子取代,形成不溶于水的海藻酸钙,形成交联凝胶体系[41],二者通过钙离子交联作用,降低微胶囊的孔隙率,可以很好地抵抗胃肠道的恶劣条件。利用壳聚糖进行外壳涂层,应用两者的静电交联聚合作用,起到缓释和包封隔离等作用,使微胶囊中的益生菌稳定性得到明显改善[42]。Phuong 等[43]使用海藻酸钠与壳聚糖包封植物乳杆菌,在模拟胃液2 h 后,活菌数损失为2.14 lg CFU/mL,为益生菌提供了有效的保护,具有良好的缓释药物性能。
不仅如此,这两种壁材复合制备的微胶囊膜致密性好,海藻酸钠-壳聚糖复合物中,壳聚糖的质子化氨基基团(NH3+)和海藻酸钠的羧酸盐基团(COO-)之间的离子相互作用的形成导致更致密的膜[44],弥补了海藻酸钠微胶囊通透性大的缺点,能够减少胆盐等不利因素的渗透,增强对益生菌的保护作用。Kamalian等[45]选取海藻酸钠和壳聚糖对假小链双歧杆菌进行包裹,发现添加壳聚糖的益生菌对胆盐的耐受性比单独海藻酸钠胶囊更强,且比其游离细胞有着更长的存活时间。海藻酸钠-壳聚糖复合体在与胆盐作用时可在微胶囊表面形成一层不溶性的物质,因而限制了胆汁扩散到微胶囊的内部,从而防止胆汁与益生菌的直接作用,可以保持益生菌在肠道中的释放效率。其原因可能是海藻酸盐与壳聚糖一道,作为壁材对于保护益生菌活力方面具有一个较高水平的协同作用。
2.3.2 乳清蛋白复合SA 乳清蛋白营养价值高、网络锁水性强,对益生菌的活性有很好的保护作用。其优异的胶凝特性常被用作益生菌载体[46],基于其两性特性,通常与带负电荷的多糖(例如海藻酸盐)混合。当溶液pH 高于乳清蛋白等电点时,蛋白质表面的“正电补丁”效应会将乳清蛋白自身的净电荷改变为正,从而引起与带负电荷的多糖相互作用形成可保护益生菌菌株的高密度凝胶网络。Luo 等[47]利用海藻酸钠-乳清蛋白复合材料包埋植物乳杆菌,在扫描电子显微镜下观察到复合微胶囊的表面形成了致密而粗糙的聚集体,并且可以在微胶囊内部观察到附着的菌体细胞。与裸菌相比,包埋的益生菌在4 ℃下的储存稳定性提高了约15%,冻干后菌体存活率提高了65.37%。Han 等[48]制备的海藻酸盐-乳清蛋白微胶囊,用于保护和递送保加利亚乳杆菌和副干酪乳杆菌,与裸菌相比,微胶囊中菌体的存活率提高了38.26%。海藻酸钠和乳清蛋白的复合,不仅可以减少乳清的废弃率,提高利用率以实现产品增值,而且为开发益生菌微胶囊新壁材提供了一种有效的方法。
使用成膜涂层材料包埋能有效提高益生菌的稳定性,如贮存稳定性、胃酸耐受性和温度耐受性等,并且该技术适用性强,任何益生菌都可以利用该技术包埋。其次,由于多种功能壁材的协同作用,多层包埋技术能有效提高益生菌的益生效果,如帮助益生菌在肠道内定植和释放等。然而,如果外壳涂层过多会使操作步骤复杂,生产成本提高,并且制备得到的微胶囊粒径普遍偏大[49],增加益生菌芯材释放的难度,影响在胃肠道中的释放。而且由于工艺的复杂性和包埋层厚度的稳定性难以控制,较难实现工业化的应用。
3 结语与展望
海藻酸钠具有诸多优点,是微胶囊理想的壁材之一,已被广泛应用到益生菌包埋技术中,但单一的微胶囊壁材通常存在缺陷。选择合适的材料对海藻酸钠进行复合有利于加强对益生菌的保护作用,例如使用某些益生元材料刺激益生菌生长,提高包埋体系的靶向性缓释,共混纳米材料提升微胶囊整体的机械性能以及复配涂层成膜材料减小孔隙率,加强膜致密性。复合壁材制备的微胶囊结构稳定性更高,对益生菌的包封能力更强、缓控释放能力更好,此类研究有着广阔的前景。
未来海藻酸钠益生菌微胶囊包埋的发展方向可从以下几个方面展开:其一,可以在一些新型壁材与其复合改性方面进一步深入研究,提高海藻酸钠复合微胶囊机械性能和成胶稳定性、构建可控的释放系统以及进一步延缓益生菌释放的速率;其二,对壁材与益生菌结合的特性进行探究,以便更好地确定是否能提高益生菌在不良条件下的抗逆能力,为益生菌微胶囊带来新的组合形式和更好的包埋效果。此外,重点关注海藻酸钠与具有靶向作用壁材的复合,利用此特点与微胶囊技术结合,可在未来食品中应用于靶向定位系统,解决相关问题。复合海藻酸钠益生菌微胶囊提高了益生菌的使用价值,为新的益生菌制品开发奠定了基础,在食品、医疗、保健等领域具有巨大的潜力。

