阿美替尼致中毒性表皮坏死松解症一例
张 晗 景海霞 王润超 王 恒
湖北医药学院附属太和医院皮肤科,湖北十堰,442000
临床资料患者,男,49岁。因全身红斑、丘疹、水疱糜烂伴痒痛10余天入院,2022年11月确诊为“肺腺癌并胸膜转移、T4NxM1c”,排除禁忌后,于12月8日起口服“甲磺酸阿美替尼片110 mg 每日一次”靶向治疗,服药半月后,患者出现面部、躯干散在红斑、丘疹,于当地医院就诊,予以“甲泼尼龙、左氧氟沙星、维生素C等”静滴,无效,皮疹增多,周身可见弥漫性红斑、水疱、大疱,大面积皮肤剥脱、糜烂、大量渗液,口腔、外阴破溃、结痂、渗液明显。为求进一步治疗,于2023年1月来我科就诊。既往有“高血压”病史10余年,最高达160/120 mmHg,长期口服氨氯地平片1片 每日1次,自诉血压控制可。有可疑冠心病病史10余年,长期口服拜阿司匹林片0.1 g每日一次,阿托伐他汀钙片 20 mg 每晚1次,否认糖尿病病史;否认肝炎、结核病史;否认手术史;2003年摔伤致使腰椎骨折,未行手术;有右上肢外伤骨折,行石膏固定;否认输血史;否认食物过敏史,有青霉素过敏史,表现为皮试阳性;吸烟史15年,10支/天,戒烟20年;饮酒史30余年,2两/天,未戒,近1周无饮酒。门诊完善胸部CT示:左侧中央型肺癌并双肺、胸膜转移, 较前好转。
患者入院后查体:T 36.3℃,P 92次/分,R 20次/分,BP 140/91 mmHg,SpO299%(未吸氧)。全身皮肤黏膜无黄染出血点,浅表淋巴结未及肿大。双侧胸廓无畸形,左肺叩诊浊音,左肺呼吸音消失,双肺未闻及干湿啰音,余未见明显异常。皮肤科检查:周身可见弥漫性红斑,水疱、大疱,大面积皮肤剥脱、糜烂、大量渗液,尼氏征阳性,少许结痂,口腔、外阴破溃渗液结痂明显(图1),检查结果回报:血常规、血沉、BNP、肌钙蛋白等未见明显异常。高敏C反应蛋白:137.65 mg/L,降钙素原0.82 ng/mL,生化:丙氨酸氨基转移酶70.1 U/L,天冬氨酸氨基转移酶51.5 U/L。彩色多谱勒常规检查:双侧胸腔积液(右侧少量、左侧中等量)。
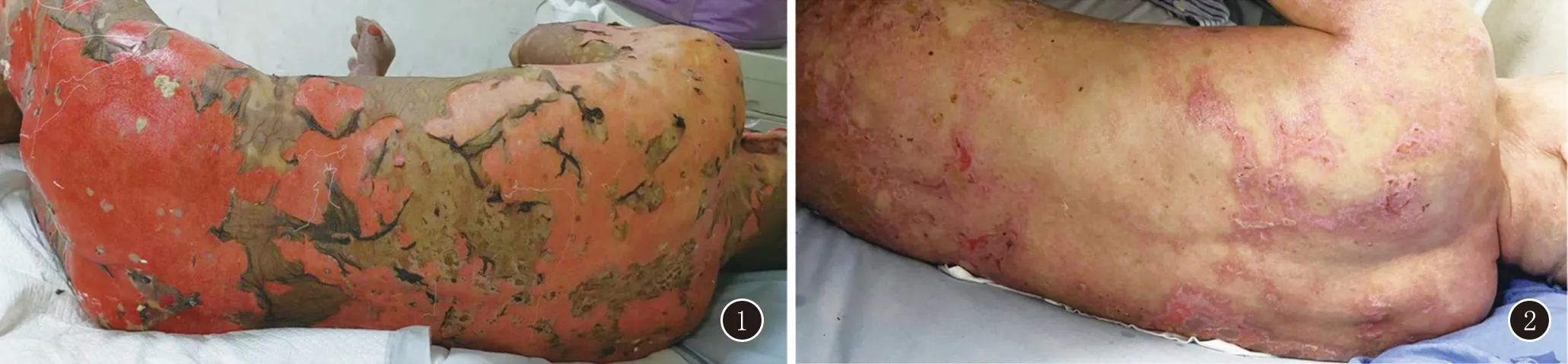
图1 治疗前患者皮损表现:周身见弥漫性红斑,水疱、大疱,大面积皮肤剥脱、糜烂、大量渗液,尼氏征阳性,少许结痂,口腔、外阴破溃,渗液结痂明显 图2 入院治疗21天后患者红斑明显变暗,水疱、大疱干涸、结痂、脱屑,出现新生皮肤,未见明显渗出
患者皮肤受累面积超过80%,在出现皮损前1个月仅使用阿美替尼治疗,结合患者详细病史及典型皮损,临床考虑诊断阿美替尼引起的中毒性表皮坏死松解症。
诊疗措施:立即停用阿美替尼,予以甲泼尼龙120 mg每日1次静滴,抗组胺药物口服(枸地氯雷他定、非索非那定),氯霉素泼尼松搽剂外用,每日4~5次,同时予以抗感染、止痛、补液、支持治疗。上述药物治疗3天,效果欠佳,加用丙种球蛋白20 g每日1次静滴,连续5天,甲泼尼龙逐渐减量至40 mg每日1次静滴。21天后,患者红斑明显变暗,水疱、大疱干涸、结痂、脱屑,出现新生皮肤,未见明显渗出(图2)。患者复查胸部增强CT:左侧中央型肺癌并双肺、胸膜转移,较前进展,左侧包裹性液气胸建议复查,患者要求出院,嘱院外继续治疗:泼尼松30 mg每日1次口服,同时辅以补钾、补钙、护胃等治疗,定期复查血常规、电解质、肝肾功能等指标,建议至肿瘤科就诊。后多次进行电话随访,患者病情持续缓解,皮疹未见新发,继续随访中。
讨论肺癌在我国男性恶性肿瘤的发病率和死亡率均高居第一,可分为非小细胞肺癌(nonsmall-cell lung cancer,NSCLC)和小细胞肺癌(small cell lung cancer),其中NSCLC占85%左右[1]。阿美替尼是一种酪氨酸激酶抑制剂,是全球第二个第3代表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor,tyrosine kinase inhibitors,EGFR-TKI)创新药[2],克服了一、二代EGFR-TKI的获得性耐药[3]。研究表明,阿美替尼在EGFR T790M突变阳性的局部晚期或转移性的NSCLC治疗的安全性、有效性及耐受性等方面都具有优势[4]。在以往的报道及药品说明书中可以看到,使用110 mg每日1次口服的剂量时,甲磺酸阿美替尼常见的(≥5%)不良反应为皮肤及皮下组织类疾病(皮疹18.0%和瘙痒12.7%),表现形式多样,包括:皮疹、皮肤瘙痒、毛囊炎、红斑、结节性红斑、皮炎、痤疮样皮炎、荨麻疹、药疹和光敏性反应等。既往文献中关于阿美替尼所致不良反应的文献较少,检索文献,阿美替尼相关不良反应主要为间质性肺炎[5]、横纹肌溶解[6]、Stevens-Johnson综合征(SJS)[7],未检索到中毒性表皮坏死松解症相关报道。
中毒性表皮坏死松解症(toxic epidermal necrolysis,TEN)是药疹中最严重的一型,发生率低,致死率极高[8,9]。其特点为起病急骤,可迅速发展为弥漫性斑片并波及全身,在红斑处出现大小不等的松弛性水疱和表皮松解。同时口腔、眼、呼吸道、胃肠道黏膜均可累及,还可伴有显著的内脏损害,全身中毒症状严重[10],死亡率可达14.8%[11]。与Stevens-Johnson综合征的不同之处在于病变范围更广,超过皮肤受累面积30%[12]。该患者病情进展迅速,全身红斑、丘疹、水疱、糜烂面积达80%以上,口腔、外阴破溃、渗液、结痂明显,入院后查肝功能受损,根据临床表现,符合典型TEN的临床表现。
TEN发病机制尚不明确,目前主要认为与药物、感染、自身免疫及机体遗传背景相关。常认为由磺胺类、解热镇痛(保泰松等)类、抗生素(四环素等)、抗抑郁药及近年来广泛应用的靶向药物等引起。感染多见于人类疱疹病毒(HHV)-6、EB病毒(EBV)、肺炎支原体、新型冠状病毒感染等[13]。机体遗传背景主要与人类白细胞抗原(human leukocyte antigen,HLA)的多态性相关[14]。TEN组织病理上表现为广泛的表皮角质形成细胞凋亡和坏死,此过程主要是细胞毒性T细胞和NK细胞浸润表皮引起[15],同时通过激活Fas配体(Fas ligand,FasL)促进上皮细胞凋亡,并且与淋巴细胞分泌的颗粒素和穿孔素、颗粒酶复合物及肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、干扰素γ(interferon-γ, IFN-γ)等高度相关[16]。在TEN早期,停止服用可疑致病药物是至关重要的。
根据我国药物不良反应监测关联性的评价方法[17]:①本例患者在使用阿美替尼半个月后出现面部、躯干皮疹,后逐步进展为中毒性表皮坏死松解症,从时间顺序上符合药物所致不良反应的特征;②患者停药后予以抗过敏等对症处理后患者症状缓解;③符合阿美替尼已知不良反应类型;④患者之后未再使用该药物;⑤患者使用该药期间,未使用其他药物,不考虑疾病本身引起。所以,阿美替尼与该患者TEN发生的相关性为很可能。
TEN的处理措施:在入院后24小时内对患者使用SCORTEN评分系统进行评分,预估病情的严重程度及预后情况,在早期阶段,停止服用致病药物,进行疼痛管理,加强皮肤护理[18],预防感染,补液和营养支持等治疗也尤为重要。目前临床常用的治疗方法包括:及早、足量使用糖皮质激素,静脉注射丙种免疫球蛋白,血浆置换,环孢素,TNF-α抑制剂等[19]。患者入院后立即使用足量糖皮质激素,未见明显改善,请肾病内科评估患者病情,结合患者既往病史,加用丙种免疫球蛋白静脉滴注,患者皮损明显好转。
TEN是一类临床少见但死亡率高的皮肤疾病,早期诊断与系统性治疗具有重大意义。随着分子靶向药物在临床的广泛应用,密切监测接受治疗患者的皮肤反应极为重要。在未来,有望通过治疗前筛查药物不良反应靶点及患者的特定人类白细胞抗原等位基因,来预防某些药物诱发TEN,以协助临床医师制定用药方案,保障临床用药安全。

