浓缩生长因子治疗雄激素性秃发的回顾性研究
刘 燕 庞 静 张雪青 刘建新 董 璐 李建可 王秀环 刘鑫洲 刘国艳
1山东第一医科大学附属皮肤病医院,山东济南,250022;2山东省皮肤病性病防治研究所,山东济南,250022;3山东中医药大学,山东济南,250014
雄激素性秃发(androgenetic alopecia,AGA)是以毛囊微型化改变为特征的非瘢痕性脱发。AGA在我国男性中的总体患病率为21.3%,女性为6%[1]。目前,米诺地尔和非那雄胺是美国食品药品监督管理局(U.S. Food and Drug Administration,FDA)唯一批准的相关药物,但该传统疗法疗效欠佳。浓缩生长因子(concentrated growth factor,CGF)作为第三代富血小板浓缩物,富含多种高浓度生长因子、CD34阳性细胞群及纤维蛋白等活性成分,可以维持细胞存活、增殖和分化,加速组织再生和修复[2]。CGF作为一种自体生物材料,已被用于口腔颌面外科、骨科、整形美容、创面修复领域[3]。但目前国内外尚无关于CGF脱发区域皮下注射治疗AGA的临床研究报道,因此本研究回顾性分析60例AGA患者采用CGF治疗的疗效和安全性。
1 对象与方法
1.1 入选与排除标准 本研究采用回顾性队列研究的方法,共纳入60例于山东第一医科大学附属皮肤病医院就诊并使用CGF治疗的AGA患者。入选标准:①年龄18~60岁,男女不限;②根据《中西医结合诊疗雄激素性秃发专家共识2021》,临床诊断为AGA;③脱发程度男性符合Norwood-Hamilton 分级中Ⅱ~Ⅵ级标准,女性符合Sinclair分级法(改良版)中Ⅱ~Ⅴ级标准;④接受3次CGF治疗。排除标准:①合并斑秃、白癜风等其他自身免疫性疾病者;②病历资料缺失者;③有凝血功能障碍等血液系统疾病,或合并头皮银屑病、严重毛囊炎、严重感染等患者;④首次就诊前6个月内接受过系统性脱发相关治疗者。
1.2 研究方法
1.2.1 临床资料收集 通过门诊电子病历系统回顾性收集患者的年龄、性别、就诊日期、病史、临床症状、诊断、分型、既往史、家族史、治疗方案、实验室检查、毛发镜图像和不良反应等,治疗前后临床大体拍照均在固定角度由同一专业医生进行拍摄。
1.2.2 CGF制备过程 CGF是抽取静脉血通过全自动不间断变速离心模式制备而成。该模式能促进血小板之间的碰撞,胞吐α颗粒释放细胞生长因子。制备过程如下:抽取患者自体静脉血于含有肝素钠抗凝剂的Vacuette真空负压采血管(9 mL)中,立即放入专用离心装置(Medifuge 200,Silfradent,意大利)中变速离心约13 min:首先加速30 s,速度达到2700 r/min后,维持旋转2 min;再降速至2400 r/min,维持旋转4 min;然后加速至2700 r/min维持旋转4 min;最后再加速至3300 r/min维持旋转3 min后减速36 s至停止。离心结束后分为三层:上层贫血小板血浆(Platelet poor plasma, PPP)层;中层浓缩血小板和生长因子层(CGF);下层红细胞(Red blood cell, RBC)层。抽取中间层进行注射。每9 mL自体静脉血可制备2.5 mL CGF有效成分进行皮损内注射。
1.2.3 CGF治疗方案 在脱发区域皮下注射CGF,每次注射剂量为0.1 mL/cm2,注射深度为5 mm,每月注射一次,连续注射3次。本研究纳入60例患者共分为两组,48例患者属于CGF联合治疗组:CGF注射+口服非那雄胺(男性5 mg/d)/螺内酯(女性80 mg/d)+外用米诺地尔酊(5%每日1次)。12例患者只注射了CGF进行治疗,属于CGF治疗组。每月随访一次,分别在治疗前和3次治疗结束后1个月进行疗效评估。
1.2.4 疗效评价
1.2.4.1 客观评价 评价治疗前和治疗3个月后单位毛发密度和毛囊单位密度改善程度,以及毛发镜图像特征变化,包括毛周褐色征、黄点征、空毛囊。毛发镜检查由专人针对头顶部正中(前发际线正中至发璇部连线中点)同一部位采集三次图像,[(毛发镜放大倍数为50×),采集视野面积为35 mm2(5 mm×7 mm),即0.35 cm2],计数后取平均值。
1.2.4.2 主观评价 医生满意度评价(由不参与此研究的同一专业医生参照临床照片进行评估)和患者满意度评价采用整体美容改善量表(GAIS量表)[4]。
-1分:改善程度为“更糟糕(不满意)”,改善比例为“比治疗前更差”;0分:改善程度为“无变化(一般)”,改善比例为“0~25%的改善”。1分:改善程度为“稍有改善(满意)”,改善比例为“26%~50%的改善”;2分:改善程度为“明显改善(非常满意)”,改善比例为“51%~75%的改善”。3分:改善程度为“完全改善(极其满意)”,改善比例为“76%~100%的改善”。
另外评估患者自觉症状的改善,包括脱发、头油、头屑、瘙痒等。
1.2.5 安全性评估 不良反应的发生例数。在随访期间,记录局部注射部位状态(如疼痛、红肿、瘙痒等)及全身症状(如头晕、恶心等)。

2 结果
2.1 基线特征 本研究共纳入60例使用CGF治疗的AGA患者,48例患者属于CGF联合治疗组,其中男21例(43.8%),女27例(56.2%),中位年龄28.5(23,34)岁,中位病史3.5(2,5)年,有AGA家族史患者12例(25%),无AGA家族史患者36例(75%),马拉色菌阳性患者38例(79.2%),马拉色菌阴性患者10例(21.8%)。12例患者为CGF治疗组,其中男8例(66.7%),女4例(33.3%),中位年龄30.5(24.25,35.75)岁,中位病史3.5(2,5.75)年,有AGA家族史者7例(58.3%),无AGA家族史者5例(41.7%),马拉色菌阳性患者9例(75%),马拉色菌阴性患者3例(25%),见表1。
城乡居民基本医保管理人员业务量繁重、工作压力大,必然产生顾此失彼现象[7]。面对新管理理念和形势,委托商保公司经办城乡居民基本医保制度设计和实施,推进了政府部门的职能转变,一定程度上实现了管办分离,发挥了管理中心的监督管理职能,还可直接利用商保公司的服务网点和管理平台,发挥专业化、信息化的优势,起到良好的补充作用[8-10],相关理论成果为本制度设计奠定了重要的理论基础。

表1 基线期人口统计学特征与临床特征 例
2.2 疗效评估 治疗3次后两组患者毛囊单位密度、毛发密度均明显增加。CGF联合治疗组治疗3次后的平均毛囊单位密度较治疗前增加了(18.04±11.15)个/cm2(P<0.05);平均毛发密度较治疗前增加了(36.43±21.18)根/cm2(P<0.05)。CGF治疗组治疗3次后的平均毛囊单位密度较治疗前增加了(8.81±5.77)个/cm2(P<0.05);平均毛发密度较治疗前增加了(16.19±12.62)根/cm2(P<0.05)。治疗3次后CGF联合治疗组的毛发密度与毛囊单位密度均高于CGF治疗组,两组之间在改善毛发密度上差异具有统计学意义(P<0.05),在改善毛囊单位密度上差异无统计学意义(P>0.05,表2)。
经过3次CGF治疗后,两组患者的毛发镜特征较治疗前毛周褐色征、黄点征和空毛囊均有明显改善,且第一次治疗后就有明显新生发(图1),但两组之间差异均无统计学意义(均P>0.05,表3)。
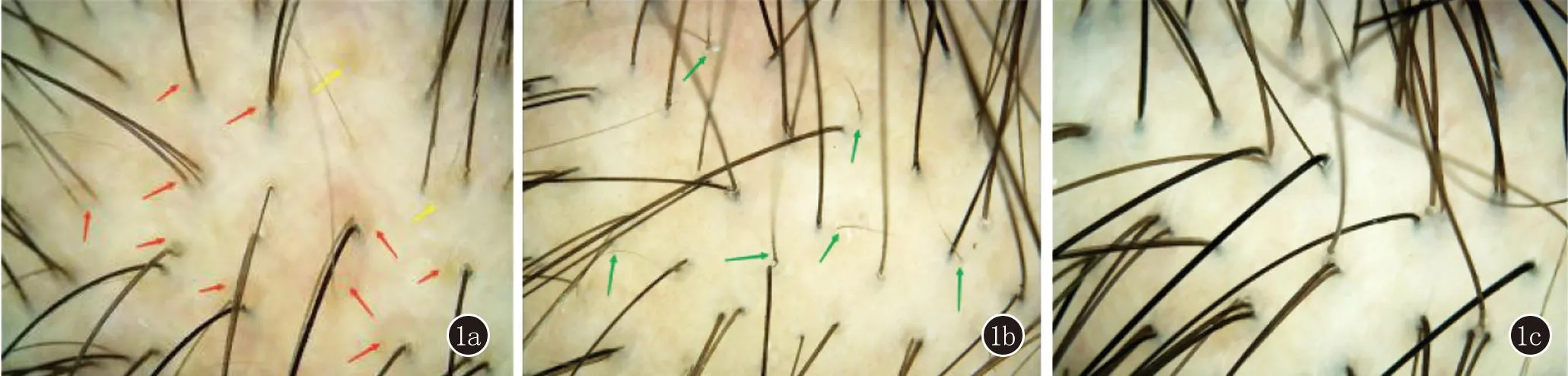
1a:治疗前,镜下见大量毛囊周围褐色征(红色箭头所指)、黄点征(黄色箭头所指);1b:治疗1次后,镜下见大量新生发(绿色箭头所指);1c:治疗3次后,毛囊周围褐色征、黄点征较治疗前明显减少,且毛发密度、毛囊单位密度显著增加

表3 毛发镜特征变化 例
满意度调查结果显示,治疗3次后CGF联合治疗组与CGF治疗组的医生与患者满意率均达到90%以上(表4)。
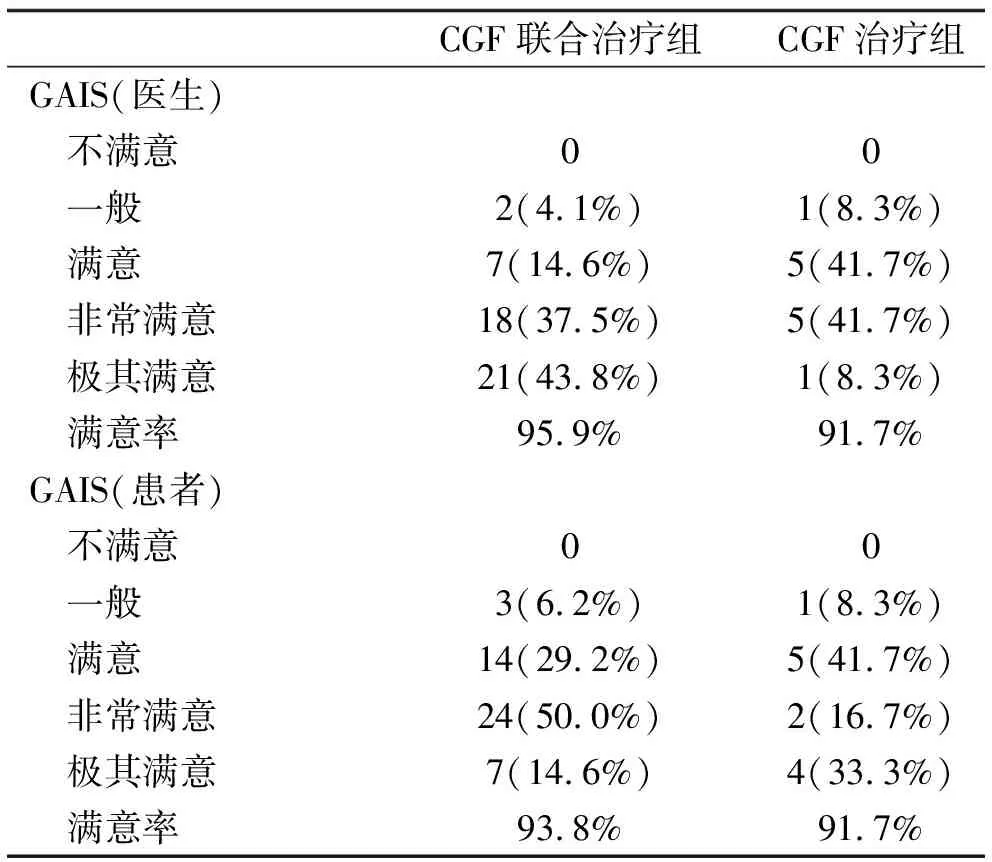
表4 GAIS评估结果
临床照片显示,患者经过CGF治疗后,头发覆盖率增加,发缝宽度得到改善 (图2、3)。

图2 CGF治疗组治疗过程临床图片

图3 CGF联合治疗组治疗过程临床图片
随访得知,经过治疗以后患者的脱发、头油、头屑、瘙痒等自觉症状均得到缓解。治疗1个月后,60例患者中有42例患者诉脱发明显减少,尤其在洗发时脱发量显著减少,31例患者诉头油减轻,由治疗前每日需洗头缩短为每两日洗头一次,且瘙痒程度减轻,头皮屑减少。治疗3个月以后,54例患者脱发得到显著控制,51例患者头皮油腻程度降低至每三日洗头一次,头皮仅轻度瘙痒,无明显头皮屑。
2.3 安全性评估 CGF注射有着良好的耐受性且副作用少,仅有少数患者出现了轻微不适症状。60例患者中仅有2例患者局部注射部位疼痛明显,3例患者注射后出现头皮瘙痒,但这些症状在治疗完成后的第2~3天内未经处理即可消失。其余患者未出现头晕、恶心,注射部位红肿、感染等不良反应。
3 讨论
雄激素性秃发已成为严重影响人们身心健康的脱发类疾病,不仅影响美观,而且使患者自卑、焦虑,甚至造成社交障碍[5]。目前,AGA的病因与发病机制尚未明确,主要与雄激素受体、炎症、细胞因子、Wnt/β-catenindeng等信号通路、基因表达等相关[6]。二氢睾酮对毛乳头细胞(dermal papilla cells, DPCs)的影响被认为是毛囊衰老的潜在原因。功能异常的DPCs会产生毛囊干细胞(hair follicle stem cells,HFSCs)的抑制因子[7]。在AGA脱发区域,HFSC的数量与未脱发区域保持一致,但增殖活跃的CD34+和CD200+干细胞数量明显减少,表明在干细胞受损的同时,HFSC并没有损伤。这一事实证明AGA具有可逆性[8,9],属于非瘢痕性脱发。因此,AGA作为一种慢性进行性疾病,不仅要抑制其进展,而且要应用修复毛囊损伤以及促进毛囊干细胞增殖的治疗[5]。
CGF是通过变速离心血液得到的血小板浓缩物,血小板变速离心活化后释放出多种生长因子:胰岛素样生长因子(IGF)、转化生长因子(TGF)、血小板衍生生长因子(PDGF)、成纤维细胞生长因子(FGF)和人类肝细胞生长因子(HGF)等,与富血小板血浆(PRP)的不同之处是CGF含有CD34阳性细胞群[10,11],其具有干细胞的活性,与多种生长因子一起参与基质重塑和血管生成,而且促进细胞增殖和分化。多项研究[7,12-14]表明CGF含有的生长因子可以刺激毛囊干细胞、促进毛囊发育及调控毛囊生长周期,诱导毛发再生;IGF-1刺激循环Ki67+基底角质形成细胞增殖,而TGF-β1通过抑制细胞生长和末端分离来确保基底角质形成细胞的增殖能力;PDGF-AA与FGF-2联合使用时,可增加毛乳头细胞的毛发诱导作用;PDGF-BB通过刺激伤口内巨噬细胞和成纤维细胞排出TGF-β1等内源性生长因子,促进合成新的胶原蛋白。Qi等[15]的研究证明,HGF通过增加β-catenin连环蛋白的表达而促进毛囊的生长。
CD34阳性细胞群在血管维护与再生、组织修复、免疫调节、细胞增殖分化等方面作用显著[16-18],而且可以促进头皮局部血供,改善毛囊周围微环境,调控毛囊进入并延长生长期,进而促进毛发再生[6]。在AGA患者的头顶部脱发区域,毛囊干细胞表达标志物CK15和CD34表达含量都较低[19]。因此,我们推测CD34的缺失是AGA发病机制之一,CGF可以通过增加AGA脱发区域CD34的表达来治疗AGA。
本研究将CGF注射到脱发区域皮下,生长因子、细胞因子等活性物质能有效逆转毛囊损伤加速修复,促进头皮血供,为毛囊毛发生长提供营养与动力。本研究结果显示CGF既可以增加毛囊单位密度也可以增加毛发密度,两组均是毛发密度的增加量高于毛囊单位密度,因此CGF改善毛发密度的效果更为显著。两组在改善毛囊单位密度方面差异无统计学意义,联合组在改善毛发密度方面优于CGF组,可能与口服和外用药物使用3个月已经开始起效相关,因此,CGF可以作为口服、外用药物的有效补充治疗。
毛囊周围褐色征、黄点征和空毛囊是AGA特征性毛发镜表现,与病情严重程度密切相关[20,21]。两组患者CGF治疗前后毛发镜下毛囊周围褐色征、黄点征和空毛囊均明显改善,且两组无统计学意义,因此该皮肤镜特征可辅助评价CGF的临床疗效。两组的医生与患者满意度均达到了90%,说明CGF治疗效果得到医生与患者的一致好评。
因CGF中含有的生长因子等成分无法抑制雄激素受体及基因表达等,尚无法完全替代口服药物。但与其他治疗方法相比,CGF具有多项优势。与米诺地尔相比不仅不会出现“狂脱期”,且止脱效果快速显著。Stanca等[10]首次报道了CGF中多种生物活性因子随时间的持续和长期释放,表明CGF适用于促进复杂而漫长的组织再生过程,而且数据表明28天是 CGF 释放因子的最长时间,因此CGF治疗可以做到快速显著止脱,而且每月注射一次效果更好。CGF是从自体血分离得到的非全血细胞成分,不存在感染、免疫排斥和疾病传播的风险。因此CGF与传统疗法联合治疗,可以相辅相成,增强治疗效果与安全性。
综上所述,CGF治疗AGA安全有效,且制备简便、易于掌握,可作为 AGA 的新型疗法,在毛发再生领域有着广阔前景。

