绞股蓝提取物用于护肤品的功效初探
莫 夏
(福建三状元生物科技有限公司,福建 福州 350700)
绞股蓝喜欢阴湿,不耐旱,是一种分布很广泛的植物,在国内外均有分布,多分布于海拔300~3200 m 的山林地带,我国主要分布于秦岭以南的陕西、四川、湖北、湖南、广东、广西、福建等地[1]。由于气候差异,南部早熟,北部略迟,其有三叶、五叶和七叶生态类型[2]。
绞股蓝性寒,民间用于治疗高脂血症、高血压、高血糖,尤其是高脂血症,其他药物和食物难以替代[3-4]。绞股蓝含有皂苷、多糖、黄酮类、水溶性氨基酸、多种维生素、微量元素、矿物质,这些营养成分对绞股蓝的药用价值有很多作用,加上其效用和人参相似,也被称为“南参”[5-6]。
1984年,我国注意到绞股蓝的功效,对其分布资源进行了调研和开发。由于绞股蓝具有很高的药用价值和保健价值,国家科学委员会于1986年将其列为星火计划中最有价值的中草药[7]。2002年3月5日,原卫生部将其列入保健品目录。全国各地的茶叶加工企业将其制成茶叶,并销往市场[8]。绞股蓝能很好地改善脑力,提高大脑机能,它除了能降低“三高”之外,还能抑制血栓形成,让老人远离动脉硬化。日常饮用绞股蓝,还能活化人体内的细胞,缓解疲劳,促进良好睡眠。除人参的功效外,它还具有人参所没有的多种功效,并且没有人参过量的反应和任何其他毒副作用[7,9]。
现代研究表明,绞股蓝具有极高的药用价值和观赏价值,这引起了学者和许多普通百姓的关注。目前,绞股蓝已经不拘泥于药用和茶类[9],它在保健食品、化妆品、饲料等制品均有涉猎。许多学者对绞股蓝的化学成分、组织培养、栽培技术等方面进行了研究[8,10]。随着科学技术发展,天然产物的提取方法越来越多[11]。绞股蓝的提取工艺也丰富多彩,最常见的有超声波辅助提取、微波辅助提取、超临界流体萃取、溶剂萃取等[12]。因此,绞股蓝具有良好的发展前景[13-15]。
随着经济的发展,人们的压力越来越大,生活不规律,使得黑色素形成,皮肤老化。因此,美白抗衰老化妆品成为化妆品领域的一个热点[5,16]。其中,天然产品化妆品的开发,特别是含有中草药活性成分的化妆品,越来越受到国内外厂商的重视[17]。
本工作研究绞股蓝有效成分对黑色素的抑制作用、抗氧化能力和抗菌能力,探讨绞股蓝提取物在化妆品中应用的可能性,为绞股蓝这一药用资源的研究开发提供试验科学依据[16,18-19]。
1 材料与方法
1.1 主要材料与试剂
绞股蓝,安国市佳雨参茸药材行;营养琼脂粉,广东环凯微生物科技有限公司;酪氨酸酶(25 KU/480),美国Worthington;L-多巴胺,南京奥多福尼生物科技有限公司;菌种,福建师范大学生命科学学院;其他试剂均为国产分析纯。
1.2 主要仪器与设备
电子天平,VAriAn;电热干燥箱,上海亚荣生化仪器厂;旋转蒸发仪,临沂正衡化玻仪器有限公司;721可见分光光度计,上海佑科仪器仪表厂;细菌培养箱,上海一恒科技有限公司;霉菌培养箱,上海一恒科技有限公司;无菌操作台,苏州净化设备有限公司。
1.3 试剂、溶液配制
1.3.1 绞股蓝样品溶液制备
配制 25 mL 2.32 mg/mL 绞股蓝样品溶液(60%的乙醇溶液为溶剂)用于绞股蓝总黄酮含量测定;
配制 1000 mL 0.4 mg/mL 绞股蓝样品溶液(PBS为溶剂)用于羟基自由基清除能力的测定;
配制 1000 mL 0.02 mg/mL 绞股蓝样液(用无水乙醇溶液为溶剂)用于DPPH自由基清除能力测定;
配制 10000 μg/mL 绞股蓝样液(PBS为溶剂)用于体外美白评价。
1.3.2 其他样品溶液制备
pH=6.8的磷酸盐缓冲溶液 (PBS);0.04 mg/mL 的芦丁标准液(60%乙醇为溶剂);0.4 mg/mL 抗坏血酸(VC)溶液(PBS为溶剂);0.3% H2O2溶液;9 mmol/L 水杨酸-乙醇溶液(75%的乙醇为溶剂);9 mmoL/L 硫酸亚铁溶液;2 mmoL/mL DPPH溶液(无水乙醇为溶剂);酶活为 100 U/mL 酪氨酸酶溶液(PBS为溶剂,4 ℃ 避光保存);2.0 mmoL/LL-多巴胺溶液(PBS为溶剂,4 ℃ 避光保存)。
1.4 实验方法
1.4.1 绞股蓝中黄酮类物质的提取
将一定量的绞股蓝草药粉碎后过筛(100目)。将过筛后的绞股蓝粉末放入 50 ℃ 的烘箱中干燥至恒重,取干燥后绞股蓝粉末m1放入 250 mL 的圆底烧瓶中,设置温度为 90 ℃,加入80%乙醇溶液 (料液比为 1 g∶20 mL),提取 2 h 后,抽滤的提取液放置 60 ℃ 烘箱蒸发乙醇,放置 70 ℃ 烘箱干燥得绞股蓝提取物m2。参照公式(1)计算其提取率:
提取率=(m2/m1)×100%
(1)
1.4.2 芦丁标准曲线的绘制
取 25 mL 容量瓶8个,分别加入 0、0.5、1.0、1.5、2.0、2.5、3.0、3.5 mL 芦丁标准液,再往其中加入 1 mL 40 g/L NaNO2溶液和 1 mL 100 g/L Al(NO3)3溶液,摇匀且静置 6 min 使其反应完全,最后加入 10 mL 40 g/L 的NaOH溶液,蒸馏水定容至刻度线,摇匀后静置反应 15 min。调节分光光度计的波长为 510 nm,测量各溶液吸光度,各测3次,取平均值,绘制芦丁标准曲线。
1.4.3 绞股蓝总黄酮含量测定
移取 2.32 mg/mL 绞股蓝样品溶液 4.0 mL 于 50 mL 容量瓶中,依次加入 40 g/L 的NaNO2溶液 2 mL 和 100 g/L 的Al(NO3)3溶液 2 mL,摇匀后静置 6 min 使其反应完全,再加入 40 g/L 的NaOH 20 mL,用蒸馏水定容至刻度线,摇匀静置 15 min。在与测定芦丁对照品吸光度同样的环境下,测定溶液的吸光度,记录数据,参照公式(2)计算其总黄酮含量:
w(总黄酮)=(ρ×V×V2)/(V1×m)×100%
(2)
式中:ρ为依据吸光度A计算出的浓度;V为溶解试样所需溶剂体积;V1为吸取试样溶液体积;V2为稀释试样溶液体积;m为试样质量。
1.4.4 绞股蓝提取物抗氧化性能测定
目前人们常利用Fenton法[20]和DPPH法[21-22]测量清除羟基自由基和DPPH自由基的能力,从而得出抗氧化剂的抗氧化效果。
1)羟基自由基清除能力测定
取 50 mL 容量瓶11个,分别加入 0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0 mL 0.4 mg/mL VC溶液,再往其中依次加入 5 mL 9 mmoL/L 硫酸亚铁、5 mL 9 mmoL/L 水杨酸-乙醇溶液;最后加入 5 mL 0.3% H2O2溶液开启反应,加入蒸馏水至刻度线,摇匀后静置 40 min;测定各溶液的吸光度,利用吸光度计算抗坏血酸对羟自由基的清除率。绞股蓝提取物羟基自由基清除能力测定步骤同上。参照公式(3)计算其羟基自由基清除率(S):
S=(A0-A1)/A0×100%
(3)
式中:A0为空白组吸光值;A1为加抗氧化剂的吸光值。
2)DPPH自由基清除能力测定
分别往8个试管中分别加入 1.0 mL 0.0015、0.0030、0.0045、0.0060、0.0075、0.0090、0.0105、0.0120 mg/mL 的绞股蓝样液,再加入 2.0 mL 2 mmoL/mL DPPH溶液,在避光条件下反应 10 min 后,在波长 517 nm 处,测各溶液的吸光值A1,并测量空白组A2、A0的吸光值。
参照公式(4)计算其自由基清除率:
样品对DPPH的清除率=[1-(A1-A2)/A0]×100%
(4)
式中,A1为不同浓度绞股蓝样品液+DPPH溶液的吸光值;A2为不同浓度绞股蓝样品液+无水乙醇的吸光值;A0为无水乙醇 +DPPH溶液的吸光值。
1.4.5 体外美白评价
1)酶活力测定[23]
依次加入 2 mLL-多巴胺溶液、0.5 mL pH=6.8的PBS、0.5 mL 酪氨酸酶溶液于比色杯中,快速摇匀,避光恒温 37 ℃ 条件下,于 475 nm 波长处每分钟测定一次溶液的吸光度值,平行测量三组,直至吸光度无变化,得出吸光度A随时间的变化曲线。
2)绞股蓝提取物浓度对酪氨酸酶的抑制作用
每管分别加入 2.0 mLL-多巴胺溶液、0.5 mL 质量浓度分别为为 50、100、200、400、600、800、2000、4000 μg/mL 的绞股蓝样品溶液、0.5 mL 酪氨酸酶溶液,待酶活数据在 37 ℃ 水浴中稳定后,在 475 nm 处测定吸光度值。
空白组用等体积PBS代替酪氨酸酶溶液,酶活数据在 37 ℃ 水浴中稳定后,用PBS将紫外分光光度计调零,在 475 nm 处测定吸光度值。
3)抑制率计算
根据吸光值A参照公式(5)计算绞股蓝提取物对酪氨酸酶的抑制率:
抑制率=[1-(C-D)/(A-B)]×100%
(5)
式中:A为磷酸盐缓冲液 0.5 mL+L-多巴胺溶液 2.0 mL+酪氨酸酶溶液 0.5 mL 混合后测得吸光度;B为磷酸盐缓冲液 1.0 mL+L-多巴胺溶液 2.0 mL 混合后测得吸光度;C为L-多巴胺溶液 2.0 mL+绞股蓝提取液溶液 0.5 mL+酪氨酸酶溶液 0.5 mL 混合后测得吸光度;D为L-多巴胺溶液 2.0 mL+绞股蓝取液溶液 0.5 mL+磷酸盐缓冲液 0.5 mL 混合后测得吸光度。
1.4.6 绞股蓝提取物的保湿评价
1)在两个不同的干燥器内分别加入饱和碳酸钾溶液和变色硅胶,并存放于 20 ℃ 的恒温箱中,制成相对湿度分别为43%和硅胶环境[24-25]。
2)将载玻片洗净烘干,并贴上医用胶带。将绞股蓝提取物,1%丙二醇溶液分别在胶带上涂抹均匀,呈不会有液滴落下的湿润状态,称质量,测量3次,取平均值m3。
3)将上述涂抹均匀的玻片放置于相对湿度为43%和硅胶环境的干燥器中,放置 8 h,每隔 2 h 迅速取出称重后放回干燥器,平行测量3次,取平均值m4。
4)参照公式(6)计算其失水率(R):
R=((m3-m4))/m3×100%
(6)
1.4.7 抗菌评价[26]
将 0.0344 g/mL 绞股蓝提取物溶液、带细菌培养基、打孔器、移液器等放于超净台中灭菌 15 min,用打孔器于培养基中心打孔后,取出孔内琼脂,用移液器将 200 μL 绞股蓝提取物加入孔内。将带有绞股蓝提取物的培养基(不倒扣、不封口)放入 37 ℃ 培养箱中,培养 24 h 后取出培养基,测抑菌圈直径大小。
1.4.8 抗炎评价
将试剂盒提前 20 min 从冰箱中取出,并平衡至室温,按说明书提前制备标准品,稀释至一系列质量浓度梯度,浓缩洗涤液按体积比1∶20稀释。取出本实验所需的条带,分别加入标准稀释剂或样品 100 μL/孔,保留空白孔,用膜密封板,在 37 ℃ 下孵育 90 min。洗涤板5次后,除空白孔外,加入预先制备好的生物素化的抗体工作液 100 μL/孔,盖膜,37 ℃ 下避光孵育 60 min。洗板5次,每孔加酶结合工作液 100 μL,覆磨封板,37 ℃ 暗孵 30 min。洗板5次,每孔加显色底物 100 μL/孔,37 ℃ 下避光孵育 15 min,加终止液 100 μL/孔,振荡器震荡 2 min,搅拌均匀,立即测量OD450。
2 结果与分析
2.1 绞股蓝中黄酮类物质的提取
在温度为 90 ℃,料液比为1 g∶20 mL下,用80% 乙醇溶液中提取2 h,可得出提取率为13.75%。
2.2 黄酮含量
为了测量绞股蓝提取物中的黄酮含量,通过标准曲线法绘制芦丁标准曲线,如图1所示。再用紫外分光光度计测出绞股蓝提取物的吸光度,代入芦丁曲线,得出绞股蓝提取物中黄酮的含量。
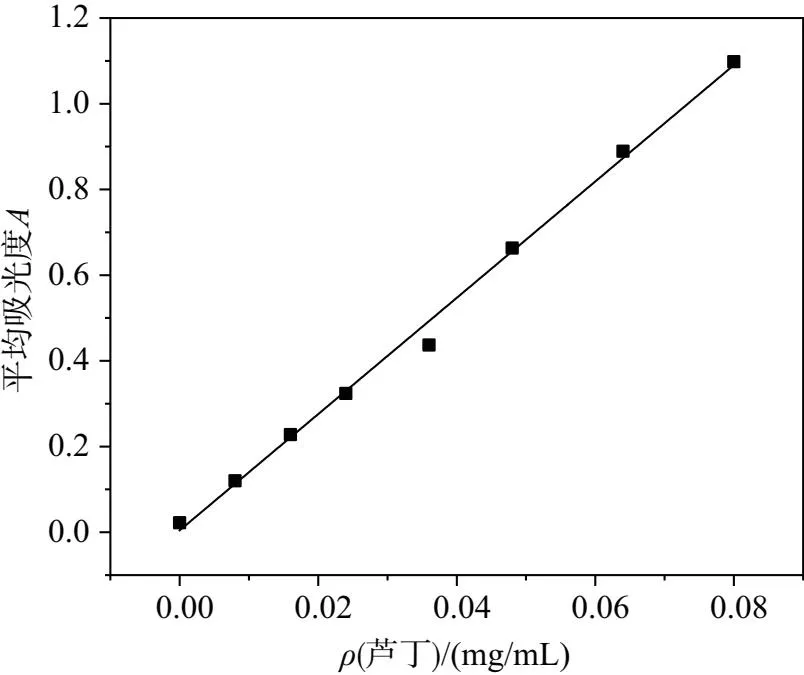
图1 芦丁浓度与吸光度关系图
绞股蓝提取物试样用分光光度计测得吸光度为0.240,把测得的值代入芦丁标准曲线中A=16.0714ρ-0.16557 (R2=0.9997),计算出黄酮含量为1.34%。
2.3 抗氧化性测定
2.3.1 清除羟基自由基能力测定
为了探究绞股蓝提取物是否能对自由基氧化反应进行阻止,通过实验,利用Fenton法对VC与绞股蓝提取物进行抗氧化测试,得出绞股蓝提取物清除羟基自由基的能力并与VC清除羟基自由基能力进行对比,所得结果如图2所示。
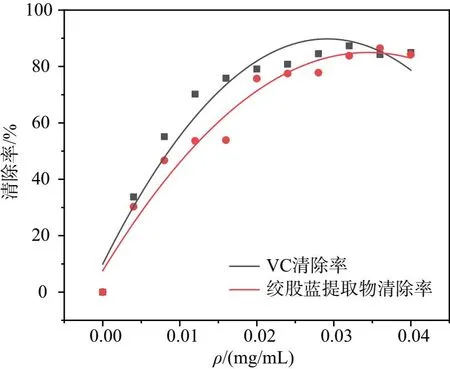
图2 绞股蓝与VC对自由基清除率对比图
由图2可知,当质量浓度达到 0.04 mg/mL 时,两者抗氧化性接近;之后绞股蓝抗氧化性会超过VC。绞股蓝提取液和VC均具有清除羟自由基的能力,且清除率与质量浓度呈正相关。从图2看出,随着绞股蓝提取物质量浓度的增加,对羟自由基的清除作用不断上升,达最高清除率85%后不再变化。但总体来看,绞股蓝最佳清除率略低于VC。结果表明,绞股蓝提取物具有一定的抗氧化作用,但抗氧化效果一般。
2.3.2 DPPH自由基清除能力测定
由于DPPH自由基有单电子,在 520 nm 处有一强吸收,醇溶液呈紫色,被广泛用于抗氧化能力的测定。为探究绞股蓝提取物的抗氧化功效,测量样品清除DPPH自由基的能力来预估绞股蓝提取物的抗氧化能力,最终得到绞股蓝提取物浓度对DPPH自由基清除率的变化图,如图3所示。
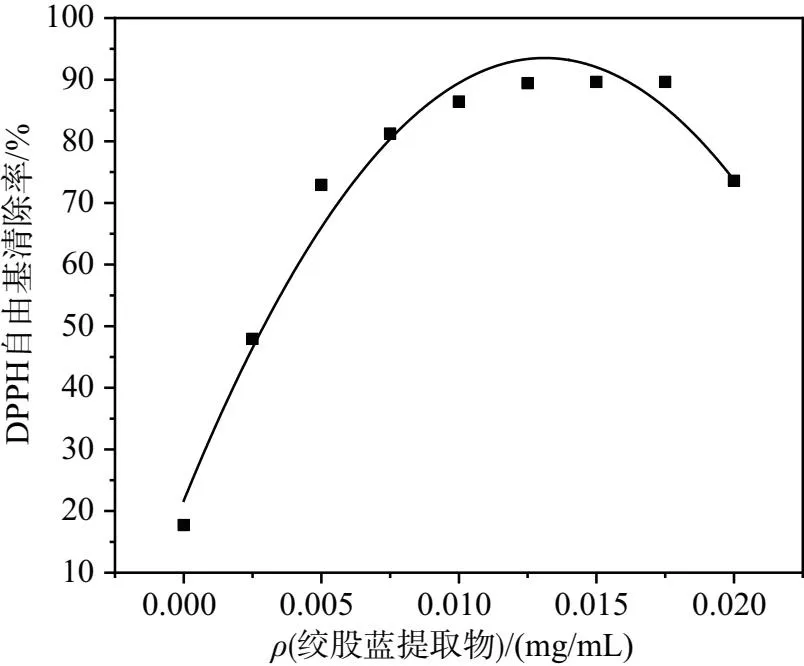
图3 绞股蓝提取物对DPPH的清除率
由图3知,随着加入不同质量浓度的提取物,对DPPH自由基的清除率呈上升趋势,可见绞股蓝提取物对DPPH自由基有消除能力,有一定地抗氧化效果,其在质量浓度达到 0.018 mg/mL 左右时绞股蓝提取物对DPPH的清除率到达最大89.64%。
2.4 体外美白评价
2.4.1 酪氨酸酶酶活力测定曲线
酪氨酸酶活力越高,代表形成黑色素的速率快,因此酪氨酸酶活力的测定在美白评价中是非常有意义的。为了探讨L-多巴与酪氨酸酶在单变量时间内相互作用的影响,设置在不同时间下的吸光度变化测定酶活性,得到时间对酶活性的影响曲线,如图4所示。
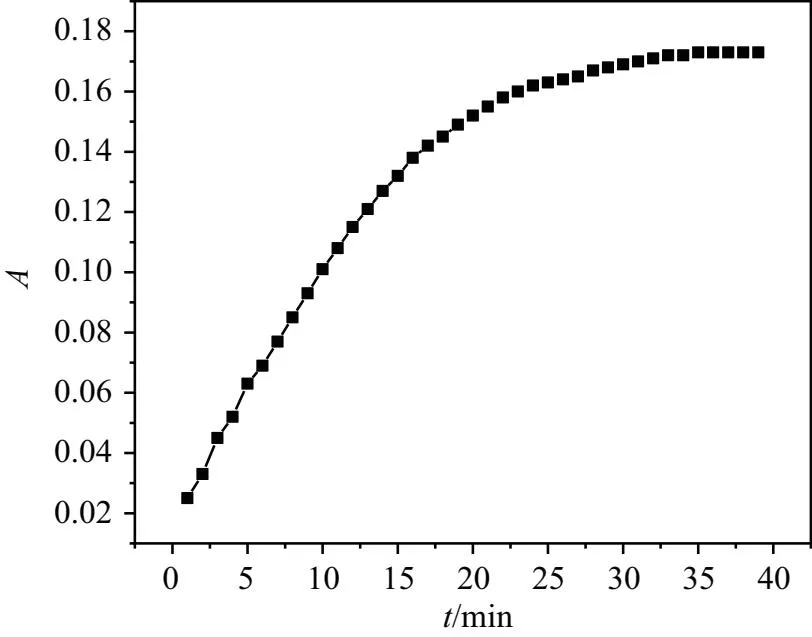
图4 酪氨酸酶活力随时间变化曲线图
从图4中看出,100 U/mL 的酪氨酸酶活力随着时间呈增长趋势,特别在前 15 min 内,酶活力与时间呈正比增长。由图4可知,30 min 后酪氨酸酶活力的增长趋势基本趋于平缓,故本实验选择在 30 min 作为反应时间,用于测定各个体系的吸光度值A。
2.4.2 绞股蓝提取物对络氨酸酶活力的影响
为探究绞股蓝提取物的美白效果,通过控制单因素变量法,测定了不同质量浓度下绞股蓝提取物和烟酰胺对酪氨酸酶活力的抑制率,从静置相同时间下的实验组和空白组的吸光度计算出抑制率,得出绞股蓝提取物和烟酰胺对络氨酸酶抑制率的对比图,如图5所示。
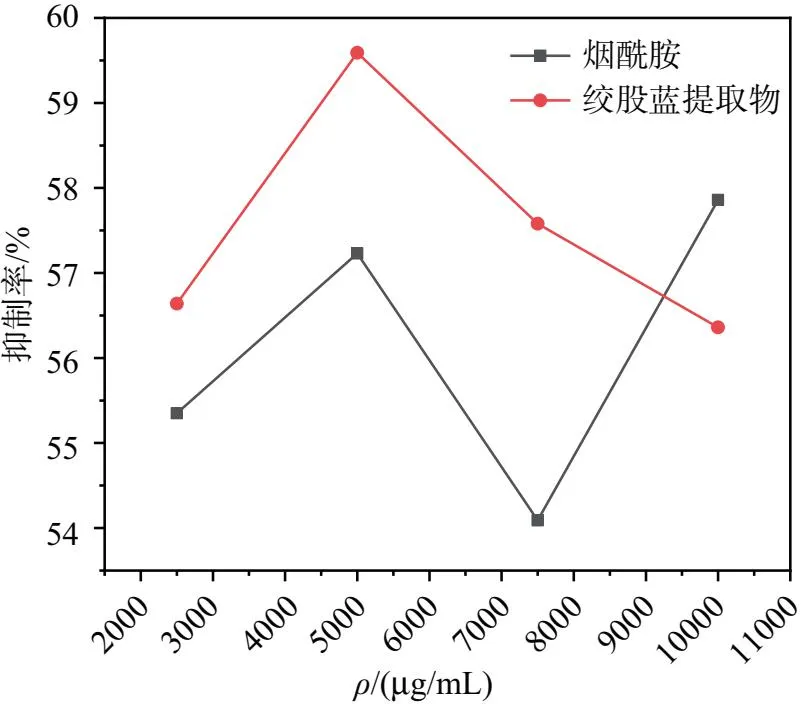
图5 烟酰胺与绞股蓝提取物对络氨酸酶活力抑制率对比图
抑制酪氨酸酶活性能是有效降低黑色素形成,提取物溶液对酶的活性抑制率越高,代表酪氨酸酶活力越低,合成黑色素就越少 。从图5可看出,绞股蓝质量浓度在6000~10000 μg/mL 时,抑制率基本稳定在55%~60%之间,有一定的美白效果;对比绞股蓝提取物与烟酰胺对酪氨酸酶活力的抑制效果,相差不大。所以绞股蓝提取物总体抑制作用较强。
2.5 保湿评价
为探究绞股蓝提取物的保湿效果,通过在相对湿度为43% 与硅胶环境下进行实验,得绞股蓝提取物的失水率同1% 丙二醇失水率对比图,如图6。
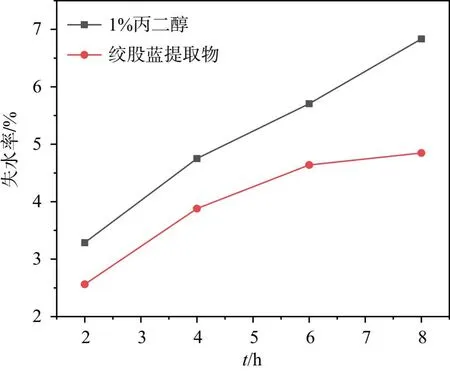
图6 相对湿度43%环境下失水率对比图
保湿是在相对干燥情况下,通过保湿剂使皮肤保持水分,改善肌肤湿润度。通过对保湿剂进行保湿评价,测量保湿剂水分挥发到空气中的能力,从而得出该保湿能力的好坏。从图6看出,在相对湿度43% 条件下,绞股蓝提取物溶液在 8 h 之内,失水率从2.56% 增加到 4.85%,但都低于1% 丙二醇溶液;从图7看出,在硅胶环境下,绞股蓝提取物在 8 h 之内,失水率从1.56%增加到4.22%,也都低于1% 的丙二醇。由此可知,绞股蓝可能有一定的保湿作用,但有待进一步纯化研究。
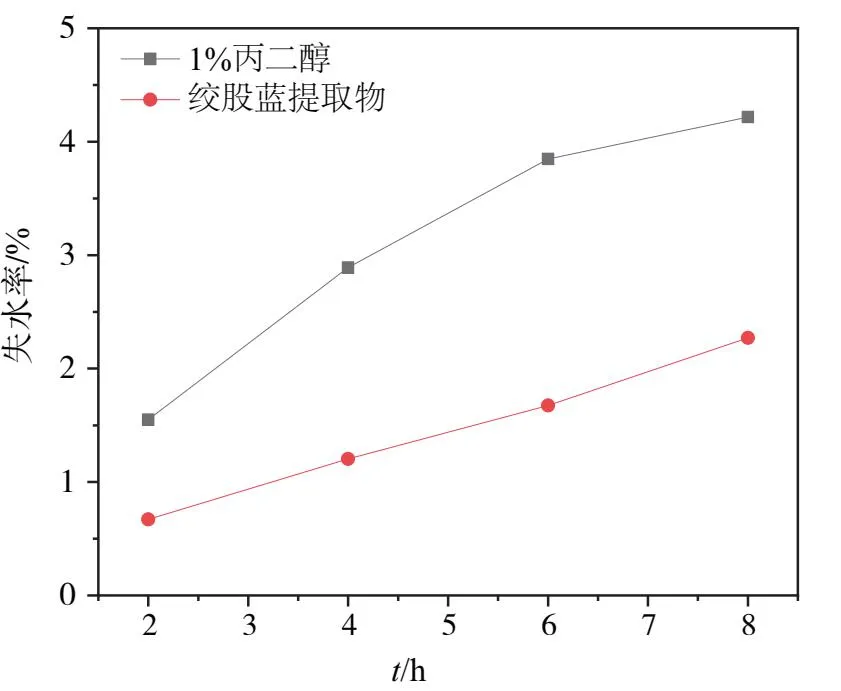
图7 硅胶环境下失水率对比图
2.6 抗菌评价
为探究绞股蓝提取物的体外抑菌效果,将绞股蓝提取物进行抗菌实验,抑菌圈测量结果如表1所示。

表1 绞股蓝提取物的抑菌圈直径
国家标准WS/T 650—2019[27]抗菌和抑菌效果评价方法中(牛津杯测量法中),当抑菌圈直径>7 mm 时,可视为有抑菌效果。由于本实验采取打孔法,且打孔直径为 12 mm,所以当抑菌圈直径>12+7 m=19 mm 者,才可视为有抑菌作用。由表1所知,绞股蓝提取物对大肠杆菌抑菌圈直径为 43 mm>19 mm、金黄色葡萄球菌抑菌圈直径为 25 mm>19 mm,所以绞股蓝提取物对金黄色葡萄球菌和大肠杆菌有抑制作用,而对铜绿假单胞菌的抑菌圈基本没有抑菌圈,没有抑制作用。
2.7 抗炎评价
为了评价绞股蓝提取物的抗菌效果,将不同浓度提取物进行抗炎测试,并用ELISA法检测炎症因子,所的结果如表2所示。
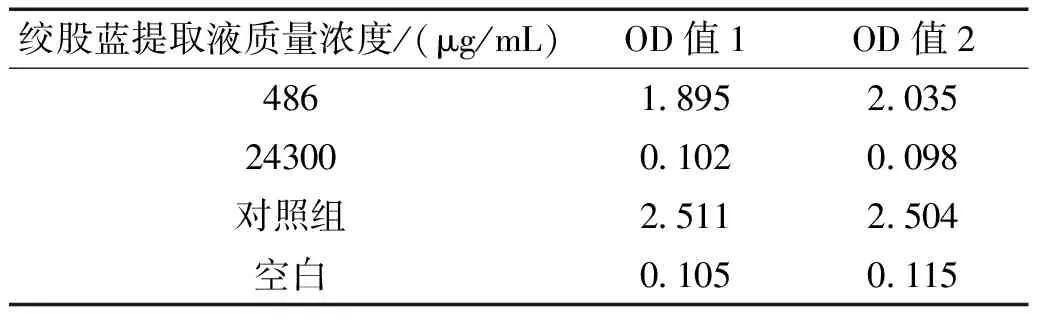
表2 绞股蓝提取物的OD值
OD值越小,代表抗炎因子浓度越高,抗炎效果越好。由表2可得,当绞股蓝质量浓度为 486 μg/mL 时,溶液颜色较浅,当质量浓度达到 24300 μg/mL 时,溶液基本呈透明,OD值可达0.1。由此可知,绞股蓝提取物有较好的抗炎效果,可应用于抗痘、消炎等日用化妆品中。
3 结论
在温度为 90 ℃,V(绞股蓝粉末)∶m(80%乙醇)=1∶20,回流时间 2 h 提取条件下,绞股蓝提取率为13.75%,绞股蓝提取物中的黄酮质量分数为1.34%。绞股蓝提取物对羟基自由基和DPPH自由基的清除率均在85%以上,有较强的抗氧化能力。通过分析绞股蓝提取物对络氨酸酶活力的抑制率,可得绞股蓝提取物质量浓度在 600 μg/mL 基本达到最大抑制率58%,但与烟酰胺相比看出,绞股蓝提取物的美白效果不显著;绞股蓝提取物在相对湿度43%和硅胶环境下的失水率均小于1%丙二醇失水率,但是具体还有待研究。通过抗菌研究,发现绞股蓝提取物对大肠杆菌、金黄色葡萄球菌有良好的体外抑菌效果,特别是对大肠杆菌有较强的抑菌效果,抑菌圈可达 43 mm,但铜绿假单胞菌几乎没有效果。通过分析测定绞股蓝提取物抗炎效果可知,绞股蓝提取物的OD值可达0.1,抗炎因子浓度高,有较强的抗炎效果。

