矢车菊素半合成方法实验教学实践*
侯婷婷,刘渝钶,杨胜男,孙萌萌,胡海鹏,王广途,王晗光,吴贺君,蒲 祥
(四川农业大学 理学院,四川 雅安 625014)
有机化学实验是农业院校面向化学、药学、生科、食品等众多专业开设的基础课。现有有机化学实验教材内容侧重于培养学生掌握基础实验原理与基本操作技能,合成物质包括天然化合物、药用有机化合物以及有机基础原料,如香豆素[1]、阿司匹林[2]和乙酸乙酯[3]等物质的制备。然而,药用或食用的天然活性成分的综合性制备实验项目仍偏少,且实验内容设计与科研和生产实践之间缺乏有效联系。这不利于化学、药学、生科、食品等相关专业学生在有机化学基础实验课程学习过程中培养从事有机化学研究或生产的从业兴趣[4]。黄酮化合物是一类重要的天然化合物,随化学化工行业发展人们对其研究也逐步深入,其中的花青素作为抗氧化的热门分子,其相关合成实验在有机化学实验教学中仍较少。因此,有必要有计划地将花青素的合成实验融入有机化学实验教学过程。
1 实验背景
花青素是一种普遍存在于植物液泡中的水溶性色素,广泛分布在植物的花朵、叶片和果实之中。它具有A-C-B典型三环结构,且B环上的羟基与生物活性密切相关,以致于其具有抗氧化、延缓衰老、抗癌、抗心血管疾病等作用[5]。2016年,Sui等[6]人发现,花青素的颜色会随着热处理从红色渐变至橙色。由于具有颜色变化效应、无毒无害且有益于人体健康等众多优点,使得花青素可作为食用色素[7-8]。
花青素具有抗氧化活性。抗氧化性是多酚类化合物的共同特点,即向活性自由基提供一个氢原子,而自身由于结构的高度离域,可使生成的自由基比之前的结构更为稳定。Plaza等[9]人对类黄酮化合物抗氧化能力研究的实验中发现,取代基跟抗氧化性能密切相关。A环上5位和8位、7位和8位的成对羟基取代,均能对抗氧化能力做出有益贡献;5位和7位的同时取代,对活性没有影响;7位单独取代没有贡献;6位单独羟基取代反而会降低抗氧化活性;但5位的单独取代可提高活性。B环上邻位多羟基结构比羟基单取代结构抗氧化活性更强;C环上3位羟基为抗氧化活性必需基团。花青素的C环结构高度离域,且pH变化时具有形成共振结构能力,所以能生成稳定的自由基,展现高抗氧化活性,与槲皮素具有活性相当的抗氧化能力[9]。
在现代工业生产上,花青素大多是从蓝莓、黑枸杞、葡萄和玉米等中提取,并通过分离纯化制备。天然花青素的应用前景广泛,但价格昂贵,因此寻找一种低成本、合成简便的方法极具实用价值。矢车菊素是花青素中含量相对丰富的一种,其结构上有多个羟基。羟基保护常见的方法是甲基化保护法,采用的甲基化试剂通常为硫酸二甲酯和碘甲烷[10],但二者均为致癌物质。2006年Kondo等[11]人采用TBSCl作为羟基保护试剂,描述了酚类TBS基团在酸性条件下相对稳定,类黄酮等多酚类物质的TBS保护基在酸性条件下很容易脱保护。TBSCl使用安全,但活性较低,通过加入催化剂DMAP可改变这一不足,还可以得到与甲基化保护法相当的产率,并且免去了脱除保护基步骤。该法酸化的同时可脱保护,与其它方法相比可减少损失,因此本实验选用TBS保护羟基的方法。
2 实验目的
掌握矢车菊素的三步合成法,通过形成硅醚以进行羟基保护,随后将4位羰基还原为亚甲基,再加入三氟乙酸形成佯盐并脱除保护基;掌握有机相洗涤、氢化铝锂后处理以及萃取纯化等后处理方法;熟悉颜色变化现象与矢车菊素结构的联系,利用颜色变化来监测反应进程;学会利用液相色谱质谱联用和根据紫外特征对矢车菊素进行定性鉴别。
3 实验原理
该实验以槲皮素为原料,依次通过三步反应制备矢车菊素:采用TBS保护方法对羟基进行保护,利用四氢铝锂对4位羰基进行还原,在甲醇溶剂和三氟乙酸中进行成盐并脱除TBS保护基。合成路线如图1所示。
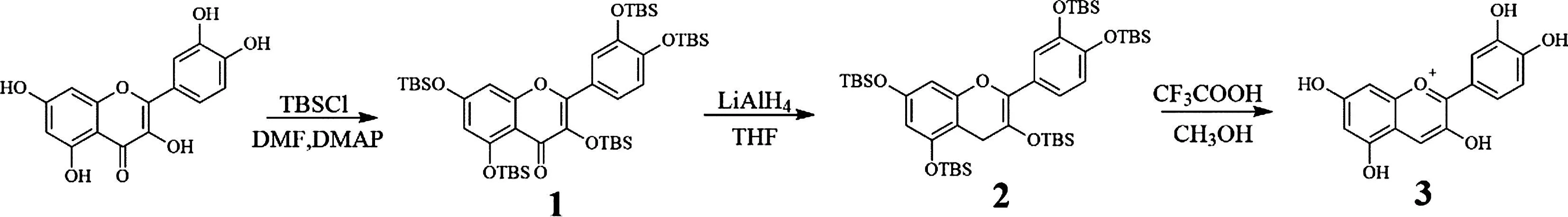
图1 矢车菊素合成路线
羟基保护方法有成酯、成醚(烷基醚、硅醚)。成酯法后续脱除保护基需要在碱性条件下水解,而产物在碱性条件下有开环分解的风险,故不适用。成烷基醚,若在苄位,脱除可采用氢解,邻二羟基结构可采用形成缩酮的方法进行成醚保护。甲基醚常用试剂为硫酸二甲酯和碘甲烷[12],前者为危化试剂,致癌致畸,后者易挥发,具有肝脏毒性,不适用于本科实验。综合考虑本实验底物结构及后续实验操作,选择采用TBSCl进行羟基保护。
针对羰基还原为亚甲基,有利用锌汞齐和盐酸酸性条件下的克莱门森还原、氢氧化钾和肼的碱性条件下进行的黄鸣龙还原、利用二硫醇形成硫缩酮然后进行氢解的中性条件下的还原。相较于这些条件,直接利用氢化铝锂进行还原不失为一种直接简便的方法。氢化铝锂是一种强的金属化合物还原试剂,利用负氢离子进攻羰基碳,铝离子络合氧,进而拔除氧原子,通过控制LiAlH4用量,可将底物还原成亚甲基[12]。机理如图2所示。
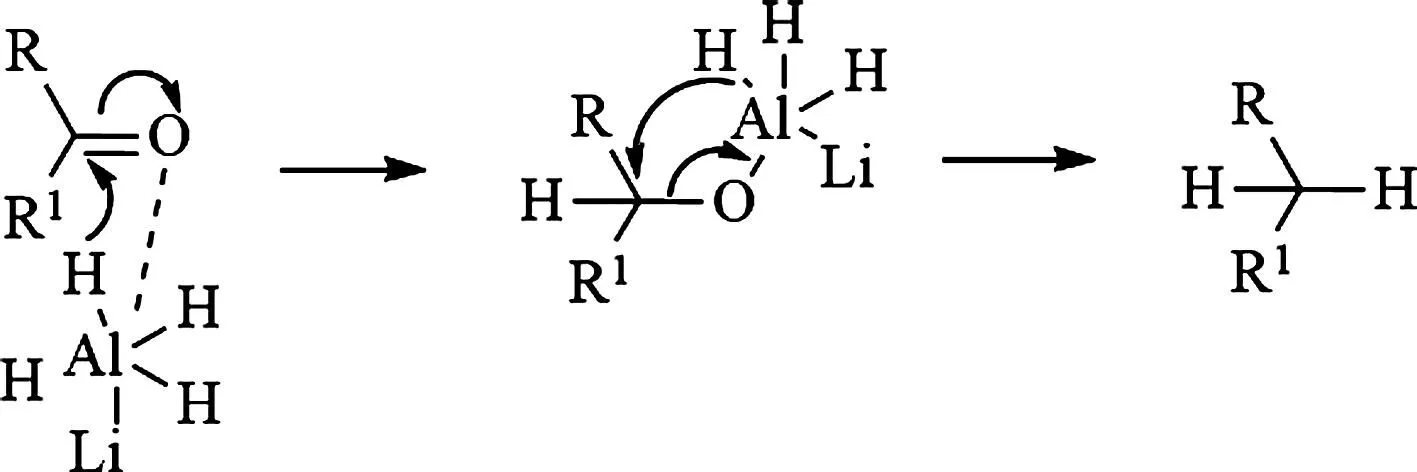
图2 LiAlH4还原羰基的机理
4 试剂与仪器
槲皮素、叔丁基二甲基氯硅烷(TBSCl)、N,N-二甲氨基吡啶(DMAP)、四氢呋喃(THF)、N,N-二甲基甲酰胺(DMF)、咪唑购自上海阿拉丁。AR级无水碳酸钠、氯化钠、硫酸镁、氢氧化钠、乙酸乙酯、石油醚、正己烷购自成都科隆化学。三氟乙酸(TFA)、氢化铝锂(LAH)购自河南北方伟业计量。薄层色谱硅胶板GF254购自青岛海洋化工。
DF-101FS集热式恒温磁力搅拌器和SHZ-D(III)循环水真空泵(巩义市予华仪器)、F80A制冰机(斯科茨曼制冰系统有限公司)、FA2004C电子天平(上海佑科)、DHG-9101恒温干燥箱(上海三发)、ZF-1三用紫外分析仪(江苏海门其林贝尔)、RE-2000A旋转蒸发仪(爱来宝生物)、8400S傅里叶变换红外光谱仪(日本岛津)、Agilent Infinity Lab液质联用仪(美国安捷伦)。
5 实验操作步骤
5.1 羟基保护反应
称取槲皮素 (5 mmol)1.6914 g、 咪唑 (70 mmol)4.767 g,TBSCl(70 mmol)10.55 g,加入5%~10%当量的DMAP,用 100 mL DMF溶解,于室温(25 ℃)下搅拌4~5 h。将反应液转移到 250 mL 分液漏斗中,加入 40 mL 的正己烷,震荡摇匀后,加入 40 mL 的水摇匀洗涤,静置分液,去除水相,再次加入 40 mL 水重复洗涤3次以除去DMF。加入 40 mL 饱和Na2CO3水溶液,洗涤3次除去DMAP。加入 40 mL 饱和NaCl溶液洗涤有机相3次。转移有机相至烧杯,向其中加入适量无水硫酸镁,搅拌后抽滤搜集滤液,减压浓缩得到产物1(棕黄色)。
5.2 羰基还原反应
向装有产物1的圆底烧瓶中投入搅拌子,加入 8 mL THF和 2 mL 的 1 mol/100 mL LiAlH4四氢呋喃溶液,置于恒温加热磁力搅拌器中,25 ℃ 下反应 30 min(呈红棕色)。冰浴条件下,进行反应的淬灭,向圆底烧瓶中加入 20 mL THF稀释,再加入 0.76 mL(与LAH质量相等)水、0.76 mL 15%氢氧化钠溶液,再加入 2.28 mL(三倍LAH的质量)的水,然后升温至 25 ℃,并且恒温搅拌 15 min。再加入无水硫酸镁,直至加入的无水硫酸镁不再结块,搅拌 15 min。抽滤,取滤液进行减压蒸发除去溶剂,得到产物2(红棕色)。
5.3 成盐与脱保护反应
向装有产物2的圆底烧瓶中加入正己烷 40 mL,全部溶解,加入 20 mL 甲醇(结合TBS基团从而脱除保护)、TFA(25 mmol)2.595 mL 室温下搅拌过夜,脱除保护基。通过观察上层正己烷的颜色判断反应进行的程度,当上层由红色变为黄色即可。取甲醇层,减压蒸发除溶剂,得产品(砖红色)。实验流程与典型实验现象如图3所示。

图3 实验流程与典型实验现象图
6 结果与讨论
6.1 保护反应试剂用量及反应时间的确定
6.1.1 羟基保护反应时间、温度及用量的确定
通过单因素实验,筛选反应时间(0.5~6 h),每半小时检测1次。通过TLC发现,在4、5、6 h 时,各物质点无明显差别,确定羟基保护反应时间为 4 h。反应温度优化实验(15~45 ℃)表明,温度过高不利于反应进行,因为TBSCl对羟基进行保护后产生的HCl迅速被DMAP、咪唑两种碱所中和,体系放出大量的热。温度过低也不利于反应进行,因为达不到反应进行所需的活化能。温度为 25 ℃ 与 35 ℃ 时,TLC比较无明显差异,因此最终确定的反应最佳温度为 25 ℃。通过TLC监测不同量的TBSCl(5~15 eq)进行羟基保护反应时间为 4 h 时的杂质点状况,得出最佳TBSCl用量为14当量,即 10.5504 g。TBSCl易吸潮水解为TBSOH,溶剂及空气中的水分均易使其变质。
6.1.2 脱除保护基反应试剂用量及选择
脱除TBS保护基机理如图4所示。
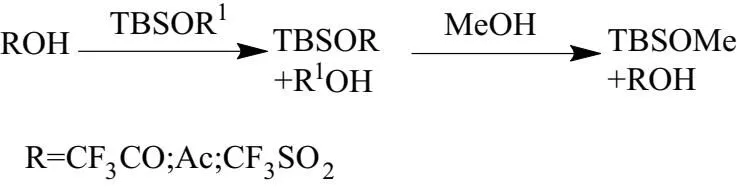
图4 脱除TBS保护基机理
在酸作用下,TBSOR1 (中间产物2)由硅醚转变为TBSOR (叔丁基二甲基硅酯),再在甲醇作用下形成硅甲醚并产生酸。 加入酸时体系立即变为紫红色,而后搅拌脱保护过程中颜色无明显变化。 得出反应是先进行酸化形成佯盐,再进行脱保护,TBS对颜色无明显影响,即对吸光度影响小。 TFA用量设置为底物槲皮素量的1当量、 5当量、 10当量、 20当量,即TFA用量为 0.143 mL、0.72 mL、1.43 mL、2.85 mL。当使用TFA量为 0.143 mL 时,搅拌 12 h 后静置,得到分界模糊且上层正己烷仍为红色体系。而使用 0.72 mL、1.43 mL、2.85 mL 的TFA时,分别在 9 h、8 h、8 h 得到分界明显且上层正己烷为亮黄色,下层为紫红色体系。因此确定最佳TFA用量为 1.43 mL。三氟甲磺酸、三氟乙酸、乙酸三者酸性由大到小,通过观察体系由均相变为上层为亮黄色,下层为紫红色的时间。发现三氟甲磺酸具有最强的脱保护能力,所需时间约为 5 h。而乙酸在 12 h 以后仍无明显分层现象。确定最佳的脱保护试剂为三氟甲磺酸。
6.2 结构分析和表征
6.2.1 中间产物1的FT-IR
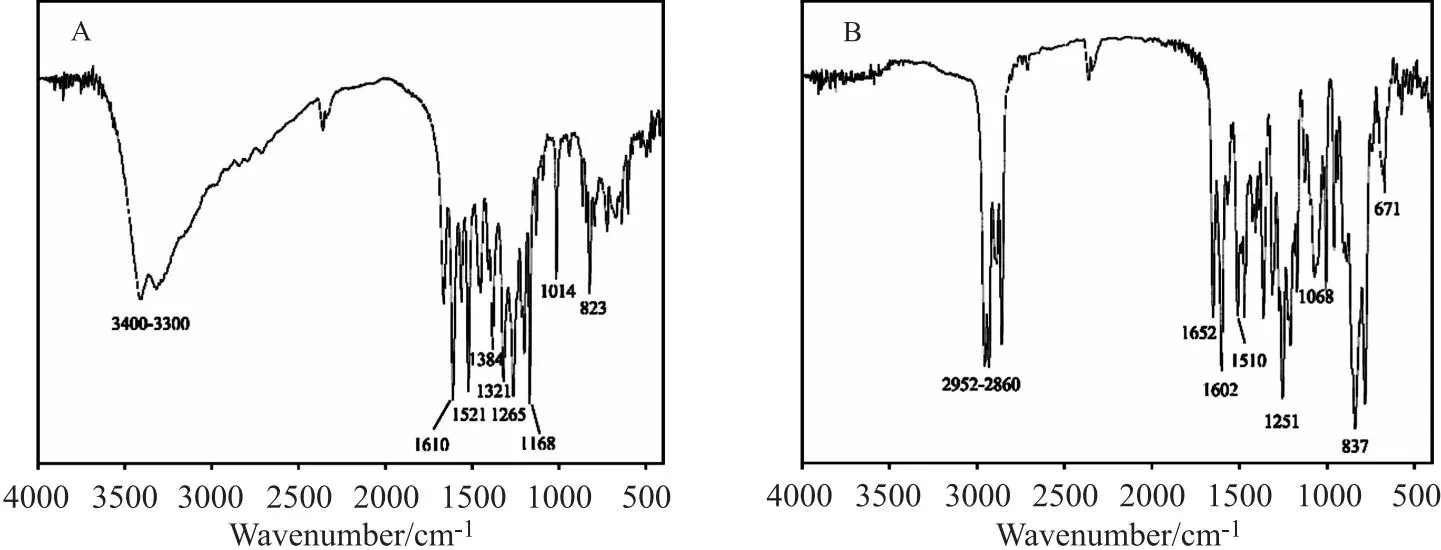
图5 底物槲皮素(A)和产物1(B)的红外谱图
6.2.2 产物3的LC-MS及UV
首先对制备得到的终产物进行LC-MS分析,发现目标产物在正离子模式下相对分子质量为288,与矢车菊素相对分子质量一致(图6A)。同时进行终产物紫外吸收光谱分析,测得最大吸收波长为 520 nm(图6B),由此表明成功制备矢车菊素。
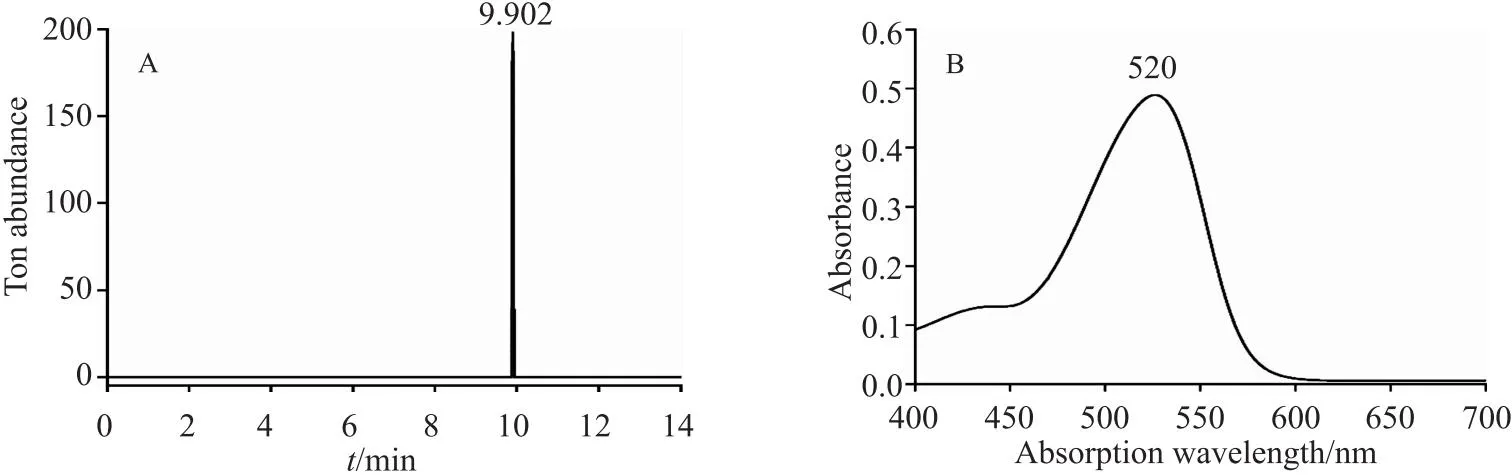
图6 目标产物EIC图(m/z 288)与紫外吸收图
6.2.3 矢车菊素稳定性实验
在矢车菊素纯化过程中,发现其不稳定,因此进行了pH(1~11)和温度(-20~65 ℃)稳定性测试。结果表明(图7),随pH增加,吸光度降低明显,即pH增大降解速度加快,且随时间延长,矢车菊素降解程度变大,颜色明显从红色变为棕黄色。时间为 0 h 时,颜色均为红色,经较长时间放置后,仅pH为1的溶液呈红色,pH为3呈粉红色,pH为5和7的呈棕黄色,pH为9和11的呈无色,说明其在pH为1时最为稳定。不同温度条件下矢车菊素稳定性实验表明,随测试温度逐渐升高,产物降解程度随时间延长逐渐提高,说明矢车菊素对温度敏感,通过单因素实验筛选得出最佳的储存温度为 -20 ℃。
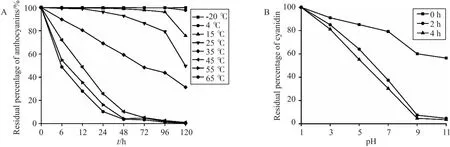
图7 目标产物稳定性实验
7 结语
本文探究了矢车菊素的一种半合成方法,以槲皮素为底物,TBSCl进行羟基保护,LiAlH4进行4位羰基还原,最后用TFA脱保护并形成佯盐,同时探索了关键反应试剂的用量、反应时间以及合适的后处理途径。实验共耗时14~15 h,矢车菊素终产率可达51.74%。本实验所选用的试剂与原料价格比较便宜、毒性低且易于购买。实验操作包括萃取、分液及浓缩等有机化学实验基本操作,同时涉及磁力搅拌器、旋转蒸发仪、紫外和红外吸收光谱仪等常用仪器的使用,即可巩固学生对黄酮类成分理化性质的认知,又可掌握食用色素矢车菊素的合成方法。实验过程颜色变化现象明显,易于通过肉眼观察判断反应进程,可有效激发学生的实验兴趣。因此本实验适于开设为高等农业院校的有机化学综合性实验。

