渐进性下蹲式抗阻训练联合低频重复经颅磁刺激应用于继发性帕金森综合征的效果
张海波
(山东省泰安荣军医院神经内科,山东泰安 271000)
继发性帕金森综合征(PDS)是由脑炎、颅脑损伤、脑动脉硬化、一氧化碳中毒等引发的帕金森症状,以肌张力增高、肌肉强直、运动迟缓、静止性震颤为主,药物治疗是主要治疗手段,但随着病情进展,药物剂量加大,易出现用药不良反应及药效减弱[1]。非药物手段如重复经颅磁刺激(rTMS)具有无创、安全性好、操作简单等特点,已被广泛应用于PDS 的治疗。 但低频rTMS 的治疗效果持续时间短暂,不适合长期使用[2]。 渐进性下蹲式抗阻训练是一种针对下肢肌肉的抗阻训练方法,可方便患者在家庭自行训练,操作简单,可实施性较强,在低频rTMS 的基础上联合此种康复训练则可达到长期治疗效果[3-4]。 基于此,本研究选取该院2020 年6 月—2023 年6 月收治的120 例继发性帕金森综合征患者为对象,探讨渐进性下蹲式抗阻训练联合低频重复经颅磁刺激应用于PDS 的效果。现报道如下。
1 资料与方法
1.1 一般资料
选取该院收治的120 例PDS 患者作为研究对象。 纳入标准:(1)符合PDS 的诊断标准[5];(2)无脑部手术史;(3)无癫痫手术史者;(4)患者及其家属签署知情同意书。 排除标准:(1)合并精神类疾病,无法配合治疗者;(2)合并四肢骨折,无法进行训练者;(3)合并其他严重基础疾病者。本研究已获院医学伦理委员会批准。 按照随机数表法将其分为对照组与观察组,各60 例。对照组男25 例,女35 例;年龄66~81 岁,平均年龄(74.55±6.18)岁;Hoehn-Yahr 分期Ⅱ期29 例,Ⅲ期16 例,Ⅳ期15 例。 观察组男24例,女36 例;年龄67~82 岁,平均年龄(73.96±5.58)岁;Hoehn-Yahr 分期Ⅱ期27 例,Ⅲ期19 例,Ⅳ期14例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
对照组采用低频重复经颅磁刺激:治疗采用华星康泰rTMS 经颅磁治疗仪(北京华星康泰科技发展有限公司,京械注准20192090543,型号:HX-C3),治疗前确定运动阈值,患者采取坐位,手掌向上平放于大腿上,并保持放松治疗,将磁刺激线圈对准患者大脑初级运动皮质区(M1 区),调节刺激部位及刺激强度,观察患者手指运动情况,10 次刺激中至少有5 次诱发患者手指运动的最小刺激强度即可认为是静息运动阈值。刺激的部位为对侧大脑M1 区,频率为1 Hz,强度为110%静息运动阈值。 每个序列包含40 个磁脉冲刺激,每个序列结束后间歇10 s。 每次治疗共刺激40 个序列,治疗5 d/周,连续治疗4 周。
观察组在对照组基础上联合渐进性下蹲式抗阻训练:患者首先站立(靠墙直立),双脚与肩同宽,手臂自然下垂,头部放松,身体保持直立。患者需要注意站姿的正确性,避免受伤。患者开始缓慢地下蹲,同时屈膝屈髋,直到膝盖弯曲到大约90°角,保持片刻。 在到达90°角后, 患者可以使用自己的重量进行抗阻训练,如尝试慢慢站起来。 这个过程中需要注意正确的姿势和动作,避免受伤。在适应基本的下蹲动作后,患者可以逐渐增加训练的难度和强度。在患者的肱四头肌绑上沙袋,双腿各增加1 kg 的重量,患者维持下蹲10~20 s 后起身,并放松肌群,休息10~20 s。每次进行20 个动作,分为两组完成,10 个/组,间隔3 min。 每天上午和下午各进行1 次,训练5 d/周,共训练4 周。在实施训练时,可以放置安全椅,并由康复实习生或家属全程监督和保护, 以防止患者因乏力或失衡而跌倒。这些增加的重量和时间可以帮助患者更好地锻炼肌肉力量和平衡能力。
1.3 观察指标
(1)干预效果:治疗后,根据患者的下肢运动功能、症状对其干预效果进行评价,总有效率=(显效+有效)/总例数×100%。 其中下肢运动功能正常、症状完全改善为显效;下肢运动功能基本正常、症状有所改善为有效;下肢运动功能异常、症状无变化为无效。
(2)运动功能:治疗前后,评估采用Berg 平衡量表(BBs)、起立-行走计时测验(TuG)、Fugl-Meyer 下肢运动功能评分量表(FMA)对患者的运动功能进行评价。 其中BBS 总分共56 分,分数越高代表患者平衡能力越好;TUG 指患者起立至正常向前走3 m 的时间,时间越长代表患者活动障碍越严重;FMA 下肢运动功能评定总分共34 分, 分数越高代表患者下肢运动功能越好。
(3)肢体肌张力:采用改良Asghworth 痉挛量表(MAS)进行评估,包括肱二头肌、肱三头肌、股四头肌及腓肠肌,MAS 总分共4 分, 取4 组肌肉的平均值,分数越低代表患者肌张力越好。
(4)步态空间参数:治疗前后,对患者的步态空间参数(步长、步幅、步频、步速)进行检测,仪器采用美国三维动作分析系统(MA)、EvaRT 4.2 版步态运动图像采集软件和Ortho-Trak 数据处理软件。
1.4 统计方法
采用SPSS 21.0 统计学软件进行数据分析。 计量资料以()表示,组间比较采用独立样本t 检验,组内比较采用配对样本t 检验;计数资料以[n(%)]表示,组间比较采用χ2检验。 P<0.05 为差异有统计学意义。
2 结 果
2.1 两组干预效果对比
观察组治疗总有效率高于对照组,差异有统计学意义(P<0.05)。 见表1。

表1 两组PDS 患者干预效果对比[n(%)]
2.2 两组运动功能对比
治疗前, 两组患者BBS 评分、FMA 评分、TUG 对比,组间差异无统计学意义(P>0.05);治疗后,两组患者BBS 评分、FMA 评分均高于治疗前,TUG 短于治疗前, 且观察组BBS 评分、FMA 评分均高于对照组,TUG短于对照组,差异有统计学意义(P<0.05)。 见表2。
表2 两组PDS 患者运动功能对比()
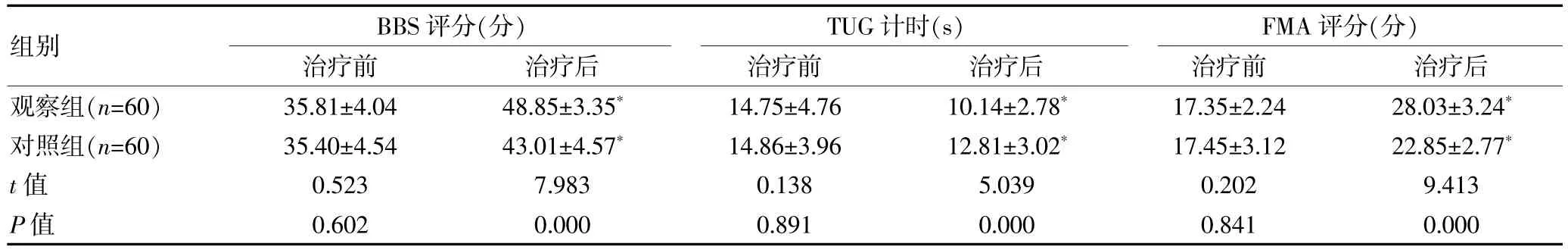
表2 两组PDS 患者运动功能对比()
注:与同组治疗前比较,*P<0.05。
组别BBS 评分(分)治疗前治疗后images/BZ_47_1091_1540_1130_1576.pngTUG 计时(s)治疗前治疗后images/BZ_47_1695_1542_1734_1578.pngFMA 评分(分)治疗前治疗后观察组(n=60)对照组(n=60)t 值P 值35.81±4.04 35.40±4.54 0.523 0.602 48.85±3.35*43.01±4.57*7.983 0.000 14.75±4.76 14.86±3.96 0.138 0.891 10.14±2.78*12.81±3.02*5.039 0.000 17.35±2.24 17.45±3.12 0.202 0.841 28.03±3.24*22.85±2.77*9.413 0.000
2.3 两组肢体肌张力对比
治疗前,两组患者MAS 评分对比,差异无统计学意义(P>0.05);治疗后,两组患者MAS 评分均低于治疗前,且观察组低于对照组,差异有统计学意义(P<0.05)。 见表3。
表3 两组PDS 患者肢体肌张力对比[(),分]

表3 两组PDS 患者肢体肌张力对比[(),分]
注:与同组治疗前比较,*P<0.05。
组别治疗前治疗后观察组(n=60)对照组(n=60)t 值P 值2.43±0.35 2.42±0.33 0.161 0.872 1.85±0.28*2.17±0.27*6.372 0.000
2.4 两组步态空间参数对比
治疗前,两组患者步长、步幅、步频、步速对比,组间差异无统计学意义(P>0.05);治疗后,两组患者步长长于治疗前,步幅大于治疗前,步频多于治疗前,步速快于治疗前,且观察组患者步长长于对照组,步幅大于对照组,步频多于对照组,步速快于对照组,差异有统计学意义(P<0.05)。 见表4。
表4 两组PDS 患者步态空间参数对比()
注:与同组治疗前比较,*P<0.05。
组别步长(cm)治疗前治疗后images/BZ_47_887_2605_925_2642.png步幅(cm)治疗前治疗后images/BZ_47_1332_2616_1371_2652.png步频(步/min)治疗前治疗后images/BZ_47_1806_2607_1845_2643.png步速(m/s)治疗前治疗后观察组(n=60)对照组(n=60)t 值P 值38.94±5.68 39.12±5.32 0.179 0.858 45.67±6.02*40.47±6.25*4.642 0.000 69.35±6.33 68.91±6.54 0.374 0.709 78.35±5.11*70.16±6.38*7.761 0.000 97.36±8.97 96.35±9.12 0.612 0.542 113.84±15.24*101.67±16.43*4.207 0.000 0.76±0.22 0.74±0.25 0.465 0.643 0.95±0.14*0.83±0.18*4.076 0.000
3 讨 论
PDS 是常见的一种神经系统变性疾病,好发于中老年人,常累及中枢神经系统,主要临床表现为静止性震颤、肌强直、步态异常及运动迟缓,严重影响患者的日常生活质量[6]。 目前临床针对PDS 患者的治疗以药物(如左旋多巴胺、普拉克索等)干预为主,但患者病情进展其药物剂量也逐渐加大,不少患者出现不同程度的用药不良反应及药效减弱等问题[7]。 近年来,PDS治疗方法及理念不断更新,许多非药物手段已被应用到临床实践, 并取得不错疗效。 有文献报道, 低频rTEM 能改善患者运动功能及自主神经功能, 且安全性较好,但其治疗效果较为短暂,可能在数周或数月后逐渐减弱[8]。 若单纯依赖该治疗方法而不进行持续的锻炼和康复,患者可能会出现症状反复或恶化的情况。 为保证长期有效的干预效果, 临床建议在低频rTEM 的基础上联合康复训练, 但常规康复治疗方法中部分训练方法依赖于康复设备, 患者难以居家训练,降低训练依从性,进而影响康复效果[9]。 渐进性下蹲式抗阻训练是一种针对下肢肌肉的抗阻训练方法,该训练通过逐渐增加下蹲的深度和抗阻的重量,从而增强下肢肌肉的力量和耐力,提高身体的平衡性和稳定性,该训练操作简单,可便于患者在家中自行训练。因此, 本研究中通过对PDS 患者采用渐进性下蹲式抗阻训练联合低频rTEM 的方式发现,该联合方式可有效提高干预效果、肢体肌张力、改善运动功能及步态空间参数。
本研究结果显示,治疗后,观察组治疗总有效率、运动能力均高于对照组(P<0.05)。 这提示对PDS 患者采用观察组的联合干预的方法可有效提高其干预效果,改善运动功能。 分析其原因可能为:低频rTEM通过在大脑皮层产生低频磁场,调节大脑皮层的神经元活动,促进多巴胺的释放,提高神经递质的传递效率,从而改善神经功能[10]。此外,经颅磁刺激还可以促进大脑皮层的重塑和神经再生,有助于恢复患者的运动功能和平衡能力。渐进性下蹲式抗阻训练主要针对下肢肌肉,包括臀大肌、股四头肌等,通过逐渐增加下蹲的深度和抗阻的重量, 增强患者的肌肉力量和耐力,提高患者的身体姿势控制能力,从而改善平衡感。运动过程的下蹲动作涉及到多个关节和肌肉的协同作用,需要大脑对身体的协调和控制,可以锻炼患者的协调能力,改善患者的步态和姿势。 并且该训练在患者出院后,可自行在家中进行训练,长期有效的锻炼能够提高患者的运动功能。
本研究结果还显示,治疗后,观察组患者MAS 评分低于对照组,步态空间参数均优于对照组(P<0.05)。这提示对PDS 患者采用观察组的联合干预方法可有效改善患者的肢体肌张力,步态空间参数。 分析其原因可能为:rTMS 作用于大脑皮层,通过调节神经元的兴奋性,改善神经传导功能,影响神经递质的合成与释放,改善患者的神经功能,对后续进行阻抗训练起促进作用。渐进性下蹲式抗阻训练可针对性地锻炼下肢肌肉,提高肌肉力量,改善帕金森患者的步态。在训练过程中,患者需协调四肢和躯干以保持平衡,这有助于提高整体运动功能和步态的稳定性。 同时,抗阻训练也可通过增加肌肉的代谢活动,提高肌肉对能量的利用效率,进而改善肢体肌张力。此外,渐进性下蹲式抗阻训练联合低频rTMS 可在院内进行,在院外患者能够自行在家中进行渐进性下蹲式抗阻训练,长期的训练对患者的肢体肌张力,步态空间参数效果具有一定的效果。
综上所述, 渐进性下蹲式抗阻训练联合低频rTMS 应用于继发性帕金森综合征可有效提高干预效果、肢体肌张力、改善运动功能及步态空间参数。

