短短芽孢杆菌X23中基因的克隆、原核表达及转录时相分析
杜杰 蔡海林 黄彬彬 黄军 张翠央 龙青山 张亮 陈海荣 唐冰璇 陈武 刘清术


摘 要:短短芽孢杆菌(Brevibacillus brevis)X23可产生非核糖体肽类抗生素伊短菌素,已被广泛用于植物病害的生物防治。伊短菌素合成基因簇中,edeB基因参与调控伊短菌素的合成积累。本研究利用基因同源重组技术,以edeB基因作为外源基因的重组片段,构建了原核表达载体pET28a-edeB,转化至大肠杆菌BL21(DE)中进行诱导表达;通过转录组测序检测edeB基因在短短芽孢杆菌不同培养时间(12、18、24、30和36 h)的轉录时相。结果表明:edeB基因全长为771 bp,编码256个氨基酸。聚丙烯酰胺凝胶电泳(SDS-PAGE)显示,在分子质量为30 kD处有一条特异条带,与生物信息学预测的EdeB蛋白的大小一致,且EdeB蛋白主要以包涵体的形式存在。转录时相分析结果表明,edeB基因在各个培养时间点均有表达,表达模式为先升高后降低,且在30 h时表达水平最高。这些结果为进一步研究edeB基因调控伊短菌素合成积累的分子机制奠定了基础,为短短芽孢杆菌高产伊短菌素菌株的构建提供了理论依据。
关键词:短短芽孢杆菌;edeB基因;原核表达;转录时相;转录组
中图分类号:Q939.96 文献标志码:ADOI:10.3969/j.issn.1007-7146.2023.02.006
Cloning, Prokaryotic Expression and Transcription Profile Analysis of edeB Gene in Brevibacillus brevis X23
DU Jie 1, CAI Hailin2, HUANG Binbin1, HUANG Jun1, ZHANG Cuiyang1, LONG Qingshan 1,
ZHANG Liang3, CHEN Hairong1, TANG Bingxuan1, CHEN Wu 3*, LIU Qingshu 1*
(1. Hunan Provincial Engineering and Technology Research Center for Agricultural Microbiology Application, Hunan Institute of Microbiology, Changsha 410009, China; 2. Changsha Tobacco Company of Hunan Province, Changsha 410011, China;
3. College of Plant Protection, Hunan Agricultural University, Changsha 410128, China)
Abstract: Brevibacillus brevis X23 can produce non-ribosomal antibiotic edeines, which have been widely used in biological control of plant diseases. The edeB gene in the edeine biosynthetic gene cluster regulates the synthesis of edeines. In this study, the prokaryotic expression vector pET28a-edeB was constructed by homologous recombination technology with edeB gene as the recombinant fragment of exogenous gene, and was transformed into Escherichia coli BL21(DE) for induced expression. The transcription profile of edeB gene in different culture times (12, 18, 24, 30 and 36 h) of B. brevis was detected by transcriptome sequencing. The results showed that the edeB gene was 771 bp in length, encoding 256 amino acids. SDS-PAGE electrophoresis showed that a specific band with a molecular weight of 30 kD appeared, which is in consistent with the bioinformatics prediction results. EdeB protein mainly existed in the form of inclusion bodies. The results of transcription profile showed that edeB gene was expressed at all culture times, and the gene expression showed a pattern of increasing at first and then decreasing with a peak at 30 h. These results laid a foundation for further study on the molecular mechanism of edeB gene regulating the synthesis of edeines, and provided a theoretical basis for the construction of high-yield edeine strains of B. brevis.
Key words: Brevibacillus brevis; edeB gene; prokaryotic expression; transcription profile; transcriptome
(Acta Laser Biology Sinica, 2023, 32(2): 146-152)
短短芽孢杆菌(Brevibacillus brevis)是一类革兰陽性菌,呈杆状,产芽孢,不产生毒素,对环境安全[1]。短短芽孢杆菌在植物病害生物防治、污染物降解和重金属修复等领域的应用均有报道。由于能产生多种抗菌活性物质,其已成为用于植物病害生物防治方面的重要菌株[2-5]。
短短芽孢杆菌X23为本课题组从茄科作物根际土壤中分离筛选到的生防菌株。该菌对由青枯雷尔氏菌(Ralstonia solanacearum)引起的茄科作物青枯病防治效果突出,已作为茄科作物青枯病生防菌得到大面积的推广应用[6-9]。短短芽孢杆菌X23能产生具有广谱抗菌活性的非核糖体肽类抗生素伊短菌素(edeines)。伊短菌素活性突出,抑菌谱广,可很好地抑制细菌、真菌、支原体以及肿瘤细胞的生长,在农业生产和生物医药等领域具有广泛的应用前景[10-13]。2012年,短短芽孢杆菌X23的基因组测序完成(GenBank ID:CP023474.1),利用antiSMASH软件分析基因组数据发现,该菌株含有伊短菌素合成基因簇 [14-15]。通过对伊短菌素基因簇进行敲除,验证了该基因簇负责伊短菌素的生物合成,并通过原位启动子工程改造获得了将伊短菌素的产量提高8倍的短短芽孢杆菌工程菌[16]。为进一步提高伊短菌素的产量,人们对伊短菌素生物合成基因簇进行了生物信息学分析,结果表明: edeB是伊短菌素合成基因簇的重要调控基因,其编码蛋白EdeB为ParB蛋白家族成员,分子质量为30.42 kD,理论等电点(pI)为6.23;该蛋白为亲水性蛋白质,无信号肽和跨膜螺旋区,其二级结构的主要形式为α螺旋和无规卷曲,并且含有16个磷酸化位点、1个N-糖基化位点和20个O-糖基化位点[17]。基因敲除和基因回补试验表明,edeB在伊短菌素的生物合成过程中起着正调控作用,此外,过表达edeB基因可显著提高短短芽孢杆菌X23中伊短菌素的产量[18]。本研究以短短芽孢杆菌X23基因组为材料,通过聚合酶链式反应(polymerase chain reaction,PCR)获得edeB基因,利用基因同源重组技术构建edeB基因的原核表达载体,进行EdeB蛋白原核表达和纯化,并通过转录组测序研究edeB基因的转录时相。这将有助于深入研究edeB基因在短短芽孢杆菌生防应用中的功能及探究其调控伊短菌素合成的分子机制。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
短短芽孢杆菌X23由湖南农业大学植保学院分离并保藏;质粒pET28a、大肠杆菌BL21(DE3)感受态细胞和GB05-dir由湖南省微生物研究院保藏。
1.1.2 培养基
肉汤培养基(Luria-Bertani medium,LB)(胰蛋白胨10.0 g、酵母提取物5.0 g、NaCl 1.0 g、水1 000 mL,pH 7.0~7.5,固体培养基则添加1.5%的琼脂粉)用于短短芽孢杆菌X23、大肠杆菌BL21(DE3)和GB05-dir的培养。
1.1.3 主要试剂
高保真DNA聚合酶PrimerSTAR Max DNA Polymerase及DNA分子量标准购自宝生物工程(大连)有限公司;限制性内切酶Xba I和Xho I购自英国NEB公司;Ni-NTA镍柱购自GIAGEN公司;异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)和卡那霉素均购自生工生物工程公司(上海);基因组DNA提取试剂盒、质粒DNA提取试剂盒、琼脂糖凝胶回收试剂盒均购自北京全式金生物技术有限公司。
1.2 方法
1.2.1 短短芽孢杆菌X23基因组的提取
从-80℃超低温冰箱中取出短短芽孢杆菌X23菌种涂板活化,挑取单菌落接种至装有10 mL LB液体培养基的三角瓶中,37℃、180 r/min恒温震荡培养12~16 h,使用基因组DNA提取试剂盒提取短短芽孢杆菌X23的基因组DNA。
1.2.2 edeB基因的扩增与表达质粒的构建
参照短短芽孢杆菌X23基因组中edeB基因序列设计1对特异性引物,引物序列如下。edeB-F:5'-CCCCTCTAGAAATAATTTTGTTTAACTTTAA
GAAGGAGATATACCATGTACGATGTGCTGGCAAATCTA-3';edeB-R:5'-GGGCTTTGTTAGCA
GCCGGATCTCAGTGGTGGTGGTGGTGGTGCTCG
AGTCGCATCGCACATATACACG-3'。以短短芽孢杆菌X23的基因组为模板,应用PrimerSTAR Max DNA Polymerase进行扩增,反应条件为:94℃预变性4 min;98℃ 30 s;58℃ 40 s; 58℃ 20 s;72℃ 20 s;共35个循环;72℃延伸10 min。用1%琼脂糖凝胶电泳检测PCR产物,并用琼脂糖凝胶回收试剂盒纯化。载体pET28a经Xba I和Xhol I双酶切处理后纯化回收,并与edeB纯化DNA片段混合;采用基因同源重组的方法电击转入含有重组系统的大肠杆菌GB05-dir;提取质粒,进行Xba I和Xhol I双酶切验证和测序,确认目的基因正确后插入载体,将重组质粒命名为pET28a-edeB。
1.2.3 EdeB蛋白的表达及纯化
将重组质粒pET28a-edeB转化至感受态细胞BL21(DE3)中,挑取单菌落过夜培养,按照体积比1:100转入50 mL LB培养基中,37℃培养2.5 h,OD600 nm达到0.5左右后加入终浓度为1 mmol/L 的IPTG,在16℃下诱导表达36 h,9 000 r/min离心5 min后收集菌体, 磷酸缓冲液(phosphate belanced solution,PBS)洗涤2次后超声破碎30 min,9 000 r/min离心10 min。收集上清并用Ni-NTA琼脂糖镍柱进行蛋白纯化,通过聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate poly acrylamide gel electrophoresis,SDS-PAGE)分析检测EdeB蛋白的表达情况。
1.2.4 EdeB蛋白系统进化关系分析
在NCBI数据库中检索并下载波特氏短芽孢杆菌(Brevibacillus porteri)、强壮短芽孢杆菌(Brevibacillus fortis)、藻渣膨胀芽孢杆菌(Tumebacillus algifaecis)、土壤短芽孢杆菌(Brevibacillus agri)、热红短芽胞杆菌(Brevibacillus thermoruber)、溶短芽孢杆菌(Brevibacillus dissolubilis)、栖深海多分枝霉菌(Polycladomyces abyssicola)、蜡样芽孢杆菌(Bacillus cereus)、克里布所岛津氏菌(Shimazuella kribbensis)、大豆白骅菌(Baia soyae)和解甘露聚糖热碱芽孢杆菌(Caldalkalibacillus mannanilyticus)共11种微生物的ParB家族蛋白。使用MEGA7.0软件,通过邻接法(neighbor-joining,NJ)构建EdeB蛋白与以上11种微生物ParB家族蛋白的系统进化树,自举检验值(bootstrap)设定为1 000,其余参数设置为默认。
1.2.5 短短芽孢杆菌edeB基因的转录时相分析
短短芽孢杆菌X23转录组测序的时间点分别为LB液体培养基培养12、18、24、30和36 h。将离心收集的菌体迅速转入–80℃的冰箱中保存,参照产品说明书提取总RNA。通过1%琼脂糖凝胶电泳检测样品总RNA的纯度及完整性,用分光光度计(NanoDrop ND2 000)进一步检测RNA浓度和OD260 nm/OD280 nm、OD260 nm/OD230 nm。转录组测序由深圳华大基因科技有限公司完成。从转录组数据中提取edeB基因的FPKM表达数据,利用TBtools軟件[19]进行基因表达热图分析。
2 结果与分析
2.1 edeB基因的序列分析及克隆
edeB基因全长为771 bp,其编码蛋白有256个氨基酸(GeneBank ID:ATF13884.1)(图1)。提取短短芽孢杆菌X23基因组,以其为模板,通过PCR扩增获得edeB全长基因,经琼脂糖凝胶电泳检测可知,长度与预期相符(图2a)。利用基因重组技术将edeB基因片段连接于pET28a质粒载体后,提取重组质粒进行Xba I和Xhol I双酶切验证(图2b),经测序验证后将重组质粒命名为pET28a-edeB,并转化E. coil BL21(DE3)构建表达菌株。
2.2 EdeB蛋白诱导表达与纯化
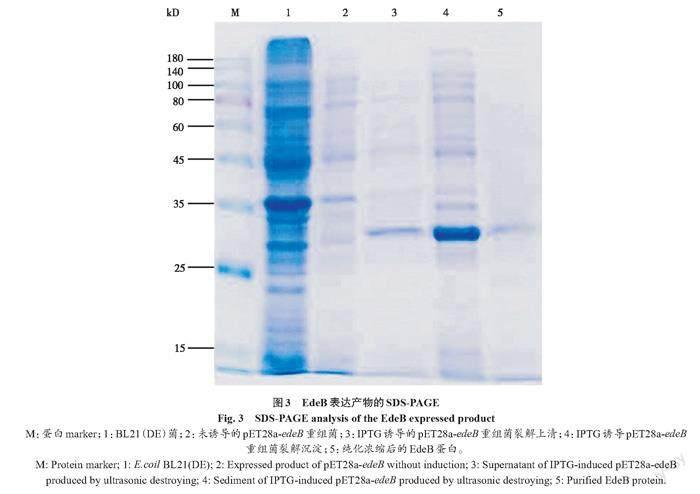
pET28a-edeB重组菌经IPTG诱导表达后,通过SDS-PAGE电泳检测分析蛋白表达情况。结果表明,诱导前无特异条带,诱导后菌体破碎离心分离得到的上清液和沉淀均在30 kD附近出现单一特异条带,而且沉淀中条带颜色较深,表明EdeB蛋白主要以包涵体的形式存在。对原核表达的EdeB蛋白纯化后在30 kD处有一清晰的条带,与预期蛋白质的大小吻合(图3)。
2.3 EdeB蛋白的系统进化树分析
为探究短短芽孢杆菌X23中EdeB蛋白与其他微生物ParB家族蛋白之间的亲缘关系,本文对EdeB与11种微生物的ParB家族蛋白进行系统发育分析,利用MEGA7.0构建NJ进化树(图4)。系统进化树结果表明,EdeB蛋白与波特氏短芽孢杆菌(Brevibacillus porteri)ParB蛋白的亲缘性最高,与解甘露聚糖热碱芽孢杆菌(Caldalkalibacillus mannanilyticus)ParB蛋白的亲缘性最低。
2.4 短短芽孢杆菌edeB基因的转录时相分析
利用转录组测序对edeB基因在短短芽孢杆菌不同培养时间(12、18、24、30和36 h)的转录时相进行分析,结果表明,在所有培养时间点edeB基因均有表达,但表达情况具有明显差异,其中,edeB基因在30 h表达量最高,在36 h表达量最低,基因表达模式呈现先升高后降低的趋势(图5)。由此可推测,短短芽孢杆菌edeB基因的转录时相可能与伊短菌素的合成积累过程有关。
3 讨论
短短芽孢杆菌属于革兰阳性菌,主要分布在土壤中,随着基因测序技术的发展,其新种陆续被发现,其中大多数都有重要的生物学意义,且具有广泛的生防潜力,可作为微生物菌剂和植物保鲜剂等[20]。据报道,短短芽孢杆菌可产生多种抗菌物质抑制病原菌的生长。例如:2002年,Sheng等[21]分离到一株可有效防治蔬菜病原霉菌的短短芽孢杆菌No.G1,其可产生具有超高热稳定性和抑菌能力的几丁质内切酶;2014年,杨廷雅等[22]分离到一株可抑制芒果炭疽菌的短短芽孢杆菌HAB-5,发现其可产生大小约为14.4 kD的抑菌蛋白。
短短芽孢杆菌X23是在茄科作物根际土壤中分离到的广谱拮抗细菌,大田试验对烟草(Nicotiana tabacum L.)青枯病的平均防治效果达到85%以上,作为茄科作物青枯病生防菌剂的主要组成菌株已经得到大面积推广[23-26]。edeB基因是短短芽孢杆菌X23伊短菌素合成基因簇中的调控基因。保守结构域分析表明,其编码的EdeB蛋白为ParB家族的一员,可以通过蛋白质-DNA结合方式发挥调控作用。
ParB家族蛋白已经在许多微生物中被鉴定出。该家族蛋白又称质粒主动分配蛋白,主要参与质粒和染色体的分配过程,具有DNA结合活性[27]。越来越多的研究表明,一些ParB家族蛋白不仅参与了质粒的分离,还参与了转录活性的调节,在各种细胞生物进程中发挥着重要的调控作用[28]。EdeB蛋白含有ParB家族结合DNA的典型HTH结构域,表明其可作为伊短菌素合成基因簇中的转录调控因子发挥调控伊短菌素合成的作用。虽然ParB家族蛋白广泛存在于短短芽孢杆菌中,但是这类蛋白参与调控抗生素生物合成的分子机制尚待进一步研究。
本研究成功克隆获得了edeB基因,构建了原核表达载体对EdeB蛋白进行诱导表达,并对edeB基因序列特征和转录时相进行了分析,为进一步研究edeB基因在调控短短芽孢杆菌伊短菌素合成积累的分子机制及其功能奠定了基础,以期为利用分子生物学手段提高短短芽孢杆菌伊短菌素的产量、筛选获得高产菌株提供有益的参考。
参考文献(References):
[1] SHENG M, JIA H, ZHANG G, et al. Siderophore production by rhizosphere biological control bacteria Brevibacillus brevis GZDF3 of Pinellia ternata and its antifungal effects on Candida albicans [J]. Journal of Microbiology and Biotechnology, 2020, 30(5): 689-699.
[2] CHE J, LIU B, LIN Y, et al. Draft genome sequence of biocontrol bacterium Brevibacillus brevis Strain FJAT-0809-GLX [J]. Genome Announcements, 2013, 1(2): e0016013.
[3] HOU Q, WANG C, HOU X, et al. Draft genome sequence of Brevibacillus brevis DZQ7, a plant growth-promoting rhizobacterium with broad-spectrum antimicrobial activity [J]. Genome Announcements, 2015, 3(4): e00831-15.
[4] MARCHE M G, MURA M E, FALCHI G, et al. Spore surface proteins of Brevibacillus laterosporus are involved in insect pathogenesis [J]. Scientific Reports, 2017, 7(1): 43805.
[5] JIANMEI C, BO L, ZHENG C, et al. Identification of ethylparaben as the antimicrobial substance produced by Brevibacillus brevis FJAT-0809-GLX [J]. Microbiological Research, 2015, 172: 48-56.
[6] CHEN W, WANG Y, LI D, et al. Draft genome sequence of Brevibacillus brevis strain X23, a biocontrol agent against bacterial wilt [J]. Journal of Bacteriology, 2012, 194(23): 6634-6635.
[7] 黎定軍, 陈武, 罗宽. 侧孢芽孢杆菌2-Q-9外泌抑菌物质性质[J]. 湖南农业大学学报 (自然科学版), 2007, 33(4): 471-474.
LI Dingjun, CHEN Wu, LUO Kuan. On characteristics of antibiotics secreted by Bacillus laterosporus strain 2-Q-9 [J]. Journal of Hunan Agricultural University (Natural Sciences), 2007, 33(4): 471-474.
[8] 吕建林, 刘二明, 柏连阳, 等. 烟草青枯病生防菌混合接种对其定殖及防效的影响[J]. 中国生物防治学报, 2010, 26(2): 200-205.
LYU Jianlin, LIU Erming, BO Lianyang, et al. Effects of mixed inoculation of different biocontrol strain on colonization in tobacco and control of tobacco bacterial wilt [J]. Chinese Journal of Biological Control, 2010, 26(2): 200-205.
[9] 张旭, 陈武, 杨玉婷, 等. 青枯菌拮抗菌2-Q-9的分子鉴定及抑菌相关基因的克隆[J]. 湖南农业大学学报 (自然科学版), 2009, 35(3): 233-236.
ZHANG Xu, CHEN Wu, YANG Yuting, et al. Identification of antagonistic bacteria 2-Q-9 against Ralstonia solanacearum and cloning function gene CodY [J]. Journal of Hunan Agricultural University (Natural Sciences), 2009, 35(3): 233-236.
[10] CZAJGUCKI Z, ANDRUSZKIEWICZ R, KAMYSZ W. Structure activity relationship studies on the antimicrobial activity of novel edeine A and D analogues [J]. Journal of Peptide Science: an Official Publication of the European Peptide Society, 2006, 12(10): 653-662.
[11] JOHNSON E T, BOWMAN M J, DUNLAP C A. Brevibacillus fortis NRS-1210 produces edeines that inhibit the in vitro growth of conidia and chlamydospores of the onion pathogen Fusarium oxysporum f. sp. cepae [J]. Antonie van Leeuwenhoek, 2020, 113(7): 1-15.
[12] KURYLO-BOROWSKA Z, SZER W. Inhibition of bacterial DNA synthesis by edeine. Effect on Escherichia coli mutants lacking DNA polymerase I [J]. Biochimica et Biophysica Acta, 1972, 287(2): 236-245.
[13] MAZERSKI J, WOJCIECHOWSKA H, ZGODA W, et al. Esters and amides of edeine A [J]. Journal of Antibiotics, 1981, 34(1): 28-33.
[14] 盧行. 短短芽孢杆菌X23外泌edeineB纯化和鉴定[D]. 长沙: 湖南农业大学, 2014.
LU Xing. The purification and identification of the antimicrobial peptide edeineB secreted by Brevibalillus brevis X23 [D]. Changsha: Hunan Agricultural University, 2014.
[15] LIU Q, SHEN Q, BIAN X, et al. Simple and rapid direct cloning and heterologous expression of natural product biosynthetic gene cluster in Bacillus subtilis via Red/ET recombineering [J]. Scientific Reports, 2016, 6(1): 34623.
[16] LIU Q, ZHANG L, WANG Y, et al. Enhancement of edeine production in Brevibacillus brevis X23 via in situ promoter engineering [J]. Microbial Biotechnology, 2021, 15(2): 577-589.
[17] DU J, ZHANG C, LONG Q, et al. Bioinformatics analysis of the structure and function of EdeB from Brevibacillus brevis X23 [C]//2022 10th International Conference on Bioinformatics and Computational Biology (ICBCB), 2022: 1-5.
[18] DU J, ZHANG C, LONG Q, et al. Characterization of a pathway?specific activator of edeine biosynthesis and improved edeine production by its overexpression in Brevibacillus brevis [J]. Frontiers in Plant Science, 2022, 13: 1022476.
[19] CHEN C, CHEN H, ZHANG Y, et al. TBtools: an integrative toolkit developed for interactive analyses of big biological data[J]. Molecular Plant, 2020, 13(8): 1194-1202.
[20] 马玉琴, 魏偲, 茆振川, 等. 生防型菌肥对黄瓜生长及根结线虫病的影响[J]. 中国农业科学, 2016, 49(15): 2945-2954.
MA Yuqin, WEI Cai, MAO Zhenchuan, et al. Effects of bioorganic fertilizerswith compound microbes on cucumber and root-knot nematode [J]. Scientia Agricultura Sinica, 2016, 49(15): 2945-2954.
[21] SHENG L I, ZHAO Z A, MING L I, et al. Purification and characterization of a novel chitinase from Bacillus brevis [J]. Acta Biochimica et Biophysica Sinica, 2002, 34(6): 690-698.
[22] 杨廷雅, 孙亮, 周婷婷, 等. 短短芽孢杆菌Brevibacillus brevs HAB-5主要抑菌活性成分的分析及其特性研究[J]. 中国生物防治学报, 2014, 30(2): 222-231.
YANG Tingya, SUN Liang, ZHOU Tingting, et al. Analysis on the key antagonistic active compositions of Brevibacillus brevs HAB-5 and its characteristics [J]. Chinese Journal of Biological Control, 2014, 30(2): 222-231.
[23] 张亮, 吕翠, 段彩琛, 等. 转录调控因子AbrB对生防短短芽胞杆菌X23中抗生素edeines生物合成的影响[J]. 中国生物防治学报, 2020, 36(4): 564-574.
ZHANG Liang, LYU Cui, DUAN Caichen, et al. Effect of transcription factor AbrB on the biosynthesis of antibiotic edeines in biocontrol bacteria Brevibacillus brevis X23 [J]. Chinese Journal of Biological Control, 2020, 36(4): 564-574.
[24] 易有金, 尹华群, 罗宽, 等. 烟草内生短短芽孢杆菌的分离鉴定及对烟草青枯病的防效[J].植物病理学报, 2007, 37(3): 301-306.
YI Youjin, YIN Huaqun, LUO Kuan, et al. Isolation and identification of endophytic Brevibacillus brevis and its biocontrol effect against tobacco bacterial wilt [J]. Acta Phytopathologica Sinica, 2007, 37(3): 301-306.
[25] 张竹青, 罗宽, 高必达. 烟草青枯病生防细菌发酵培养条件研究[J].湖南农业大学学报 (自然科学版), 1999, 25(2): 143-146.
ZHANG Zhuqing, LUO Kuan, GAO Bida. Studies on the fermentative cultural condition of three bacteria for biological bontrol of tobacco bacterial wilt [J]. Journal of Hunan Agricultural University (Natural Sciences), 1999, 25(2): 143-146.
[26] 陈武, 彭曙光, 周清明, 等. 侧孢芽孢杆菌 2-Q-9 菌株外泌抗菌肽的纯化与鉴定[J]. 湖南农业大学学报 (自然科学版), 2011, 37(1): 26-30.
CHEN Wu, PENG Shuguang, ZHOU Qingming, et al. Purification and characterization of antimicrobial peptide secreted by Bacillus laterosporus 2-Q-9 [J]. Journal of Hunan Agricultural University (Natural Sciences), 2011, 37(1): 26-30.
[27] JALAL A, TRAN N T, STEVENSON C E, et al. Diversification of DNA-binding specificity by permissive and specificity-switching mutations in the ParB/Noc protein family [J]. Cell Reports, 2020, 32(3): 107928.
[28] KHARE D, ZIEGELIN G, LANKA E, et al. Sequence-specific DNA binding determined by contacts outside the helix-turn-helix motif of the ParB homolog KorB [J]. Nature Structural & Molecular Biology, 2004, 11(7): 656-663.
收稿日期:2023-02-07;修回日期:2023-03-02。
基金項目:长沙市自然科学基金项目(kq2208130);国家自然科学基金项目(32000047);湖南省技术攻关“揭榜挂帅”项目(2021NK1040);湖南省烟草公司长沙市公司科技项目(CS2022KJ02)。
作者简介:杜杰,助理研究员,主要从事微生物分子遗传与功能基因组学的研究。
* 通信作者:刘清术,研究员,主要从事微生物分子生物学的研究,E-mail: liuqingshu2012@126.com; 陈武,副教授,主要从事作物土传病害生物防控研究,E-mail: chenwuworrior@163.com。

