棕榈酸诱导胰岛细胞氧化应激和内质网应激的研究进展
张茜 王瑞 于智超 张硕 黄延芹
摘 要:2型糖尿病(T2DM)主要由胰島β细胞的胰岛素分泌缺陷和胰岛素抵抗引起。棕榈酸作为人体内最丰富的游离脂肪酸之一,其体内含量过高易造成脂代谢紊乱,诱导胰岛β细胞功能障碍及胰岛素抵抗。这与T2DM的发生发展密切相关,但具体机制尚未完全明确。棕榈酸诱导胰岛β细胞发生的氧化应激和内质网应激(ERS)是影响胰岛β细胞功能以及破坏胰岛素信号传导的关键应激途径。棕榈酸通过增加线粒体氧化、二酰基甘油-蛋白质激酶C-还原型辅酶Ⅱ途径、改变线粒体呼吸链正常功能和炎症刺激加重氧化应激,通过影响内质网折叠能力、破坏胞内蛋白运输途径、上调未折叠蛋白反应相关转录因子、棕榈酰化、降解羧肽酶E和减少内质网中Ca2+促进ERS,加剧胰岛β细胞功能障碍和凋亡,最终导致T2DM的发生与发展。本文综述了棕榈酸与胰岛β细胞内氧化应激和ERS的关联性,介绍了蛋白激酶R抑制剂、人参皂苷Rg1和三黄汤等具有潜力的中、西医靶向干预药物,为T2DM的临床治疗提供新思路。
关键词:胰岛β细胞;2型糖尿病;棕榈酸;氧化应激;内质网应激
中图分类号:R587.1 文献标志码:A DOI:10.3969/j.issn.1007-7146.2023.02.003
Research Progress of Palmitic Acid Induced Oxidative Stress and Endoplasmic Reticulum Stress on Islet β Cell
ZHANG Xi1, WANG Rui1, YU Zhichao1, ZHANG Shuo1, 2, HUANG Yanqin3*
(1. College of Traditional Chinese Medicine, Shandong University of Traditional Chinese Medicine, Jinan 250014, China; 2. Shandong Collaborative Innovation Center for Classic and Famous Prescriptions of Traditional Chinese Medicine, Jinan 250355, China; 3. The Affiliated Hospital of Shandong University of Traditional Chinese Medicine, Jinan 250011, China)
Abstract: Type 2 diabetes mellitus (T2DM) is mainly caused by defective insulin secretion and insulin resistance of islet β cells. Palmitic acid is one of the most abundant free fatty acids in the human body. When its content in the body is too high, it is easy to cause lipid metabolism disorder and induce islet β cells dysfunction and insulin resistance, which are closely related to the occurrence and development of T2DM. However, the specific mechanism is not precise. The function of islet β cells could be affected by oxidative stress and endoplasmic reticulum stress (ERS) induced by palmitic acid. It is also the critical pathway for destroying insulin signaling. Palmitic acid aggravates oxidative stress by increasing mitochondrial oxidation, diacyl glycerol-protein kinase C-nicotinamide adenine dinucleotide phosphate pathway, changing the normal function of the mitochondrial respiratory chain and inflammatory stimulation. It also affects the folding ability of the endoplasmic reticulum, destroys the intracellular protein transport pathway, upregulates unfolded protein response-related transcription factors, makes palmitoylation, degrades carboxypeptidase E, and reduces Ca2+ in the endoplasmic reticulum to promote ERS. Both promote islet β cells dysfunction and apoptosis, ultimately leading to the occurrence and development of T2DM. This paper reviewed the relationship between palmitic acid and islet β cells, the correlation between intracellular oxidative stress and ERS and the potential Chinese and Western medicine-targeted intervention drugs such as protein kinases R inhibitor, Ginsenoside Rg1 and Sanhuang Decoction. It would provide a novel idea for the clinical treatment of T2DM.
Key words: islet β cell; type 2 diabetes mellitus; palmitic acid; oxidative stress; endoplasmic reticulum stress
(Acta Laser Biology Sinica, 2023, 32(2): 118-125)
2型糖尿病(type 2 diabetes mellitus,T2DM)是全球最常见的慢性代谢疾病之一,主要由胰岛β细胞的胰岛素分泌缺陷和胰岛素抵抗(insulin resistance,IR)引起,以血糖水平的升高为特征表现。胰岛β细胞具有分泌和释放胰岛素的功能,故其功能对T2DM的发病机制至关重要[1]。游离脂肪酸(free fatty acids,FFA)作为生物体的必需燃料,是线粒体氧化代谢和ATP合成不可或缺的反应底物。棕榈酸是最丰富的FFA之一,占血浆FFA总量的30%~40%。棕榈酸也是反映脂代谢紊乱的关键指标,与T2DM并发症的进展以及胰岛素敏感性密切相关[2]。过量累积的棕榈酸会造成胰岛β细胞的遗传易感性产生差异,受到氧化应激和内质网应激(endoplasmic reticulum stress,ERS)等毒性应激压力,最终可能导致胰岛功能受损和细胞凋亡[1-3]。
我们总结近五年来关于在T2DM中以棕榈酸为代表的高脂刺激诱导胰岛β细胞发生氧化应激和ERS相关分子机制的研究,并找出针对相关机制作用的中、西医治疗药物,为T2DM的治疗提供新的方向。
1 棕榈酸
棕榈酸是一种16碳饱和脂肪酸,在细胞中具有合成膜磷脂、转运脂质和棕榈酰化蛋白的重要作用[4]。在正常情况下,棕榈酸会转化为甘油三酯以进行长期储能,但过量的棕榈酸会导致不利于人体机能的代谢物产量增加。棕榈酸本身不但会损害胰岛素信号传导,还会增加NO的释放、活性氧(reactive oxygen species,ROS)的生成和脂质的过氧化[5]。棕榈酸通过破坏诸如肝细胞、心肌和骨骼肌细胞、下丘脑神经元等多种细胞类型的胞内胰岛素信号传导途径来诱导IR,这些机制存在有害的交叉作用[6]。
2 棕榈酸对胰岛β细胞功能的影响
胰岛β细胞氧化应激和ERS与功能细胞丢失和胰岛素分泌受损有关[3]。两种应激机制相互联系,蛋白质异常折叠会诱导ROS的产生;同样,ROS的过量产生会扰乱内质网的氧化还原状态,从而破坏正常的二硫键形成和蛋白质折叠[6]。在细胞内部,棕榈酸及其代谢产物充当不同信号通路的膜受体和核受体的配体,通过氧化应激和ERS诱导胰岛β细胞功能障碍,影响葡萄糖刺激胰岛素分泌,并激活β细胞的凋亡程序[7-8]。这些应激途径之间的串扰存在多个水平上的互相影响,在胰岛β细胞功能受损过程中具有重要意义。
2.1 棕榈酸与氧化应激
2.1.1 胰岛β细胞与氧化应激
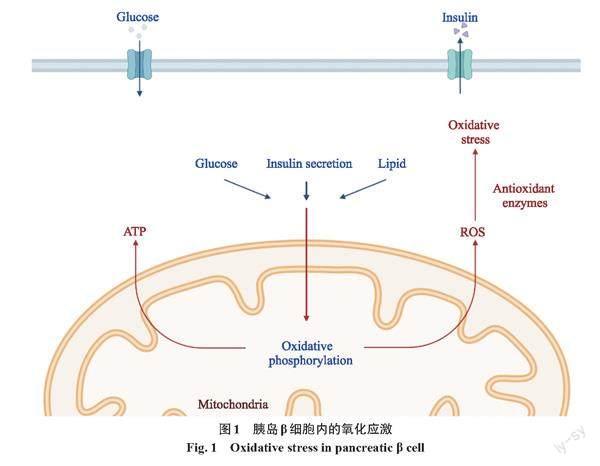
氧化应激是IR进展和T2DM发生的关键因素[9]。胰岛β细胞中的ROS主要来源于葡萄糖刺激胰岛β细胞分泌胰岛素的过程。胰岛β细胞需要氧化磷酸化产生ATP,ROS是线粒体呼吸的副产物[9]。线粒体产生的大量ROS是调节正常细胞功能的重要信号[10]。胰岛素分泌和糖脂代谢很大程度上取决于线粒体功能的正常与否。因此,过量的胰岛素需求会导致ATP合成增加,下游的ROS会随之增多。与其他细胞类型相比,胰岛β细胞对氧化应激高度敏感。ROS通过干预胰岛β细胞中的各种细胞行为在T2DM的病程进展中发挥作用,导致细胞器损伤和细胞凋亡[10]。
由于抗氧化能力不足,胰岛β细胞相对α细胞更容易受到ROS或细胞炎性因子造成的氧化损伤[11]。胰岛中丰度相对较低的抗氧化酶是导致人类胰岛β细胞对氧化应激的易感性较强的重要原因之一。Miki等[12]研究发现,与胰岛中的α细胞相比,胰岛β细胞对氧化应激的敏感性显著提高,但谷胱甘肽过氧化物酶和过氧化氢酶的表达水平非常低,抗氧化酶在胰岛β细胞中并无优势。在过量ROS诱导的氧化应激的不利影响下,胰岛β细胞中与H2O2的产生和去除有关的酶促机制之间存在显著的非平衡关系,最终导致细胞功能障碍和凋亡[13](图1)。
2.1.2 棕榈酸诱导的氧化应激
棕榈酸诱导的氧化应激是破坏胰岛素信号传导的重要机制。棕榈酸可通过对多种代谢途径的影响而促使氧化应激的发生[14],其中包括线粒体氧化增加、神经酰胺通过破坏复合物I和III的电子传输、通过内质网氧化还原酶-1α(endoplasmic reticulum oxidoreductin 1α,ERO 1α)和蛋白质二硫键异构酶错误折叠的蛋白质诱导的ROS生成以及二酰基甘油(diacyl glycerol,DG)-蛋白质激酶C(protein kinase C,PKC)-还原型辅酶Ⅱ(nicotinamide adenine dinucleotide phosphate,NADPH)途径[15-16]。长期暴露于高葡萄糖和棕榈酸触发的氧化应激环境中也改变了线粒体呼吸链(mitochondrial respiratory chain,MRC)的正常功能,包括降低线粒体的呼吸能力、增加MRC中的质子泄漏、改变线粒体内膜电位差和降低线粒体膜的完整性[17]。在氧化应激的发生过程中往往伴随着炎症表现,棕榈酸诱导单核细胞趋化蛋白1、基质金属蛋白酶2、白细胞介素1β(interleukin 1β,IL-1β)、白細胞介素-6和α肿瘤坏死因子(tumor necrosis factor-α,TNF-α)等有关基因表达上调,胞内炎症介质增加,以此来促进炎症的发生[18]。受到炎症刺激的T2DM患者可能会发生巨噬细胞浸润[19],而胰岛中的巨噬细胞能直接降低胰岛β细胞分化和功能行使的基因的表达,也可间接通过分泌炎性细胞因子来放大棕榈酸导致的脂毒性作用[20]。
2.2 棕榈酸与ERS
2.2.1 胰岛β细胞与ERS
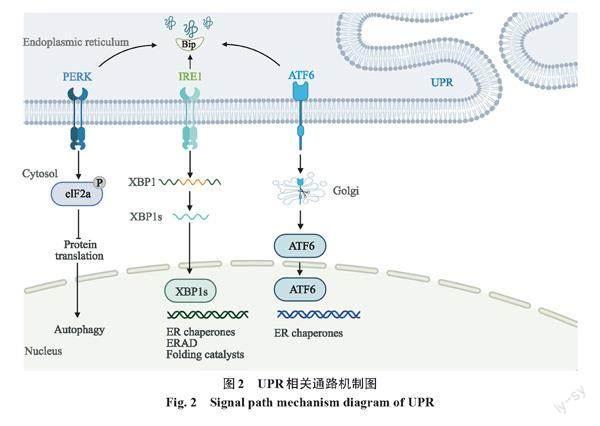
内质网是对于胰岛β细胞功能的正常发挥和胰岛素的合成、正确折叠都起着关键作用的代谢细胞器。ERS是指内质网腔中未折叠或错误折叠蛋白质的积累,是T2DM发病机理中的重要步骤[21]。细胞具有一个完整的信号系统以预防和应对ERS,恢复正常的内质网功能。未折叠蛋白反应(unfolded protein response,UPR)是构成这种反应的基本途径。有毒的错误折叠蛋白质积累后,UPR在恢复体内平衡方面发挥着关键作用[22]。UPR由三种跨膜蛋白启动,包括蛋白激酶R样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)、肌醇需求酶1(inositol-requiring enzyme 1,IRE1)和激活转录因子6(activating transcription factor 6,ATF6)。在ERS情况下,重链结合蛋白(heavy-chain binding protein,BiP)从IRE1α、ATF6和PERK中释放,触发UPR。UPR通过PERK介导的底物翻译起始因子2α(eukaryotic initiation factor 2 α,eIF2α)磷酸化减弱蛋白质翻译,以减少蛋白质流入ER[22]。
同时,IRE1α包含丝氨酸/苏氨酸激酶和核糖核酸内切酶(ribonuclease,RNase)结构域,并在ERS期间从BiP释放后被激活。通过激活的IRE1α剪切X-box结合蛋白1(X-box-binding protein 1,XBP1)mRNA中26个碱基的内含子,产生正常的XBP1蛋白質。XBP1作为转录因子诱导BiP的表达,可增加折叠蛋白的能力[23]。IRE1/XBP1信号通路促进了包括内质网伴侣、折叠催化剂和ERAD机制等多种基因的转录,维持细胞胰岛素原加工、胰岛素分泌和适应性增殖等功能。研究表明,β细胞中XBP1缺失的小鼠在胰岛素原加工、胰岛素分泌和适应性胰岛β细胞增殖方面出现缺陷,导致葡萄糖耐受不良和高血糖[24]。UPR也可通过内质网相关降解(endoplasmic reticulum associated degradation,ERAD)和自噬去除错误折叠和未折叠的蛋白质(图2)。
若内质网中未折叠或错误折叠蛋白的超载无法解决,UPR最终会通过激活C/EBP同源蛋白(C/EBP homologous protein,CHOP)诱导细胞凋亡[25]。这是由于PERK在与BiP解除结合后被同二聚化和自磷酸化的ERS激活,活化的PERK进一步磷酸化eIF2α以减弱蛋白质翻译,并通过下游激活CHOP导致细胞死亡。
2.2.2 棕榈酸诱导的ERS
棕榈酸通过影响内质网折叠能力导致内质网中错误折叠的蛋白质过量累积,从而扰动触发ERS;且脂毒性改变破坏了内质网到高尔基体的蛋白运输,导致胰岛素原成熟障碍和胰岛素含量降低,影响胰岛素的敏感性,并抑制相关蛋白质的合成[21]。棕榈酸上调伴侣蛋白BiP蛋白、UPR转录因子(eIF2α、ATF6、XBP1s),激活与ERS相关的CHOP的表达,促进细胞凋亡[21]。棕榈酸还可通过异常的蛋白质棕榈酰化影响蛋白质折叠,或是引起内质网脂质种类的改变,从而影响内质网脂筏的组成和分布,引发ERS[26]。研究表明,棕榈酸还可诱导胰岛素加工所需的羧肽酶E的快速降解,增强内质网的压力[26]。内质网作为胞内Ca2+储存器控制Ca2+释放到细胞质,参与胰岛素的合成。棕榈酸显著降低了内质网中的Ca2+水平,造成未折叠蛋白超载和程序性细胞死亡[27]。由于蛋白质折叠机制正常进行时需要较高的胞内Ca2+含量,因此,内质网内Ca2+耗竭会积累错误折叠的蛋白质,触发ERS[19]。有研究发现,在胰腺中,棕榈酸通过上调葡萄糖调节蛋白75(glucose regulated protein 75,GRP75)的表达,减少内质网与线粒体相关膜蛋白(mitochondria-associated endoplasmic reticulum membranes,MAMs)之间的接触面积和相互作用,造成线粒体内Ca2+增加、线粒体膜电位受损、ROS产生增加,从而导致胰岛素耐量受损,诱导细胞凋亡[19,27]。多项研究表明,药物干预调节ERS蛋白表达对棕榈酸诱导的胰岛β细胞凋亡具有保护作用[28-29],可见棕榈酸可通过多种途径诱导胰岛β细胞内ERS的发生和凋亡。
3 西药相关的治疗研究
棕榈酸通过氧化应激和ERS触发胰岛β细胞凋亡程序,加速了T2DM的发展,并导致T2DM患者血糖代谢控制的逐步恶化。针对棕榈酸引起的氧化应激和ERS,胰岛β细胞相关的靶向治疗具有重要意义,可有效预防或治疗T2DM。蛋白激酶R(protein kinases R,PKR)抑制剂、过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)激动剂、表儿茶素(epicatecho,EC)、
1,2-二棕榈酰-SN-甘油-3-磷酸胆碱(1,2-Dipalmitoyl-SN-glycero-3-phosphocholine,DPPC)和二酰甘油酰基转移酶1(diacylglycerol acyltransferase 1,DGAT1)抑制剂等药物可通过抑制胰岛β细胞的氧化应激或ERS来减弱IR,削弱棕榈酸对两种机制的影响,对于T2DM伴随血脂代谢紊乱的治疗具有研究前景。
3.1 PKR抑制剂
PKR是一种可被ERS激活的细胞应激激酶。PKR对eIF2α磷酸化进行催化,以响应各种细胞应激信号。PKR磷酸化活性的显著增加也与IR有关,并有助于T2DM的进展。Yalcin等[30]用两种咪唑/羟吲哚衍生的PKR抑制剂C16和2-氨基嘌呤处理胰岛β细胞。结果表明,两种PKR抑制剂通过降低eIF2α磷酸化和阻断XBP1mRNA的剪切修饰抑制了ERS,显著减轻了棕榈酸介导的胰岛素分泌抑制,可用于增强糖尿病晚期胰腺的胰岛素分泌能力。
3.2 PPARγ激动剂
PPARγ是肥胖和糖尿病的有效治疗靶标,有关其激活机制的研究仍是当前科研方向的热点。Hong等[31]使用一定浓度的棕榈酸处理后,发现MIN6细胞出现了ERS和炎症反应,并选用PPARγ激动剂吡格列酮进行干预。研究结果显示,吡格列酮显著改善了细胞的胰岛素分泌和细胞凋亡情况,逆转了炎性细胞因子和ERS标志物的表达。已有研究证明,PPARγ激动剂不仅具有改善IR的作用,而且可通过拮抗ERS和炎症来预防胰岛β细胞损伤[32]。PPARγ新型激动剂的有关研究可能为改善糖尿病患者胰岛素分泌和增强胰岛β细胞存活提供新的治疗选择。
3.3 EC
Cremonini等[33]獲得的结果表明,EC及其代谢物可防止棕榈酸诱导的HepG2细胞中NADPH氧化酶上调,减少氧化应激和IR。EC在肝脂质超负荷条件下可通过抑制NADPH氧化酶来提高胰岛素的敏感性。EC以及NADPH氧化酶抑制剂在生理浓度下即可预防棕榈酸的有害作用[33]。
3.4 DPPC
Park等[34]提出了磷脂酰胆碱的主要活性物质DPPC是治疗脂肪代谢和IR的有效物质。DPPC不仅可以增强脂肪细胞的脂解作用,还能减弱棕榈酸诱导的IR和细胞凋亡[34]。动物试验研究显示,对高脂饮食的小鼠施用DPPC,小鼠的胰岛素敏感性得到改善,血清葡萄糖以及肝脂质水平下降[35]。
3.5 DGAT1抑制剂
DGAT1是甘油三酯合成步骤的关键酶,参与催化以DG和酰基辅酶A为底物的酯化反应,在脂质代谢中起着至关重要的作用[36]。DGAT1抑制剂可以减少棕榈酸诱导的细胞内甘油三酯积累、ERS和促炎反应[29],抑制巨噬细胞中NLRP3炎症小体活化,有助于胰岛β细胞的抗凋亡作用[37]。DGAT1抑制剂联合其他抗糖尿病药物可能在改善葡萄糖和脂质代谢方面显示出更好的疗效。DGAT1抑制剂这一有效抗糖尿病药物目前正在进行临床试验,并有多种相关药物化合物研发[38-39]。DGAT1作为治疗T2DM和脂质代谢紊乱的新靶点,在对抗T2DM的潜在机制里值得进一步深入探讨。
4 中药相关治疗研究
中药在调节T2DM的糖脂代谢中具有多成分和多靶点的特征,不仅可以增加胰岛素受体的数量和调节信号转导,还可以预防和控制糖尿病及其并发症的发生与发展[40]。目前,中药在治疗T2DM等领域中已有广泛应用。部分中药提取物如人参皂苷Rg1(ginsenoside Rg1,GRg1)、知母皂苷B-II(timosaponin b-II,TB-II)、黄连素(berberine,BBR)、葛根素(puerain)和紫檀芪(pterostilbene,PTS)能够通过抑制有关基因的表达来减少细胞中的ROS或ERS,从而产生抗氧化作用以减轻炎症反应和IR。三黄汤、加味苓桂术甘汤、金芪降糖剂和当归补血汤等中药复方亦可改善T2DM患者的糖脂代谢紊乱,提高机体对胰岛素的敏感性。
4.1 中药提取物
4.1.1 GRg1
GRg1是中草药人参和三七的重要有效成分,对治疗糖尿病具有显著作用。Fan等[41]的研究探讨了GRg1治疗IR的相关分子机制,通过生化分析可得,GRg1可抑制促炎因子的表达。Mo等[42]发现,GRg1能逆转棕榈酸造成的IR并降低胞内的ROS水平。
4.1.2 TB-II
TB-II是中药知母的主要成分之一。Yuan等[43]研究调查发现,TB-II可显著改善棕榈酸诱导的IR和炎症反应,有效提高细胞活力;Ji等[44]通过细胞试验证明,TB-II可抑制NO、ROS和促炎性细胞因子的产生,起到抗炎的作用。研究认为,TB-II有望成为治疗棕榈酸诱导的IR和炎症的潜在药物[43]。
4.1.3 BBR
BBR是在对抗代谢紊乱中具有潜在治疗效益的药物。Han等[45]的研究结果显示,BBR给药处理减轻了肥胖小鼠和FFA处理的脂肪细胞的ERS和炎症反应的发生。BBR也可通过调节miR-204/SIRT1途径缓解棕榈酸诱导的MIN6细胞功能障碍和胰岛素分泌作用受损[46]。
4.1.4 葛根素
高含量的饱和脂肪酸会导致线粒体功能障碍和IR发展中的炎症[47]。Chen等[47]最近发现,葛根素干预处理改善了胰岛素的敏感性,调节了线粒体融合和裂变。葛根素在拯救因棕榈酸受到损害的线粒体的同时减轻炎症因子的释放。
4.1.5 PTS
PTS是白藜芦醇(resveratrol,Res)的甲氧基化类似物。IR发生在T2DM发作之前,氧化应激的增加是导致IR的不利因素之一[48]。Malik等[48]评估了PTS在逆转棕榈酸介导的HepG2细胞损害中的能力。结果表明,PTS可减少脂质的积累,具有抗氧化的作用,可降低棕榈酸诱导的胞内ROS积累和随后的氧化脂质损伤,最终逆转IR。PTS不会影响HepG2细胞中FFA的摄取,但会调节甘油三酸酯的积累和FFA的代谢。
4.2 中药复方
4.2.1 三黄汤
现代药理研究发现,三黄汤参与影响糖脂代谢紊乱中的氧化应激和炎症反应。艾力亚斯·阿不拉等[49]收集了三黄汤联合利拉鲁肽注射液治疗的132例老年合并肥胖的T2DM患者,结果表明,三黄汤联合利拉鲁肽注射液治疗后的患者的氧化应激指标和炎症因子水平的改善明显优于对照组,疗效显著。方中的黄芩与黄连合用于治疗T2DM已有数千年的历史。Cui等[50]观察到经黄连、黄芩处理过的T2DM模型大鼠的高血糖、血脂异常、炎症反应及IR现象均得到明显改善。上述结果进一步证明了三黄汤及其组成药物在改善T2DM大鼠的糖脂代谢方面具有巨大潜力。
4.2.2 加味苓桂术甘汤
Sun等[51]发现,加味苓桂术甘汤可降低T2DM大鼠的TNF-α和IL-6水平,减少脂肪因子和炎性细胞因子。与肥胖T2DM大鼠相比,加味苓桂术甘汤处理后的大鼠体内的FFA水平显著降低。
4.2.3 精制金芪降糖剂
精制金芪降糖剂由中药复方金芪降糖片三大中药黄连、黄芪和忍冬提取物的精制混合物组成。Liu等[52]研究证明,精制金芪降糖剂可直接增强胰岛素刺激下葡萄糖的摄取,改善胰岛素信号传导、炎症反应和氧化应激,是改善T2DM糖代谢和胰岛素敏感性的重要方剂。
4.2.4 当归补血汤
孙丽丽等[53]通过代谢组学方法发现,与正常小鼠相比,經棕榈酸等FFA处理会导致小鼠胰岛β细胞分泌缺陷,肝糖原的输出增加,肌肉组织的葡萄糖吸收减少。而经当归补血汤给药的T2DM模型小鼠,其体内多种代谢物(如牛磺胆酸、棕榈酸、L-亮氨酸、白三烯E等)的含量都具有回归正常小鼠的趋势。根据不同代谢物的变化,推测当归补血汤可通过提高机体对胰岛素敏感性、抑制患者FFA水平来调节糖脂代谢、减轻炎症反应等缓解T2DM的代谢紊乱现象。
5 总结与展望
目前,T2DM的发病机制仍待明确。虽然降糖药物和胰岛素的种类并不单一,但关于T2DM涉及的分子机制和相关药物的研发仍是当前的研究热点,这对于疾病的发生发展至关重要。综上所述,胰岛β细胞是T2DM病情进展的关键,过量蓄积的棕榈酸通过多种代谢途径诱导胰岛β细胞发生氧化应激和ERS。棕榈酸作为人体内主要的FFA,参与多条通路诱导胰岛β细胞内氧化应激和ERS的发生,影响胰岛素分泌并加速细胞凋亡。棕榈酸对于增加线粒体氧化、激活DG-PKC-NADPH途径、破坏MRC功能和加重炎症刺激所引发的氧化应激具有重要的意义。同时,像内质网折叠能力受损、胞内蛋白运输途径的破坏、棕榈酰化、羧肽酶E降解和内质网中Ca2+的减少造成的ERS也都受过量棕榈酸累积的影响。氧化应激和ERS势必会增加人体炎症因子的表达,破坏细胞稳态,从而影响胰岛β细胞的正常功能。此外,在应激机制启动时所产生的中间产物亦有可能诱导胰岛β细胞的凋亡,对T2DM的不良发展有推动作用。因此,减少胰岛β细胞的应激反应或可成为对抗棕榈酸与T2DM相互影响的新型治疗方法。虽然已有大量临床和动物试验研究证明,中、西医针对T2DM中棕榈酸诱导氧化应激或ERS效果显著,同时具有调节糖脂代谢、改善IR和增加抗氧化作用等多方益处,但药物研究尚处于起步阶段,值得进一步探索和发展。故通过减少棕榈酸诱导的氧化应激和ERS来预防胰岛β细胞功能障碍以及凋亡的发生是当前新型T2DM治疗药物研发的新思路。
参考文献(References):
[1] GALICIA-GARCIA U, BENITO-VICENTE A, JEBARI S, et al. Pathophysiology of type 2 diabetes mellitus[J]. International Journal of Molecular Sciences, 2020, 21(17): 6275-6308.
[2] WILLIAMS R, KARURANGA S, MALANDA B, et al. Global and regional estimates and projections of diabetes-related health expenditure: results from the International Diabetes Federation Diabetes Atlas, 9th edition[J]. Diabetes Research and Clinical Practice, 2020, 162: 108072-108084.
[3] INAISHI J, SAISHO Y. Beta-cell mass in obesity and type 2 diabetes, and its relation to pancreas fat: a mini-review[J]. Nutrients, 2020, 12(12): 3846-3851.
[4] KORBECKI J, BAJDAK-RUSINEK K. The effect of palmitic acid on inflammatory response in macrophages: an overview of molecular mechanisms[J]. Infammation Research, 2019, 68(11): 915-932.
[5] SAMSONOV M V, PODKUYCHENKO N V, KHAPCHAEV A Y, et al. AICAR protects vascular endothelial cells from oxidative injury induced by the long-term palmitate excess[J]. International Journal of Molecular Sciences, 2021, 23(1): 211-226.
[6] KUHRE R E, HOLST J J, KAPPE C. The regulation of function, growth and survival of GLP-1-producing L-cells[J]. Clinical Science, 2016, 130(2): 79-91.
[7] CERF M E. Developmental programming and glucolipotoxicity: insights on beta cell inflammation and diabetes[J]. Metabolites, 2020, 10(11): 444-457.
[8] TZENG H T, CHYUAN I T, CHEN W Y. Shaping of innate immune response by fatty acid metabolite palmitate[J]. Cells, 2019, 8(12): 1633-1647.
[9] SINGH A, KUKRETI R, SASO L, et al. Mechanistic insight into oxidative stress-triggered signaling pathways and type 2 diabetes[J]. Molecules, 2022, 27(3): 950-969.
[10] MUKHERJEE N, LIN L, CONTRERAS C J, et al. Beta-cell death in diabetes: past discoveries, present understanding, and potential future advances[J]. Metabolites, 2021, 11(11): 796-824.
[11] KOWLURU A. Oxidative stress in cytokine-induced dysfunction of the pancreatic beta cell: known knowns and known unknowns[J]. Metabolites, 2020, 10(12): 480-496.
[12] MIKI A, RICORDI C, SAKUMA Y, et al. Divergent antioxidant capacity of human islet cell subsets: a potential cause of beta-cell vulnerability in diabetes and islet transplantation[J]. PLoS One, 2018, 13(5): e196570-e196585.
[13] LENZEN S. Chemistry and biology of reactive species with special reference to the antioxidative defence status in pancreatic β-cells[J]. Biochimica et Biophysica Acta-General Subjects, 2017, 1861(8): 1929-1942.
[14] LY L D, LY D D, NGUYEN N T, et al. Mitochondrial Ca2+ uptake relieves palmitate-induced cytosolic Ca2+ overload in MIN6 cells[J]. Molecules and Cells, 2020, 43(1): 66-75.
[15] LY L D, XU S, CHOI S K, et al. Oxidative stress and calcium dysregulation by palmitate in type 2 diabetes[J]. Experimental and Molecular Medicine, 2017, 49(2): e291-e302.
[16] OH Y S, BAE G D, BAEK D J, et al. Fatty acid-induced lipotoxicity in pancreatic beta-cells during development of type 2 diabetes[J]. Frontiers in Endocrinol (Lausanne), 2018, 9: 384-393.
[17] YARIBEYGI H, SATHYAPALAN T, ATKIN S L, et al. Molecular mechanisms linking oxidative stress and diabetes mellitus[J]. Oxidative Medicine and Cellular Longevity, 2020, 2020: 8609213-8609225.
[18] GIRONA J, ROSALES R, SAAVEDRA P, et al. Palmitate decreases migration and proliferation and increases oxidative stress and inflammation in smooth muscle cells: role of the Nrf2 signaling pathway[J]. American Journal of Physiology-Cell Physiology, 2019, 316(6): C888-C897.
[19] ZHOU J, ZHANG X, JI L, et al. Identification of potential biomarkers of type 2 diabetes mellitus-related immune infiltration using weighted gene coexpression network analysis[J]. BioMed Research International, 2022, 2022: 9920744-9920757.
[20] YING W, FU W, LEE Y S, et al. The role of macrophages in obesity-associated islet inflammation and beta-cell abnormalities[J]. Nature Reviews Endocrinology, 2020, 16(2): 81-90.
[21] PERRY B D, RAHNERT J A, XIE Y, et al. Palmitate-induced ER stress and inhibition of protein synthesis in cultured myotubes does not require Toll-like receptor 4[J]. PLoS One, 2018, 13(1): e191313-e191328.
[22] LEE J H, LEE J. Endoplasmic reticulum (ER) stress and its role in pancreatic beta-cell dysfunction and senescence in type 2 diabetes[J]. International Journal of Molecular Sciences, 2022, 23(9): 4843-4864.
[23] STONE S I, ABREU D, MCGILL J B, et al. Monogenic and syndromic diabetes due to endoplasmic reticulum stress[J]. Journal of Diabetes and its Complications, 2021, 35(1): 107618-107624.
[24] LEE K, CHAN J Y, LIANG C, et al. XBP1 maintains beta cell identity, represses beta-to-alpha cell transdifferentiation and protects against diabetic beta cell failure during metabolic stress in mice[J]. Diabetologia, 2022, 65(6): 984-996.
[25] LEMMER I L, WILLEMSEN N, HILAL N, et al. A guide to understanding endoplasmic reticulum stress in metabolic disorders[J]. Molecular Metabolism, 2021, 47: 101169-101187.
[26] LYTRIVI M, CASTELL A L, POITOUT V, et al. Recent insights into mechanisms of beta-cell lipo- and glucolipotoxicity in type 2 diabetes[J]. Journal of Molecular Biology, 2020, 432(5): 1514-1534.
[27] TIWARY S, NANDWANI A, KHAN R, et al. GRP75 mediates endoplasmic reticulum-mitochondria coupling during palmitate-induced pancreatic beta-cell apoptosis[J]. Journal of Biological Chemistry, 2021, 297(6): 101368-101383.
[28] WANG Y, LIU J, LIU Z, et al. Sall2 knockdown exacerbates palmitic acid induced dysfunction and apoptosis of pancreatic NIT-1 beta cells[J]. Biomed Pharmacother, 2018, 104: 375-382.
[29] HUANG J S, GUO B B, WANG G H, et al. DGAT1 inhibitors protect pancreatic beta-cells from palmitic acid-induced apoptosis[J]. Acta Pharmacologica Sinica, 2021, 42(2): 264-271.
[30] YALCIN A, SARKICI G, KOLAC U K. PKR inhibitors suppress endoplasmic reticulum stress and subdue glucolipotoxicity-mediated impairment of insulin secretion in pancreatic beta cells[J]. Turkish Journal of Biology, 2020, 44(2): 93-102.
[31] HONG S W, LEE J, CHO J H, et al. Pioglitazone attenuates palmitate-induced inflammation and endoplasmic reticulum stress in pancreatic beta-cells[J]. Endocrinology and Metabolism, 2018, 33(1): 105-113.
[32] DEL P S, CHILTON R. Practical strategies for improving outcomes in T2DM: the potential role of pioglitazone and DPP4 inhibitors[J]. Diabetes, Obesity and Metabolism, 2018, 20(4): 786-799.

