基于网络药理学和分子对接技术探讨柴胡疏肝散治疗肝血管瘤的作用机制
冯玲 黄朝霞 秦乐乐 胡玉姗 张永勤

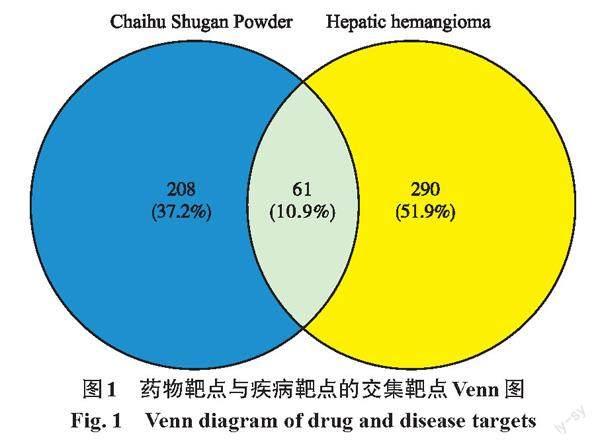
摘 要:肝血管瘤是常見的良性肿瘤之一,临床上常采用柴胡疏肝散进行治疗,但其具体的作用机制仍是未知的。本研究利用网络药理学和分子对接方法,通过成分-靶点网络图分析得出关键靶点和成分信息,对关键靶点和成分进行分子对接,获得相应分子对接图谱,并探讨其作用机制。结果显示,共获得柴胡疏肝散活性成分142个,相对应靶点269个,肝血管瘤疾病靶点351个,两者共同交集靶点61个。基因本体(GO)功能富集有184条生物学过程,主要涉及转录因子活性、DNA结合及转录的正向调控。京都基因和基因组百科全书(KEGG)通路富集分析筛选得到138条信号通路,主要涉及PI3K-Akt、乙型肝炎、MAPK、AGE-RAGE等信号通路。分子对接结果显示,AKT1蛋白与活性成分β-谷甾醇结合稳定,VEGFA蛋白与活性成分槲皮素和异鼠李素均结合稳定,ESR1和MAPK3分别与β-谷甾醇和柚皮素结合稳定。柴胡疏肝散可能是通过槲皮素、异鼠李素、β-谷甾醇、山柰酚和柚皮素等活性成分作用于STAT3、AKT1、VEGFA、ESR1、MAPK3等靶点的,通过诱导血管新生、保护血管和肝细胞的活化等发挥治疗肝血管瘤的作用,这为临床上应用柴胡疏肝散治疗肝血管瘤提供了理论研究依据。
关键词:柴胡疏肝散;肝血管瘤;网络药理学;分子对接;信号通路
中图分类号:R285;R289. 5 文献标志码:A DOI:10.3969/j.issn.1007-7146.2023.02.011
A Study on the Mechanism of Chaihu Shugan Powder in the Teatment of Hepatic Hemangioma Based on Network Pharmacology and
Molecular Docking
FENG Linga, HUANG Zhaoxiab, QIN Lelea, HU Yushana, ZHANG Yongqinb*
(Guizhou University of Traditional Chinese Medicine a. College of Pharmacy; b. College of Basic Medicine,
Guiyang 550025, China)
Abstract: Hepatic hemangioma is one of the common benign tumors, which is treated with Chaihu Shugan Powder in clinical, but its specific mechanism of action is still unknown. In this study, network pharmacology and molecular docking methods were used to obtain the information of key targets and components through the analysis of the compositional target network diagram, and molecular docking of key targets and components was carried out to obtain the corresponding molecular docking map and explore the mechanism of action. A total of 142 ingredients of Chaihu Shugan Powder were obtained, and 61 targets were intersections with hepatic hemangioma. There were 184 biological processes for gene ontology (GO) functional enrichment, which mainly involving transcription factor activity, DNA binding, and positive regulation of transcription. 138 signaling pathways were identified by Kyoto encyclopedia of genes and genomes (KEGG) pathway enrichment analysis, which mainly involve PI3K-Akt signaling pathway, Hepatitis B signaling pathway, MAPK signaling pathway, and AGE-RAGE signaling pathway, etc. Molecular docking showed that AKT1 protein was stable with β-sitosterol, VEGFA protein was stable with quercetin and isorhamnetin, ESR1 and MAPK3 were stable with β-sitosterol and naringin, respectively. The mechanism of Chaihu Shugan Powder in the treatment of hepatic hemangioma may be related to inducing angiogenesis and protecting the activation of blood vessels and liver cells, in which active ingredients such as quercetin, isorhamnetin, β-sitosterol, kaempferol and naringin, through act on targets such as STAT3, AKT1, VEGFA, ESR1 and MAPK3, which has provided theoretical reference for clinical aplication.
Key words: Chaihu Shugan Powder; hepatic hemangioma; network pharmacology; molecular docking; signal pathway
(Acta Laser Biology Sinica, 2023, 32(2): 184-192)
肝血管瘤是临床上较为常见的良性肿瘤,发病率为0.4%~20.0%[1]。肝血管瘤又名肝癥瘕,属于中医学症瘕范畴,其病因常以气滞血瘀者较多见,或因饮食失节、水湿不化、脾虚失运、痰滞脉络与血气相结聚积而成症瘕[2]。目前,肝血管瘤的发病机制尚未完全清楚,一般认为是由异常的血管生成和促血管生成因子的增加引起的肝内血管生长异常[3]。西医常采取手术切除、肝动脉结扎和放射治疗等方法对此病进行治疗,但许多患者因惧怕手术常求治于中医。中医临床治疗则常以行气疏肝、活血化瘀、软坚散结为主[4]。柴胡疏肝散出自于《景岳全书》,处方为柴胡和陈皮各二钱,川芎、芍药、香附和枳壳各一钱半,炙甘草五分,具有活血止痛、疏肝行气的功效。方中柴胡具有调肝散结的作用,为君药;川芎行气开郁,活血化瘀,香附疏肝理气、解郁止痛,二者为臣药;佐以枳壳、陈皮行滞理气,白芍、甘草养血柔肝;甘草调和诸药,兼作使药。诸药合用,主治肝气郁结和气滞血瘀证[5-6]。临床研究发现,益气化瘀法中的经典方柴胡疏肝散对肝血管瘤具有良好的治疗效果,能够显著降低患者肝血管瘤的大小[7],但其治疗的作用机制及其物质基础仍是未知的。
中药网络药理学是从整体角度研究中药单药或复方对疾病的作用机制,通过构建中药成分-靶点-疾病的相互作用关系网络,揭示中药复方多成分、多靶点、多通路共协同治疗疾病的作用机理,为中药复方治疗疾病的物质基础和机制研究提供新的思路和方法[8]。分子对接技术能够反应一些小分子化合物与重要的相关蛋白的结合位点和结合能力,为小分子化合物在机体中的作用机制提供了良好的研究思路和方法[9]。为了进一步研究柴胡疏肝散治疗肝血管瘤的作用机制,本研究通过网络药理学和分子对接技术探究柴胡疏肝散的有效成分和作用靶点及其治疗肝血管瘤的调控机制,为临床上应用柴胡疏肝散治疗肝血管瘤提供理论研究依据。
1 材料与方法
1.1 鉴定柴胡疏肝散有效化合物作用靶点
根据口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug-likeness,DL) ≥0.18的标准,从中药系统药理学分析平台TCMSP[10](http://tcmspw.com/tcmsp.php)检索柴胡疏肝散(柴胡、陈皮、白芍、川芎、枳壳、香附、甘草)的有效化合物和蛋白靶点。筛选完成后,利用UniProt数据库(https://www.uniprot.org)将靶点转换为标准基因名称。
1.2 柴胡疏肝散治疗肝血管瘤的作用靶点
在GeneCards数据库(https://www. genecards.org)和OMIM数据库(http://www. omim.org)中,以“hepatic hemangioma”为关键词检索治疗肝血管瘤的潜在靶点。在Genecards数据库中,靶点与疾病的联系的密切性与Relevance score值成正相关,筛选Relevance score≥7的靶点,合并OMIM数据库靶点后删除重复值,得到肝血管瘤的作用靶点,将肝血管瘤蛋白靶点与柴胡疏肝散作用靶点利用在线网站venny2.1进行交集,得到柴胡疏肝散治疗肝血管瘤的关键作用靶点。
1.3 构建柴胡疏肝散活性成分与靶点网络
利用Cytoscape 3.8.2软件导入柴胡疏肝散有效成分和靶点及肝血管瘤疾病的相关靶点信息,构建柴胡疏肝散治疗肝血管瘤的“中药-成分-靶点-疾病”网络图,然后利用CytoHubba插件分析网络特征,利用“Analyze Network”的分析功能得出柴胡舒肝散治疗肝血管瘤的重要活性成分。
1.4 构建柴胡疏肝散治疗肝血管瘤蛋白质-蛋白质相互作用(PPI)网络
将柴胡疏肝散治疗肝血管瘤的作用靶点导入STRING数据库(https://stringdb.org/),选择物种为“Homo sapiens”,获得交集蛋白靶点互作信息。将蛋白互作信息导入Cytoscape 3.8.2软件构建蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络,并进行拓扑分析,筛选核心作用靶点。
1.5 基因本体(GO)功能富集分析和京都基因和基因组百科全书(KEGG)通路富集分析
利用DAVID平台(https://david. ncifcrf. gov)输入柴胡疏肝散与肝血管瘤作用所得的交集靶点,对将柴胡疏肝散与肝血管瘤的相互作用靶点基因进行基因本体(gene ontology,GO)功能分析[如生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞成分(cellular component,CC)分析],以P<0.05为筛选条件,取排名前20的条目绘制气泡图。同时进行京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,以P<0.05为显著富集筛选条件,得到柴胡疏肝散治疗肝血管瘤的主要作用通路。根据P<0.05,选择排名前20的信号通路绘制气泡图。
1.6 分子对接
从Protein Data Bank中下载拓扑分析中排名前5的核心蛋白,使用AutoDock Tools 1.5.7软件对蛋白质进行去水、氢化等处理。在TCMSP数据库中根据柴胡舒肝散药物成分,通过Pubchem(https://pubchem. ncbi. nlm. nih. gov/)检索InChIKey,获得药物活性成分3D结构的SDF格式,使用OpenBabel 2.4.1进行mol2的格式转换[11]。将处理好的蛋白质与活性成分通过AutoDock Vina进行分子对接,利用Pymol 2.8.0对结果进行分析及可视化分析和处理。
2 结果与分析
2.1 柴胡疏肝散有效成分收集及靶点预测
通过TCMSP平台检索,以OB≥30%、DL≥0.18为标准筛选出有效成分160个,其中柴胡17个、陈皮5个、白芍14个、川芎8个、枳壳5个、香附19个、甘草92个。本方以柴胡为君药,香附、川芎为臣药,陈皮、枳壳、芍药、甘草均为佐药,经筛选合并重复成分后,共得到142种主要有效成分。通过检索TCMSP平台成功得到药物靶标,其中柴胡348个、陈皮95个、枳壳123个、川芎42个、香附465个、白芍389个、甘草1 764个,删除靶点重复项后,最终得到269个药物靶点。在柴胡疏肝散中部分化合物成分信息见表1。
2.2 肝血管瘤疾病相关靶点与柴胡疏肝散作用靶点的筛选
通过数据库筛选共得到351个肝血管瘤相关靶点。与柴胡疏肝散作用物靶点进行交集,最终获得61个柴胡疏肝散作用于肝血管瘤的靶点(图1)。
2.3 柴胡疏肝散成分与靶点的网络构建及分析
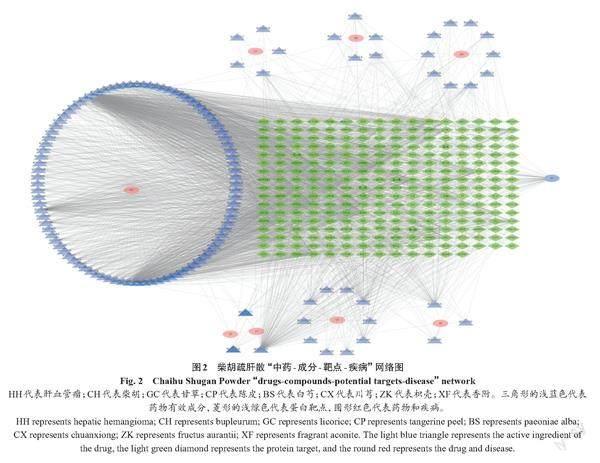
通过Cytoscape 3.8.2软件构建“中药-成分-靶点-疾病”网络图(图2)。网络图中可以直观地展示具体节点的拓扑学特征,也可以表现生物交互作用的一般特征。该图共有142个药物活性成分、61个交集靶点、7个药物名称和1个疾病名称,表明柴胡疏肝散中有142个有效成分作用于肝血管瘤的靶点。
2.4 柴胡疏肝散治疗肝血管瘤的关键靶蛋白
将数据导入Cytoscape软件中构建网络图,使用CytoHubba插件,选择最大集团中心度(maximal clique centrality,MCC)方式进行核心靶点的提取,根据MCC score提取前10的靶点,它们分别是信号传导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)、蛋白激酶1(serine/threonine kinase 1,AKT1)、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、雌激素受体1(estrogen receptor 1,ESR1)、丝裂原活化蛋白激酶3(mitogen activated protein kinases 3,MAPK3)、表皮生长因子受体(epithelial growth factor receptor,EGFR)、肿瘤坏死因子(tumor necrosis factor,TNF)、白细胞介素-6(interleukin-6,IL-6)、肿瘤抑制因子p53(cell tumor antigen p53,TP53)、過氧化物酶体增殖物激活受体γ(peroxisome proliferater activated receptor gama,PPARG)(图3)。这10个靶蛋白可能就是柴胡疏肝散治疗肝血管瘤的关键靶蛋白。
2.5 柴胡疏肝散治疗肝血管瘤关键靶点的GO
与KEGG富集分析
GO分析共富集到184条生物学过程,其中BP为126条,CC为25条,MF为33条。KEGG通路富集分析共涉及138条信号通路。运用Omicshare在线工具,以P<0.05为阈值,对富集基因进行筛选,绘制富集气泡图。GO分析结果显示,MF生物学过程主要包括转录因子活性、DNA结合、RNA聚合酶II核心启动子近端区序列特异性DNA结合等条目;CC生物学过程主要包括核、细胞质、质膜的组成部分、核浆等条目;BP生物学过程主要包括转录的正向调控、RNA聚合酶II启动子转录的负调控、蛋白激酶B信号的正向调控等条目(图4a)。 KEGG通路富集结果显示,Top 20信号通路中主要包括人类巨细胞病毒感染、癌症蛋白聚糖、PI3K-Akt信号通路、脂质和动脉粥样硬化、乙型肝炎、MAPK信号通路、AGE-RAGE信号通路等(图4b)。这说明,柴胡疏肝散可以通过多靶点多通路协调作用,从而发挥治疗肝血管瘤的功效。
2.6 柴胡疏肝散部分活性成分与关键靶点的分子对接结果
网络图中度值排名前5的化合物分别是槲皮素、山奈酚、β-谷甾醇、柚皮素和异鼠李素。将这些化合物与拓扑分析中排名前5的核心蛋白的晶体结构进行分子对接,若结合能<-5 kJ/mol,表明两者具有较好的结合能力,结合结果如表2所示。分别将5个靶点所对应结合能最高的化合物的分子对接结果进行2D图展示,其中,β-谷甾醇能够与AKT1的191号谷氨酸残基结合,且结合能为-7.81 kJ/mol。此外,β-谷甾醇还能与ESR1具有较好的结合,其主要作用力为氢键和疏水作用。槲皮素与VEGFA的32位亮氨酸残基具有良好的结合,且结合能为-6.21 kJ/mol,其主要作用力为离子键和疏水作用。异鼠李素与VEGFA的第50位苏氨酸残基具有良好的结合,且结合能为-6.74 kJ/mol,其主要作用力为离子键和氢键作用。柚皮素与STAT3的第438位亮氨酸残基和第370位的赖氨酸残基均具有良好的结合,且结合能为-5.83 kJ/mol,其主要作用力为离子键和疏水作用。山奈酚与MAPK3的第125位的甲硫氨酸残基和第131位的赖氨酸残基均具有良好的结合,且结合能为-6.42 kJ/mol,其主要作用力为离子键和疏水作用(图5)。
3 讨论
柴胡疏肝散具有疏肝理气、活血化瘀的功效,临床上常用于治疗心血管疾病、阿尔茨海默症、功能性消化不良以及妇科类疾病[12-14]。临床研究发现,柴胡疏肝散可通过调节IRE-1α/NF-κB通路抑制过度的内质网应激来调节肝脏脂质代谢紊乱,减轻肝脏炎性反应,防止非酒精性脂肪性肝炎(non-alcoholic fatty liver disease,NAFLD)的进展[15]。柴胡疏肝散已广泛应用于肝脏疾病的治疗。为了深入研究柴胡疏肝散治疗肝血管瘤的作用机制,本研究采用网络药理学和分子对接方法,借助多个数据库收集,得到柴胡疏肝散中142个成分和其对应的269个靶点,根据OB和DL参数筛选出61个靶点与肝血管瘤相关。
本研究通过“中药-成分-靶点-疾病”相互作用网络分析发现,槲皮素、山奈酚、β-谷甾醇、柚皮素和异鼠李素有较高的度值,其中槲皮素的度值最高,其主要来自柴胡、香附和甘草3味药材。在肝脏疾病领域,槲皮素对肝脏具有清除自由基、抗氧化、抗乙肝病毒、抗肝癌、抗肝纤维化、保护肝损伤等药理作用,是许多治疗肝脏疾病中药材的有效活性成分[16]。研究发现,槲皮素可通过上调IL-10和HO-1的表达抑制NLRP3炎症小体激活和炎症因子的分泌,进而发挥对急性酒精性肝损伤的保护作用[17]。柴胡、白芍、香附、甘草4味药材中均含有山奈酚。山奈酚对四氯化碳引起的小鼠急性肝损伤具有保护作用,可显著缩小肝细胞坏死和炎症细胞浸润的范围并降低其对细胞的损害程度[18]。β-谷甾醇是柴胡疏肝散中白芍和枳壳2味药材均含有的成分,研究表明,β-谷甾醇能抑制血清中酒精引起的生化指标的变化,减轻酒精引起的氧化应激,减少谷胱甘肽消耗,恢复红细胞膜的流动性和抗氧化酶活性,减少丙二醛的过度产生,还可以通过PI3K/Akt通路下调凋亡相关基因的表达[19]。柚皮素能够改善氧化应激和胰岛素抵抗,减少炎症反应,调节脂质代谢、脂肪酸氧化,减少细胞凋亡,在肥胖症和NAFLD的治疗方面具有显著的药理作用[20]。异鼠李素是从天然植物中提取的一种黄酮物质,现有研究表明,其具有良好的抗氧化、抗炎、保肝等作用[21]。
本研究通过PPI网络拓扑学分析发现,排名前5位的核心靶点分别为STAT3、AKT1、VEGFA、ESR1、MAPK3。在肝细胞中,STAT3可促进肝细胞再生,有助于肝脏的修复,但是STAT3的过表达会导致肝血管的过度增生,诱导肝血管内皮细胞活化异常,诱发肝脏癌变[22]。AKT1参与调节机体细胞增殖、凋亡以及血管生成等多个生理生化过程。AKT1的缺失可完全阻止小鼠诱导的肝细胞癌形成,调节AKT1诱导血管新生,保护血管,从而改善肝血管瘤[23-24]。而VEGFR作为血管生成的重要调控因子,在肝血管瘤中具有重要的作用。VEGFR通路可能是肝血管瘤的最佳治疗靶点[25-26]。ESR1是一种蛋白质编码基因,与其相关的疾病包括雌激素抵抗和乳腺癌[27]。临床发现,女性较男性发病率高的原因是女性雌激素分泌过过多会导致肝脏雌激素异常,从而导致肝血管瘤的发生[28]。从KEGG通路富集中可知,柴胡疏肝散治疗肝血管瘤可能通过PI3K-Akt、乙型肝炎、MAPK等关键通路发挥作用。通过分子对接技术发现,β-谷甾醇、异鼠李素、山奈酚、柚皮素和槲皮素能够与STAT3具有较好的结合能力,在肝细胞中,STAT3的過表达会导致肝血管过度增生,诱导肝血管内皮细胞活化异常,诱发肝脏癌变[29]。因此我们推测,β-谷甾醇、异鼠李素、山奈酚、柚皮素和槲皮素能够调控STAT3的表达,进而抑制肝血管的内皮细胞活化异常。槲皮素、异鼠李素、β-谷甾醇、柚皮素和山奈酚均能够与VEGFR蛋白具有较好的结合能力。VEGFR作为生长因子诱导血管内皮细胞的增殖和迁移,是生理和病理血管生成所必需的[30]。在肝血管瘤的研究中,有学者认为,血管瘤的增生是由血管膨胀、扩张以及血管内皮细胞增生异常导致的[4,31-32]。因此我们推测,柴胡疏肝散可能通过槲皮素、异鼠李素、β-谷甾醇和柚皮素调控VEGFR通路抑制肝血管瘤的增生,进而改善肝血管瘤。β-谷甾醇与ESR1具有良好的结合位点,因此我们推测,在治疗肝血管瘤的过程中,柴胡疏肝散可能通过β-谷甾醇等小分子化合物调控ESR1相关通路,进而改善肝血管瘤。此外,β-谷甾醇、山奈酚、异鼠李素、柚皮素和槲皮素均与MAPK3具有良好的结合位点和能力,而β-谷甾醇、异鼠李素、槲皮素、柚皮素和山奈酚均能够很好地结合AKT1。在肝血管瘤研究中,PI3K-Akt和MAPK信号通路在肝血管瘤的发生和发展过程中具有重要的作用。MAPK信号通路可通过调控肝血管内皮细胞的增殖和分化来调控肝细胞和肝血管内皮细胞的生长发育;MAPK3在肝细胞的增殖、迁移和侵袭中具有重要的作用[33]。因此我们推测,柴胡疏肝散可能通过山奈酚、柚皮素、异鼠李素和β-谷甾醇等小分子化合物调控PI3K-Akt和MAPK信号通路,促进肝细胞以及肝血管内皮细胞的增殖和分化,进而达到改善肝血管瘤的目的。
综上所述,本研究利用网络药理学和分子对接技术,初步探讨了柴胡疏肝散多成分、多靶点、多通路协同增效治疗肝血管瘤的作用机制。柴胡疏肝散可能是通过槲皮素、异鼠李素、β-谷甾醇、山柰酚和柚皮素等活性成分作用于STAT3、AKT1、VEGFA、ESR1、MAPK3等靶点来参与多通路的调控,通过诱导血管新生、保护血管和肝细胞的活化等发挥治疗肝血管瘤的作用。该研究为柴胡疏肝散治疗肝血管瘤的相关靶点及通路的进一步验证、柴胡疏肝散新功能的发现以及治疗肝血管瘤新药的开发提供了一定的参考依据,同时为深入开发柴胡疏肝散提供了方法学支撑,也为后续的基础机制研究奠定了基础。但本研究仅从网络药理学和分子对接层面来探究柴胡疏肝散抗肝血管瘤作用的有效活性成分及作用靶点,存在一定的局限,因此,在后续的研究中将进行分子生物学验证,并结合体内外试验进行进一步的验证。
参考文献(References):
[1] 王学军, 胡 晟, 陈轶晖, 等. 肝血管瘤治疗研究进展[J]. 现代医药卫生, 2022, 38(16): 2808-2813.
WANG Xuejun, HU Sheng, CHEN Yihui, et al. Advances in the treatment of hepatic hemangioma [J]. Modern Medicine & Hygiene, 2022, 38(16): 2808-2813.
[2] 关利君, 马和平, 张学军. 肝血管瘤的临床治疗进展[J]. 内蒙古医学杂志, 2008, 4(4): 454-456.
GUAN Lijun, MA Heping, ZHANG Xuejun. Clinical progress in the treatment of hepatic hemangioma [J]. Inner Mongolia Medical Journal, 2008, 4(4): 454-456.
[3] 黄纪伟, 朱则昕, 廖明恒, 等. 肝血管瘤的诊疗现状[J]. 中国普外基础与临床杂志, 2016, 23(2): 143-146.
HUANG Jiwei, ZHU Zexin, LIAO Mingheng, et al. Diagnosis and treatment of hepatic hemangioma [J]. Chinese Journal of General Surgery Basic and Clinical, 2016, 23(2): 143-146.
[4] 陈孝平, 夏 锋, 李雪松. 肝血管瘤诊断和治疗多学科专家共识 (2019版)[J]. 临床肝胆病杂志, 2019, 35(9): 1928-1932.
CHEN Xiaoping, XIA Feng, LI Xuesong. Multidisciplinary expert consensus on diagnosis and treatment of hepatic hemangioma (2019 edition)[J]. Journal of Clinical Hepatobiliary Diseases, 2019, 35(9): 1928-1932.
[5] 倪新强, 曹美群, 吴正治, 等. 柴胡疏肝散的化学成分和药理作用研究进展[J]. 上海中医药杂志, 2017, 51(9): 109-113.
NI Xinqiang, CAO Meiqun, WU Zhengzhi, et al. Research progress on chemical constituents and pharmacological effects of Chaihu Shugan Powder [J]. Shanghai Journal of Traditional Chinese Medicine, 2017, 51(9): 109-113.
[6] 张宏武, 邹忠梅. 柴胡疏肝散的临床应用及现代研究进展[J]. 时珍国医国药, 2007, 140(5): 1234-1236.
ZHANG Hongwu, ZOU Zhongmei. Clinical application and modern research progress of Chaihu Shugan Powder [J]. Lishzhen Medicine and Materia Medica Research, 2007, 140(5): 1234-1236.
[7] 胡子生. 疏肝化瘀散结汤治疗肝血管瘤7例[J]. 湖北中医杂志, 1995, 3(3): 38.
HU Zisheng. Treatment of 7 cases of hepatic hemangioma with Shuggan Huayu Sanjie Decoction [J]. Hubei Journal of Traditional Chinese Medicine, 1995, 3(3): 38.
[8] LUO T, LU Y, YAN S, et al. Network pharmacology in research of Chinese medicine formula: methodology, application and prospective [J]. Chinese Journal of Integrative Medicine, 2019, 26(1): 72-80.
[9] SAIKIA S, BORDOLOI M. Molecular docking: challenges, advances and its use in drug discovery perspective [J]. Current Drug Targets, 2019, 20(5): 501-521.
[10] RU J, LI P, WANG J, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines [J]. Journal of Cheminformatics, 2014, 16(6): 13.
[11] LIU W, FAN Y, TIAN C, et al. Deciphering the molecular targets and mechanisms of HGWD in the treatment of rheumatoid arthritis via network pharmacology and molecular docking[J]. Evidence-based Complementary and Alternative Medicine, 2020, 26: 7151634.
[12] 張 喆, 赵静洁, 王永志, 等. 柴胡疏肝散药理作用及机制研究进展[J]. 中国中医药信息杂志, 2017, 24(9): 128-131.
ZHANG Zhe, ZHAO Jingjie, WANG Yongzhi, et al. Advances in pharmacological action and mechanism of Chaihu Shugan Powder[J]. China Information Journal of Traditional Chinese Medicine, 2017, 24(9): 128-131.
[13] 梁瀞云, 唐 燕, 司马玲, 等.柴胡疏肝散在肝脏疾病中的应用研究进展[J]. 陕西中医, 2022, 43(11): 1651-1653.
LIANG Jingyun, TANG Yan, SIMA Ling, et al. Application of Chaihu Shugan Powder in liver diseases [J]. Shaanxi Journal of Traditional Chinese Medicine, 2022, 43(11): 1651-1653.
[14] 谭奚扬, 陈晓云, 谈欣怡, 等. 柴胡疏肝散治疗代谢相关脂肪性肝病的网络机制研究[J]. 世界科学技术-中医药现代化, 2021, 23(11): 4058-4071.
TAN Xiyang, CHEN Xiaoyun, TAN Xinyi, et al. Study on network mechanism of Chaihu Shugan Powder in the treatment of metabolism-related fatty liver disease [J]. World Science and Technology-Modernization of Traditional Chinese Medicine, 2021, 23(11): 4058-4071.
[15] 白 钰, 陈永灿, 赵 乐, 等. 柴胡疏肝散对非酒精性脂肪性肝炎大鼠肝脏IRE-1α/NF-κB通路的影响[J]. 中华中医药杂志, 2018, 33(6): 2592-2596.
BAI Yu, CHEN Yongcan, ZHAO Le, et al. Effect of Chaihu Shugan Powder on IRE-1α/NF-κB pathway in liver of rats with nonalcoholic steatohepatitis [J]. Chinese Journal of Traditional Chinese Medicine, 2018, 33(6): 2592-2596.
[16] 张 娟, 毛文静, 白庆云. 槲皮素及其衍生物防治肝损伤作用及机制的研究进展[J]. 中草药, 2021, 52(23): 7348-7357.
ZHANG Juan, MAO Wenjin, BAI Qinyun. Research progress on the effect and mechanism of quercetin and its derivatives in preventing and treating liver injury [J]. Chinese Herbal Medicine, 2021, 52(23): 7348-7357.
[17] LIU S, TIAN L, CHAI G, et al. Targeting heme oxygenase-1 by quercetin ameliorates alcohol-induced acute liver injury via inhibiting NLRP3 inflammasome activation [J]. Food & Function, 2018, 9(8): 4184-4193.
[18] 童方念, 罗 超, 罗 丹, 等. 山奈酚对四氯化碳致小鼠急性肝损伤的保护作用[J]. 西安交通大学学报 (医学版), 2014, 35(6): 816-819.
TONG Fannian, LUO Chao, LUO Dan, et al. Protective effect of kaferol on acute liver injury induced by carbon tetrachloride in mice [J]. Journal of Xian Jiaotong University (Medical Edition), 2014, 35(6): 816-819.
[19] CHEN Z, WU A, JIN H, et al. β-Sitosterol attenuates liver injury in a rat model of chronic alcohol intake [J]. Archives of Pharmacal Research, 2020, 43(11): 1197-1206.
[20] 季 鵬, 赵文明, 于 桐. 柚皮素的最新研究进展[J]. 中国新药杂志, 2015, 24(12): 1382-1386, 1392.
JI Peng, ZHAO Wenming, YU Tong. Recent research progress of naringin [J]. Chinese Journal of New Medicine, 2015, 24(12): 1382-1386, 1392.
[21] 滕 丹, 栾新尧. 异鼠李素的药效学研究进展[J]. 中医药临床杂志, 2016, 28(4): 593-596.
TENG Dan, LUAN Xinyao. Research progress on pharmacodynamics of isorhamnetin [J]. Clinical Journal of Traditional Chinese Medicine, 2016, 28(4): 593-596.
[22] XIONG J, WANG C, CHEN H, et al. Aβ-induced microglial cell activation is inhibited by baicalin through the JAK2/STAT3 signaling pathway [J]. International Journal of Neuroscience, 2014, 124(8): 609-620.
[23] XU Z, XU M, LIU P, et al. The mTORC2-Akt1 cascade is crucial for c-Myc to promote hepatocarcinogenesis in mice and humans[J]. Hepatology, 2019, 70(5): 1600-1613.
[24] KOU K, CHEN Y, ZHOU J, et al. Hepatic epithelioid hemangioendothelioma: update on diagnosis and therapy [J]. World Journal of Clinical Cases, 2020, 8(18): 3978-3987.
[25] MELINCOVICI C S, BOSCA A B, ?U?MAN S, et al. Vascular endothelial growth factor (VEGF) - key factor in normal and pathological angiogenesis [J]. Romanian Journal of Morphology and Embryology, 2018, 59(2): 455-467.
[26] TELLI T A, OKTEN I N, TUYLU T B, et al. VEGF-VEGFR pathway seems to be the best target in hepatic epithelioid hemangioendothelioma: a case series with review of the literature [J]. Current Problems in Cancer, 2020, 44(5):100568.
[27] ZHENG L,WEN X, DAI Y. Mechanism of Jianpi Qingchang Huashi Recipe in treating ulcerative colitis: a study based on network pharmacology and molecular docking [J]. World Journal of Clinical Cases, 2021, 9(26): 7653-7670.
[28] LEON M, CHAVEZ L, SURANI S. Hepatic hemangioma: what internists need to know [J]. World Journal of Gastroenterology, 2020, 26(1): 11-20.
[29] ZHAO J, QI Y, YU Y. STAT3: a key regulator in liver fibrosis [J]. Annals of Hepatology, 2021, 21: 100224.
[30] WALLACE S J, TACKE F, SCHWABE R F, et al. Understanding the cellular interactome of non-alcoholic fatty liver disease [J]. JHEP Reports : Innovation in Hepatology, 2022, 4(8): 100524.
[31] 张宗利, 黄建成, 王庆良, 等. 152例肝血管瘤的臨床治疗分析[J]. 中国现代普通外科进展, 2011, 14(4): 281-285.
ZHANG Zongli, HUANG Jiangcheng, WANG Qinglian, et al. Clinical analysis of 152 cases of hepatic hemangioma [J]. Advances in Chinese Modern General Surgery, 2011, 14(4): 281-285.
[32] FANG Y, YAN D, WANG L, et al. Circulating microRNAs (miR-16, miR-22, miR-122) expression and early diagnosis of hepatocellular carcinoma [J]. Journal of Clinical Laboratory Analysis, 2022, 36(7): e24541.
[33] KASSOUF T, SUMARA G. Impact of conventional and atypical MAPKs on the development of metabolic diseases[J]. Biomolecules, 2020, 10(9): 1256.
收稿日期:2022-12-12;修回日期:2022-12-30。
基金项目:国家自然科学基金项目(82160167);贵州省科技计划项目(黔科合基础-ZK[2022]一般509);贵州省卫健委项目(gzwkj2022258);贵中医博士启动基金项目(3043-043200006,3043-043190090)。
作者简介:冯玲,讲师,主要从事中药资源方面的研究。
* 通信作者:张永勤,讲师,主要从事中西医结合基础及自身免疫性疾病防治方面的研究。E-mail: zhangyongqin044@gzy.edu.cn。

