北沙参化学成分、药理作用研究进展及质量标志物(Q-Marker)预测
安 莹,张姗姗,张 云,刘可春,王荣春,周洪雷,夏 青*
1.山东中医药大学药学院,山东 济南 250355
2.齐鲁工业大学(山东省科学院),山东省科学院生物研究所,山东 济南 250103
北沙参GlehniaeRadix为伞形科植物珊瑚菜GlehnialittoralisFr.Schmidt ex Miq.的根,分布在中国河北、山东、江苏、浙江、福建、台湾等地,当前主产区为内蒙古、河北和山东[1]。北沙参是山东的道地药材,又名“莱阳参”“莱胡参”,属于临床常用中药,具有滋阴润肺、益胃生津的功效,用于胃阴不足、肺热燥咳、虚痨久咳、阴伤咽干、口渴等症[2]。《中药大辞典》记载北沙参“以根条细长、均匀色白、质坚实者佳”[3]。目前《中国药典》2020年版仅收录了性状和鉴别项,缺少特异性质量控制指标,急需提升和完善其质量标准。
中药成分复杂,影响其质量的因素多样,建立“化学成分-生物效应-功能主治”相关联的多元化质量控制体系,对提升中药质量标准和临床用药有效性、安全性具有重要意义[4]。刘昌孝院士[5-6]提出中药质量标志物(quality marker,Q-Marker)的概念,进一步将中药质量控制与其安全性、有效性紧密联系。本文通过收集北沙参相关文献并利用文献计量学方法对其进行分析,将发文量、作者国家、各国合作强度和关键词进行可视化。结合文献调研系统综述北沙参化学成分及药理作用研究进展。利用网络药理学方法预测分析北沙参有效成分,构建北沙参“成分-靶点-通路”网络图。结合中药Q-Marker理论,从植物亲缘学、传统药性和药效相关性、化学成分特有性、有效性、可测性等方面,预测其Q-Marker,为提升北沙参质量标准提供理论参考,促进北沙参的开发利用。
1 基于文献计量学的北沙参研究概况
北沙参主要分布于北太平洋沿岸,如中国、日本等[7]。在Web of Science 中以“Glehnialittoralis”为检索词,时间截至2023 年8 月,搜集到与北沙参相关英文文献112 篇,选择全记录与引用的参考文献选项,导出到VOSviewer version 1.6.19 软件,选择“Co- authorship”项下的“Countries”,设置一个国家的最小发文量为1,结果显示我国是研究北沙参最多的国家,发文量50 篇,其次是韩国34 篇和日本28 篇,且各个国家的合作强度较低,多是国内合作,这与北沙参在全球的分布和在这些国家的使用率也相关。同时选择“Co-occurrence”项下的“All keywords”,设置英文文献关键词出现的最小频次为4 次,得到36 个节点,图1-A 显示出现最多的关键词包括Glehnialittoralis(北沙参,72次)、constituents(化学成分,15 次)、furanocoumarin(呋喃香豆素,14 次)、antioxidant(抗氧化,13 次)、Apiaceae(伞形科,9 次)、coumarins(香豆素,8 次)等。
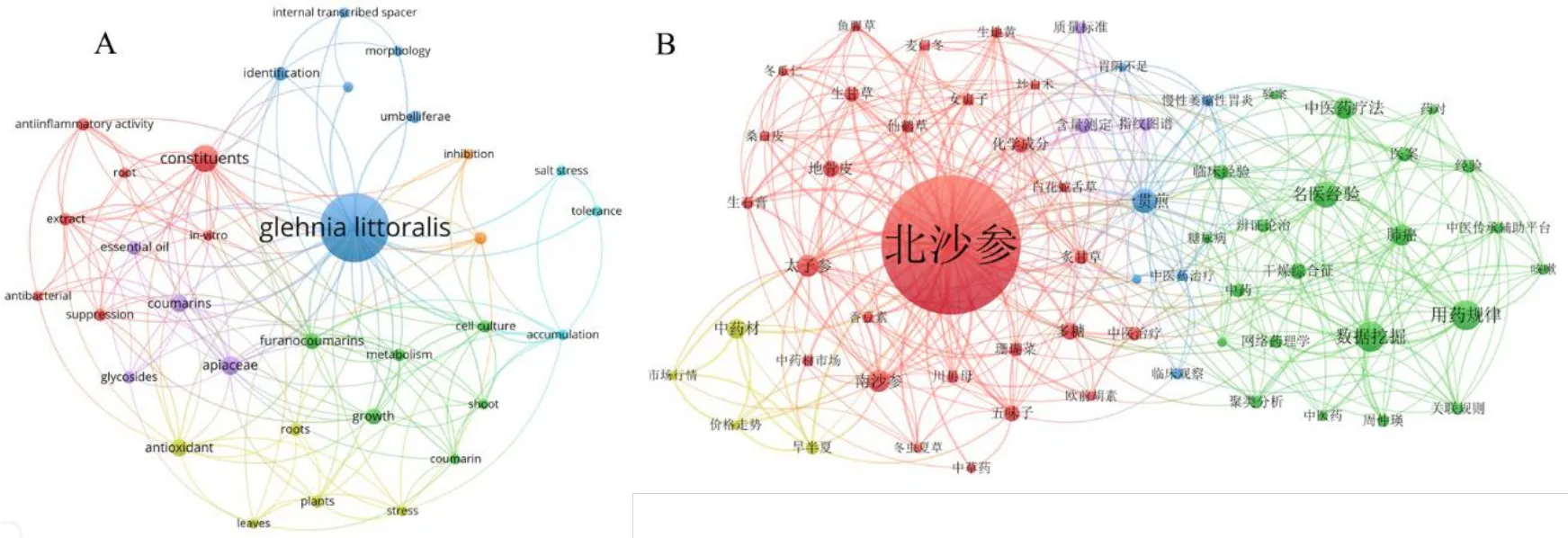
图1 北沙参英文文献(A)和中文文献(B)关键词共现Fig.1 Keywords co-occurrence of English literature (A) and Chinese literature (B) of Glehniae Radix
在中国知网数据库中,以“北沙参”为检索词,截至2023 年8 月,共收集文献2 365 篇。选择Refworks格式导出到VOSviewer version 1.6.19 软件中,选择“Co-occurrence”项下“keywords”,设置中文文献关键词出现的最小频次为15,共得到62个中文关键词,图1-B 显示北沙参(1 107 次)、数据挖掘(103 次)、用药规律(97 次)、一贯煎(72次)、南沙参(62 次)、肺癌(55 次)、多糖(41 次)等关键词出现频次较高。由文献计量学分析结果可知,北沙参当前研究多集中于其中医临床应用、含北沙参的中药方剂、北沙参多糖、北沙参香豆素类成分等。北沙参的药理作用机制、药动学、质量控制等研究不够深入,仍需进一步的研究。
2 北沙参化学成分研究
本文综合文献调研结果对北沙参化学成分进行了整理。共整理得到170 个化合物,包括多糖、香豆素类、聚乙炔类、木脂素类、萜类、黄酮类等[8]。其中多糖含量最高,香豆素类成分种类最丰富。
2.1 多糖类
北沙参中多糖成分含量最高,其总糖含量达70%以上[9]。高效液相色谱(high performance liquid chromatography,HPLC)显示北沙参多糖中的单糖主要包括甘露糖、葡萄糖、半乳糖、阿拉伯糖、半乳糖醛酸和鼠李糖[10]。据报道,北沙参多糖有免疫调节、抗肿瘤、抗氧化等活性[11-12]。目前对北沙参多糖的研究多为提取工艺优化和免疫调节药理活性方面,对多糖的分离纯化和结构鉴定研究较少。目前报道的多糖组分共18 个,见表1。
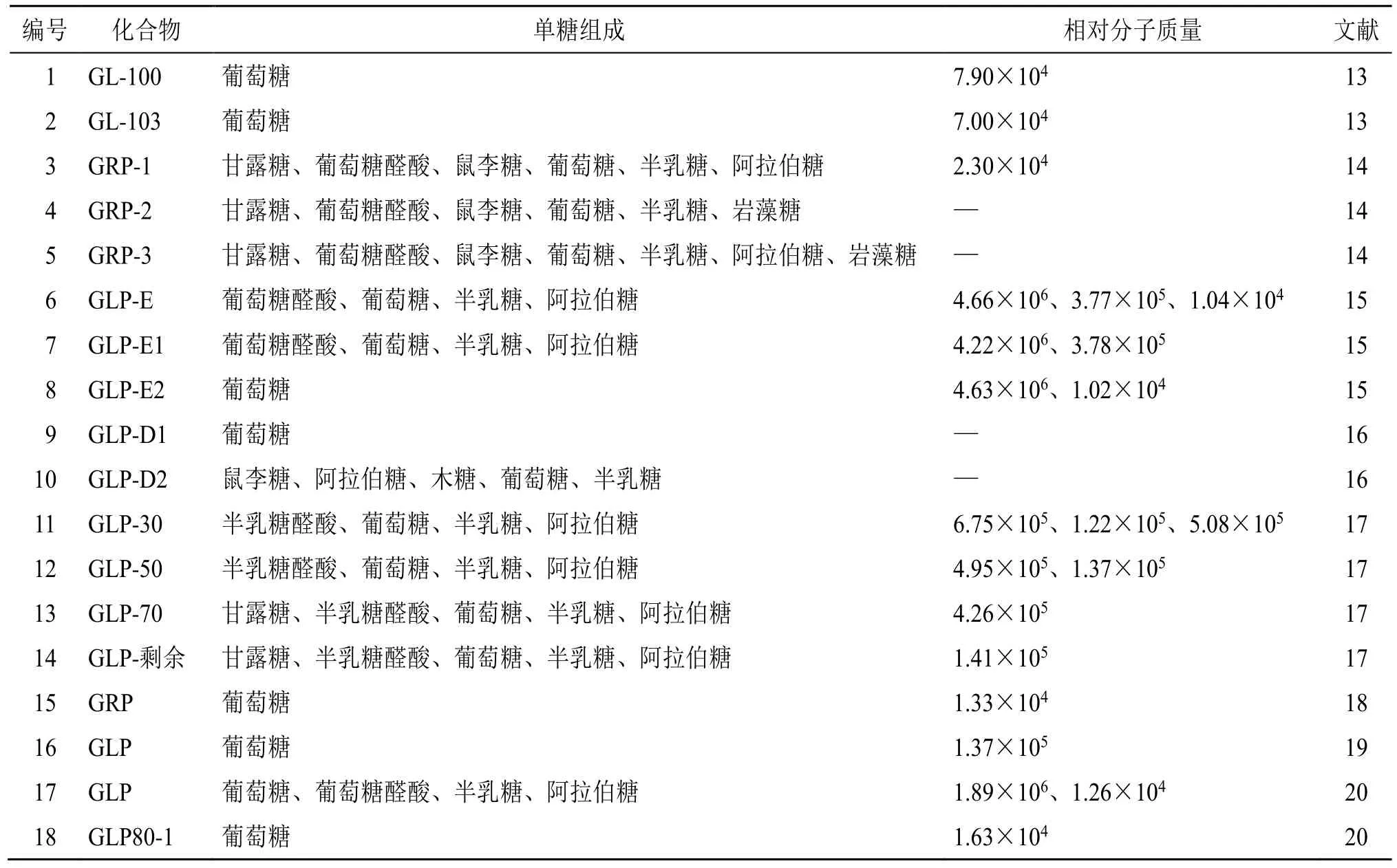
表1 北沙参中的多糖类成分Table 1 Polysaccharides in Glehniae Radix
2.2 香豆素类
香豆素类化合物基本母核为苯骈α 吡喃酮,是伞形科植物的特征性成分之一,也是北沙参的主要活性成分,具有抗炎、镇痛、抗肿瘤、抗菌等活性[21-22]。北沙参中香豆素类成分种类丰富。Kitajima等[23]从北沙参甲醇提取物中分离得到12个香豆素类化合物,其中有8 个新化合物(40~47),分别被鉴定为 (S)-白花前胡醇、(S)-7-O-白花前胡醇、异紫花前胡香豆素衍生物。赵亚等[24]从北沙参醇提物的水溶性部位分离得到1 个新化合物,经多种波谱技术鉴定为香柠檬酚5-O-β-D-龙胆二糖苷(62)。结合文献,共整理得到北沙参香豆素类化合物44 个,见表2。

表2 北沙参中的香豆素类化学成分Table 2 Coumarins in Glehniae Radix
2.3 聚乙炔类
聚乙炔类化合物是一类具有碳碳3 键结构的低极性化合物,主要分布在伞形科、五加科等[39]。北沙参中发现的聚乙炔类化合物主要有法卡林二醇(63)[27]、人参炔醇[28]、镰叶芹醇[40]、人参二醇(66~68)[41]等。见表3。
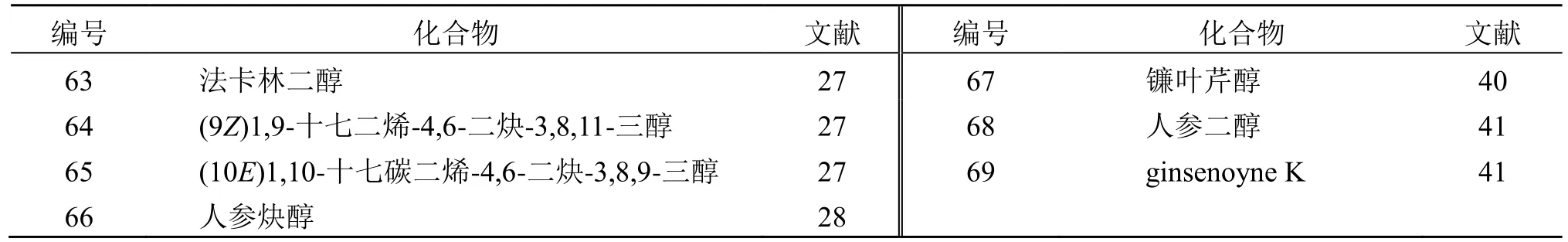
表3 北沙参中聚乙炔类化学成分Table 3 Polyacetylenes in Glehniae Radix
2.4 木脂素类
北沙参中共鉴定出木脂素类化合物16 个。主要包括可来灵素A~J 和裂异落叶松脂醇及其衍生物[21,42]。见表4。
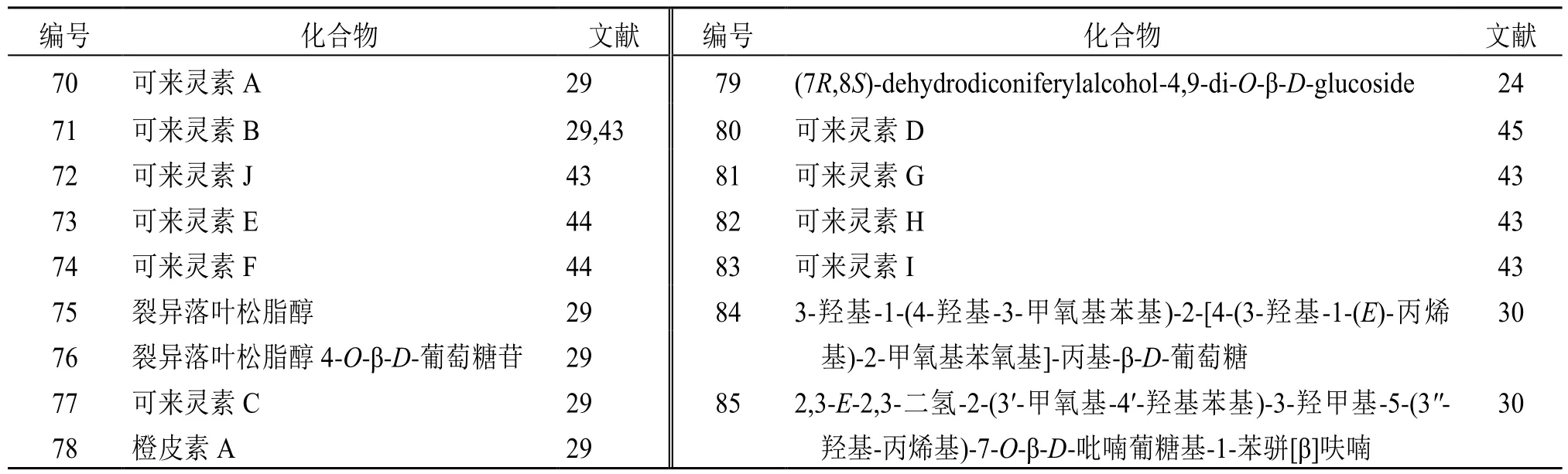
表4 北沙参中木脂素类化学成分Table 4 Lignans in Glehniae Radix
2.5 萜类和甾体类
目前研究发现北沙参中主要含有单萜类化合物。Kitajima 等[46]从北沙参中共分离得到9 个单萜苷类化合物,其中化合物86~90 为新化合物。此外,Kitajima 等[34]还发现1 个新的半萜化合物(95)。Ishikawa 等[31]从北沙参中分离得到4 个单萜类化合物(98~101)。甾体类化合物主要有谷甾醇[26]、豆甾醇[33]、豆甾醇葡萄糖苷[33]、胡萝卜苷[48]、赛勒维甾醇[47](105~109)等。见表5。
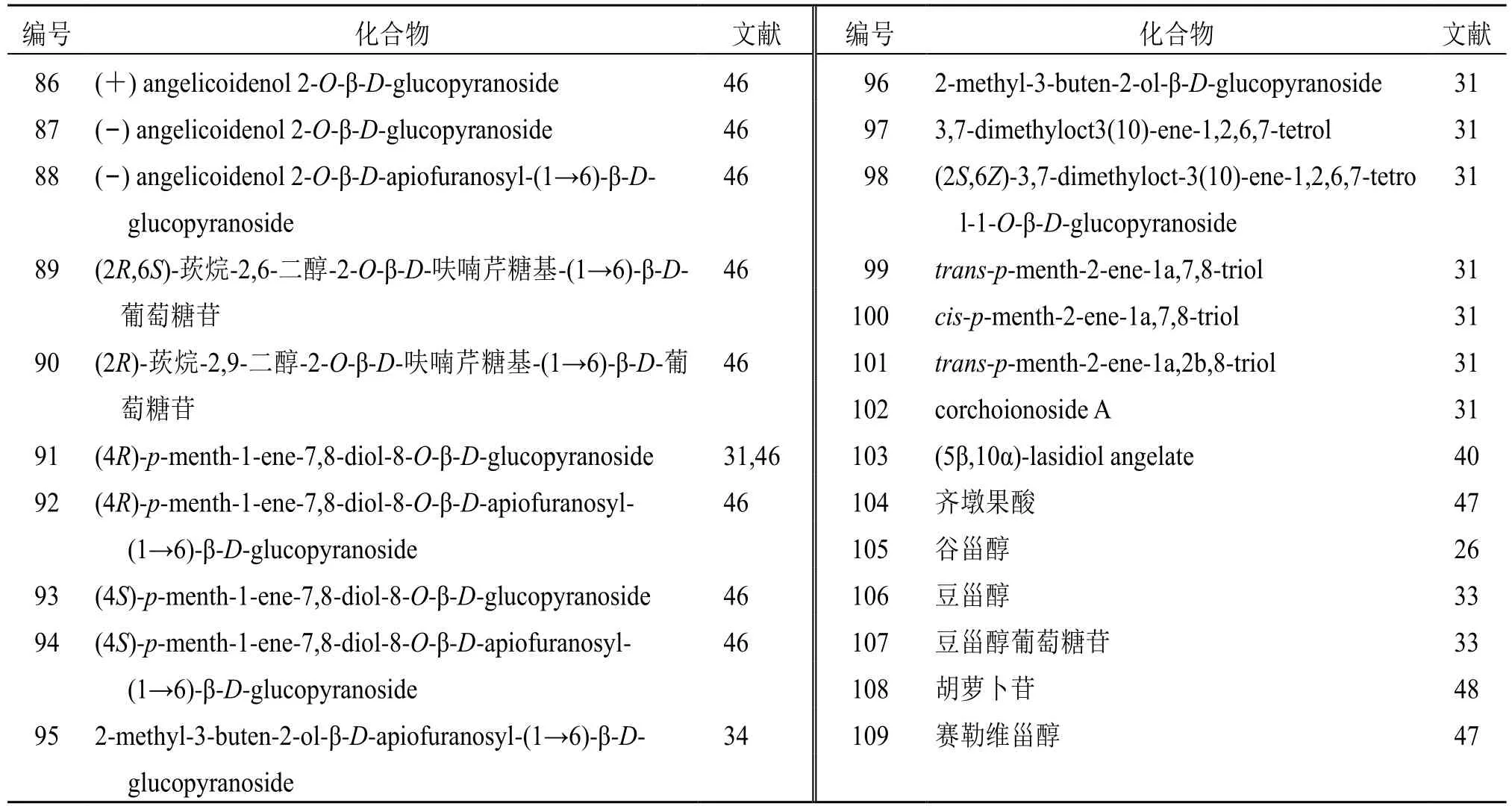
表5 北沙参中萜类和甾体化学成分Table 5 Terpenoids and steroids in Glehniae Radix
2.6 酚酸类
酚酸类成分在植物中广泛存在,北沙参中含有21 个酚酸类化合物,主要包括绿原酸(110)、咖啡酸(111)、阿魏酸(115)、香草酸(116)、水杨酸(125)等。见表6。
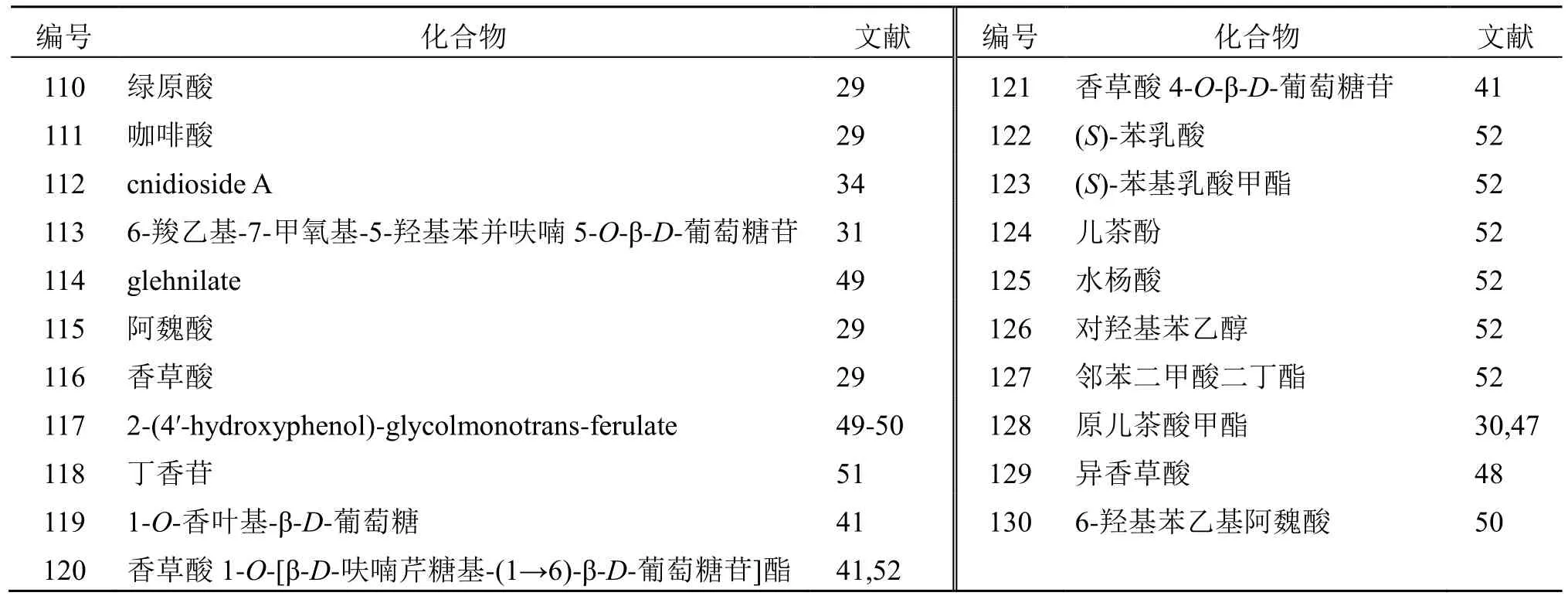
表6 北沙参中酚酸类化学成分Table 6 Phenolic acids in Glehniae Radix
2.7 黄酮类
目前从北沙参中共发现4 个黄酮类成分包括槲皮素、异槲皮素、芦丁、山柰酚(131~134)。
2.8 含氮化合物
北沙参中共发现9 个含氮化合物(135~143)。原忠[33]首次从北沙参正丁醇部位分离到腺苷和尿苷。Zhang 等[52]从北沙参醇提取物中分离并鉴定出3 个β-咔啉类生物碱。是从伞形科植物中发现的第1 个β-咔啉类生物碱。Li 等[53]从北沙参根中鉴定出1 个异恶唑衍生物naphthisoxazol A(139)。此外,还含有多种氨基酸,其中精氨酸的含量最高,占总氨基酸含量的65.44%[54]。
第二,加强对非正规金融的监管,促进非正规金融健康发展。可以根据经济发展水平,因地制宜,对不同地区的农村非正规金融组织要求持有不同数量资本金;辅导非正规金融组织建立严格的内控制度,对其管理人员与从业人员的准入做出规定;限定非正规金融组织的业务范围,不容许其经营风险较大的股票、黄金、外汇交易等金融业务;定期收集非正规金融资金流量和流向以及利率变动等各种数据,便于政府制定农村经济政策时参考。
2.9 挥发油类
北沙参地上部分挥发油中主要成分为水芹烯(12.96%)、辛酸丙酯(16.89%)、棕榈酸(14.45%)、亚油酸(8.79%)和亚油酸甲酯(5.47%)。北沙参根部油中共鉴定出66 种成分,主要成分为α-蒎烯、水芹烯和大牻牛儿烯[55-56]。王辉明等[57]发现镰叶芹醇是不同产地北沙参挥发油的共有成分之一,也是其中相对含量最高的。莱阳产北沙参挥发油中富含脂肪酸类成分,而安国和赤峰产地的北沙参挥发油类成分中倍半萜类含量高。张艺馨等[58]发现不同批次北沙参的共有挥发油成分有12 个,其中河北产地的挥发油含量低于山东和内蒙古地区。比较同产地北沙参去皮和不去皮的挥发油含量,发现不去皮的北沙参挥发油含量高,并且去皮加工会使一些有效成分含量降低。
2.10 其他类
此外,还发现了糖苷类成分(144~156)及其他类成分(157~170),见表7。
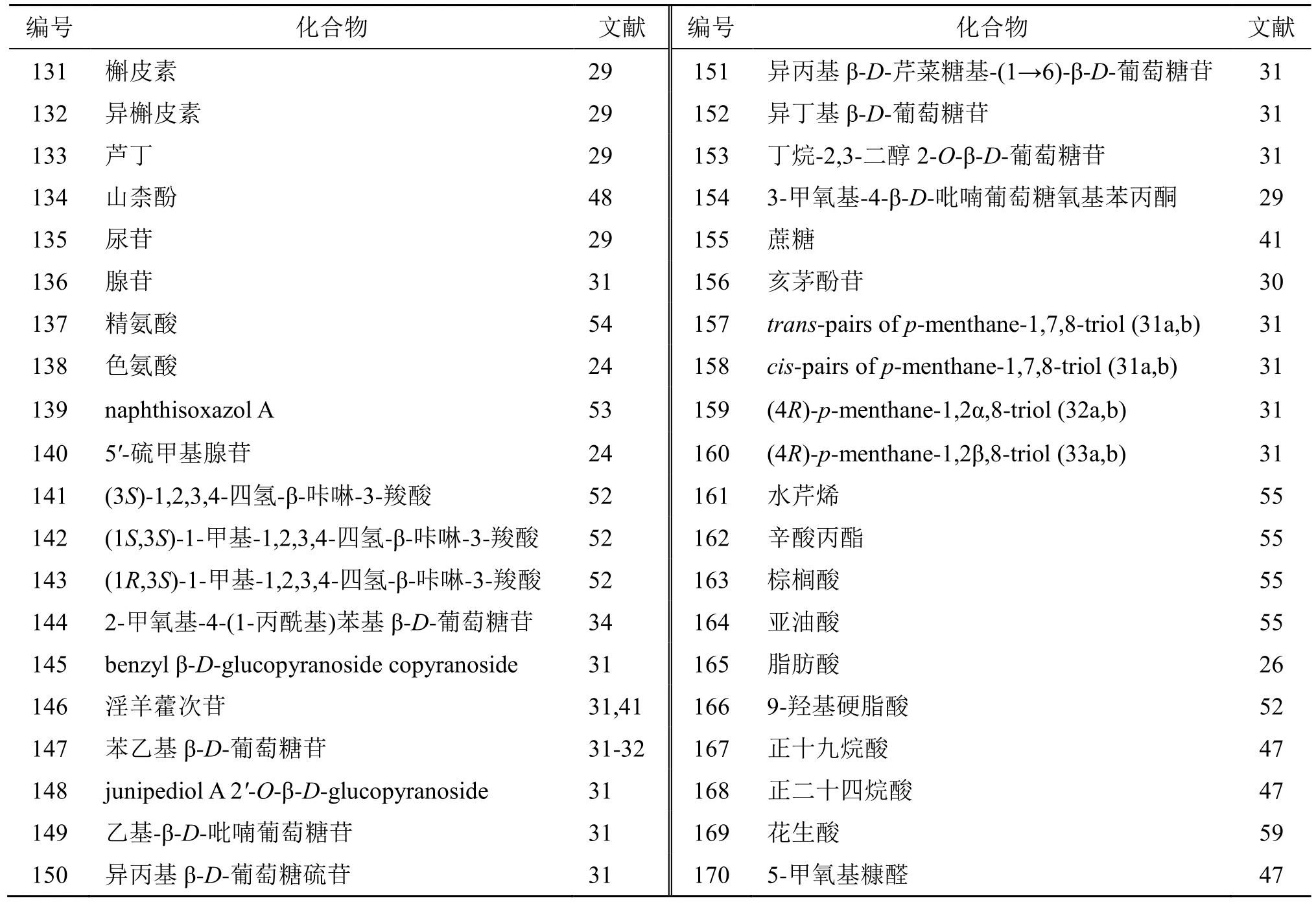
表7 北沙参中黄酮类、含氮化合物及其他类化学成分Table 7 Flavonoids, nitrogen-containing compounds and other chemical ingredients in Glehniae Radix
3 北沙参药理作用研究
3.1 免疫调节作用
目前已明确北沙参具有显著的免疫调节作用,研究主要集中于北沙参提取物及多糖成分,具体作用机制见图2。北沙参超临界二氧化碳萃取物能提高环磷酰胺诱导的免疫抑制C57BL/6J 小鼠外周血白细胞和血小板的数量,提高CD3+T、CD3+CD4+T、CD3+CD8+T 细胞在外周血的含量,说明超临界二氧化碳萃取物能显著改善小鼠的外周免疫功能[60]。吕方军等[61]通过研究北沙参茎叶的水提物(A)、水提后醇提物(B)、醇提物(C)及醇提后水提物(D)的免疫调节作用,发现北沙参茎叶不同提取物可在一定程度上提高小鼠外周血白细胞数量、胸腺指数、免疫低下小鼠网状内皮系统吞噬碳粒的K 值及α 指数,其作用强度为B>A>D>C,其中B 和A 作用明显。
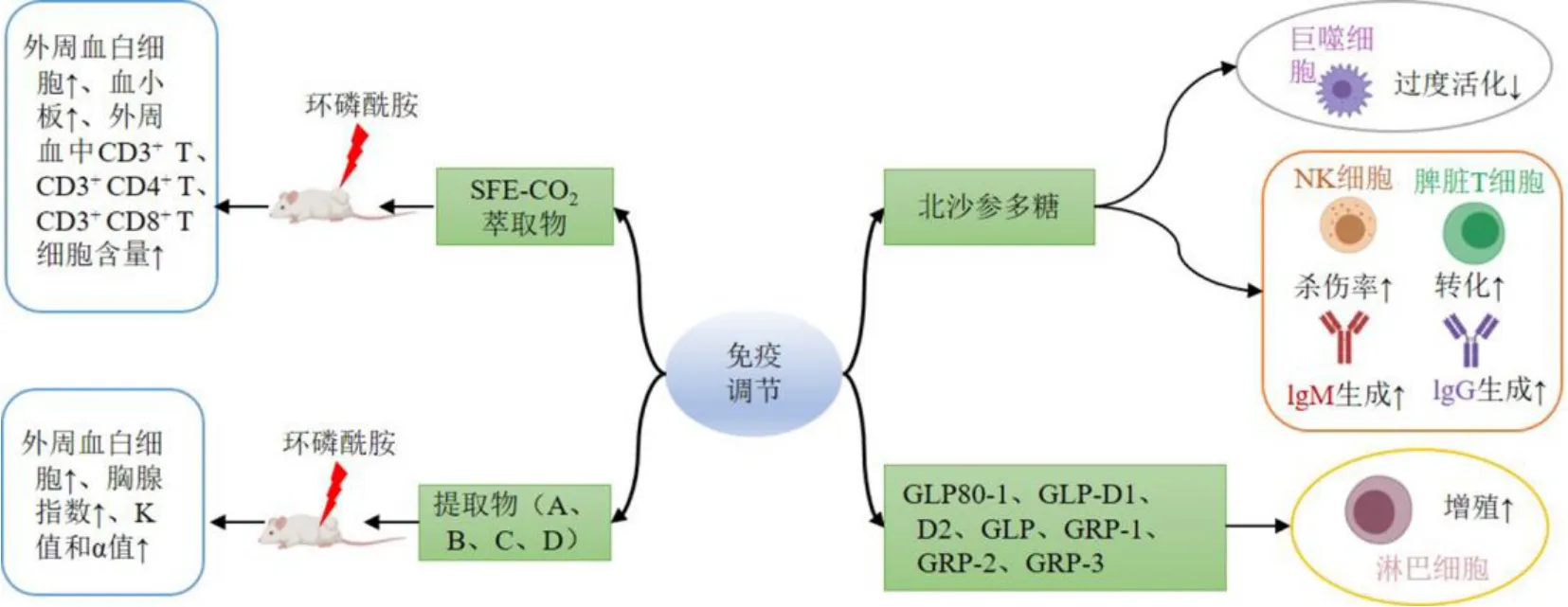
图2 北沙参免疫调节作用Fig.2 Immunomodulatory effects of Glehniae Radix
巨噬细胞可直接或间接参与免疫系统的免疫反应,北沙参多糖(GLP)10、50 μg/mL 对小鼠巨噬RAW264.7 细胞具有明显的增殖作用,进一步用脂多糖诱导的RAW264.7 细胞,发现与脂多糖组相比不同浓度GLP 均能显著抑制脂多糖诱导的RAW264.7细胞过度活化,说明GLP 可作为潜在的免疫调节剂[62]。GLP 能显著增加甲状腺素和利血平诱导的甲亢型阴虚模型小鼠的体质量,GLP 800 mg/kg 能显著提高阴虚小鼠自然杀伤细胞的杀伤率和增强脾脏T细胞转化功能。GLP 400、600 mg/kg 可显著增强免疫球蛋白M(immunoglobulin M,IgM)抗体的生成,低、高剂量组可显著增强IgG 抗体的生成[63]。荣立新等[64]通过比较去皮和未去皮北沙参粗多糖的免疫调节功能的差异,结果显示2 组多糖均具有一定的免疫调节功能,但各相同剂量组间的作用差异无统计学意义。此外,GRP-1~3(3~5)、GLP-D1、D2(9、10)、GLP、GLP80-1(17、18)等多糖组分均对小鼠脾脏淋巴细胞有促进增殖作用,可作为潜在的免疫调节剂,其具体作用机制仍需深入研究[14,16,20]。
3.2 抗肿瘤作用
北沙参及其含有的聚乙炔类、香豆素类等成分具有显著的抗肿瘤活性。北沙参醇提物通过促进组织金属蛋白酶抑制剂2(recombinant tissue inhibitors of metalloproteinase 2,TIMP2)分泌和上调其基因表达,进而显著抑制人肺癌H460 细胞的迁移和侵袭能力,且呈剂量相关性[65]。北沙参粗提物和正己烷、85%甲醇、正丁醇、水部位均能不同程度地抑制人胃癌AGS 细胞、人纤维肉瘤HT1080 细胞、人白血病U937 细胞和人结肠癌HT-29 细胞增殖,其中正己烷和85%甲醇部位的活性尤为显著[32,66]。进一步发现其中的聚乙炔化合物人参炔醇和法卡林二醇在所有癌细胞中均表现出最高的抑制增殖活性,佛手柑内酯、异茴芹内酯和花椒毒素分别对AGS、HT1080 和U937 细胞有一定的抑制作用[32]。董芳等[67]通过噻唑蓝法发现不同浓度佛手柑内酯均能抑制人肝癌HepG2 细胞的增殖,且高浓度的抑制作用尤为显著。此外,高浓度佛手柑内酯也能显著抑制人胃癌SGC-7901 细胞的增殖。北沙参水提物能通过阻滞G0/G1期来抑制人乳腺癌细胞MCF-7 的增殖,且呈剂量相关性。进一步研究其作用机制发现,提取物能显著增加p21 和p27 的表达,抑制细胞周期蛋白 cyclin D1 和细胞周期蛋白激酶 4(cyclin-dependent kinase 4,CDK4)的表达[68]。GLP能显著抑制人肺癌A549 细胞的增殖和迁移,下调增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)的表达[69],见图3。
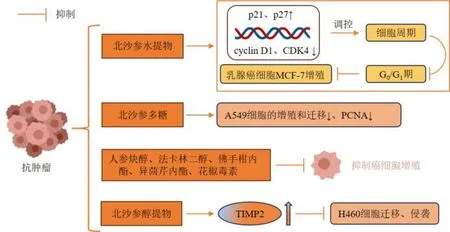
图3 北沙参抗肿瘤作用Fig.3 Antitumor effects of Glehniae Radix
3.3 抗炎作用
北沙参70%乙醇提取物能改善佛波酯诱导的急性和慢性皮肤炎症小鼠耳的水肿,显著抑制乙酸诱导的小鼠血管通透性,抑制白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和髓过氧化物酶(myeloperoxidase,MPO)的产生[70]。为进一步明确北沙参的抗炎作用机制,Yoon 等[71]发现北沙参提取物二氯甲烷组分的抗炎活性优于北沙参提取物,结果显示二氯甲烷组分(MCF-GLE)可能通过核因子-κB(nuclear factor-κB,NF-κB)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路来抑制炎症介质一氧化氮、TNF-α、IL-1β、前列腺素E2(prostaglandin E2,PGE2)的产生,进而发挥抗炎活性。北沙参提取物中的伞形花内酯(19)、佛手柑内酯(20)、花椒毒素(23)、东莨菪内酯(24)等香豆素成分有一定的抗炎活性[25]。Lee 等[37]从北沙参中分离出的多个香豆素化合物均能抑制脂多糖诱导的RAW264.7 细胞中一氧化氮的生成,结果显示C-3′和C-4′位具有酯基的角型二氢吡喃香豆素类成分比其他成分活性好,推测该类化合物具有潜在的抗炎作用。此外,欧前胡素可以显著抑制脂多糖诱导的RAW264.7 细胞中诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和环氧合酶-2(cyclooxygenase-2,COX-2)的蛋白表达,进而抑制一氧化氮、TNF-α、IL-1β 和PGE2的产生。体内研究显示其可减轻角叉菜胶诱导的小鼠足爪水肿,减少炎症部位的中性粒细胞浸润,其可能是通过抑制炎症介质产生、增加抗氧化酶来发挥抗炎作用[72]。见图4。
3.4 抗氧化作用
北沙参叶的70%乙醇提取物、北沙参茎叶醇提物的醋酸乙酯和正丁醇部位均对1,1-二苯基-2-三硝基苯肼自由基(1,1-diphenyl-2-picryl-hydrazyl,DPPH)和2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸自由基有较强的清除能力[73-74]。北沙参有机提取物有较强的抑制大鼠脑匀浆脂质过氧化作用[75]。采用乙醇分级沉淀法纯化GLP,其中GLP-50 组分具有显著的抗氧化活性。GLP-50 组分与其他分级沉淀多糖组分相比,其半乳糖醛酸含量最高且蛋白质含量也较多,因此推测多糖中半乳糖醛酸的含量和蛋白质含量可能是影响其发挥抗氧化作用的因素之一[17]。
3.5 神经保护作用
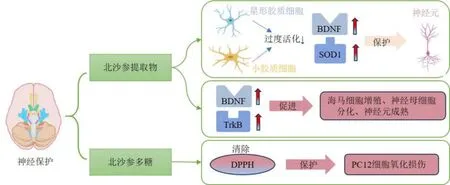
图5 北沙参神经保护作用Fig.5 Neuroprotective effects of Glehniae Radix
3.6 调脂作用
Hong 等[80]研究结果表明北沙参水提物可呈剂量相关性抑制小鼠胚胎成纤维3T3-L1 细胞分化和分化后脂肪细胞内脂质积累,显著降低高脂饮食小鼠的体质量增长和脂肪蓄积,通过下调过氧化物酶体增殖物激活受体γ、CCAAT 增强子结合蛋白β、固醇调节元件结合蛋白1c、脂质代谢介质等基因的表达来抑制脂肪细胞内脂质积累。
3.7 抗菌作用
聚乙炔类化合物具有较强的抗菌作用。法卡林二醇(63)能显著抑制大肠杆菌和金黄色葡萄球菌的生长,(9Z)1,9-十七二烯-4,6-二炔-3,8,11-三醇(64)和 (10E)1,10-十七碳二烯-4,6-二炔-3,8,9-三醇(65)对菌有一定的生长抑制作用[27,81]。北沙参内生真菌中的02-R-3、02-R-9、02-S-12、02-S-21 菌株能不同程度的抑制大肠杆菌生长,02-L-22、02-S-3、02-R-5等15 株菌株能抑制金黄色葡萄球菌生长,这些研究有助于寻找新的抑菌活性物质[82]。
3.8 其他药理作用
北沙参叶的水提物对人正常成纤维HS68 细胞和小鼠黑色素瘤B16F10 细胞均无毒性,提取物处理经紫外线照射过的HS68 细胞,结果显示5%样品提取物组与抗坏血酸组的细胞存活率相当,10%提取物处理组细胞存活率显著高于抗坏血酸组。10%的提取物显著抑制酪氨酸酶和弹性蛋白酶活性[83]。上述结果显示北沙参具有皮肤美白和抗皱的特性。此外,有研究发现北沙参乙醇提取物具有肝损保护作用[84],北沙参醋酸乙酯部位具有显著的镇咳祛痰作用[85-86]。
4 北沙参网络药理学研究
4.1 候选化合物筛选
根据上述整理的化合物,建立北沙参化学成分数据库。以口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug likeness,DL)≥0.18 为条件[87-88],从中药系统药理学数据库搜索[89-91],得到符合条件的9 个有效成分,见表8。利用PubChem数据库查阅9 个成分的SMILES,并将其导入Swiss Target Prediction 数据库,获得相关靶点,去重后得到311 个靶点。
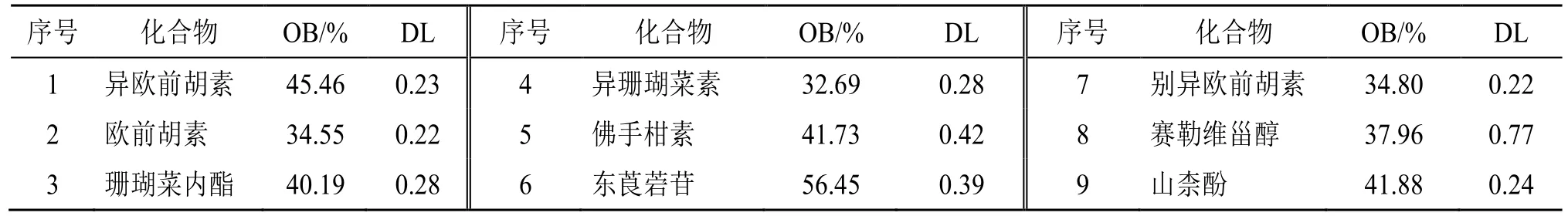
表8 北沙参中有效成分Table 8 Active ingredients in Glehniae Radix
4.2 蛋白- 蛋白相互作用( protein-protein interaction,PPI)网络构建
将311 个靶点导入STRING 数据库构建PPI 网络,选择物种为智人,设定蛋白交互分数阈值为最高置信度0.9,隐藏无联系的2 个节点。将结果导入Cytoscape 3.9.1 软件中,进行可视化处理,以度值中位数进行筛选,保留大于等于中位数10 的靶点,共获得102 个关键靶点,导入Cytoscape 3.9.1 软件中构建PPI 网络图(图6-A)。结合度较高的蛋白主要有酪氨酸蛋白激酶SRC(tyrosine-protein kinase SRC,SRC)、PI3-激酶p110-α 亚基(PI3-kinase p110-α subunit,PIK3CA)、PIK3CB、PIK3CD、PIK3R1、雌激素受体α(estrogen receptor α,ESR1)、蛋白激酶B α(protein kinase B α,AKT1)、黏着斑激酶1(focal adhesion kinase 1,PTK2)、细胞色素P450 3A4酶(cytochrome P450 3A4,CYP3A4)、热休克蛋白HSP90-α(heat shock protein HSP 90-α,HSP90AA1)。
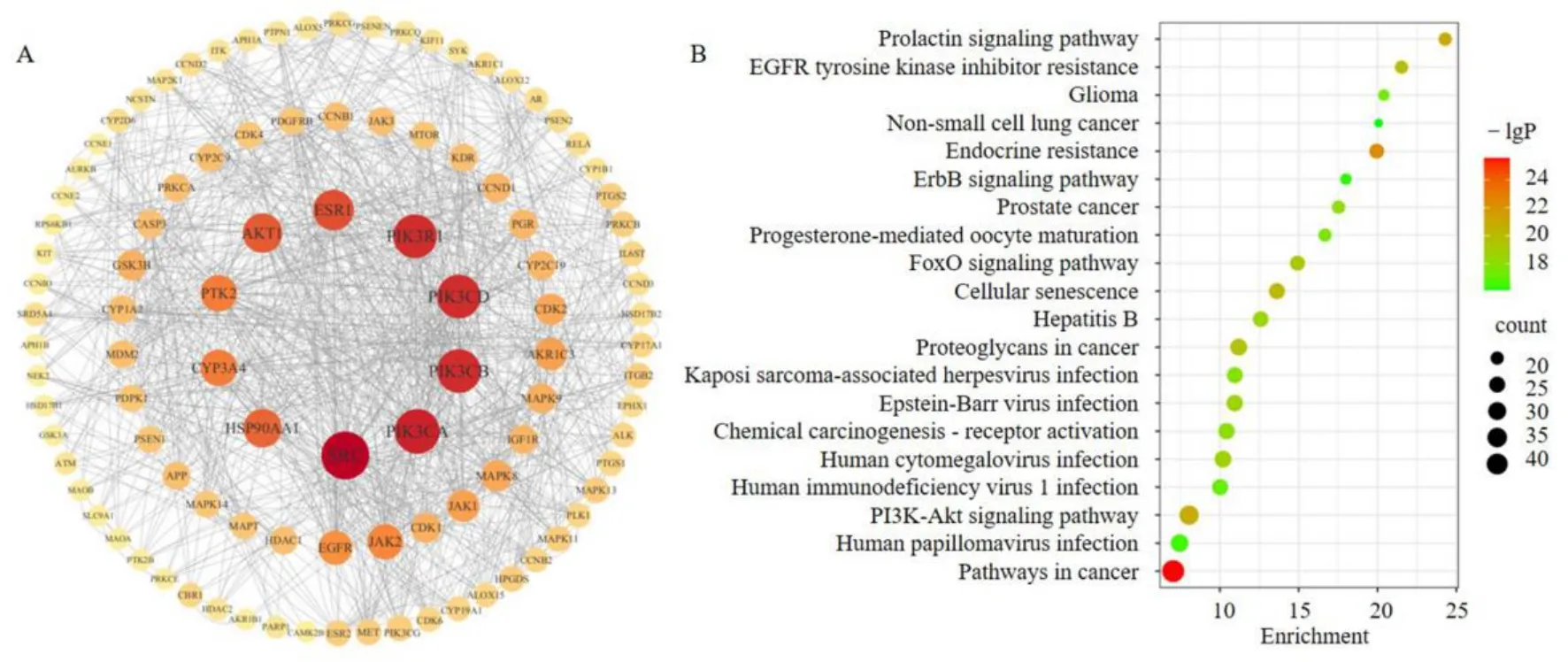
图6 北沙参关键靶点的PPI 网络图(A)和KEGG 通路分析气泡图(B)Fig.6 PPI network diagram (A) and KEGG pathway analysis bubble diagram (B) of key targets of Glehniae Radix
4.3 基因本体(gene ontology,GO)功能和京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析
通过DAVID 数据库进行GO 功能和KEGG 通路富集分析。在GO 和KEGG 富集分析中,以P≤0.01和错误发现率≤0.05 为条件,筛选出381 个GO 条目和148 条KEGG 通路。381 个GO 条目中258 条和生物过程(biological process,BP)相关、45 条和细胞组成(cell composition,CC)相关、78 条和分子功能(molecular function,MF)相关,在BP 条目中,主要和蛋白磷酸化、信号转导、凋亡过程的负调控等条目相关。在CC 条目中与细胞质、细胞溶质和细胞核等相关。在MF 条目中主要与蛋白丝氨酸/苏氨酸/酪氨酸激酶活性、三磷酸腺苷结合、蛋白激酶活性相关。选择排名前20 的KEGG 通路,利用微生信绘制KEGG 分析图(图6-B)。KEGG 结果显示富集到的通路主要与癌症通路、内分泌耐药、催乳素信号通路、磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)/Akt 信号通路、细胞衰老、表皮生长因子受体酪氨酸激酶抑制剂耐药等相关。
4.4 北沙参“成分-靶点-通路”网络的构建
将成分、成分相关的关键靶点、关键通路导入到Cytoscape 3.9.1 软件中,构建“成分-靶点-通路”网络图并根据度值对相关有效成分进行排序,具体见表9 和图7。依据度值排序结果显示,赛勒维甾醇与关键靶点的关联度最高,而别异欧前胡素和佛手柑素的度值较低。网络药理学结果显示赛勒维甾醇、山柰酚、欧前胡素、异欧前胡素、异珊瑚菜素、珊瑚菜内酯等化合物具有较高连接度,可能是北沙参的活性成分。
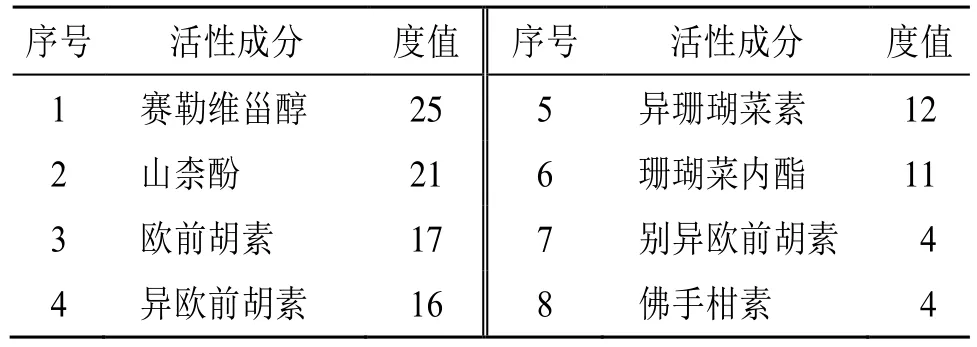
表9 北沙参活性成分度值Table 9 Degree value of active ingredient of Glehniae Radix
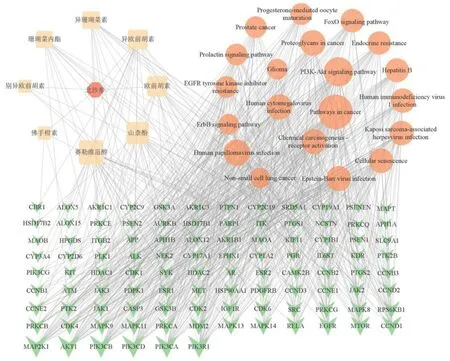
图7 北沙参的“成分-靶点-通路”网络图Fig.7 “Ingredient-target-pathway” network diagram of Glehniae Radix
5 北沙参Q-Marker 预测
北沙参作为临床常用中药,《中国药典》2020年版仅收载了其性状和鉴别,缺少了浸出物测定和成分含量测定等项目,难以反映北沙参的质量优劣。影响中药质量的因素复杂,包括药材道地性、用药部位、生长环境、栽培种植、采收加工、炮制加工、运输贮藏、工艺处理等,进而导致中药质量控制问题变得困难[5,92]。基于刘昌孝院士提出的Q-marker概念[93-95],并通过对北沙参已有研究的整理,进一步对其Q-Marker 进行预测(图8),为提升和完善北沙参质量标准提供一定的参考。
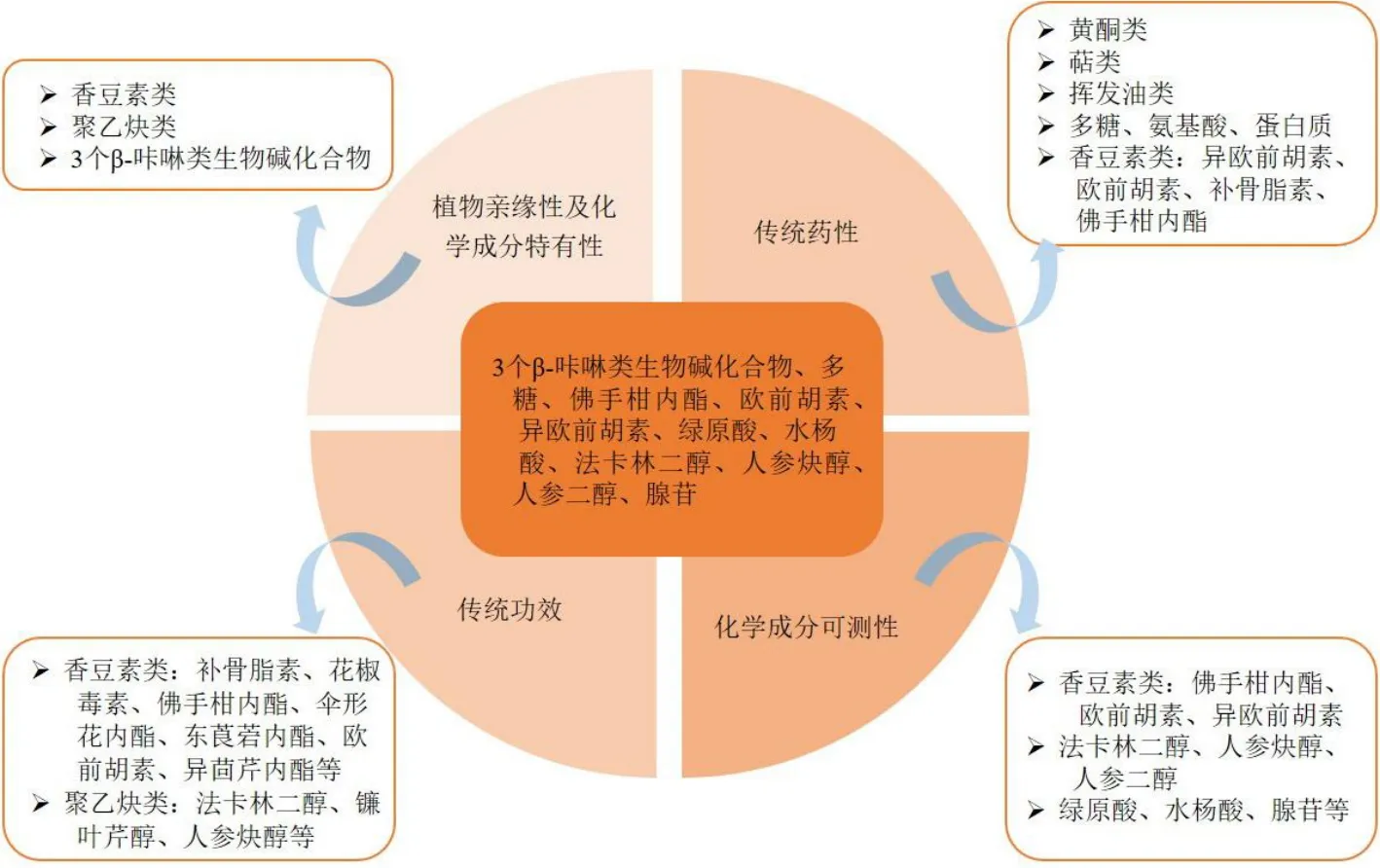
图8 北沙参Q-Marker 预测分析Fig.8 Predictive analysis on Q-Marker of Glehniae Radix
5.1 植物亲缘性及化学成分特有性
沙参始载于《神农本草经》,到宋代《图经本草》中记载了2 种沙参形态,由此推测宋代开始出现南、北沙参同为沙参使用。到明清时期北沙参和南沙参逐渐区分开来[96-98]。北沙参属于伞形科珊瑚菜属。伞形科植物在我国是1 个大科,约有100 个属,614个种,其中药用植物有65 个属,262 个种,伞形科中还有多个单种属,如珊瑚菜属、防风属等[99]。北沙参又归属于当归亚族,是该亚族中唯一生长在沿海沙滩的植物,因此和其他属亲缘关系最远,分类地位非常孤立[100]。目前也有研究显示北沙参和防风亲缘关系相近,《本草纲目》中曾记载珊瑚菜可作为防风的别种使用,又名石防风。有学者对比二者的镇痛抗炎等功效,发现二者镇痛抗炎功效相似[101]。伞形科植物含有多个属,所包含植物丰富多样,其化学成分也复杂多样,主要有香豆素类、挥发油、聚乙炔类、黄酮类、萜类、生物碱类等成分[102]。北沙参中也含有香豆素类、聚炔类、萜类等成分。目前研究显示香豆素类成分具有抗肿瘤、抗炎、镇痛等多种药理活性,聚炔类成分具有抗肿瘤、抗菌等活性[22,103-104]。据报道北沙参中首次分离到β-咔啉类生物碱化合物 (3S)-1,2,3,4-四氢-β-咔啉-3-羧酸、(1S,3S)-1-甲基-1,2,3,4-四氢-β-咔啉-3-羧酸和(1R,3S)-1-甲基-1,2,3,4-四氢-β-咔啉-3-羧酸,也是首次出现在伞形科植物中,可认为是北沙参区别于同科植物的特有性成分[52]。综上所述,北沙参中的香豆素类、聚乙炔类和3 个β-咔啉类生物碱化合物可作为北沙参Q-Marker 的参考选择。
5.2 成分有效性
5.2.1 基于传统药性的Q-Marker 预测分析 北沙参味甘微苦,性微寒,归肺、胃经。在传统中医理论中,甘味药具有补养、缓和作用,多用于虚证、缓急止痛和调和药性。苦味药具有泄、燥、坚等作用,多用于清热泻火、燥湿(坚阴)等[105-106]。北沙参养阴清肺、益胃生津的传统功效与其性味相符。现代研究发现,寒性中药主要与黄酮类、萜类、挥发油类、糖类等物质有关[107]。甘味药的甘味多源于多糖、氨基酸、蛋白质和维生素等物质[108]。现代药理研究显示甘味中药的味觉表达与1 型味觉受体2、3 有一定关系,并且可能在肠道系统中也有特异性表达[109]。有学者研究发现北沙参中含有多种香豆素类化合物,包括异欧前胡素、欧前胡素、补骨脂素、佛手柑内酯等。这些成分也是辛味药如防风、羌活、白芷等的有效成分之一,并且北沙参与上述植物同属于伞形科,尤其历史上还曾作为防风的别种使用,亲缘关系比较相近[110]。同时现代药理研究发现,血管活性是辛味中药的共同药理活性之一,北沙参中含有的欧前胡素具有显著的血管舒张活性,因此认为北沙参应当具有辛味[111-112]。综上,多糖、挥发油类、黄酮类和香豆素类成分可作为北沙参Q-Marker 的主要选择。
5.2.2 基于传统功效的Q-Marker 预测分析 北沙参传统功效为益胃生津、清肺止咳、滋阴润燥[1]。现代药理研究显示,北沙参多糖具有显著的免疫调节作用,GLP-D1、D2、GRP-1~3 等多糖组分均有显著的小鼠脾淋巴细胞增殖作用[14,16,113]。动物在处于阴虚状态时,可能导致体内免疫功能降低,ig 北沙参多糖可显著增加阴虚模型小鼠的体质量,促进脾淋巴细胞的增殖、小鼠脾脏抗体生成细胞的产生和提高小鼠腹腔巨噬细胞的吞噬能力等,进一步发挥其滋阴作用[64,114]。上述研究显示北沙参多糖成分是发挥其滋阴作用的有效成分之一。北沙参是益胃汤[115]、沙参麦冬汤[116]等多个古代经典名方的组成成分之一。孙源[117]采用超高效液相色谱-质谱联用技术建立了测定沙参麦冬汤中9 个有效成分含量的方法,其中补骨脂素、花椒毒素、佛手苷内酯这3 个成分可能部分来源于北沙参。胡钰荧等[118]对一贯煎的Q-Marker 进行预测,其中来源于北沙参的补骨脂素、花椒毒素、佛手柑内酯和法卡林二醇可作为其Q-Marker。北沙参还具有镇咳祛痰的作用,结果显示北沙参中镰叶芹醇、法卡林二醇和 (8E)-1,8-heptadecadiene-4,6-diyne-3,10-diol 是发挥镇咳作用的主要成分,而发挥祛痰作用的有效成分尚不明确[86]。北沙参水溶性部位具有抗胃溃疡的作用,进一步对其水溶性部位的化学成分进行研究发现主要含有花椒毒酚8-O-β-D-吡喃葡糖苷、橙皮素A、裂异落叶松脂醇4-O-β-D-葡萄糖苷、可来灵素A、阿魏酸、腺苷等。然而这些化合物是否是发挥抗胃溃疡作用的物质仍需进一步研究[119]。此外,北沙参中含有的佛手柑内酯、异茴芹内酯、花椒毒素、法卡林二醇、人参炔醇均有一定的抗肿瘤作用[32,67]。香豆素类化合物伞形花内酯、东莨菪内酯、花椒毒素、佛手柑内酯和欧前胡素等也有显著的抗炎活性[25]。上述提到的化合物可作为Q-Marker 的主要选择。
5.3 化学成分可测性
“可测性”是建立质量评价方法和质量标准的必要条件,所选化学成分要有一定的含量,能够有符合专属性的含量测定方法[92]。冯子晋等[120]建立了同时测定补骨脂素、花椒毒素、欧前胡素、异欧前胡素4 种香豆素成分和人参二醇、法卡林二醇、人参炔醇3 种聚炔类成分的方法,结果显示香豆素类成分含量偏低,聚炔类成分含量相对较高,并且发现不同产地北沙参的有效成分含量差异较大。苏柯萌等[121]采用紫外分光光度法并以补骨脂素为对照品测定北沙参的总香豆素含量,结果显示22 批北沙参药材的总香豆素质量分数在1.18~2.73 mg/g。李师仰等[122]利用超高效液相色谱-四极杆-静电场轨道阱高分辨质谱联用法测定了16 批次北沙参中5个香豆素类成分和7 个酚酸类成分的含量,实验结果表明各批次药材的成分含量差异较大,其中异欧前胡素、佛手柑内酯、欧前胡素、绿原酸和水杨酸含量较高,可作为Q-Marker 的主要选择。有学者采用HPLC 法测定5 批北沙参药材中腺苷的含量,结果发现在北沙参中腺苷质量分数为0.015~0.083 mg/g,其中产自山东莱阳且未经加工去皮的北沙参的腺苷含量最高[123]。综上,佛手柑内酯、欧前胡素、异欧前胡素、绿原酸、水杨酸、法卡林二醇、人参炔醇、人参二醇、腺苷等成分含量较高且已具备较好的含量测定技术,可作为北沙参Q-Marker筛选的重要对象。
6 结语及展望
北沙参是临床常用中药之一,又可作为保健食品使用,应用十分广泛。目前使用的北沙参药材多为人工种植,山东莱阳、河北安国和内蒙古赤峰为其3 大主产区。由于北沙参有去皮和不去皮2 种加工方式,加上种植、采收、运输、贮藏和炮制等因素影响,导致药材质量良莠不齐。本文通过文献计量学方法将北沙参国内外研究概况可视化。在国际上,北沙参的研究主要集中在中国、韩国和日本,国内外对北沙参的质量控制研究较少。因此,从多维度考虑北沙参的质量评价体系是非常必要的。
近年来随着对北沙参研究的不断深入,已初步明确了北沙参中所含成分的种类。本文结合文献发现北沙参中主要含有170 个成分,包括18 个多糖组分、44 个香豆素类、7 个聚乙炔类、16 个木脂素类、24 个萜类和甾体、21 个酚酸类、4 个黄酮类、9 个含氮化合物、13 个糖苷类及14 个其他类。已有研究显示北沙参具有多种药理活性,包括免疫调节、抗癌、抗氧化、抗炎、神经保护、抗菌、调脂、镇咳祛痰等作用。按照OB 值和DL 值筛选得到9 个北沙参化学成分,结合网络药理学预测分析结果表明,北沙参中的成分可能通过SRC、PIK3R1、HSP90AA1、PIK3CA、AKT1、PTK2、ESR1、CYP3A4等靶点作用于癌症通路、细胞衰老、PI3K/Akt 等通路。其中赛勒维甾醇、山柰酚、欧前胡素、异欧前胡素、异珊瑚菜素、珊瑚菜内酯是北沙参中发挥作用的主要成分。从植物亲缘学、成分有效性、可测性方面推测北沙参潜在的Q-Marker 选择对象,推测3 个β-咔啉类生物碱化合物、多糖、佛手柑内酯、欧前胡素、异欧前胡素、绿原酸、水杨酸、法卡林二醇、人参炔醇、人参二醇、腺苷可作为Q-Marker的预选化合物。北沙参多糖的研究主要集中在提取工艺及其免疫调节活性上,其结构特征和发挥活性的作用机制还不明确。多糖含量测定多选择苯酚-硫酸法,但该方法准确度较低,多糖的结构表征也比较困难,若作为潜在的Q-Marker 需要结合指纹图谱等方法对其单糖组成及特征性多糖片段进行深入的研究。目前,北沙参药理学研究多集中在提取物上,对单一成分研究较少,对北沙参的入血成分和体内代谢相关研究较少,北沙参养阴清肺、益胃生津等功效的药效物质基础均不明确,仍需进一步研究。本文通过文献整理进一步总结了北沙参的化学成分和药理作用,在此基础上对其Q-Marker 进行预测,为北沙参后续的研究方向和质量控制标准的建立提供一定的参考。
利益冲突所有作者均声明不存在利益冲突