采用傅里叶变换红外光谱和HPLC 法分析附子炮制品黑顺片和白附片差异
蒲婷婷,刘 杰,周忠瑜,管 芹,张 蕾,陶爱恩*,段宝忠*
1.大理大学药学院,云南 大理 671000
2.大理州种子管理站,云南 大理 671000
附子为毛茛科植物乌头AconitumarmichaeliiDebx.的子根加工品,具有回阳救逆、补火助阳、散寒止痛等功效,用于亡阳虚脱、肢冷脉微和心阳不足等[1],因其具有毒性,临床上主要使用其炮制品[2],炮制后能有效降低毒性、改变药性、提高药效[3-4]。目前附子炮制品主要以黑顺片和白附片为主[5-6],从炮制工艺来看黑顺片、白附片的主要差异在于去皮者为“白附片”,不去皮者为“黑顺片”。针对2 种附片的使用,历代医籍大多记载为“白缓黑急”,即病轻、缓者,以去皮炮制后的附子入药,如《伤寒论》治少阴病、手足痛[7],《普济方》治大便冷秘[8],《本草拾遗》治喉痹肿塞[9];病较急者则以不去皮炮制后的附子入药[10],如《经验方》治呕逆翻胃[11],《宣明沦方》治一切厥心痛[12],《简易方论》治中风偏废[11]。目前,黑顺片和白附片均被用于治疗急性心肌梗死、冠心病和慢性心力衰竭等[13-14],临床上并无严格区分[15],与古代传统应用不一致,二者是否应区分使用,是值得关注和思考的问题。关于黑顺片和白附片,已有学者报道了指纹图谱和含量测定等研究[16-18],但尚未见采用多维仪器联用结合化学计量学从整体化学成分、主要活性组分和毒性指标差异性,探究附子饮片“白缓黑急”临床应用的合理性。已有大量研究表明,附子不同炮制品的功效与化学成分差异密切相关[19-20],鉴于此,本研究采用傅里叶变换红外光谱(fourier transforms infrared,FTIR)和HPLC,结合化学计量法对黑顺片、白附片整体成分、主要活性组分和毒性指标成分的等同性和差异性进行了探讨,以期为安全、合理地应用黑顺片和白附片奠定科学基础。
1 仪器和材料
1.1 仪器
Nexus 型傅里叶变换红外光谱仪(美国Thermo Nicolet 公司);Agilent 1260 型高效液相色谱仪(G1322A 型在线脱气机、G1311A 型四元梯度泵、G1313A 型进样器、G1316A 型柱温箱、G1314A 型VWD 检测器和 Chem Station 色谱工作站);MS205DM 型电子天平(梅特勒托利多科技(中国)有限公司);HW-3 型红外烘干箱(天津市光学仪器厂);HY-12 型压片机(天津天光光学仪器有限公司);FY135 型中草药粉碎机(天津泰斯特仪器有限公司);SB25-12D 型超声波清洗机(宁波新芝生物科技股份有限公司)。
1.2 材料
光谱级溴化钾单晶粉末(批号170421)购自天津天光光学仪器有限公司;对照品苯甲酰乌头碱(批号MUST-18110710)、苯甲酰新乌头原碱(批号MUST-19032406 )、苯甲酰次乌头碱(批号MUST-19032807)、乌头碱(批号MUST-18110905)、新乌头碱(批号MUST-19080210)、次乌头碱(批号MUST-18111308)均购自成都曼斯特生物科技有限公司,以上对照品质量分数均>98%。色谱级乙腈(批号20171031)购自德国默克公司;乙酸铵(批号C11805665)购自天津市科密欧化学试剂有限公司;水为超纯水,其他试剂均为分析纯(国药集团化学试剂有限公司)。35 批饮片样品购于云南、四川当地市场,经大理大学段宝忠教授鉴定为毛茛科植物乌头A.carmichaeliiDebx.的子根加工品,详细信息见表1。

表1 35 批饮片样品信息Table 1 Information of decoction pieces of 35 batches of samples
2 方法
2.1 FTIR
2.1.1 供试品的制备 取样品粉末1 mg 至玛瑙研钵中,加入溴化钾粉末200 mg 作为分散剂,混合研磨均匀,取适量细粉平铺于模具中,以20 MPa压片,压制1 min,取出,对光检视,以样品均匀、半透明为佳,作为供试品[21]。
2.1.2 FTIR 条件和方法学考察 光谱扫描范围400~4 000 cm−1,分辨率为4 cm−1,扫描累加32次,每次扫描时均扣除H2O 和CO2的干扰。精密度、稳定性实验等参照本课题组已发表文献方法进行[22]。
2.2 HPLC 指纹图谱的建立
2.2.1 对照品溶液的制备 取对照品苯甲酰乌头原碱、苯甲酰新乌头碱、苯甲酰次乌头碱、乌头碱、新乌头碱、次乌头碱适量,精密称定,置25 mL 量瓶中,以甲醇超声溶解并定容至刻度,分别制成1.80、1.80、1.60、2.05、2.05、1.10 mg/mL 的混合对照品溶液,备用。
2.2.2 供试品溶液的制备 取样品粉末(过3 号筛)2 g,精密称定,置锥形瓶中,加氨试液3 mL,精密加入异丙醇-醋酸乙酯(1∶1)50 mL,称定质量,超声处理1 h,放冷,补足减失的质量,离心15 min(3000 r/min)。取上清液于50 ℃水浴挥干,残渣精密加入异丙醇-三氯甲烷(1∶1)混合溶液2 mL 溶解,滤过,取续滤液,过0.22 μm微孔滤膜,备用。
2.2.3 色谱条件 Agilent Zorbax SB-C18色谱柱(250 mm×4.6 mm,5 μm);以乙腈(A)-0.1 mol/L醋酸铵(B)为流动相;梯度洗脱程序为:0~10 min,10% A;10~23 min,10%~35% A;23~33 min,35% A;33~47 min,35%~58% A;47~53 min,58%~100% A;体积流量1.0 mL/min;柱温30 ℃;进样体积10 μL;检测波长235 nm。
2.2.4 稳定性试验[23]精密称定S1 样品粉末,按“2.2.2”项方法制备样品溶液,按“2.2.3”项下色谱条件,分别在0、2、4、8、12、18、24 h 进样测定,记录色谱峰。以保留时间、峰面积均适中且分离度较好的苯甲酰新乌头原碱为参照峰,计算指纹图谱中各共有峰的相对保留时间及相对峰面积。其峰面积的RSD 分别为1.64%、1.85%、1.47%、1.67%、1.55%、1.96%、1.87%。
2.2.5 精密度试验[23]精密吸取供试品溶液(S1),按“2.2.3”项下色谱条件连续进样6 次,进行精密度考察,以苯甲酰新乌头原碱为参照峰,计算指纹图谱中各共有峰的相对保留时间及相对峰面积。6种成分峰面积的RSD 分别为0.998%、0.97%、1.34%、1.13%、0.78%、1.21%。
2.2.6 重复性试验[23]精密吸取供试品溶液(S1),平行6 份,按“2.2.3”项下色谱条件分别进样测定,以苯甲酰新乌头原碱为参照峰,计算峰面积。6 种生物碱含量的RSD 值分别为0.96%、1.24%、1.11%、0.88%、0.79%、1.05%。
2.3 指标成分测定
2.3.1 对照品溶液的制备 同“2.2.1”项。
2.3.2 供试品溶液的制备 同“2.2.2”项。
2.3.3 色谱条件 同“2.2.3”项。
2.3.4 方法学考察 精密度、重复性、稳定性试验参考本课题组[23]之前研究,均符合要求。精密吸取供试品溶液(S1),平行6 份,分别加入6 个对照品适量,按“2.2.3”项色谱条件记录色谱图。苯甲酰乌头原碱、苯甲酰新乌头碱、苯甲酰次乌头碱、乌头碱、新乌头碱、次乌头碱平均加样回收率分别为98.34%、97.19%、94.58%、100.45%、99.88%、101.20%,RSD 分别为1.08%、1.23%、1.53%、1.70%、1.12%、1.13%。
2.3.5 线性关系考察 分别精密吸取各化合物对照品贮备液,逐级稀释,配成6 个浓度,每个对照品进样5 μL,进样测定。以进样量为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,计算回归方程,结果见表3 所示。苯甲酰乌头原碱、苯甲酰新乌头碱、苯甲酰次乌头碱、乌头碱、新乌头碱、次乌头碱线性回归方程分别为Y=270.22X+6.847 6(R2=0.999 9)、Y=229.9X+5.725(R2=0.998 9)、Y=209.05X+6.994(R2=0.998 7)、Y=173.58X+5.027 9(R2=0.998 2)、Y=365.86X+19.023(R2=0.998 4)和Y=115.21X+14.595(R2=0.997 9),线性范围分别为0.18~3.60、0.18~3.60、0.16~3.20、0.205~4.100、0.205~4.100 和0.11~2.20 mg/mL。
2.3.6 样品含量测定 分别取35 批样品2 g,精密称定,按“2.2.2”项下方法制备供试品溶液,按“2.2.3”项下色谱条件进样,每个样品平行3 份,采用外标法计算苯甲酰新乌头原碱、苯甲酰次乌头原碱、苯甲酰乌头原碱、新乌头碱、乌头碱和次乌头碱的含量。
2.4 数据分析
红外光谱数据采用OMNIC 9.2 软件进行坐标归一化、基线校正和自动平滑等处理,并计算二阶导数,红外指纹图谱采用OriginPro 2018 绘制[24];HPLC 指纹图谱相似度采用《中药色谱指纹图谱相似度评价系统》(2012.130723 版)进行计算[25];聚类分析(hierarchical clustering analysis,HCA)和统计学检验采用IBM SPSS(version 19.0)软件;主成分分析(principal component analysis,PCA)和正交偏最小二乘法判别分析(orthogonal partial least-squares-discrimination analysis,OPLS-DA)采用SIMCA 13.0 软件[26]。
3 结果与分析
3.1 FTIR 指纹图谱分析
3.1.1 方法学结果 精密度实验结果显示各光谱间相关系数均大于0.999 6,RSD 为0.09%;重复性结果显示各光谱间相关系数均大于0.999 3,RSD 为0.06%;稳定性结果显示各光谱间相关系数均大于0.999 1,RSD 为0.52%,表明供试品5 h内稳定。
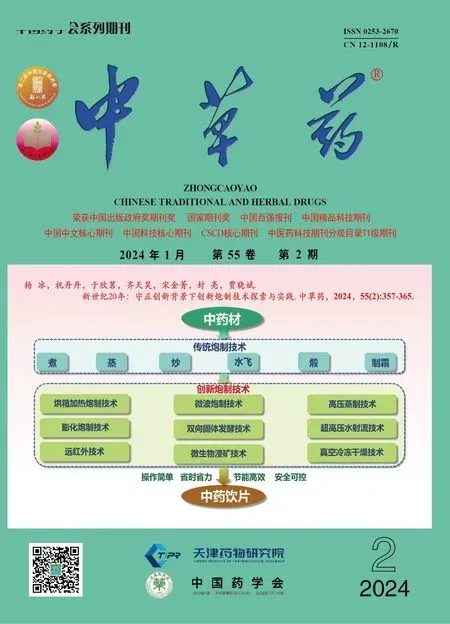
3.1.2 FTIR 指纹图谱 红外光谱技术可从药材的整体化学信息探究饮片质量的等同性和差异性[27-28]。黑顺片和白附片的平均红外光谱图见图1,从图1 中可以看出,二者峰形、峰位基本相似,而峰高,即吸光度(A)值具有差异,表明附子饮片中化学成分组成基本相同,但累积量不同;中强度吸收578.66 cm−1可能为脂肪酮的C-CO-C 面内弯曲振动,767.44 cm−1和858.75 cm−1归属为苯环C-H 键的弯曲振动,926 cm−1归属于烯烃中C-H 面内变形振动,1 028.04 cm−1和1 084.47 cm−1主要为羰基C-O 键的弯曲振动,1 158.34 cm−1处为C-O 单键伸缩振峰,1 367.64 和1 425.10 cm−1为烷烃中CH3的C-H键的弯曲振动所产生的吸收峰,1 645.69 cm−1归属于C=C 键伸缩振动峰,2 160.74 和2 359.78 cm−1附近的吸收峰归属C≡C 的吸收振动,2 931.26 cm−1为亚甲基的C-H 振动伸缩[29-30]。为进一步探讨2 种附片整体化学成分的差异,提高样品鉴别的分辨率[22,31],本研究对红外光谱数据进行二阶导数处理,结果见图2,可见2 种附片在1 430~2 000 cm−1羰基特征区处的“锯齿”吸收峰,数量和强度存在明显差异。
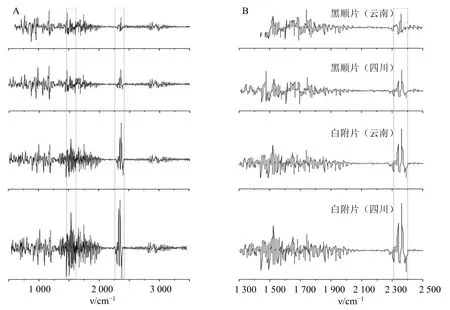
图2 黑顺片和白附片的红外二阶导数图谱 (A) 及其局部放大图 (B)Fig.2 Second derivative FTIR spectra (A) and local enlarged drawing (B) of Heishunpian and Baifupian
3.1.3 OPLS-DA 为更直观表征黑顺片和白附片整体化学成分差异,采用OPLS-DA 进行分析,将35 批样品红外光谱矩阵数据导入SIMCA 13.0,绘制散点图,结果见图3。结果显示,云南和四川产黑顺片和白附片分别聚为2 大类(I、II),2 种饮片类型明显分开,同一饮片类型下,亦可根据产地进行区分,表明白附片和黑顺片整体化学成分差异明显,饮片类型差异高于产地差异。
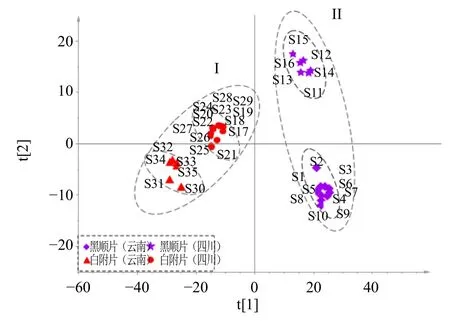
图3 35 批样品OPLS-DA 得分图Fig.3 OPLS-DA score plot for 35 batches of samples
3.2 HPLC 指纹图谱分析
3.2.1 HPLC 指纹图谱 为进一步探究黑顺片与白附片主要活性组分差异。取上述35 批样品,按照“2.2.2”项下方法制备供试品,“2.2.3”项下色谱条件进行测定,记录色谱图。19 批白附片和16 批黑顺片的指纹图谱分别导入《中药指纹图谱相似度评价系统》,采用中位数法进行多点校正,时间窗宽度设置为0.1 min,生成各自的共有模式指纹图谱及叠加指纹图谱,结果见图4。通过与混合对照品保留时间比对,确认1、2、3、4、5、6 号峰分别为苯甲酰新乌头原碱、苯甲酰次乌头原碱、苯甲酰乌头原碱、新乌头碱、乌头碱和次乌头碱。
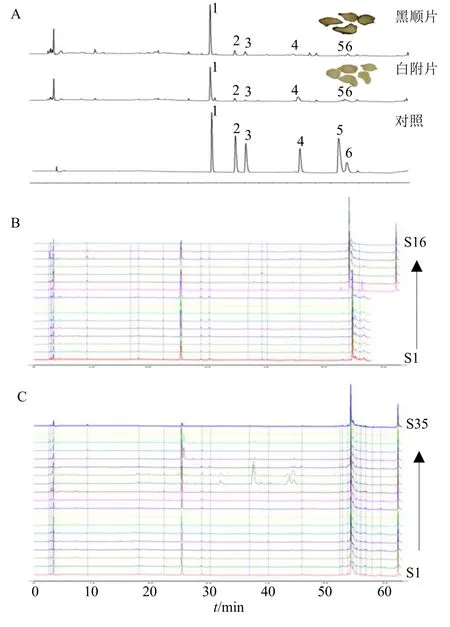
图4 黑顺片和白附片样品共有指纹图谱 (A)、黑顺片叠加指纹图谱 (B) 和白附片的HPLC 叠加指纹图谱 (C)Fig.4 HPLC of mutual fingerprint of Heishunpian and Baifupian (A), HPLC superimposed fingerprint of Baifupian (B) and r Baifupian (C)
3.2.2 相似度分析(similarity analysis,SA) 将19 批白附片和16 批黑顺片导入软件进行分析,分别生成共有模式指纹图谱,35 批样品分别与白附片和黑顺片的共有模式图谱比较,计算相似度,结果显示,19 批白附片与分差异较大,相比饮片类型,产地对成分的影响相对较小。
白附片共有模式图谱比较,相似度为0.808~0.908,与黑顺片共有模式图谱比较,相似度均小于0.5;16 批黑顺片与黑顺片共有模式图谱比较,相似度为0.806~0.990,与白附片共有模式图谱比较,相似度均小于0.5,通过相似度值可有效区分白附片和黑顺片,见图5。上述结果表明黑顺片和白附片的组内及组间相似度具有明显区分度,HPLC 指纹图谱主要组分差异较大。
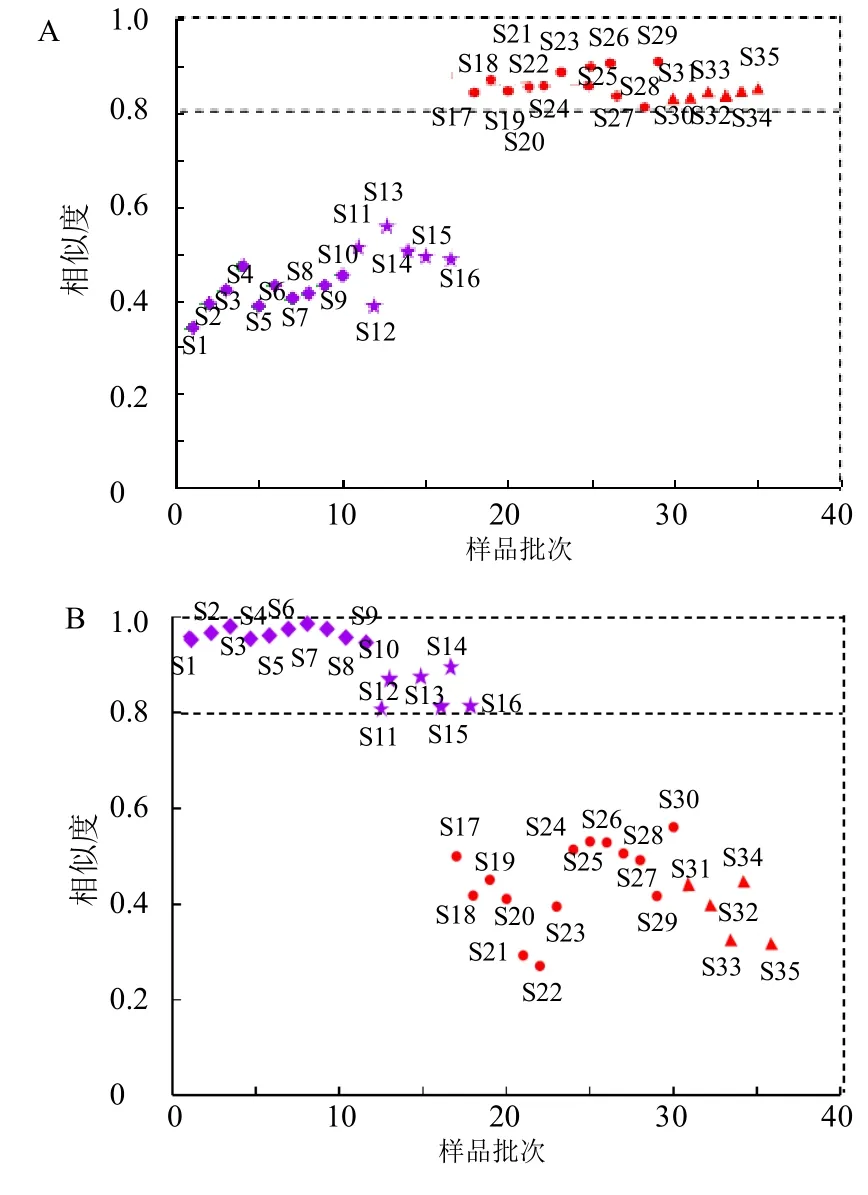
图5 白附片 (A) 和黑顺片 (B) 的相似度结果分布图Fig.5 Similarity evaluation results of Baifupian (A) and Heishunpian (B)
3.2.3 HCA 以35 批样品的共有峰的峰面积为变量,采用组间联接法和欧几里得度量法进行系统聚类,结果见图6。根据聚类图可以看出,当分类距离为20 时,35 批样品被划分为2 个类群,其中16批黑顺片(S1~S16)聚为第I 类;19 批白附片(S17~S35)聚为第II 类,表明不同附子饮片类型的化学组分存在明显差异,而相同饮片不同产地的活性组分指纹图谱较为一致,提示附片质量与其炮制工艺存在较高相关性,与产区相关性较弱,该结果与相似度评价结果一致。
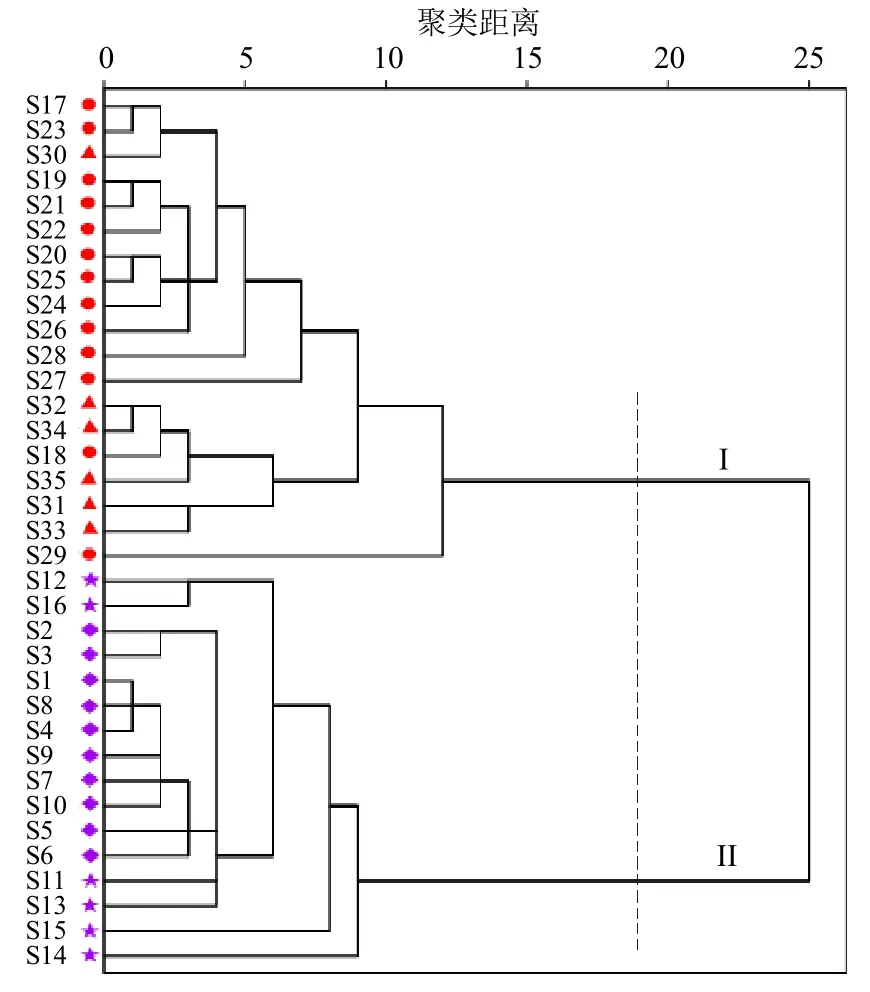
图6 35 批样品的聚类分析树状图Fig.6 Dendrogram of cluster analysis for 35 batches of samples
3.2.4 PCA 将35 批样品的共有峰的峰面积数据导入SIMCA 13.0 软件,采用无监督模式识别方法进行PCA,并绘制得分散点图,结果见图7。模型解释率参数R2X为0.69,预测能力参数为0.39,表明提取的主成分可解释69%的原始变量,模型预测能力为39%。从PCA 散点图可看出,35 批样品聚为2 组,不同产地的白附片和黑顺片分别聚为2 类,2 种饮片类型明显分开,而产地相互交叉,PCA 结果与HCA 一致,表明白附片与黑顺片主要活性组分差异较大,相比饮片类型,产地对成分的影响相对较小。
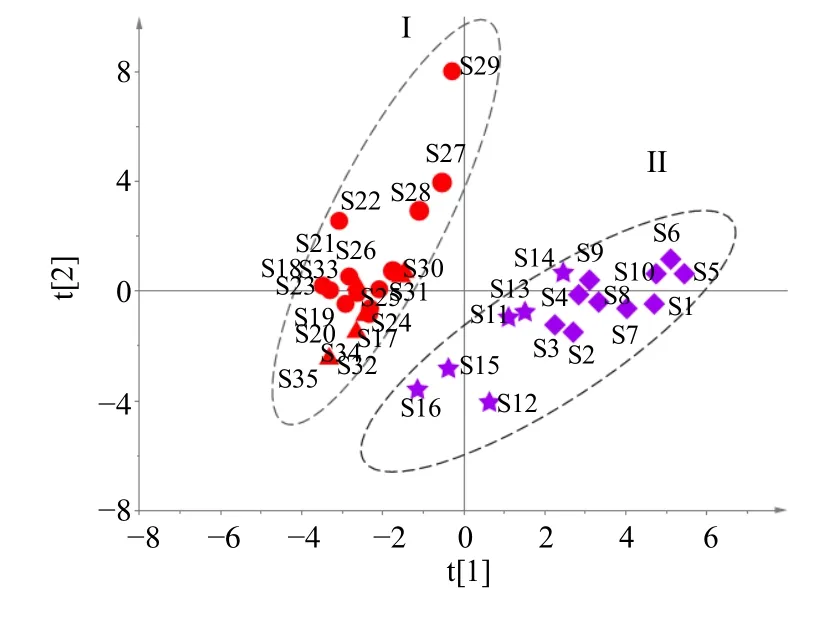
图7 35 批样品PCA 得分图Fig.7 PCA score plot for 35 batches of samples
3.2.5 OPLS-DA 为进一步筛选导致黑顺片和白附片产生差异标志性成分,将35 批样品共有峰的峰面积数据,导入SIMCA 13.0 进行有监督模式的OPLS-DA,见图8。结果显示,该预测模型累计解释能力参数R2X为0.67,R2Y为0.76,预测能力Q2为0.60,均大于0.5,表明模型稳定可靠、预测能力强;此外,采用置换检验(n=200)验证,结果显示左端随机排列产生的R2和Q2均小于右端的原始值[检验参数R2=(0.0,0.225),Q2=(0.0,−0.42)],表明所建OPLS-DA 模型拟合度良好。OPLS-DA 得分图见图8-A,可见35 批样品划分为2 类,黑顺片聚为一类,白附片聚为另外一类,结果与PCA 一致。根据变量重要性投影值(VIP)越高对组间差异的影响越大[32],以VIP 值>1 为阈值,筛选出15 个差异性质量标志物,结果见图8-B,得分前3 名的分别是9、25、18 号峰,提示这3 个成分是白附片和黑顺片的差异标志性成分,其中18 号经与对照品保留时间比对确认为苯甲酰乌头原碱,另外2 个峰需进一步确认。
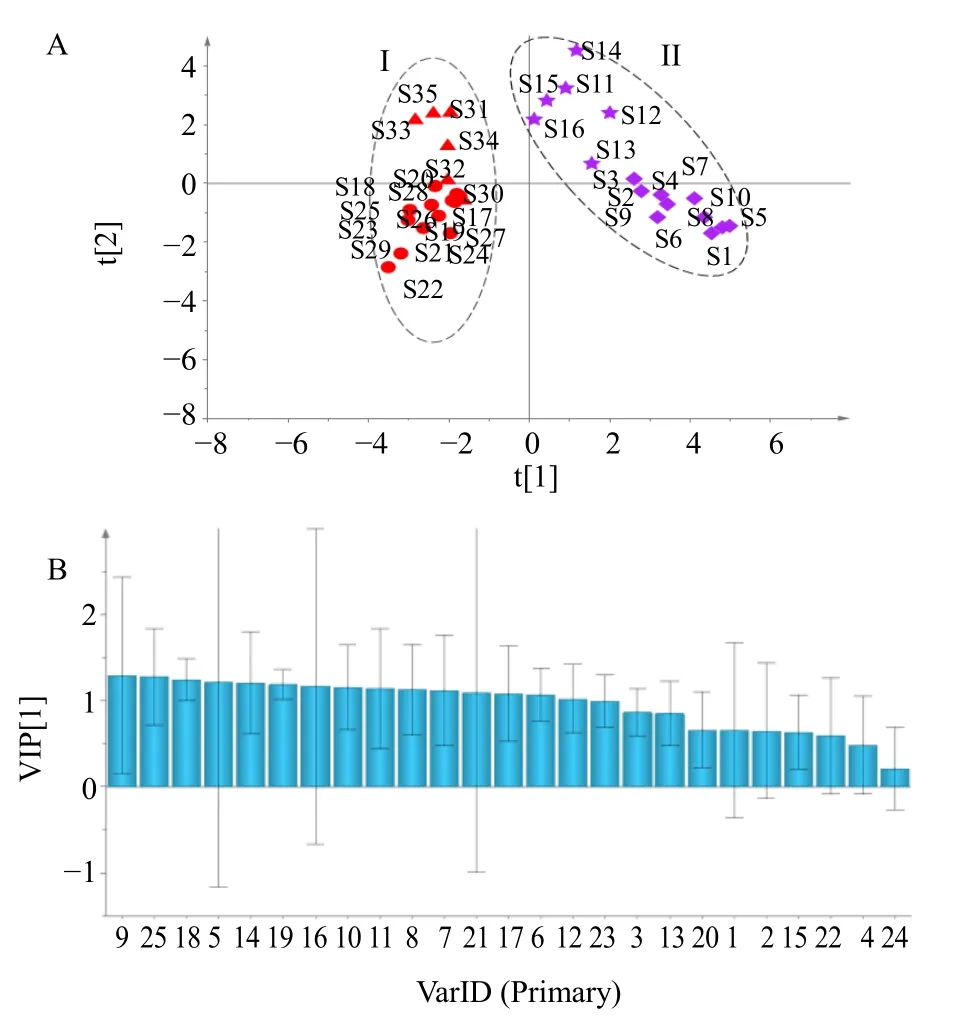
图8 35 批样品的OPLS-DA 得分图 (A) 及其VIP 值 (B)Fig.8 OPLS-DA score plot (A) and VIP values (B) for 35 batches of samples
3.3 活性成分含量
为了辨识2 种饮片的差异,本研究对白附片和黑顺片的6 种成分含量进行了测定,包括活性成分单酯型生物碱(乌头碱、新乌头碱、次乌头碱)和毒性成分双酯型生物碱(苯甲酰新乌头原碱、苯甲酰乌头原碱和苯甲酰次乌头原碱),结果表明白附片的单酯型生物碱和双酯型生物碱质量分数分别为0.003%~0.017%和0.001%~0.017%;黑顺片分别为0.003%~0.023%及0.000 7%~0.002 0%。按《中国药典》2020 年版附子质控要求,即单酯型生物碱≥0.01%,双酯型生物碱≤0.01%[1],35 批药材中有13 批不符合《中国药典》2020 年版要求,其中白附片11 批,占19 批白附片的57.89%。通过Student’st检验,发现黑顺片和白附片中的单酯型生物碱含量差异显著,具有统计学意义(P<0.01),而双酯型生物碱含量差异不显著(P>0.05),见图9,进一步证实了附子不去皮炮制(黑顺片)能提高单酯型生物碱含量,增强药效,佐证了“白缓黑急”的合理性。35 批样品中6 种生物碱成分含量见表2。
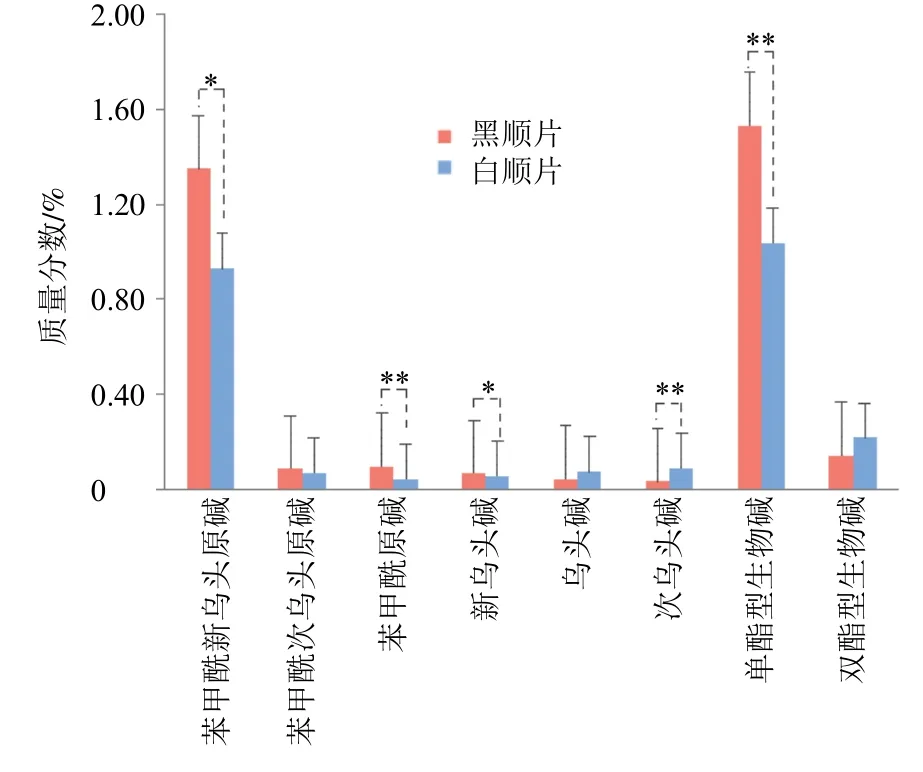
图9 白附片及黑附片生物碱成分统计学检验结果Fig.9 Statistical test of alkaloids components of Baifupian and Heishunpian
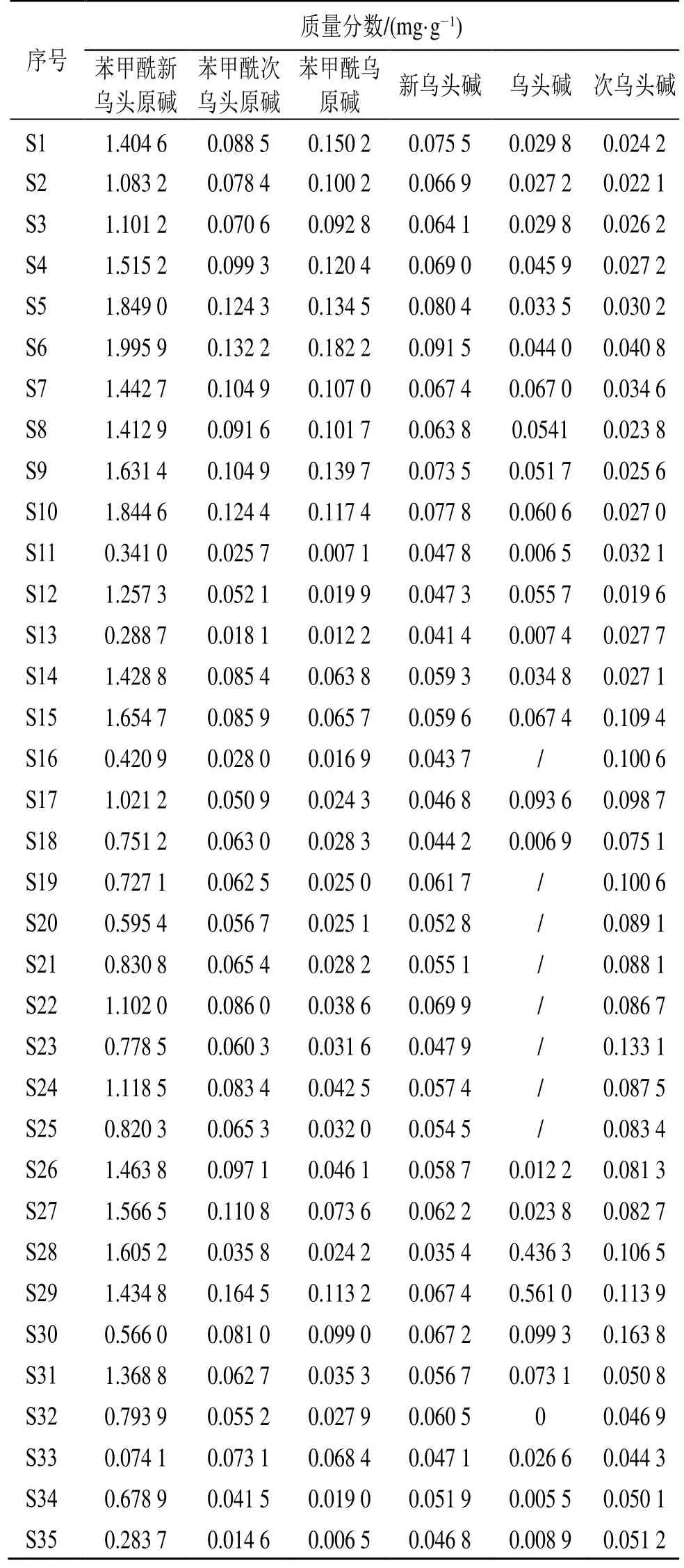
表2 35 批样品的6 种生物碱成分含量Table 2 Content of six alkaloids of 35 batches of samples
4 讨论
本研究基于FTIR 和HPLC,结合化学计量学方法,对黑顺片和白附片的整体化学成分进行研究,并通过独立样本t检验对其有效和毒性成分含量进行比较分析。FTIR 和HPLC 研究结果显示,2 种饮片的成分类型有明显差异,同一饮片类型下,亦可根据产地进行区分,表明白附片和黑顺片整体化学成分差异明显,饮片类型的差异高于产地差异。本研究中,黑顺片和白附片中的单酯型生物碱含量差异显著,具有统计学意义(P<0.01),而双酯型生物碱含量差异无统计学意义(P>0.05),且黑顺片单酯型生物碱含量更高,已有研究表明单酯型生物碱是附子发挥抗炎、镇痛和调节免疫的主要活性成分之一[33-34],与临床治疗类风湿关节炎机制密切相关[35],邵峰等[36]证实黑顺片镇痛抗炎作用优于白附片,佐证了古代医籍记载附子临床区分使用的合理性。目前,在临床应用中,黑顺片和白附片并无严格区分,主要用于抗炎、镇痛,以及急性心肌梗塞、冠心病和慢性心力衰竭等引起的休克[15,37],本研究显示白附片和黑顺片化学成分差异较大,活性成分含量差异显著,因此,在临床上应将2 者区分使用。此外,活性成分及毒性成分含量测定结果显示,35批饮片中有13 批不符合《中国药典》2020 年版要求,有关研究指出,附子在加工过程中有炮制过度的现象,难于保证临床用药的有效[38],本研究显示当前附子饮片质量参差不齐,与之前学者研究认为附子加工缺乏统一炮制规范、市场流通附子饮片质量不稳定[39]的结论一致,今后附子饮片加工应进一步规范化,以确保临床用药质量稳定。
利益冲突所有作者均声明不存在利益冲突