IVF/ICSI-ET术后早期妊娠丢失患者绒毛组织拷贝数变异异常的高危因素分析
黄蕾,何蕊,许晓雪,闫慧,赵君利,哈灵侠,刘春莲*
(1.宁夏医科大学总医院生殖医学中心,银川 750004;2.宁夏医科大学,银川 750004)
早期妊娠丢失(early pregnancy loss,EPL) 是指妊娠12周内胚胎停育、自然流产及生化妊娠等,占临床确诊妊娠的10%~20%,其中高达50 %与染色体异常有关[1]。近年来体外受精(IVF) /卵胞浆内单精子注射(ICSI) 技术成为提高不孕症患者临床妊娠率的重要手段,但术后EPL仍高达16.6%~18.3%[2],成为亟待解决的问题。拷贝数变异测序技术(copy number variation sequencing,CNV-seq) 作为一种低深度全基因组测序技术,能够提高胚胎染色体异常的诊断率,是EPL病因研究中最为重要的检测手段之一[3-4]。本回顾性研究通过分析IVF/ICSI助孕后EPL患者绒毛组织的拷贝数变异(copy number variation,CNV) 结果,以及两组患者一般临床资料、临床及实验室指标,探寻可能的高危因素,以期指导临床采取干预措施,提高IVF/ICSI助孕后的活产率。
资料和方法
一、研究对象
选择2020年6月至2022年12月就诊于宁夏医科大学总医院生殖医学中心接受IVF/ICSI-ET助孕后的EPL患者中绒毛组织CNV异常的周期作为病例组(n=29)。随机抽选同期IVF/ICSI-ET助孕后正常活产的周期作为对照组(n=60)。
所有周期均为新鲜胚胎移植周期,排除资料不全者。
本研究经宁夏医科大学总医院医学伦理委员会审批通过。
二、诊疗回顾
1.IVF/ICSI-ET助孕:根据患者的自身情况选择合适的卵巢刺激方案,包括标准长方案、超长方案、短方案、拮抗剂方案及微刺激方案等。男方于取卵当日采取手淫法取精,梗阻性无精子症患者采用经皮睾丸/附睾穿刺取精留取精液。依据精液质量的不同,采用常规IVF或ICSI完成授精。取卵后3 d或5 d(D3/D5)选择1~3级的卵裂期胚胎或3CC以上的囊胚期胚胎1~3枚进行移植,移植后肌肉注射黄体酮60 mg/d给予黄体支持。移植后35 d行B超检查,可见妊娠囊者为临床妊娠。EPL定义为B超检查可见妊娠囊,但妊娠12周前妊娠自然终止;活产定义为妊娠28周及以上娩出有生命体征的婴儿。
2.CNV-seq:无菌条件下获取EPL患者绒毛组织样本,放至专用无菌标本瓶内冷冻保存,送至山东贝康医学检验所进行CNV-seq分析,送检前患者均知情并签署知情同意书。
检测原理与方法:将收集的绒毛组织进行核酸提取和纯化;提取的人基因组用DNA酶切打断,然后在其两端添加测序接头,通过磁珠分选富集20~500 bp大小的文库片段,构建测序文库;利用DNA纳米球技术对测序文库进行扩增,形成测序模板,通过基于联合探针锚定聚合测序技术的基因测序仪进行测序;利用生物信息学软件对测序数据进行分析,得到匹配到每条染色体上的有效序列数量,计算有效序列数量与参考数据库中相应染色体序列数量的比值,判断染色体非整倍体异常。
结果解读和报告标准:根据DECIPHER(https://www.deciphergenomics.org/)、在线人类孟德尔遗传(OnlineMendelian Inheritance in Man,OMIM;https://omim.org/) 数据库,结合患者表型进行综合分析;依据ACMG(2019) 指南对所有变异进行致病性评级,将所有变异分为5类:致病性、可能致病性、临床意义未明、可能良性及良性;根据指南共识建议进行结果报告,报告标准为染色体非整倍体、100 Kb以上已知明确致病的CNVs以及1 Mb以上的基因组缺失/重复。
3.移植胚胎评分标准:(1)根据胚胎形态学评分[5]对卵裂期胚胎评分:根据卵裂球数目、卵裂球均匀性和碎片比例等评分指标将胚胎分为1~4级,形态学评级为1~2级属于优质胚胎,形态学评级为3~4级属于非优质胚胎。(2)根据Gardner评分[6]方法对囊胚期胚胎评分:观察指标包括囊胚腔大小、内细胞团和滋养层细胞。根据囊胚腔的大小和是否孵出将囊胚的发育分为1~6期、根据内细胞团分为A~C级,根据滋养层细胞分为A~C级,评为4、5、6(AA、AB、BA、BB) 的囊胚属于优质囊胚,其他囊胚属于非优质囊胚。
三、观察指标
患者一般资料,包括年龄、体质量指数(BMI)、不孕年限/类型、孕产史、基础激素水平;控制性促排卵相关资料,包括促性腺激素(Gn)天数/用量、Gn启动日及HCG日激素水平、内膜状况、获卵数等;受精、胚胎培养及胚胎移植相关资料,包括受精方式、移植胚胎类型/数量/治疗以及移植后14 d HCG水平等;病例组绒毛组织CNV-seq结果。
四、统计学处理
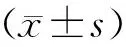
结 果
一、患者基本资料
本研究纳入了IVF/ICSI-ET助孕新鲜周期移植后EPL患者绒毛组织检出CNV-seq结果异常的29个周期(病例组),以及同期IVF/ICSI-ET助孕新鲜周期移植后正常活产的60个周期(对照组)。
病例组患者的年龄、自然流产次数显著高于对照组(P<0.05),而抗苗勒管激素(AMH)水平显著低于对照组(P<0.05);两组患者间BMI、不孕年限、不孕类型、基础激素[卵泡刺激素(FSH)、黄体生成素(LH)、雌二醇(E2)] 水平比较均无统计学差异(P>0.05)(表1)。

表1 患者基本资料比较[(-±s),n(%)]
二、患者临床及实验室指标
病例组Gn启动日FSH水平、Gn启动日LH水平、HCG日LH水平均显著高于对照组(P<0.05);两组患者间Gn启动日E2水平、Gn总天数、Gn总量、HCG日E2、孕酮(P)水平、HCG日内膜厚度、获卵数、受精方式、移植胚胎数、移植胚胎来源/类型/质量及移植14 d后HCG水平比较,均无统计学差异(P>0.05)(表2)。
三、病例组患者绒毛CNV-seq结果
29例EPL患者绒毛CNV-seq结果异常样本中,检出染色体数目异常21例(72.41%),以常染色体三体最为常见,共16例(55.17%),其中16-三体共5例(17.24 %)、22-三体3例(10.34%),21、13、8-三体各2例(各占6.90%),18、20-三体各1例(各占3.45%);另有三倍体3例(10.34%)、Turner综合征2例(6.90%)。
检出染色体结构异常(部分重复/缺失) 8例(27.59%),其中4例CNVs有明确致病性(13.79%)、2例CNVs提示可能致病(6.90%)、2例CNVs为临床意义不明(6.90%)。

表2 患者临床及实验室指标比较[(-±s),n(%)]
讨 论
随着辅助生殖技术(ART) 技术的发展,临床妊娠率在过去十年中逐渐提高,但EPL仍是常见并发症,染色体异常是其最重要原因[7]。尽管许多研究已经评估了ART妊娠后EPL的危险因素,但很少有研究比较EPL绒毛染色体异常患者与正常活产患者之间的差异。本回顾性研究通过分析讨论高龄、卵巢储备功能减退对EPL的致病机理,探索IVF/ICSI助孕后EPL胚胎染色体异常的高危因素,以期帮助医生改进方案,并就危险因素向孕妇提供ART咨询,最大限度地降低EPL的风险。
本研究病例组平均年龄为(33.45±3.78)岁,显著高于对照组的(29.52±4.27)岁(P<0.05)。Xu等[8]的研究中年龄被认为是对妊娠结局预测影响最大的变量;Eldin等[9]对195例ICSI周期治疗后EPL患者进行了回顾性研究,发现女性高龄会使EPL的风险增加约2.5倍。研究表明,35岁以上女性的卵母细胞质量较差,胚胎移植后的妊娠率和活产率均低于年轻女性,这种低成功率被认为与胚胎的非整倍体率的增加有关[10-12]。高龄增加胚胎非整倍体率的机制较为复杂,包括线粒体功能异常、端粒缩短、染色体粘连异常以及纺锤体稳定性下降等,一方面可造成胚胎发育速率部分降低,另一方面则导致减数分裂染色体分离异常,最终显著增加胚胎非整倍体率[13-15]。此外,高龄干扰子宫内膜容受性,包括子宫内膜的形态和功能改变,如胶原含量增加、基质细胞组织中DNA含量减少、内膜细胞中雌激素受体及子宫血流量减少等,均可对种植后的胚胎产生负面影响,导致EPL[16]。Fujii等[17]的研究表明高龄伴有子宫内膜乳酸杆菌微生物群减少,而后者已证实与子宫内膜容受性显著相关。一项Meta分析仅纳入了年轻卵母细胞捐赠周期,作为研究高龄影响子宫内膜容受性的一个科学模型,结果表明高龄是影响子宫内膜容受性的独立风险因素[18]。
AMH被认为是卵巢储备功能的重要标志之一,其他重要指标包括基础内分泌水平以及窦卵泡数(AFC) 等。卵巢储备功能减退(diminished ovarian reserve,DOR) 患者的卵母细胞数量和质量减低,即使采ART助孕,活产率仍然较低[19]。在本研究中,病例组的AMH平均值为(2.49±2.05) ng/ml,显著低于对照组[(4.03±2.67)ng/ml],这与Atasever等[20]的报道结果一致。一项Meta分析表明DOR与EPL有显著相关性[21];Tan等[22]研究表明AMH水平与流产率呈负相关(相关系数为-0.154,P<0.001)。Jiang等[23]发现年龄大于35岁且AMH水平较低的女性,非整倍体比例也显著升高;Arnanz等[24]的研究也表明AMH水平低与高龄产妇非整倍性风险增加有关;Jaswa等[25]通过控制接受IVF助孕的DOR患者的年龄,发现DOR患者囊胚活检的整倍体率较非DOR患者降低了24%。还有研究表明,DOR患者的卵泡微环境受到氧化应激损伤,从而对卵母细胞的生长和成熟产生不利影响,导致胚胎质量下降[26]。国内外关于DOR与胚胎非整倍体形成机制的研究相对较少,未来需要更多的研究进一步探索。
染色体数目异常是EPL最常见的原因[27]。在我们所纳入EPL病例的流产绒毛样本中,发现的染色体异常大部分(72.41%)是数目异常,其中主要的为常染色体三体(55.17%),其中16-三体和22-三体最常见(分别为17.24 %和10.34%),这与Zhu等[28]的研究结果一致。既往报道减数分裂重组、染色体凝聚力减弱、异常端粒结构可能是造成染色体数目异常的原因[29],而常染色体三体的发生通常是因为在减数分裂时同源染色体或姐妹染色单体不分离,其中近端着丝粒染色体(13、14、15、16、21和22号染色体)最容易发生减数分裂失败而形成三体[30-31]。国内外关于16-三体发生机制的相关研究中,有报道证实特定基因的启动子高度甲基化,可能导致表达减少、滋养细胞分化及有丝分裂障碍、染色体嵌合,进而通过三体拯救等机制进行自我纠正[32]。Yao等[33]通过蛋白质组学技术检测发现,免疫功能相关分子如人白细胞抗原(HLA)-G、HLA-C、IgG受体Fc片段Ⅲ等,及胚胎植入和发育相关分子与16-三体诱导早期胚胎死亡有关。有研究使用单核苷酸多态性阵列和CNV测序对反复妊娠丢失(RPL)患者流产组织标本进行检测,发现16q24.3和16p13.3的重复明显更频繁(P<0.05),因此被认为与RPL有关[34]。此外,亦有inv(16)(p13q22)染色体核型导致急、慢性髓性白血病的病例报道[35]。因此16号染色体异常与不良孕产史显著相关。
本研究提示高龄、卵巢储备功能减退是IVF/ICSI-ET术后胚胎染色体异常的重要影响因素,对流产组织进行CNV-seq分析,可以帮助寻找可能的致病因素,避免再次发生EPL。EPL患者下次助孕前建议对染色体核型进行重新分析,排除“隐匿性染色体异常”的可能性,并可采取子宫内膜容受性检测(endometrial receptivity test,ERT) 及胚胎植入前遗传学非整倍体检测(PGT-A) 技术,加上孕期严密产检,以提高活产率并降低出生缺陷率。本研究同时也存在一些不足之处:首先,样本量不够大,容易导致结果偏差;其次,由于该研究是回顾性的,因此无法研究其他相关因素,且这是一项单中心研究,结果的普遍性有限。希望在后续的研究中进行一些病例的积累,扩大样本量,细化各项指标,进行更加系统的分析,为EPL患者绒毛CNV异常的高危因素研究提供更有力的支持。

