子宫黏膜下肌瘤行子宫动脉栓塞术后严重感染成功处理1例
孙见微,杜喆,牛备战,孙智晶
(中国医学科学院 北京协和医学院 北京协和医院妇产科,国家妇产疾病临床医学研究中心,北京 100730)
一、病例资料
患者,女,49岁,因“经量增多2年,子宫动脉栓塞术后1月,发热16天”于2023年6月19日入院。
患者近2年经量增多伴贫血,外院彩超提示子宫黏膜下肌瘤直径6+cm,诊断“子宫黏膜下肌瘤、子宫腺肌病”。患者口服米非司酮,每日25 mg共4个月。因考虑药物副作用,此后隔日1次,共治疗1年,停药后症状恢复。2023年5月17日外院盆腔磁共振成像(MRI)提示:子宫大小13.9 cm×9.6 cm×12.1 cm,肌层增厚,宫腔内团块状混合等T1、T2低信号影,最大截面9.3 cm×6.3 cm。因其强烈保留子宫意愿,于5月18日在外院行子宫动脉栓塞术,过程顺利。栓塞术后2周自觉阴道脱出组织物,无发热、出血、腹痛等不适。外院宫腔镜检查:颈管被赘生物充满,宫腔内见巨大肌瘤,肌瘤底部宽大,充满宫腔,右侧壁及部分前壁见坏死组织,肌瘤下缘脱入阴道内,左侧壁及后壁内膜菲薄。因切除困难,仅将脱入阴道内病灶切除,次日出院,病理结果为子宫肌瘤。术后第2天患者出现发热,体温最高39℃,伴下腹痛、腹胀及阴道少量出血,排气尚可,无呼吸道及泌尿系感染症状。自行口服药物抗炎1周效果不佳,就诊外院,血常规提示:白细胞(WBC)22.91×109/L、中性粒细胞百分比(NEUT%)94.7%,、血红蛋白(HGB)108 g/L、C反应蛋白(CRP) 44.80 mg/L、降钙素原(PCT) 5.51 ng/ml(CRP参考值范围:<3.00 mg/L心血管低风险,>8.00 mg/L提示急性炎症;PCT参考值范围:0~0.5 ng/ml)。阴道分泌物培养未提示异常。盆腔超声提示:子宫肌层低回声结节(考虑肌瘤,最大位于子宫后壁,大小10.6 cm×9.4 cm×7.3 cm)。予以亚胺培南、中药等治疗3 d后腹痛加剧,范围扩大至全腹,伴恶心呕吐,排气减少、腹胀,阴道血性分泌物增多、异味。6月16日就诊我院,查体全腹压痛及反跳痛明显,子宫增大如孕12周大小,活动欠佳,压痛明显;双侧附件区增厚明显,活动欠佳,压痛明显。查CRP 110.50 mg/L。妇科彩超提示子宫增大明显,内见气体样强回声;腹盆计算机断层扫描(CT)示小肠梗阻改变,盆腹腔内多发包裹性积液,病变与右下腹盆腔及子宫右侧壁分界不清(图1)。考虑盆腹腔感染、继发肠梗阻。应用亚胺培南1.0 g q8h静脉输注抗炎同时,禁食禁水、抑酸、补铁、补液等治疗,并口服石蜡油、开塞露灌肠等通便治疗。治疗3 d后,复查血常规:WBC 17.56×109/L、NEUT% 93.4%、HGB 90 g/L、血小板(PLT)259×109/L;CRP 217.10 mg/L、PCT 0.81 ng/ml、CA125 135.0 U/ml。多学科会诊意见:(1)考虑盆腔严重感染。亚胺培南抗炎1周,体温无明显下降趋势,血常规及感染指标较前进一步升高。如若继续保守治疗,有感染性休克、菌血症、弥散性血管内凝血(DIC)等危及生命风险,失去手术机会。拟剖腹探查术+双侧输尿管D-J管置入,保护输尿管,行全子宫、双附件切除;(2)抗生素升级为亚胺培南1.0 g q8h+万古霉素 1.0 g q12h抗炎,并定期监测万古霉素血药浓度;(3)患者有肠梗阻表现,考虑盆腹腔感染累及肠道,无法完全排除肠瘘可能,术中外科同时上台评估肠管;(4)考虑手术困难、时间长,并发症风险高,术前充分备血,术后及时转入ICU。入院诊断:盆腹腔重度感染、盆腹腔多发脓肿、栓塞治疗后、子宫黏膜下肌瘤部分切除术后、卵巢巧克力囊肿、贫血、肠梗阻。
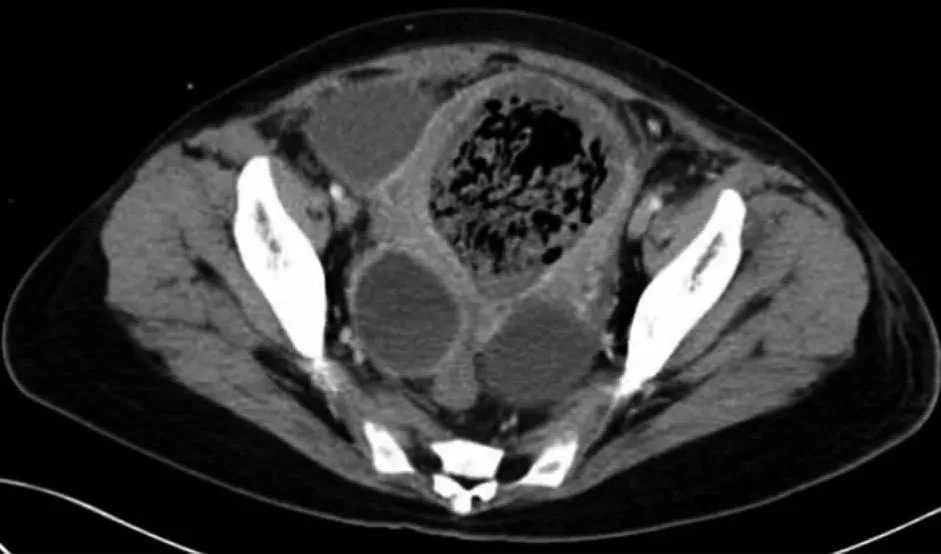
子宫壁增厚,宫腔内见大量稍高密度影及气体影。图1 术前盆腹腔增强CT影像
于6月20日全麻下行剖腹探查+盆腹腔脓肿清除+全子宫+双附件切除+盆腹腔粘连松解+双侧输尿管D-J管置入术。术中见腹膜增厚肠管水肿粘连成团,肠管与腹膜间隙多发脓肿,肠管与子宫粘连成团,无法分辨解剖(图2A~C);分离粘连中流出大量恶臭脓液。恢复盆腔解剖,见子宫增大如孕12周大小,切除子宫及双附件。外科医生上台探查腹腔肠管水肿严重,清理肠间隙间脓肿。因感染严重,腹膜增厚水肿严重,间断缝合关闭腹膜、筋膜,减张线缝合腹部切口,丝线缝皮。台下切开子宫,可见感染严重并恶臭,宫腔内可见坏死黏膜下肌瘤大小约6 cm(图2D、2E)。术后转入ICU。
术后病理示:(子宫、双附件)宫颈、子宫内膜及双侧输卵管系膜可见大量急性及慢性炎性细胞浸润,部分伴脓肿形成;肌壁间可见多量蓝染无定形物,部分区域广泛玻璃样变性,符合栓塞治疗后改变;左卵巢子宫内膜异位囊肿,右卵巢未见特殊。
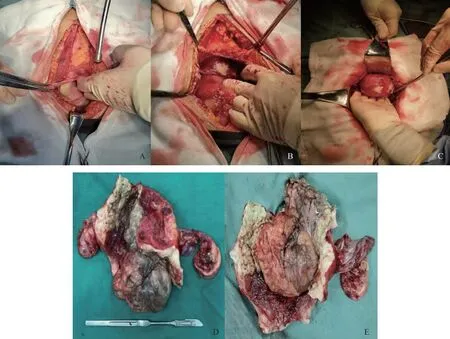
A:腹膜增厚水肿,可见腹腔内积脓;B:肠管粘连成团,间隙积脓;C:子宫增大,病灶即将穿透宫壁;D:黏膜下肌瘤已坏死、宫腔积脓;E:坏死的黏膜下肌瘤。图2 术中所见及切除子宫图像
ICU予以留置胃管、肠外营养,抗炎、抗凝、镇静镇痛,呼吸功能锻炼,监测出入量、引流、感染指标等变化。术后第2天患者体温恢复正常,术后第3天转回我科。
抗生素应用:因术中盆腔积液细菌涂片结果为革兰阴性球杆菌大量、革兰阳性球菌大量、革兰阳性棒杆菌偶见、革兰阴性杆菌大量,考虑患者盆腹腔严重感染,肠道受累及,暂不能排除肠瘘。结合伤口愈合情况,感染科多次会诊,抗生素由舒普深3.0 g q8h+万古霉素1.0 g q12h,调整为头孢他啶2.0 g q8h+万古霉素1.0 g q12h+甲硝唑0.5 g q8h加强抗炎。患者炎症指标及血象持续改善,体温恢复正常,伤口较前明显好转后,调整抗生素为头孢吡肟2 g q8h+甲硝唑0.5 g q8h。血象及体温持续正常,盆腹腔CT提示原有感染病灶大部分消失后,抗生素降级为头孢他啶2.0 g q8h+甲硝唑0.5 g q8h。当伤口趋于愈合,改成口服左氧氟沙星0.5 g qd。
肠道功能恢复:患者术前肠梗阻,术中见肠道水肿增厚。术后多次基本外科、消化内科会诊,历经肠外营养、清流饮食、少渣饮食、半流食缓慢过渡,肠道功能恢复正常。
伤口愈合不良处理:术后第5天伤口出现发红、渗出,术后第9天拆线后伤口裂开深达筋膜、有脓性渗液,伤口分泌物培养为奇异变形杆菌。感染科、整形外科定期会诊,在原有抗生素基础上,每日多次换药,伤口渗出减少、变浅后蝶形胶布拉合,伤口进一步变浅、良性肉芽生长后放置负压封闭引流(vacuum sealing drainage,VSD),此后伤口拉链缝合器对合伤口至完全愈合(图3)。
术后病理示:(子宫、双附件)宫颈、子宫内膜及双侧输卵管系膜可见大量急性及慢性炎性细胞浸润,部分伴脓肿形成;肌壁间可见多量蓝染无定形物,部分区域广泛玻璃样变性,符合栓塞治疗后改变;左卵巢子宫内膜异位囊肿,右卵巢未见特殊。
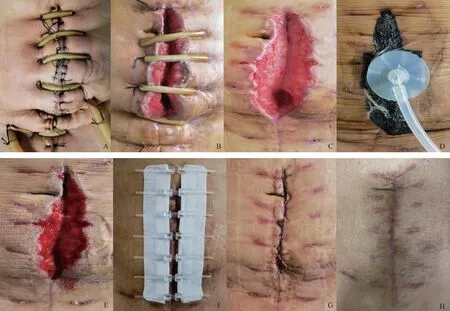
A:术后伤口;B:拆除丝线,伤口裂开;C:规律换药后,伤口变浅;D:伤口进一步变浅后置VSD;E:VSD1周后取出;F:拉链缝合器对合伤口;G:拉链缝合器1周后取下;H:术后2个半月伤口。图3 术后伤口愈合不良及处理
二、病例警示
1.子宫动脉栓塞治疗子宫肌瘤以及子宫腺肌病适应证:子宫动脉栓塞术(uterine artery embolization,UAE)治疗子宫肌瘤及子宫腺肌病已有20多年历史,其通过阻断对病灶的血供,造成病灶缺血缺氧后发生坏死、溶解、吸收,从而使病灶缩小或消失。其不仅能保留子宫及生育,而且与现有的药物治疗、子宫肌瘤剔除、子宫切除、海扶治疗相比,有恢复快、创伤小、疗效确切、并发症少的优势[1-2]。
国内外指南普遍认为症状性子宫肌瘤及子宫腺肌病是UAE的适应证。对于要求改善症状为主、有保留子宫意愿,并且药物治疗依从性差、各种原因无法手术的患者,可选择UAE。但关于黏膜下子宫肌瘤是否适合UAE,有共识指出对于直径大于5 cm的子宫黏膜下肌瘤需谨慎,有术后肌瘤脱落形成嵌顿的风险,需要宫腔镜或者扩宫清除残余组织[3]。因此,子宫黏膜下肌瘤经UAE后接受宫腔镜操作的机会增加,而宫腔镜操作能否清除缺血坏死的瘤体,一定程度上决定了UAE的效果及引起并发症的风险。目前国内外研究并未将黏膜下肌瘤归于UAE的绝对禁忌证,也未证明黏膜下肌瘤大小与不良临床结局及并发症有直接关联。
UAE术后子宫内感染率估计为0.9%~2.5%,黏膜下肌瘤的UAE术后感染发生率可能更高(3.4%)[4]。UAE后2~3 d至12个月,随着血供被阻断,黏膜下肌瘤出现坏死、液化,脱离过程中伴随着小腹疼痛、分泌物增多、血性分泌物以及组织碎屑经阴道排出。如果肌瘤无法完全排出,残瘤积聚宫腔,宫腔与外界相通,宫颈屏障破坏,阴道菌群上行,极易引起盆腔或全身感染,甚至败血症危及生命。所以肌瘤无法排出是引起UAE术后感染的潜在风险。其次,子宫肌瘤及腺肌病患者有经量增多引起隐匿性子宫内膜炎可能,尤其是黏膜下肌瘤栓塞后因肌瘤坏死或坏死排出而加重感染[3]。此外,患者既往盆腔感染、输卵管积水、宫颈机能不全、糖尿病、贫血、肥胖、呼吸系统疾病及免疫抑制等问题增加了UAE术后感染的风险[4-7]。对于存在感染因素的患者,有研究建议UAE术后预防应用抗生素[8],但缺乏证据基础。
本例患者于外院行UAE时黏膜下子宫肌瘤直径已达9+cm,同时合并子宫腺肌病,子宫增大,症状明显。从治疗角度出发,既要保留子宫,又要控制症状、消灭瘤体,难度很大。如果先应用促性腺激素释放激素激动剂(GnRH-a)缩小肌瘤及子宫,再行宫腔镜或腹腔镜剔除肌瘤,效果及安全性可能更好。然而对于围绝经期女性,这些都不如子宫切除效果彻底。除介入科外,同时需要妇科医生做出治疗适应证的决策,也就是UAE术前共同评估,如宫颈条件是否允许瘤体排出,以及宫腔镜操作是否能够完全排瘤、存在感染该如何处理等,从而选择合适的患者。对于大的肌瘤,要充分考虑UAE后继发感染等严重并发症风险,并充分做好治疗预案,包括术后宣教若有阴道分泌物增多、出血、组织排出需及时就诊干预等。若出现分泌物异味、下腹痛甚至发热,提示感染可能。应在分泌物培养同时,积极经验用药,包括抗革兰氏阴性菌及厌氧菌抗生素的口服或静脉用药。若病灶无法排出,感染加剧,需要做好切除子宫准备。对于本例患者,关于各种治疗方案利弊需要充分告知,让患者充分知情并选择。显然,直径9+cm的黏膜下肌瘤完全占据了宫腔,远远超出已有报道的UAE范围,并不适合UAE。加上围绝经期女性宫颈条件差,未充分扩张,难以排瘤。出现阴道排瘤后,宫腔镜发现无法取出腔内残瘤组织,坏死组织残留加上宫腔操作,阴道菌群极易上行进入宫腔,造成宫腔感染等严重并发症。而且,UAE术后内膜缺血、菲薄,增加了宫腔镜检查并发症如子宫穿孔、内膜炎等风险。患者宫腔镜术后并未继续住院观察,失去了早期发现感染并及时干预的机会。经历了1周左右药物治疗后至我院,患者已出现了严重的盆腹腔感染甚至肠梗阻,最终必须切除子宫及双附件以去除感染源头。
2.感染形成脓肿后的处理及手术时机:UAE术后由于子宫内膜感染坏死导致抗生素无法有效进入,使感染不易治疗[5]。当UAE术后排瘤继发感染,如果经足量强力抗感染治疗仍无好转,需全子宫切除术[6]。已有UAE术后因盆腔感染而引发的小肠梗阻、致死性败血症等罕见病例的报道[7-8]。鉴于黏膜下肌瘤UAE后存在潜在感染的风险,一旦有感染征兆,应更积极、早期抗炎治疗,及时行感染指标监测及影像学检查发现感染灶,避免宫腔积脓、感染性休克等严重并发症出现。本例患者在宫腔镜术后发生感染的1周内,自行口服抗生素治疗不到位,更没有及时就诊,症状加重时已有明显盆腹腔感染、感染性休克、败血症、肠瘘等征象。经多科协作,完善评估和准备,在强力抗炎3 d无效的情况下,果断选择剖腹探查,行盆腹腔脓肿清除+全子宫+双附件切除,才得以去除感染灶,扭转了感染进一步加重的局势,为患者康复创造了决定性的转机。
3.肠道管理:本例患者术前肠梗阻症状明显,术中发现肠管水肿,与周围组织粘连成团,间隙存在大量积脓。此时切忌冒进分离,否则容易造成肠壁破损,加重肠道感染甚至坏死。因感染严重且经历手术,务必保留胃肠减压管,饮食需要缓慢过渡,耐心观察排气、排便等迹象,并观察有无恶心呕吐、腹痛及腹胀情况,警惕肠瘘风险。患者于术后第4天开始排气排便,伴随轻度小腹疼痛。术后第6天拔除胃管,从清流饮食+肠内营养剂逐渐过渡到流食、半流食,期间一直口服调节肠道菌群药物。饮食过渡期需根据患者耐受情况逐渐增加进食量。当排除肠瘘风险后,监测感染指标回落,影像学提示盆腔感染灶消失后,抗生素逐渐降级。
4.伤口管理:患者盆腹腔感染严重,术中腹膜均有增厚水肿,术后已考虑到伤口存在愈合不良高风险。所以术后每日换药,关注伤口变化。当伤口愈合不良发生时,充分引流。及时取分泌物培养,调整抗生素使用。同时多学科定期会诊,共同协作促进伤口愈合。
通过本例子宫黏膜下肌瘤UAE术后出现严重并发症警示,对于子宫肌瘤这种常见问题的处理原则和个体化方式选择仍不容轻视。对于月经量多的患者,应注意排查有无黏膜下肌瘤。在肌瘤体积不大的情况下,经宫腔镜去除0-Ⅱ型的黏膜下肌瘤应为首选方式,而过大的黏膜下肌瘤,应结合其与肌层的位置关系,经腔镜或开腹切除瘤体仍是首选的方式。UAE应定位于无明确可切除病灶,以难治性出血为表现的患者。对于直径过大的黏膜下肌瘤行UAE治疗存在明显风险,由于肌瘤坏死后无法顺利排出,继发感染的风险明显增加。术前最好由介入科及妇科等共同评估,多角度判断衡量是否适合UAE,充分评估术后的感染风险;治疗后也应密切监测,争取早期发现并积极、有效治疗继发的感染。若感染无法控制,要果断、及时切除子宫,避免感染扩散、肠瘘、休克等危及生命的严重并发症发生。力挽狂澜固然令人振奋,但明智预判风险,引导患者理智选择最优方案更值得追求。

