子宫巨大未分化多形性肉瘤1例报道并文献复习
王黎,姚志强,杨永秀*
(1.兰州大学第一临床医学院,兰州 730000;2.兰州大学第一医院妇产科,兰州 730000)
未分化多形性肉瘤(Undifferentiated polymorphic sarcoma,UPS)是一种来源于间叶细胞的高级别肉瘤,好发于中老年人的四肢等部位,无特征性临床表现,临床上易误诊误治。近期兰州大学第一医院妇科收治了1例子宫巨大UPS患者,肿物位于子宫左侧宫角处,大小约30 cm×25 cm×10 cm,极其罕见,术前未能充分利用影像学检查及穿刺病理组织活检来明确肿瘤性质,手术完整切除肿块、子宫、双侧附件及大网膜,术后病理组织学检查诊断为UPS。本文整理该病例的诊断、治疗和预后资料并复习相关文献,以加强临床上对该肿瘤的认知,减少误诊,改善预后。
一、病例资料
患者,53岁,女,已婚,自然绝经6年,因“下腹部增大伴腹痛、腹胀4月余”于2021年12月16日收入我院。
患者自诉于入院4月前发现下腹部增大,伴腹痛、腹胀。于入院3 d前就诊于陇南市宕昌县中医院,行腹部计算机断层扫描(CT)提示:(1)腹水;(2)盆腔积液;(3)盆腔巨大肿块影。行妇科超声提示:(1)腹腔内巨大混合回声包块;(2)腹水(大量)。我院妇科以“(1)盆腔肿物(性质待查);(2)腹水;(3)盆腔积液”收住院。
发病以来体重减轻7.5 kg。入院后完善相关检查,检测肿瘤标志物提示:糖类抗原125(CA125)64.6 U/ml、甲胎蛋白(AFP)3.6 U/ml、癌胚抗原(CEA)0.7 ng/ml、糖类抗原199(CA199)14.3 U/ml、人附睾蛋白4(HE4)63.5 pmol/L。妇科超声检查提示:(1)盆腹腔巨大囊实性占位(上界达剑突下,下界至盆腔,左侧至腋后线,右侧至腋中线,内见无回声及低回声区,其内部可见血流信号);(2)盆腔积液(约27 mm)。妇科检查示:外阴发育正常,已婚已产型,阴道畅;宫颈光滑,无举痛及摇摆痛;子宫前位,正常大小,形态规则;腹部膨隆,如孕5月,有压痛。
患者于2021年12月17日行经腹左侧宫角巨大肿瘤切除术+大网膜切除术+全子宫切除术+双侧卵巢输卵管切除术。术中探查可见肿物呈实性,表面凹凸不平,质脆活动度差,与腹膜粘连;钝性分离腹膜后探查肿块上界至肝缘下,且与肝脏有粘连带,胃部、脾区整个被肿块占据,两侧至侧腹壁髂血管水平以下,下界至盆底道格拉斯窝。取部分肿块送术中冰冻病理检查。延长切口,钝性分离肿块,见巨大肿物在左侧宫角处有约3 cm的蒂部与子宫相连,钳夹、切断蒂部,缝扎宫角部。肿块大小约30 cm×25 cm×10 cm(图1)。术中冰冻病理结果回报:腹腔肿物形态学支持恶性病变。后行全子宫切除术+双侧卵巢输卵管切除术。
术后病理检查诊断报告:(1)肉眼所见:①腹腔肿物(术中冰冻):灰白灰红色不规则组织2块,大小6 cm×5 cm×1.5 cm,切面呈灰黄灰红色,呈鱼肉状;②灰黄间灰红色不规则肿物2块,总体积24 cm×22 cm×8 cm,切面呈灰白灰黄灰红色,部分区域囊性变,部分区域呈胶冻样,质韧。(2)镜下所见:瘤细胞圆形或卵圆形,胞浆丰富,嗜酸,核淡染,可见核仁,其间可见巨核、多核瘤巨细胞,核分裂像常见,呈弥漫片状排列,部分区域瘤组织出血、坏死(图2)。免疫组化染色示:HMB-45(个别细胞+)、CD117(局灶+)、CD34(血管+)、CD99(-)、CDK4(局灶+)、CK(Pan)(个别细胞+)、CR(-)、Desmin(局灶+)、DOGI(局灶+)、ER(-)、Inhibin α(-)、Ki-67(70%)、MDM2(-)、Melan A(-)、MyoD1(-)、Myogenin(-)、p53(70%)、PR(-)、S100(-)、SMA(局灶+)、SOX-10(-)、STAT6(-)、TLE1(局灶+)、Vimentin(+)、WT-1(-)。(3)病理诊断:间叶源性恶性肿瘤,结合形态学及免疫组化结果,考虑UPS。
术后转入重症医学科治疗,生命体征平稳后转入妇科给予对症支持治疗,一般情况好转后出院。
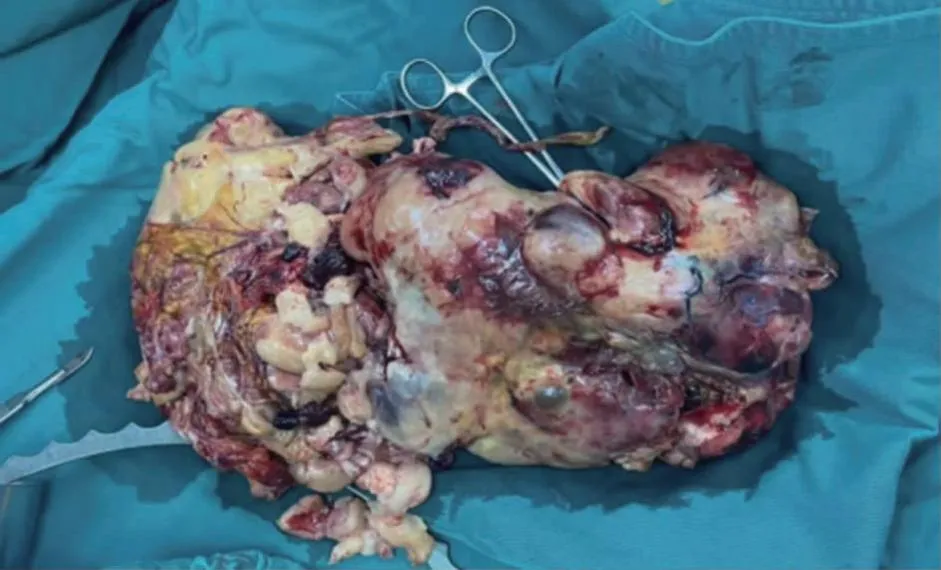
图1 子宫巨大UPS大体标本
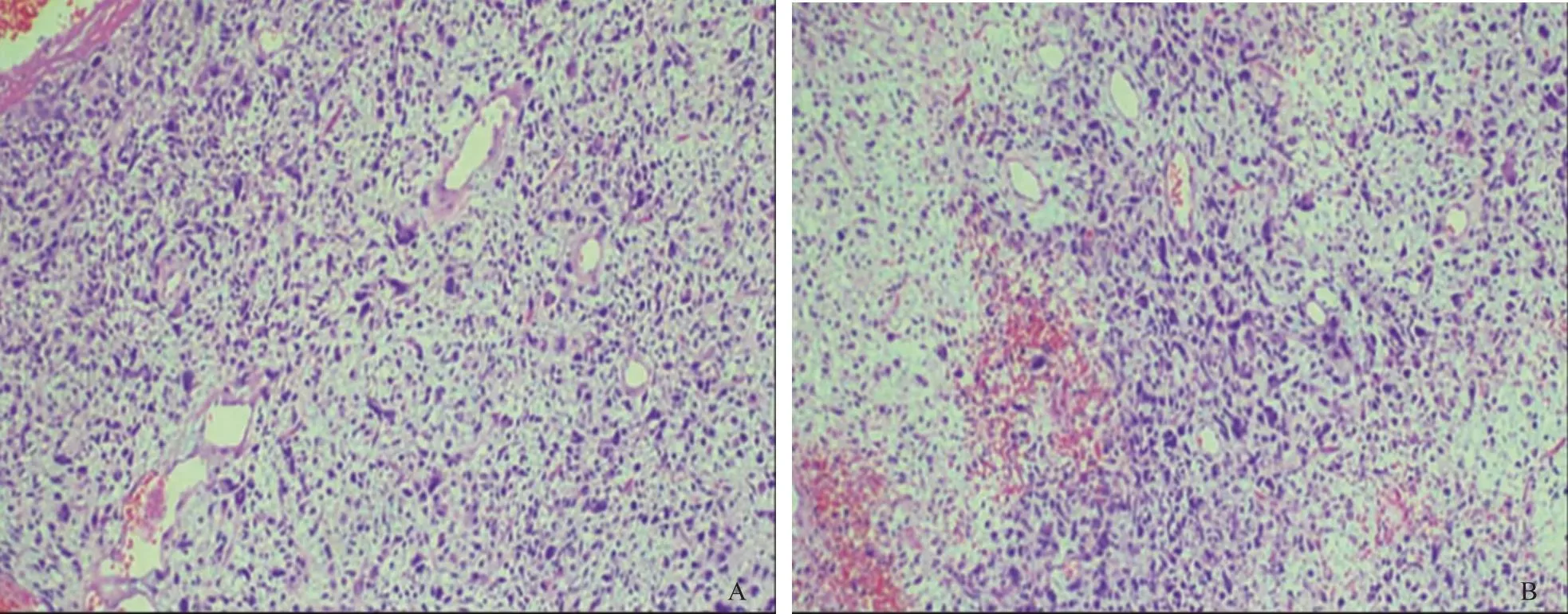
A:图中可见瘤细胞呈圆形或卵圆形;B:图中还可见部分区域瘤组织出血、坏死。图2 巨大UPS镜下特点(HE染色 ×100)
患者及家属拒绝术后放疗,后给予多柔比星脂质体60 mg静脉化疗6次,化疗过程顺利。2022年5月25日行盆腔磁共振成像(MRI)检查提示:右下腹多房囊性肿物(图3A)。5月27日复查腹部CT提示:右侧腹、盆腔多房囊性肿物(约6.2 cm×5.0 cm),恶性病变不除外(图4A)。6月19日复查妇科超声提示:(1)盆腔囊性占位;(2)腹水。穿刺抽液后盆腔包块明显变小,行腹水脱落细胞学检查提示未找到异性细胞,胸部CT未见明显异常,遂出院随访。2022年9月19日再次复查腹部CT提示:(1)新增右侧腹腔及腹膜多发条片及结节状异常强化灶,考虑转移;(2)右侧腹、盆腔多房囊性肿物较前增大(图4B)。9月26日再次复查盆腔MRI提示:腹、盆腔多房囊性占位,病灶较前略增大,其内新增少量出血(图3B)。综上考虑肿瘤复发,与患者及家属充分沟通病情后患者及其家属决定行靶向治疗,方案为每日口服1粒盐酸安罗替尼胶囊,连服两周,停药1周,周期进行。随访至今,患者诉下腹痛逐渐加重,与患者及家属再次沟通病情后患者及家属选择继续口服靶向药物。
二、讨论
UPS过去被称之为恶性纤维组织细胞瘤(Malignant fibrous histiocytoma,MFH),是一种来源于间叶细胞的高级别肉瘤。最早于1963年由Ozzello等[1]提出。1978年,Weiss等[2]通过分析200例MFH患者的病理资料,将MFH分为4种组织学亚型:巨细胞型、黏液样型、梭形细胞型和炎症型。2002年,世界卫生组织(WHO)认为MFH与UPS相似,并将其分为3个亚型(巨细胞型、多形性型和炎症型),后续在此基础上进行了一定程度的更新[3]。2013年,第4版WHO骨与软组织肿瘤分类中将MFH删除,并将其命名为UPS,归类于未分化/未分类软组织肉瘤,这是一类没有明确分化方向的异质性肿瘤,在病理学上是一个排他性的诊断[4]。目前尚未明确UPS的发病诱因,其发病率占软组织肿瘤的30%以上,常见于中老年人,主要集中在50~60岁,且男性发病率是女性的2~3倍。UPS最常见的发病部位是下肢,约占49%;其次是上肢,约占19%;腹膜和腹腔约占16%;其他部位较罕见[5]。其病变组织主要位于深部的肌肉和筋膜,少数位于皮下组织[6]。
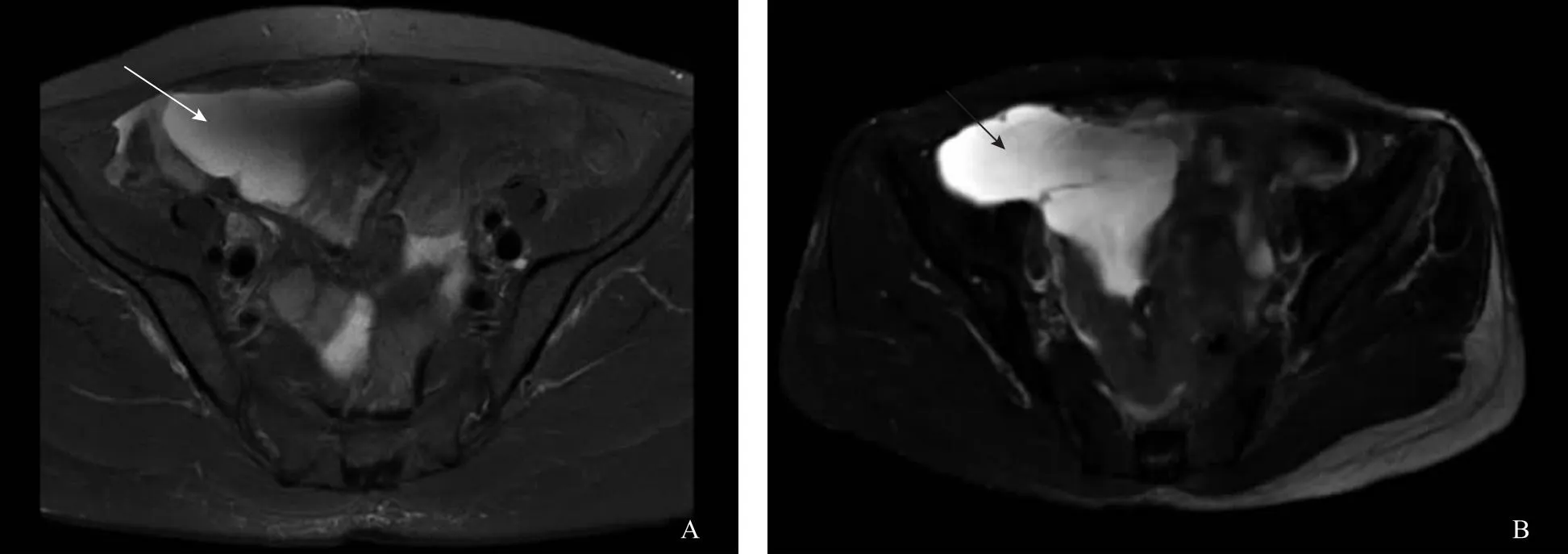
A:术后5个月盆腔MRI(T2W1)图像,箭头示右下腹多房囊性肿物;B:术后9个月盆腔MRI(T2W1)图像,箭头示腹、盆腔多房囊性占位,病灶较前增大。图3 术后盆腔MRI图像
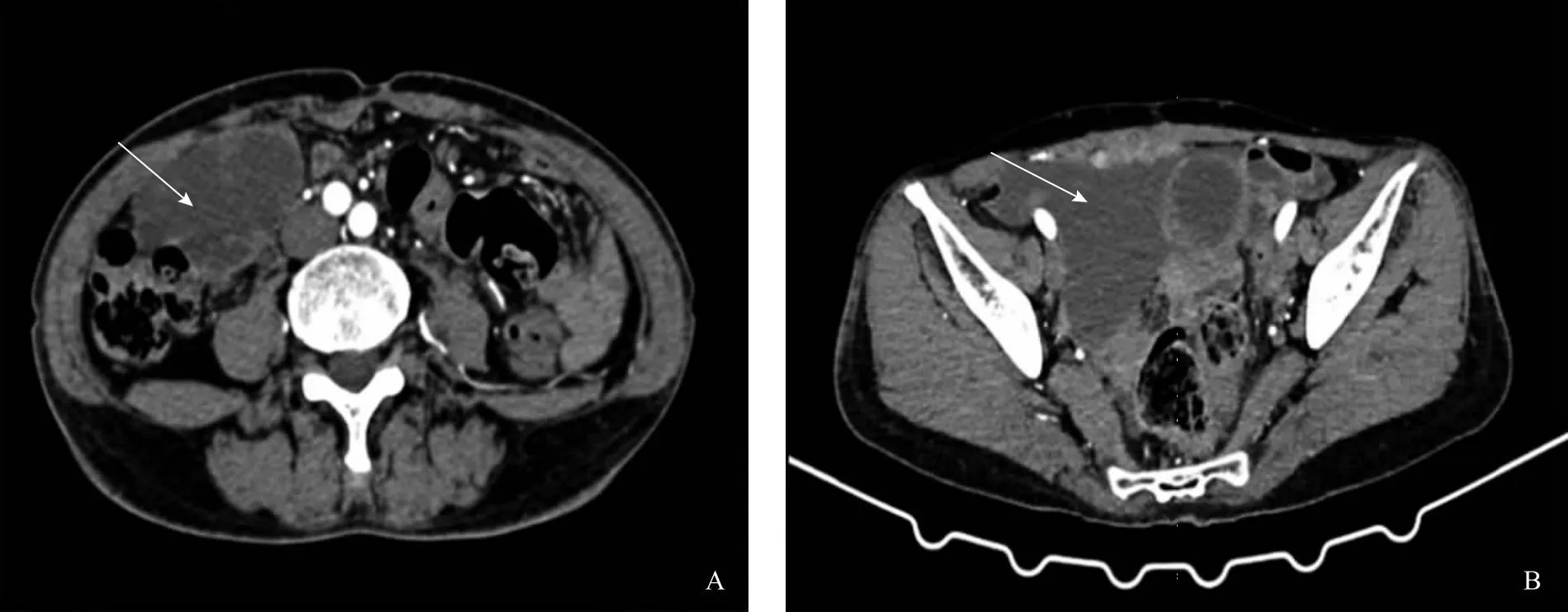
A:术后5个月腹部CT检查图像,箭头示右侧腹、盆腔多房囊性肿物;B:术后9个月腹部CT检查图像,箭头示右侧腹、盆腔多房囊性肿物,病灶较前增大。图4 术后腹部CT检查图像
UPS的诊断需参考临床表现及影像学检查,术前穿刺活检在明确诊断方面也具有一定意义,但其诊断的“金标准”仍是术后病理组织学检查。UPS的临床表现缺乏特异性,大多数患者因体表肿块、疼痛及压迫症状而就诊[7]。实验室检查缺乏特异性,通常肿瘤标志物无明显异常,但有文献报道炎症型UPS可能出现白细胞升高或类白血病反应[8]。影像学检查对UPS的诊断具有辅助作用。超声检查下,大部分UPS呈不规则形状,内部多为低回声,肿瘤内部和周边可见数量不等的彩色血流信号[9];尽管超声表现缺乏特征性,但可以初步确定肿瘤的大小、形态及与周围组织的关系。UPS在CT检查中的表现因肿瘤部位而异,但大多形态上呈卵圆形、不规则形或分叶形,平扫呈低密度,钙化很少见,边界不清;增强后呈多样性强化,可能与肿瘤内血管成分、纤维成分及坏死程度有关[10]。总的来说,CT检查对于UPS具有良好的定位效果。相较于CT,MRI具有更高的软组织分辨率,且可以进行多方位成像,因此在显示UPS病变范围、肿瘤成分、有无周围组织浸润方面更具优势[11],还可以更好地为手术方案的制定及术后复发情况的评估提供依据。UPS在T1W1上多呈等信号,如病灶合并坏死则表现为低信号,合并出血则表现为高信号;在T2W1上表现为低、等、高混杂信号[12]。
UPS的大体组织多表现为孤立或分叶状的鱼肉样肿物,切面多为灰色或白色。显微镜下,常观察到由呈束状或席纹状排列的梭形细胞和多形性细胞混合而成的瘤组织,其特征表现为多形性区域出现大量染色质丰富、核不规则的多核巨细胞[13],瘤细胞中常见病理性核分裂象;间质中富含血管和胶原纤维,可有炎症细胞浸润。UPS的免疫组化标记物没有特异性,但在多数病例中可见Vimentin、CK、CD68、EMA表达。Al-Agha等[14]认为UPS仅对Vimentin表现出弥散且较强的免疫反应,Vimentin(+)对诊断UPS具有重要意义。
UPS的鉴别诊断包括多形性脂肪肉瘤、多形性平滑肌肉瘤、多形性横纹肌肉瘤、黏液纤维肉瘤和恶性黑色素瘤等其他间叶源性肿瘤[13]。本例患者肿瘤发病部位为子宫宫角处,且肿块巨大,约30 cm×25 cm×10 cm大小,临床上极其罕见,容易误诊误治,术前需与卵巢良恶性肿瘤、输卵管恶性肿瘤、消化道肿瘤等鉴别。其临床表现、影像学检查、病理特征与文献中的描述大致符合,但术前未进一步行MRI及穿刺病理组织活检来明确肿瘤性质,导致术前并未制定合适的治疗方案,这是在以后的临床诊疗工作中需要改正的地方。
UPS患者的主要治疗目标是提高生存率、降低复发率,并最大限度地保留功能,提高生活质量。目前,UPS的首选治疗方式是手术治疗,手术原则是完整切除肿瘤及肿瘤周围1 cm的正常组织,并确保切缘为阴性[15]。此外,UPS淋巴转移的风险并不高,术中是否需要清扫淋巴结因个体而异。大部分学者认为放疗可以减少UPS的复发及转移[16]。然而,放疗的时机目前仍存在争议,一些学者发现,在术后进行放疗的UPS患者,10年无复发生存率为62%,总体生存率为80%[17]。其他学者则提出相较于术后放疗,术前放疗者复发率更低、总生存率更高[18]。而Peiper等[19]认为术前放疗+手术+术后放疗在UPS这类高级别肉瘤中具有显著效果,可缩小肿瘤范围并降低术后复发率。化疗是否能作为治疗UPS的一种重要方式,目前也存在争议。常用的术后化疗药物包括多柔比星和异环磷酰胺[20],一些研究发现,多柔比星和异环磷酰胺的联合应用可显著提高患者的总生存率[21],但也有研究指出化疗可能增加患者的病死率[22]。随着靶向药物及免疫检查点抑制剂(PD-1、PDL-1抑制剂)的快速发展,它们也逐渐被应用于软组织肉瘤的治疗中。目前尚无指南推荐用于治疗UPS的靶向药物,但临床上已有一些靶向药物投入使用,如派母单抗、贝伐单抗、安罗替尼等。一项研究通过对86例UPS患者进行二期临床试验,得出派母单抗对UPS有效的结论[23]。因此,靶向治疗与免疫治疗有望成为晚期UPS患者的最佳治疗方案。本例患者以手术治疗为主,术前及术后均未行放疗,手术完整切除了肿块、子宫、双侧附件和大网膜,但未切除肿瘤周围其它正常组织,也未清扫淋巴结。术后未行基因检测,给予多柔比星化疗6次,未采用多柔比星联合异环磷酰胺的化疗方案。术后9个月考虑复发,口服安罗替尼行靶向治疗至今。
总体来说,UPS恶性程度高,术后易复发,预后较差。影响预后的因素包括肿瘤部位、大小、浸润深度、分化程度、肿瘤切除是否彻底以及是否发生远处转移等[24]。其远处转移最常见的部位是肺,其次是骨、肝等,所以建议UPS患者术后定期行胸部CT检查,以评估是否发生肺部转移。国外一项研究显示UPS患者复发率高达50%,5年生存率仅有14%[25]。有学者提出UPS患者肿瘤越大(直径>5 cm)、位置越深,预后越差[26]。另外有研究表明不同部位的UPS,患者的总生存率也有所差异,例如躯干和四肢UPS患者的5年总生存率约为77%,而头颈部患者的5年总生存率仅为48%[24]。本例患者术后9个月考虑肿瘤复发,随访至今,患者诉下腹痛逐渐加重,选择继续口服靶向药物,后续仍会定期随访。
综上,UPS好发于中老年人的四肢等部位,因其无特征性临床症状,临床上容易误诊误治,需要与其它疾病仔细鉴别。超声、CT、MRI等影像学检查在术前诊断中具有重要意义,但术后病理组织学检查仍是诊断UPS的“金标准”。其治疗方式以手术治疗为主,放疗、化疗等其他治疗为辅,但术后易复发,预后较差,需严密随访。本例患者术后仅9个月复发的可能原因包括:(1)术前肿瘤巨大,约30 cm×25 cm×10 cm;(2)术前未能完善相关辅助检查;(3)术中未切除肿瘤周围其它正常组织,也未清扫淋巴结;(4)术前及术后均未行放疗;(5)术后未行基因检测来指导后续治疗;(6)术后未采用多柔比星联合异环磷酰胺的化疗方案,仅给予多比柔星单药治疗。本文通过报告本例患者的诊治及预后情况,为加强临床上对该肿瘤的认知、吸取经验教训、减少误诊及制定最佳的治疗方案提供了一定的借鉴和参考,以期改善此类患者的预后。

