硫醇加成/氧化构建具稳定阻转异构体的萘醌化合物
吴玉玲, 詹 固, 黄 维.
(成都中医药大学 药学院 西南特色中药资源国家重点实验室,四川 成都 611137)
萘醌类化合物作为天然产物中分布最为广泛的物质之一(例如Shikonin, Phenanthroviridin aglycon和Jadomycin A等,图1a),皆具有良好的生物学效应[1-3]。已有研究表明:多种萘醌衍生物具有良好的抗炎、抗肿瘤以及肝保护作用。如具萘醌母核的紫草素可通过抑制巨噬细胞中HMGB蛋白的表达、抑制核转录因子NF-κB的活性、抑制肿瘤坏死因子TNF-α的表达和TLR4信号通路的传递来发挥抗炎作用[4];经过后期结构修饰的酰基-β-糖基紫草宁衍生物对K562/ADR, MCF-7/ADR, HL60/ADR等耐药肿瘤细胞表现出显著的细胞毒性[5]。萘醌母核作为一种优势骨架也广泛存在于酶抑制剂和靶向药物分子中,如STAT3抑制剂Napabucasin(BBI608), TDO/IDO抑制剂Halenaquinone等[6-7](图1a)。同时,萘醌类物质本身是一类很好的天然色素,大多带有丰富而鲜艳的颜色,在染料,食品色素和化妆品行业表现出极大的应用价值[8]。因此,通过廉价易得的材料开发一种便捷、高效的途径来制备不同类型的萘醌衍生物对进一步探索此类物质的潜在功能和应用价值具有重要意义。
另一方面,手性是自然界的本质属性,广泛存在于各种天然产物和生物活性分子中。当前,针对化合物的手性研究一直是有机化学和药物合成领域的重点和前沿话题,在药物研发过程中具有重要意义,尤其是不同构型的2个异构体所表现出的活性差异甚至是相反的药理活性对研究稳定及安全的候选药物至关重要。除研究广泛的中心手性外,药物分子和其他功能性分子中所含的轴手性元素近年来也受到极大的重视。重要的是,当中心手性和轴手性同时存在时,与手性中心相比,轴手性所产生的影响可能更大。已有研究表明:阻转异构体对受体和酶靶标表现出不同的生物活性,并且在药理学、毒理学和药代动力学特性方面也不同[9-10]。因此,开发全新的合成策略构建含轴手性的化合物从而探究其作用规律和进一步的应用价值将是一个长久的课题。
联芳基萘醌类化合物的基本结构为萘醌与另一个芳环通过单键直接相连,萘醌母核的双键位点具有很好的反应活性,能够通过各种加成、偶联等反应方式来构建具有高度官能团化的衍生物[11-13]。虽然对于联芳基萘醌化合物的研究很广泛,但涉及到轴手性萘醌的合成研究却较少,与其它联苯型或杂环型的轴手性化合物相比,萘醌型轴手性化合物的构建更具有挑战性,目前只有少数直接的策略已被报道。如2020年,DONG课题组以螺环吡咯烷恶唑啉(SPDO)为配体,在铜催化下,首次实现了C-2位阻吲哚与萘醌酯的直接不对称偶联反应,以良好的产率和对映选择性得到了多种结构的轴手性3-萘醌吲哚[14];CHEN等在手性磷酸催化下将亲核试剂直接加成到萘醌位点上,通过中心-轴手性转换获得了具有稳定轴手性的萘醌化合物[15];SAGAR D等报道了第一个二芳基胺类骨架的第一个阻转选择性合成实例,即N-芳基醌类化合物在手性磷酸催化下的原子选择性亲电卤化反应,该方法以优异的产率和阻转选择性产生了立体化学稳定的N-芳基萘醌类化合物[16]。另外,(1,2′-联萘)-1′,4′-二酮与常见的2,2′-双取代的1,1′-联萘不同,其手性轴的旋转能垒较小,室温下构型不稳定,故通过简单高效反应构建具有稳定阻转异构体的1,2′-联萘醌是一项有吸引力的课题。
本文通过对(1,2′-联萘)1′,4′-萘醌和硫醇间加成/氧化反应条件的探索,以及对萘环上取代基的合理选择,设计合成了一类具有稳定轴手性的萘醌衍生物,所得产物经手性柱分析,证实了阻转异构体的存在。以不同位阻取代的(1,2′-联萘)1′,4′-萘醌(1)为底物,醋酸铜为助氧剂,乙醇作为溶剂,在三乙胺的催化下,硫醇(2)作为亲核试剂加成,随后在醋酸铜的催化下经空气迅速氧化,成功得到产物3(图1b)。该策略经历了一个轴转中心再转轴的过程,硫醇作为亲核试剂加成之后,形成具有中心手性的中间体,此时C—C轴已经稳定存在,随后发生氧化,中心手性消失,轴向手性形成,由此,成功得到一对稳定的阻转异构体化合物。
1 实验部分
1.1 仪器与试剂
BUCHI M-565型熔点仪;Bruker-600/150 MHz型核磁共振仪(DMSO-d6或CDCl3为溶剂,TMS为内标); Agilent G1969-85000型质谱仪; 岛津LC-16型高效液相色谱系统; RCT basic Ⅱ型磁力搅拌器; RE-2000B型旋转蒸发仪; SHB-Ⅲ-021型紫外暗箱式分析仪。
所用试剂均为分析纯。
1.2 萘醌衍生物(3a~3i)的合成
在干净的10 mL反应试管中,加入(1,2′-联萘)-1′,4′-萘醌(1, 0.10 mmol)、硫醇(2, 2.5 eq.)、C2(10%,物质的量分数,下同)和Cu(OAc)2(0.2 eq.),随后,加入溶剂乙醇(2.0 mL),在氧气氛围25 ℃下搅拌混合物直到原料完全被消耗(TLC监测)。反应完成后,通过硅胶快速柱色谱纯化,洗脱剂为石油醚 ∶乙酸乙酯=10 ∶1~5 ∶1,V∶V,最终得到产物3。
2-(苄氧基)-3′-(苄硫基)-[1,2′-联萘]-1′,4′-二酮(3a): 黄色固体,收率81%, m.p.48.4~49.0 ℃;1H NMR(600 MHz, DMSO-d6)δ: 8.12(dd,J=7.2 Hz, 1.8 Hz, 1H), 8.00(d,J=9.0 Hz, 2H), 7.94~7.85(m, 3H), 7.52(d,J=9.0 Hz, 1H), 7.46(d,J=9.6 Hz, 1H), 7.42~7.35(m, 2H), 7.29~7.24(m, 2H), 7.24~7.20(m, 3H), 7.13~7.09(m, 3H), 7.04(dd,J=7.8 Hz, 2.4 Hz, 2H), 5.21(d,J=12.6 Hz, 1H), 5.16(d,J=12.6 Hz, 1H), 4.29(d,J=13.2 Hz, 1H), 4.18(d,J=13.2 Hz, 1H);13C NMR(150 MHz, DMSO-d6)δ: 181.8, 181.1, 153.4, 150.6, 143.0, 137.7, 137.6, 134.8, 134.4, 133.3, 132.3, 131.8, 131.0, 129.3, 128.8, 128.7, 128.6, 128.1, 127.6, 127.4, 127.4, 127.1, 126.7, 124.6, 124.3, 117.8, 115.3, 70.6, 37.5; HR-MS(ESI-TOF)m/z: Calcd for C34H24O3NaS+{[M+Na]+}535.1338, found 535.1336。
2-(苄氧基)-3′-((2-甲基苄基)硫基)-[1,2′-联萘]-1′,4′-二酮(3b): 黄色固体,收率76%, m.p.43.8~44.2 ℃;1H NMR(600 MHz, DMSO-d6)δ: 8.15(dd,J=7.2 Hz, 1.8 Hz, 1H), 8.01(d,J=7.2 Hz, 1H), 7.99(d,J=9.6 Hz, 1H), 7.95~7.87(m, 3H), 7.54~7.49(m, 2H), 7.42~7.35(m, 2H), 7.28(dd,J=7.8 Hz, 3.6 Hz, 2H), 7.26~7.20(m, 3H), 7.02(td,J=7.2 Hz, 1.8 Hz, 1H), 6.98(dd,J=7.8 Hz, 1.8 Hz, 2H), 6.94(td,J=7.2 Hz, 1.2 Hz, 1H), 5.21(d,J=12.6 Hz, 1H), 5.17(d,J=12.6 Hz, 1H), 4.19(d,J=12.0 Hz, 1H), 4.08(d,J=12.0 Hz, 1H), 1.93(s, 3H);13C NMR(150 MHz, DMSO-d6)δ: 181.8, 181.2, 153.5, 150.9, 142.8, 137.6, 137.2, 134.9, 134.8, 134.4, 133.3, 132.3, 131.9, 131.0, 130.8, 130.2, 128.8, 128.7, 128.6, 128.2, 128.1, 127.4, 127.4, 127.1, 126.7, 126.4, 124.6, 124.3, 117.7, 115.1, 70.5, 36.0, 18.8; HR-MS(ESI-TOF)m/z: Calcd for C35H26O3NaS+{[M+Na]+}549.1495, found 549.1502。
2-(苄氧基)-3′-((4-甲氧基苄基)硫基)-[1,2′-联萘]-1′,4′-二酮(3c): 黄色固体,收率70%, m.p.44.7~45.6 ℃;1H NMR(600 MHz, CDCl3)δ: 8.18(dd,J=7.8 Hz, 1.8 Hz, 1H), 8.08(dd,J=7.2 Hz, 1.8 Hz, 1H), 7.89(d,J=9.0 Hz, 1H), 7.82(dd,J=6.6 Hz, 3.6 Hz, 1H), 7.78~7.70(m, 2H), 7.35(dt,J=9.6 Hz, 3.0 Hz, 2H), 7.31(d,J=9.0 Hz, 1H), 7.31~7.27(m, 3H), 7.26~7.20(m, 3H), 6.94(d,J=9.0 Hz, 2H), 6.62(d,J=8.4 Hz, 2H), 5.19(d,J=12.6 Hz, 1H), 5.14(d,J=12.6 Hz, 1H), 4.25(d,J=12.6 Hz, 1H), 3.92(d,J=12.6 Hz, 1H);13C NMR(150 MHz, CDCl3)δ: 182.3, 181.0, 158.8, 153.5, 150.6, 143.5, 137.2, 133.9, 133.3, 133.2, 132.6, 131.8, 131.0, 130.4, 129.3, 128.9, 128.5, 128.5, 127.7, 127.2, 127.0, 126.9, 126.8, 124.2, 124.0, 114.5, 113.9, 71.1, 55.2, 37.5; HR-MS(ESI-TOF)m/z: Calcd for C35H26O4NaS+{[M+Na]+}565.1444, found 565.1443。
2-(苄氧基)-3′-(邻甲苯硫基)-[1,2′-联萘]-1′,4′-二酮(3d): 黄色固体,收率65%, m.p.82.4~83.2 ℃;1H NMR(600 MHz, CDCl3)δ: 8.14(dd,J=7.2 Hz, 1.8 Hz, 1H), 8.11(dd,J=7.2 Hz, 1.2 Hz, 1H), 7.79(d,J=8.4 Hz, 1H), 7.78~7.70(m, 3H), 7.56(d,J=8.4 Hz, 1H), 7.44(t,J=8.4 Hz, 1H), 7.39~7.33(m, 1H), 7.35~7.30(m, 2H), 7.29~7.21(m, 3H), 7.11(d,J=9.0 Hz, 1H), 6.97(td,J=7.8 Hz, 1.8 Hz, 1H), 6.93(dd,J=7.2 Hz, 1.2 Hz, 1H), 6.87(dd,J=7.8 Hz, 1.2 Hz, 1H), 6.70(td,J=7.2 Hz, 1.8 Hz, 1H), 5.12(d,J=12.0 Hz, 1H), 5.08(d,J=12.0 Hz, 1H), 2.12(s, 3H);13C NMR(150 MHz, CDCl3)δ: 181.6, 181.4, 153.4, 150.5, 143.8, 140.2, 137.1, 134.0, 133.5, 133.5, 132.8, 132.7, 131.7, 131.5, 130.9, 130.0, 128.9, 128.6, 128.5, 128.1, 127.8, 127.1, 127.0, 127.0, 127.0, 125.9, 124.1, 123.9, 117.1, 113.8, 70.6, 20.7; HR-MS(ESI-TOF)m/z: Calcd for C34H24O3NaS+{[M+Na]+}535.1338, found 535.1337。
2-(苄氧基)-3′-(4-甲苯硫基)-[1,2′-联萘]-1′,4′-二酮(3e): 黄色固体,收率85%, m.p.83.5~83.9 ℃;1H NMR(600 MHz, CDCl3)δ: 8.10(dd,J=6.6 Hz, 2.4 Hz, 2H), 7.77~7.69(m, 4H), 7.48(dd,J=9.0 Hz, 1.2 Hz, 1H), 7.40(td,J=7.8 Hz, 1.2 Hz, 1H), 7.35~7.29(m, 3H), 7.28~7.21(m, 3H), 7.13(d,J=9.0 Hz, 1H), 6.88(d,J=7.8 Hz, 2H), 6.69(d,J=7.8 Hz, 2H), 5.14(d,J=12.0 Hz, 1H), 5.10(d,J=12.0 Hz, 1H), 2.16(s, 3H);13C NMR(150 MHz, CDCl3)δ: 181.7, 181.6, 153.2, 150.4, 143.6, 137.8, 137.2, 134.0, 133.5, 132.8, 132.7, 132.4, 132.0, 130.7, 129.2, 128.9, 128.6, 128.5, 128.1, 127.8, 127.1, 127.0, 127.0, 127.0, 124.1, 123.9, 117.2, 113.9, 70.8, 21.2; HR-MS(ESI-TOF)m/z: Calcd for C34H24O3NaS+{[M+Na]+}535.1338, found 535.1338。
3′-(苄硫基)-2-(甲氧基)-[1,2′-联萘]-1′,4′-二酮(3f): 黄色固体,收率83%, m.p.79.6~78.6 ℃;1H NMR(600 MHz, CDCl3)δ: 8.19(dd,J=7.8 Hz, 1.8 Hz, 1H), 8.09(dd,J=7.2 Hz, 1.8 Hz, 1H), 7.94(d,J=8.4 Hz, 1H), 7.85~7.81(m, 1H), 7.75(pd,J=7.4 Hz, 1.6 Hz, 2H), 7.37~7.30(m, 3H), 7.26~7.21(m, 1H), 7.19~7.11(m, 3H), 7.04(dd,J=7.2 Hz, 3.0 Hz, 2H), 4.29(d,J=13.2 Hz, 1H), 4.01(d,J=13.2 Hz, 1H), 3.84(s, 3H);13C NMR(150 MHz, CDCl3)δ: 182.3, 181.0, 154.2, 150.3, 143.8, 137.4, 133.9, 133.4, 133.2, 132.5, 131.7, 131.1, 129.2, 128.8, 128.5, 128.4, 127.3, 127.2, 127.0, 126.9, 124.0, 123.8, 117.0, 113.0, 56.6, 37.9; HR-MS(ESI-TOF)m/z: Calcd for C28H20O3NaS+{[M+Na]+}459.1025, found 459.1025。
3′-(苄硫基)-2-(乙氧基)-[1,2′-联萘]-1′,4′-二酮(3g): 黄色固体,收率63%, m.p.83.9~90.5 ℃;1H NMR(600 MHz, CDCl3)δ: 8.19(dd,J=7.8 Hz, 1.8 Hz, 1H), 8.09(dd,J=7.2 Hz, 1.2 Hz, 1H), 7.92(d,J=9.0 Hz, 1H), 7.85~7.80(m, 1H), 7.79~7.71(m, 2H), 7.37~7.29(m, 3H), 7.25~7.20(m, 1H), 7.15~7.11(m, 3H), 7.06~7.01(m, 2H), 4.28(d,J=12.6 Hz, 1H), 4.13(p,J=7.0 Hz, 2H), 3.96(d,J=12.6 Hz, 1H), 1.25(t,J=6.6 Hz, 3H);13C NMR(150 MHz, CDCl3)δ: 182.3, 181.1, 153.8, 150.1, 144.0, 137.4, 133.9, 133.4, 133.2, 132.6, 131.8, 131.0, 129.2, 128.8, 128.5, 128.4, 127.3, 127.1, 126.9, 126.8, 124.1, 123.8, 117.4, 114.1, 65.0, 37.8, 15.1; HR-MS(ESI-TOF)m/z: Calcd for C29H22O3NaS+{[M+Na]+}473.1182, found 473.1182。
3′-(苄硫基)-2-((4-甲氧基苄基)氧基)-[1,2′-联萘]-1′,4′-二酮(3h): 黄色固体,收率60%, m.p.44.1~45.1 ℃;1H NMR(600 MHz, DMSO-d6)δ: 8.11(dd,J=7.2 Hz, 1.8 Hz, 1H), 7.99(d,J=9.0 Hz, 2H), 7.94~7.86(m, 3H), 7.53(d,J=9.0 Hz, 1H), 7.45~7.41(m, 1H), 7.41~7.35(m, 2H), 7.20(d,J=9.0 Hz, 2H), 7.15~7.09(m, 3H), 7.03(dd,J=7.2 Hz, 2.4 Hz, 2H), 6.77(d,J=8.4 Hz, 2H), 5.13(d,J=12.0 Hz, 1H), 5.07(d,J=12.0 Hz, 1H), 4.28(d,J=12.6 Hz, 1H), 4.16(d,J=12.6 Hz, 1H), 3.68(s, 3H);13C NMR(150 MHz, DMSO-d6)δ: 181.8, 181.0, 159.2, 153.5, 150.5, 142.9, 137.7, 134.7, 134.3, 133.3, 132.2, 131.7, 130.9, 129.3, 129.3, 129.2, 128.8, 128.8, 128.6, 127.6, 127.3, 127.0, 126.7, 124.6, 124.2, 117.8, 115.4, 114.1, 70.5, 55.4, 37.4; HR-MS(ESI-TOF)m/z: Calcd for C35H26O4NaS+{[M+Na]+}565.1444, found 565.1503。
2-((3,5-二叔丁基苄基)氧基)-3′-(4-甲苯硫基)-[1,2′-联萘]-1′,4′-二酮(3i): 黄色固体,收率67%, m.p.43.6~44.5 ℃;1H NMR(600 MHz, CDCl3)δ: 8.14~8.09(m, 2H), 7.82(d,J=9.0 Hz, 1H), 7.79(d,J=8.4 Hz, 1H), 7.76~7.70(m, 2H), 7.50(d,J=8.4 Hz, 1H), 7.42(t,J=6.6 Hz, 1H), 7.34(t,J=6.6 Hz, 1H), 7.30(t,J=1.8 Hz, 1H), 7.23(d,J=9.6 Hz, 1H), 7.19(d,J=1.8 Hz, 2H), 6.89(d,J=7.8 Hz, 2H), 6.64(d,J=7.8 Hz, 2H), 5.13(d,J=11.4 Hz, 1H), 5.10(d,J=11.4 Hz, 1H), 2.16(s, 3H), 1.19(s, 18H);13C NMR(150 MHz, CDCl3)δ: 181.5, 181.5, 153.2, 151.0, 150.4, 144.1, 137.7, 136.2, 134.0, 133.5, 132.9, 132.7, 132.4, 132.1, 130.7, 129.2, 128.9, 128.5, 128.4, 127.2, 127.1, 127.1, 124.0, 123.8, 121.6, 121.0, 117.0, 113.6, 71.0, 34.8, 31.4, 21.2; HR-MS(ESI-TOF)m/z: Calcd for C42H40O3NaS+{[M+Na]+}647.2590, found 647.2591。
2 结果与讨论
2.1 反应条件分析
以(1,2′-联萘)1′,4′-萘醌1a和硫醇2a为底物在不加碱的条件下,反应不能进行,未能得到目标产物,加入0.5 eq.的Et3N后,反应可正常发生,且以不错的收率得到了萘醌化合物3a。在成功拿到目标产物后,对反应条件进行了优化(表1)。首先,本文对反应溶剂进行了筛选(Entries 2~7),发现溶剂效应对反应的收率有较大影响,使用乙醇做溶剂时,反应效果极佳,在室温下即可达到高转化率和高收率,而醚系和苯系溶剂的反应效果很差,故选用乙醇为反应溶剂。进一步本文将Et3N的用量减少到0.1 eq.,发现反应仍然可以高效进行,收率无明显改变(Entry 8)。最终,确定了反应条件:以Et3N(0.1 eq.)为碱,Cu(OAc)2(0.2 eq.)为助氧剂,于氧气氛围、25 ℃条件下在乙醇中进行反应。
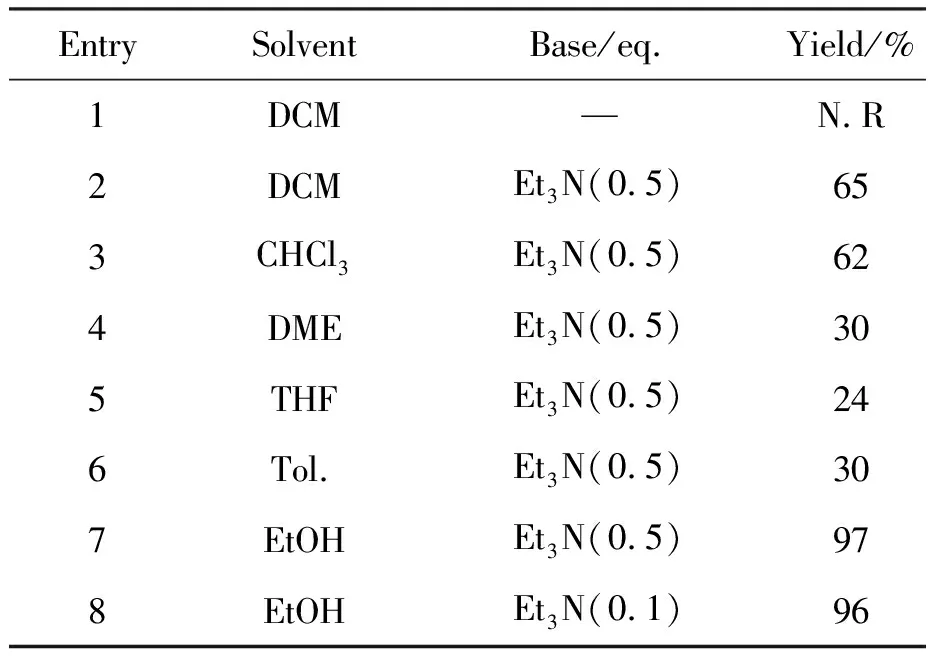
表1 合成3a的反应条件优化
2.2 底物范围分析
在最优条件确定后,对底物的适用范围进行了考察(图2)。用不同位阻的底物进行反应,均能以良好的收率得到产物3a~3i,但底物的位阻效应对反应效果有一定的影响。保持底物1萘环上的R1基团为苄氧基不变,不同取代的硫醇或硫酚参与反应,均能成功得到目标化合物,但位阻更大的2-甲基苯硫酚的产率有所下降(如3a~3e)。保持底物2为苄硫醇不变,改变底物1,发现其同样能影响反应的效果(如3f~3h)。另外,将底物换为位阻更大的3,5-二叔丁基苄硫醇时,产物收率仅有67%(如3i,与3e相比)。

图2 底物范围分析
2.3 代表产物3a的HPLC手性分析
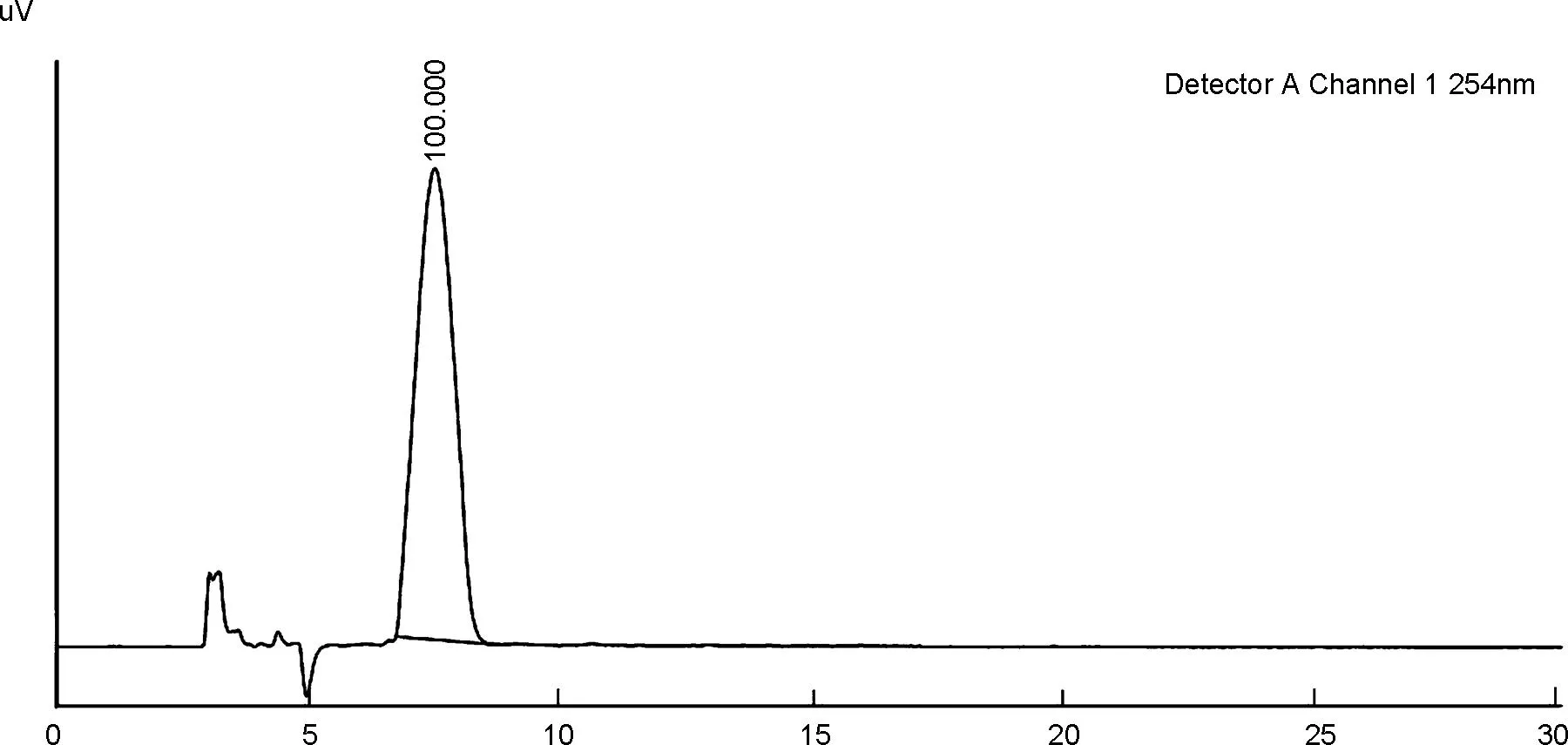
以构建的化合物3a为代表,通过高效液相色谱系统和手性分析柱(IA)进行检测分析,结果显示:在保留时间为23 min和38 min时各出现一个峰,二者比例为50 ∶50,即产物为含有一对阻转异构体的消旋体,也证实了本文构建的萘醌产物的C—C轴具备足够的稳定性(图3)。同时,为方便进行直观的比较,本文对反应的底物1a也进行了手性分析。以IG柱(正己烷 ∶异丙醇=70 ∶30,V∶V)进行测试,结果显示在保留时间为7.5 min时出现一个峰(图4),随后,将流动相极性进一步减小(正己烷 ∶异丙醇=90 ∶10,V∶V)(图4),这是因为化合物1a的C—C轴为半稳定状态,构象之间处于持续相互转化的过程中,并不能得到足够稳定的一对阻转异构体(使用其它手性柱如IA、 AD等进行了测试,所有分析结果的峰形均相同)。
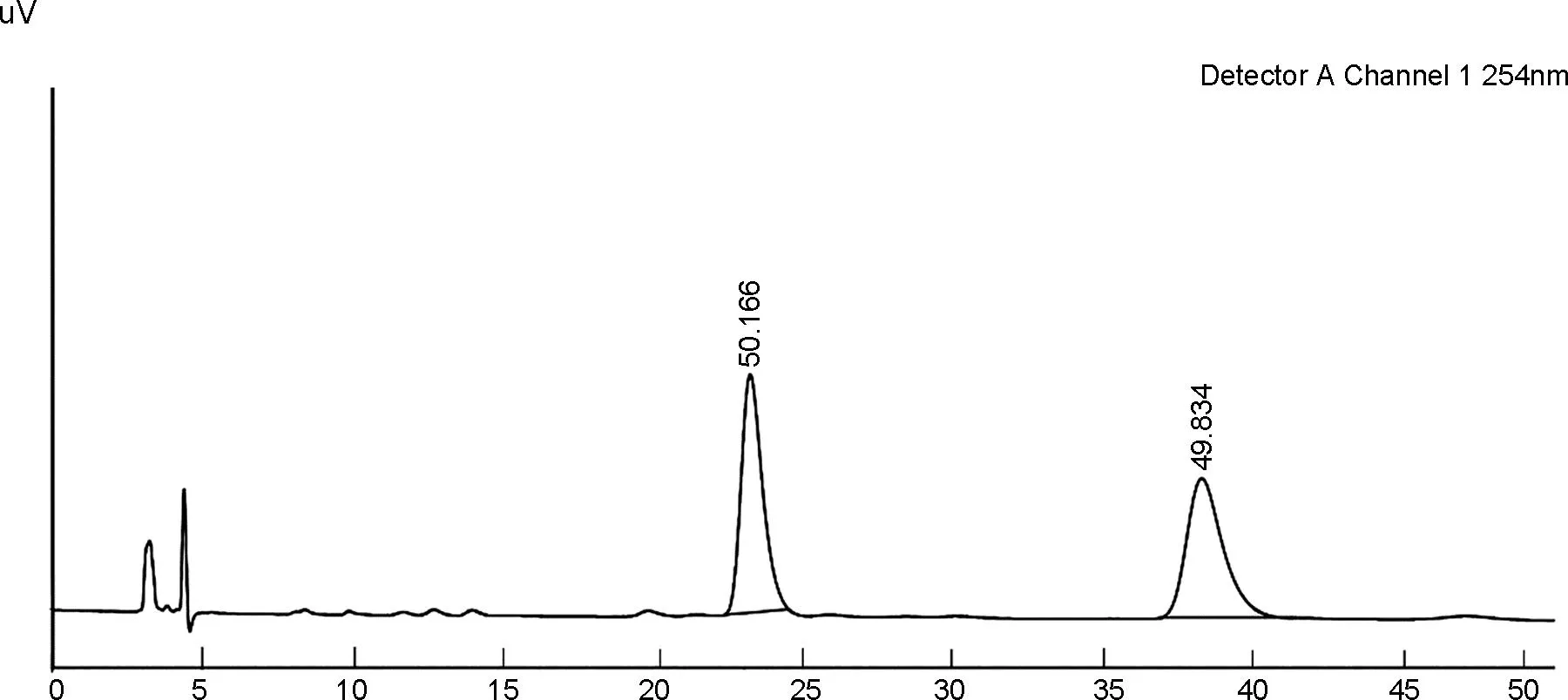
time/min图3 化合物3a的手性分析
time/min

time/min图4 底物1a的手性分析
在三乙胺的作用下,以不同位阻取代的(1,2′-联萘)-1′,4′-二酮为底物,醋酸铜为助氧剂,乙醇为溶剂进行了硫醇的加成/氧化反应,通过对反应条件的筛选和底物普适性的考察,以温和的条件和良好的产物收率成功合成了9种具有稳定阻转异构体的萘醌衍生物,为轴手性萘醌类化合物的构建提供了新途径。该策略中使用的催化剂三乙胺和助氧剂醋酸铜具备经济、高效的优点;所用的溶剂系统符合绿色化学理念;反应物的化学活性好,产率高,有进一步扩大应用的可能。另外,本文对于产物进一步的立体选择性控制研究也正在进行。

