合成源1,4-萘醌类衍生物的抗肿瘤活性研究进展
付毅红, 刘佳敏, 唐震华, 王贞超,2,3*, 欧阳贵平,2,3*
(1. 贵州大学 药学院,贵州 贵阳 550025;2. 贵州医科大学 药用植物功效与利用国家重点实验室,贵州 贵阳 550014;3. 贵州省合成药物工程实验室,贵州 贵阳 550025)
萘醌是一种在自然界中分布广泛的天然色素,因其具有重要的生物活性而受到广泛关注。根据醌环上两羰基位置的不同,萘醌可以分为三类:1,2-萘醌、1,4-萘醌以及2,6-萘醌(图1)。1,4-萘醌类化合物由于其广泛的生物学活性,包括抗菌[1]、抗病毒[2,3]、抗肿瘤[4-6]、抗疟[7]等作用而大量应用于医药和农业行业[8]。1,4-萘醌化合物结构常出现于多种癌症靶标抑制剂中,如DNA拓扑异构酶[9]、HSP90(热休克蛋白)[10]和单胺氧化酶(MAO)[11]等,因而1,4-萘醌衍生物已成为抗癌药物的研究热点之一。
1 概述
因其具有较好的抗肿瘤活性,1,4-萘醌主体结构的衍生物已大量应用于抗肿瘤药物的研究中,包括天然存在的简单结构,如Lawsone、Lapachol、Juglone、Shikonin、Plumbagin等(图1),也有更复杂的衍生物,例如阿霉素和那布卡星[12-14]等(图1)。这些1,4-萘醌衍生物的结构修饰方式有醌环取代、苯环醌环取代、萘醌并杂环等三种主要方式。前期文献调研发现,关于萘醌类衍生物的抗肿瘤活性研究主要偏重于1,2-萘醌或天然来源的萘醌类,并未针对合成源1,4-萘醌进行系统的抗肿瘤活性及构效关系分析。本文根据1,4-萘醌衍生物取代位的不同进行分类,主要对醌环取代、苯环醌环取代、萘醌并杂环这三大类合成源的1,4-萘醌衍生物的抗肿瘤活性进行综述,并进行构效关系分析,以期为后续新型1,4萘醌衍生物抗癌药物的设计提供一定的参考。
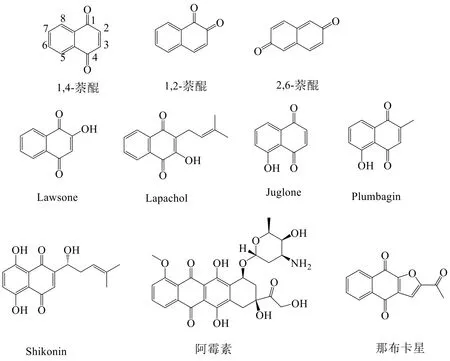
图1 萘醌的三种结构及含1,4-萘醌主体结构的衍生物
2 不同1,4-萘醌类结构的抗肿瘤活性
2.1 单醌环取代的1,4-萘醌衍生物
萘醌支架的C-2或C-3和C-5位置的氨基、羟基、甲基取代对癌细胞和正常细胞具有选择性毒性[15]。因此醌环上的取代位多为C-2或C-3,而常见的取代基有-NH2、-OH、-OR、-S、卤素及烷基等。
2017年Shin等[16]在CeCl3催化剂作用下,将1,4-萘醌与胺偶联反应合成了一系列2-氨基-1,4-萘醌衍生物,利用MTT法对卵巢癌细胞系A2780、SKOV3、OVCAR3进行细胞毒性测试,大部分化合物表现出中等强度的细胞毒性。而化合物1(图2)对三株卵巢癌细胞均表现出较强的抑制活性(IC50分别为5.6、2.8、6.8 μM),表现出了2-氨基-1,4-萘醌结构在卵巢癌药物开发中的巨大潜力。
同为单叔胺取代物,Valença等[17]引入N-磺酰基三唑基团,合成的N-磺酰-1,2,3-三唑杂化物有着更优越的活性和广谱性。作者通过2-氨基-1,4-萘醌与炔丙基溴的炔丙基化得到N-炔丙基化的2-氨基-1,4-萘醌,再通过铜催化的叠氮化物-炔烃环加成反应合成三唑,再与甲苯磺酰基反应即可得到目标产物。其中化合物2a、2b和2c(图2)对八种人癌细胞具有很高的活性,IC50在0.31~1.20 μM(72小时)范围内,可以作为抗癌药物的先导化合物。基于此,该团队将氮原子换成氧原子,分别以Lapachol、nor-Lapachol和Lawsone为原料,与丙炔基溴反应后,用以上的类似方法合成了磺酰基三唑系萘醌,得到的化合物3a、3b、3c(图2)对8种人癌细胞同样具有很强的抑制活性,IC50在0.27~4.22 μM范围内(72小时),这也说明磺酰基三唑系萘醌具有很高的研究价值。
Lapachol和Lawsone的结构总是备受青睐。2018年Romão团队[18]基于将化疗药物与多胺(PA)骨架结合可能提高药物的抗肿瘤活性的[19,20]原理,分别将Lapachol、Lawsone与多胺结构进行偶联,形成了新型化合物4a、4b、5(图2),并在胶质母细胞瘤(GBM)细胞系U87MG和GBM95中测试其活性。研究结果表明,与PA的结合增强了Lapachol、Lawsone对GBM细胞的抗肿瘤活性和抑制肿瘤侵袭的能力。作者进一步使用分子对接原理,证明了与PA的结合有利于1,4-萘醌与topo2α(DNA拓扑异构酶II-α)的ATP结合位点的相互作用,为新型抗肿瘤药物的设计提供了参考。
Prachayasittikul等[21]选择引入氯取代,以 2,3-二氯-1,4-萘醌为起始原料,通过氨基取代设计合成了一系列2-取代-3-氯-1,4-萘醌衍生物。以四种人癌细胞(HepG2肝癌细胞、HuCCA-1胆管癌细胞、A549肺癌细胞、MOLT-3急性 T淋巴细胞白血病细胞)为测试对象进行抑癌活性检测。研究结果发现:化合物对MOLT-3细胞毒性更好,其中化合物6a(为间乙酰基苯基氨基取代,图2)对HepG2、HuCCA-1、A549、MOLT-3的IC50分别达到4.758、2.364、12.279、3.193 μM;而6b(对乙酰基苯基氨基取代,图2)对MOLT-3的IC50达到2.118 μM,拥有最强细胞毒性,有一定的研究价值。而2017年Liu等[22]同样以2,3-二氯-1,4-萘醌为起始原料,通过与4-氨基甲酸苯甲酸取代、胺取代后,得到了17个2-取代-3-氯1,4-萘醌衍生物,得到的化合物7(图2)在十六种癌细胞系中均表现出优异的抗增殖活性(GI50为0.1~5 μM),对正常细胞则活性较差。且化合物7在体内体外对人多发性骨髓瘤细胞RPMI-8226均具有较好的抑制作用,是治疗多发性骨髓瘤的先导化合物。
除了氨基取代,硫取代也是1,4-萘醌抗癌药物中的常见基团,在抗癌活性方面的潜能不容小觑。2014年Sreelatha团队[23]合成了一系列具有硫醚和酰胺键的1,4-萘醌衍生物,并评估了化合物对宫颈癌细胞HeLa和舌鳞状细胞癌细胞SAS的抗癌活性,结果显示该系列化合物中8a、8b(图2)对SAS细胞有相对较好的活性,而3D-QSAR表明在硫附近的供电子基团的存在增强了对HeLa细胞的活性,为后续进行硫取代的化合物提供了一定参考价值。
Ning等[24]合成的2,3-二硫代氨基甲酸酯取代的萘醌化合物9(图2)对人结直肠癌细胞HCT116,人乳腺癌细胞MCF7、MDA-MB231,宫颈癌细胞HeLa,肺癌细胞H1299和黑色素瘤细胞B16细胞的IC50值最小为61 nM,最大为135 nM,抗癌活性极强且对正常细胞低毒性。后期生物实验证明:此化合物可以通过干扰癌细胞新陈代谢来抑制肿瘤细胞的增殖,是一种很有潜力的肿瘤代谢抑制剂。
2019年Schepetkin等[25]以含2,3位取代基的1,4-萘醌为母体,以细胞分裂周期25(Cdc25)和有丝分裂原激活的蛋白激酶激酶7(MKK7)为靶点,设计了三十个1,4-萘醌衍生物,以人体的9种癌细胞(肺癌、滑膜肉瘤、乳腺癌、结直肠腺癌、早幼粒白血病、单核白血病、慢性淋巴系白血病、急性单核白血病、淋巴癌)和外周血单核细胞为测试对象,发现大部分化合物均有较好的抑癌活性。其中化合物10a、10b、10c(图 2)对 MKK7具有较强的亲和性,甚至 10b的亲和值达到 230 nM,是非常有潜力的 MKK7抑制剂。
甲基取代在1,4-萘醌抗癌药物的设计较多,而长烷基取代基则并不多见。Kongkathip团队[26]以1-羟基-2-萘甲酸为原料,分九到十个步骤分别合成了十四个新型萘醌脂肪族酰胺和十七个萘醌脂肪族酯,并用KB细胞(人口腔表皮样癌细胞)测试其抗癌活性,构效关系结果表明:当脂肪族的碳链大于7时,萘醌脂肪族酰胺活性强于脂肪族酯。其中,表现最佳的化合物11(图2)对KB细胞的IC50为5.12 μM,为脂肪族的萘醌化合物提供了一定的参考价值。
Silva等[27]则设计将碳碳三键与醌环相邻,合成了一系列2,3-二炔取代-1,4-萘醌的衍生物,并在3种癌细胞(人胃癌细胞NCI-H358M、人卵巢癌细胞OVCAR-8和人前列腺癌细胞PC-3M)上进行细胞毒性测试,所得的化合物均表现出较强的抗增殖活性,较为突出的是12a(对3种细胞的IC50分别为2.98、2.28、4.28 μg/mL)、12b、12c、12d(图2),为1,4-萘醌衍生物的多样性提供了一定的参考价值。
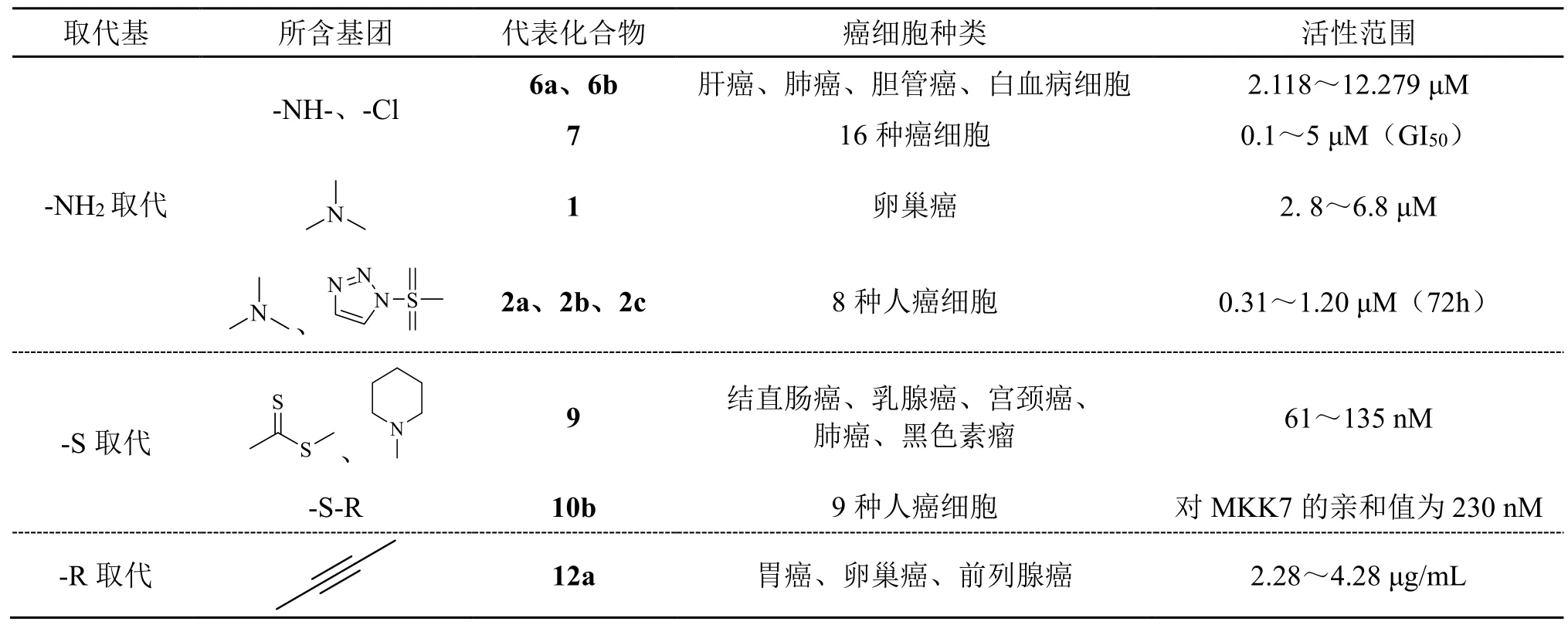
表1 单醌环取代的1,4-萘醌衍生物活性总结
1,4-萘醌衍生物的醌环取代基既有供电子基团,也有吸电子基团。通过表 1可以发现氨基中叔胺、仲胺取代均能获得较好的抗癌活性;含硫醚键和二硫代酯基取代的衍生物的抗癌活性达到了纳摩尔级,具有较为理想的抗癌活性;烷氧基取代及炔键取代;哌啶、磺酰基三唑杂环等也颇具研究价值。
2.2 苯环醌环均有取代的1,4-萘醌衍生物
2013年,Bhasin等[28]以Juglone、Plumbagin及课题组前期的先导化合物为设计基础,经过一系列反应得到PD系列的新型5-取代的萘醌衍生物,并以人前列腺癌细胞DU-145、乳腺癌细胞MDA-MB-231、结直肠癌细胞HT-29为测试对象,研究结果表明化合物13a、13b、13c、13d、13e、13f(图3)对三株癌细胞均具有较强的抗癌活性(IC50为1~3 μM),具有较高的研究价值。2015年Zhang等[29]以Juglone为原料,并引入三唑基团设计并合成了一系列5-取代化合物。所得的化合物中14a、14b(图3)对肺癌细胞A549的IC50为4.72、4.67 μM,是具有高活性的细胞毒性药物,构效关系分析认为在三唑的邻位上引入吸电子基有利于提高肿瘤细胞抑制活性。
2018年Li等[30]以3,5-二甲氧基苯甲醛为起始原料,得到3,5-二甲氧基苯乙酸,再经过酰化、环化,获得以5,7-二甲氧基-1,4-萘醌主体结构的一系列衍生物,而经过C-2氯化得到的化合物15(图3),对早幼粒急性白血病细胞HL-60的抑制效果是最好的,其IC50为3.8 μM,对正常细胞则为40.7 μM,具有高活性及高选择性,可以成为治疗早幼粒细胞性白血病的先导化合物,且经过构效分析认为2-Cl取代对活性强弱至关重要。同年[31],该团队以3,4,5-三甲氧基苯甲醛为起始原料,按上述方法得到了5个以2-氯-3-烷基-5,6,7-三甲氧基-1,4-萘醌为主体结构的新型衍生物。得到的化合物整体而言都具有较高的活性和选择性(对HL-60的IC50范围为2.85~12.89 μM),其中化合物2-氯-3-乙基-5,6,7-三甲氧基-1,4-萘醌(16,图3)具有最强抑癌活性,对HL-60的IC50为2.85 μM,而对正常细胞的IC50为23.81 μM。进一步的构效关系实验则认为在苯环上引入吸电子取代基,可以作为结构修饰的重点。
2019年Liu等[32]合成了一种新型1,4萘醌衍生物,命名为2-(萘-2-硫基)-5,8-二甲氧基-1,4-萘醌(17,图3),并采用MTT法在肝癌细胞HepG2、Hep3B和Huh7中进行细胞毒性测试,该化合物对三株癌细胞的IC50分别为0.87、0.90、2.84 μM。机制研究发现,化合物17还能通过ROS积累诱导HepG2细胞的凋亡,从而引起MAPK、AKT和STAT3信号通路的激活,并最终导致线粒体相关的凋亡,表明化合物17可能是治疗肝癌的潜在化合物。
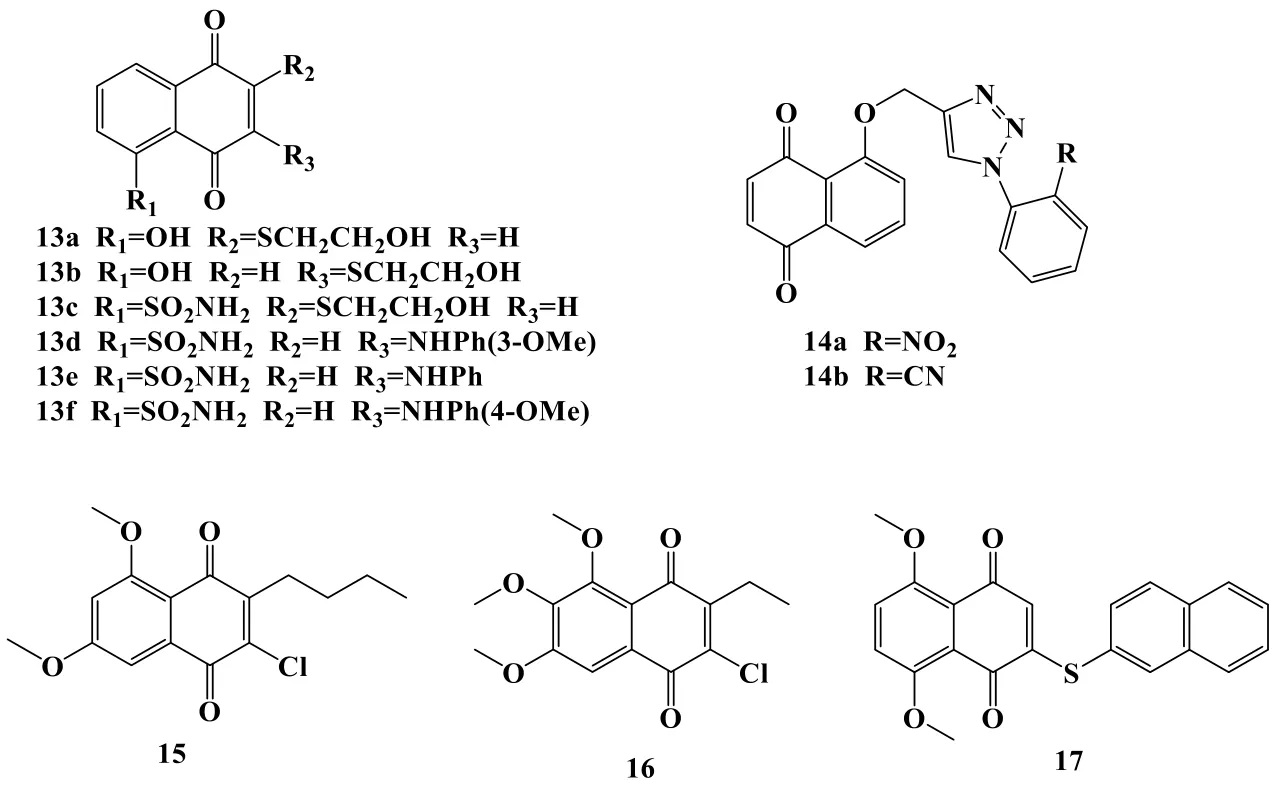
图3 苯环醌环均有取代的1,4-萘醌衍生物结构
从表2可以看出,苯环上的取代位多为5-位单取代或与7-位、8-位共取代,多连有吸电子取代基团,如-OH、-OCH3等,醌环上的取代基团仍是-NH2、-Cl、-S等,-SO2NH2也能获得较强的活性,有较好的研究价值。
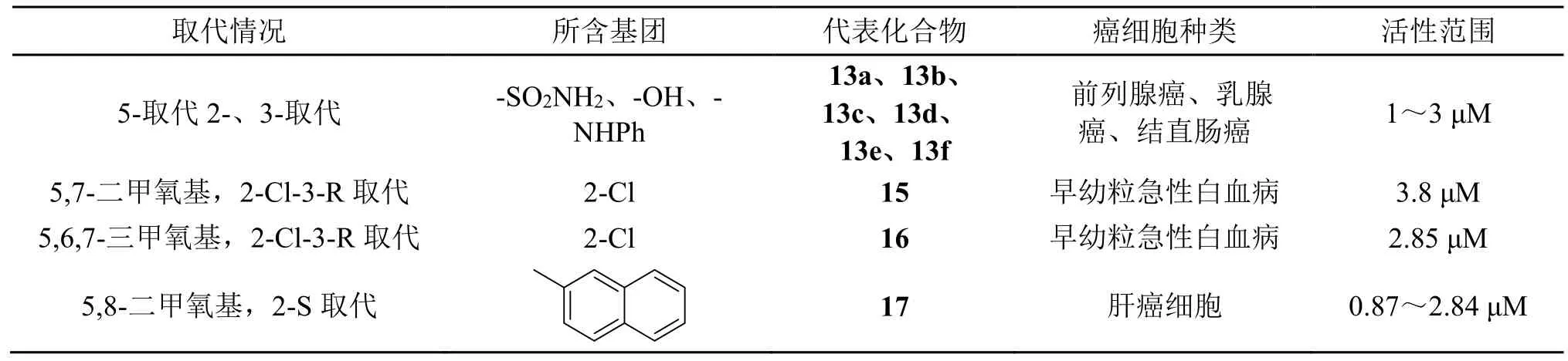
表2 苯环醌环均有取代的1,4-萘醌衍生物活性总结
2.3 1,4-萘醌并杂环衍生物
Zhang等[33]设计合成了两个环氧萘醌化合物18a、18b(图4),采用MTT法测试了其对三种肺癌细胞的细胞毒性,研究发现化合物对A549具有最强的毒性(IC50分别为2.59、7.54 μM),且对正常细胞低毒。化合物18a、18b可以通过ROS介导的丝裂原活化蛋白激酶(MAPK)、Akt和STAT3信号通路的激活,诱导A549细胞的细胞周期停滞和凋亡,具有很高的研究潜力。
Duchowicz团队[34]合成了萘醌并呋喃、萘醌并吡喃的衍生物,其中萘醌并呋喃系列的化合物19a、19b、19c、19d、19e(图4)对乳腺癌细胞HBL-100、宫颈癌细胞HeLa、肺癌细胞SW1573、结肠癌细胞WiDr均有较强的抑制作用(GI50值不超过3 μM),活性最好的19b、19d甚至达到纳摩尔级,有很大的参考价值,而萘醌并吡喃的活性较差一些。
2018年,Acuña等[35]以2-羟基-1,4-萘醌为原料,合成了一系列1,4-萘醌并杂环的衍生物,包括萘醌并呋喃、萘醌并吡咯、萘醌并噻唑、萘醌并噻吩,并在人结直肠癌细胞HT-29中对比细胞毒性,结果表明萘醌并噻吩系列化合物20a、20b(图4)具有最强活性,IC50分别为1.73、3.07 μM,且20a拥有与阳性药阿霉素(IC50=1.07 μM)相当的活性。除此之外,萘醌并呋喃系列化合物21a(IC50=2.67 μM,图4)、21b(IC50=4.16 μM,图4)也有较强的活性。其余系列则具有中等或中等偏下的活性。同年,Liu等[36]合成了一系列新型1,4-萘醌并咪唑衍生物,得到的化合物22(图4)对A549肺癌细胞的IC50为9.3 μM,但其他化合物只有较弱的抗癌活性。
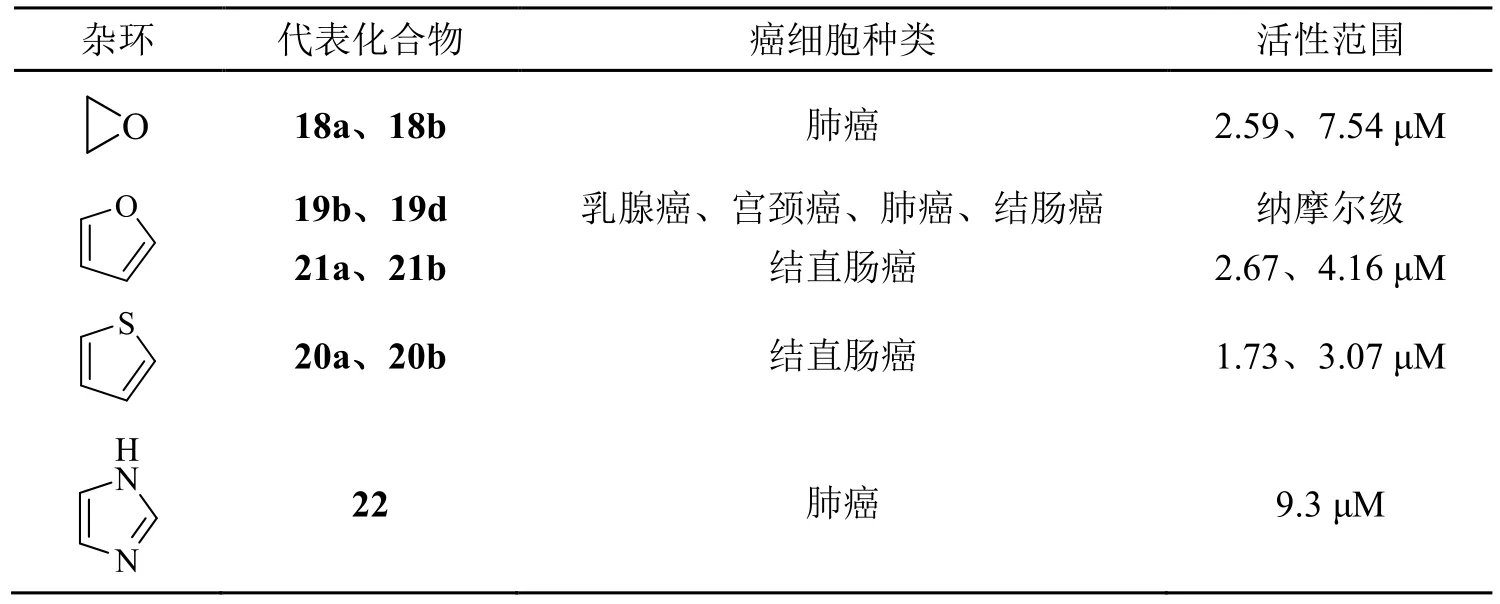
表3 1,4-萘醌并杂环衍生物活性总结
文中总结了近几年与1,4-萘醌醌环相并的简单杂环衍生物的抗肿瘤活性,通过表3不难发现三元和五元杂环的活性比六元杂环相对更好,而五元杂环中,噻吩和呋喃环具有更优越的活性。
2.4 其他衍生物的抗癌活性
2017年Huang等[37]尝试对1,4-萘醌醌环上的羰基进行修饰,合成了十八个6-取代1,4-萘醌肟衍生物,并在四个癌细胞系(人结直肠癌细胞HCT-15、胃癌细胞MGC-803、肝癌细胞Bel7402、乳腺癌细胞MCF-7)和正常细胞(HSF)中进行了细胞毒性筛选,研究结果显示该系列化合物对正常细胞毒性较低,且对HCT-15具有更高的敏感性,其中化合物23a、23b、23c(图4)对HCT-15的IC50分别为2.52、1.64、2.27 μM,强于阳性对照阿霉素(IC50=2.74 μM)、5-氟尿嘧啶(IC50=8.24 μM),具有较高的研究价值。
同年[38]该团队继续萘醌肟系列,以类似的方法合成了一系列6-取代的5,8-二甲氧基-1,4-萘醌肟衍生物,其中化合物24a、24b、24c、25a、25b(图4)具有与阳性药5-氟尿嘧啶相当的抗癌活性;而2018年[39]该团队的第三系列化合物中26(图4)脱颖而出,抗癌活性远高于5-氟尿嘧啶,对白血病细胞K562、人结直肠癌细胞HCT-15、HCT-116的IC50分别为1.25、1.63、2.47 μM。对K562的效果最为突出,约是阳性药的12倍。这一系列的研究为6-取代的萘醌肟系列化合物提供了较好的研究参考。这种将醌环上的羰基进行修饰的方法也为1,4-萘醌新型衍生物的设计提供了更广阔的参考空间。

图4 1,4-萘醌并杂环衍生物和其他衍生物的结构
3 总结与展望
本文对近几年合成源1,4-萘醌类衍生物的抗肿瘤活性作了简单概述,通过对这些化合物的结构以及活性分析发现:1,4-萘醌系列的衍生物大都具有广谱性,尤其对乳腺癌、肺癌、宫颈癌、结直肠癌、白血病等具有更优越的选择性。2-位氨基取代最为常见且具有较强的抑癌活性(主要是仲胺、叔胺),但似乎硫取代比氨基具有更强的细胞毒性,而含有N、S同时存在的基团,比如磺酰基三唑系列基团、磺酰胺基等均具有不错的活性,值得进一步的研究。苯环上5-、8-吸电子基取代较多见,5,8-二甲氧基的取代活性也较为出色。目前萘醌并杂环的合成方法研究也越来越多,从活性数据上看,萘醌并呋喃环、噻吩环的活性更加理想,而其他更多杂环的活性报道却并不多见,有待进一步的研究。6-取代萘醌肟具有高活性的同时对正常细胞毒性很小,具有良好的选择性,这在1,4-萘醌抗癌药物的研究当中具有非凡的借鉴意义。尽管目前已发现一些高活性的1,4-萘醌衍生物,但因其对癌细胞和正常细胞间的选择性差或代谢毒性、稳定性等原因而影响其后期成药。该类化合物的构效关系、作用机理、体内实验等也是进一步的研究重点。研究出高效、低毒的1,4-萘醌衍生物仍然是医药行业的努力方向,相信在不久的将来,1,4-萘醌衍生物也将迎来更好的发展。

