间氯过氧化苯甲酸可控性氧化2-巯基萘醌类化合物的合成与鉴定
申贵男 ,郝莹莹 ,张雷 ,曹立明 ,韩英浩 ,王伟东 ,李婧 ,金成浩
(1.黑龙江八一农垦大学生命科学技术学院,大庆 163319;2.黑龙江八一农垦大学动物科技学院)
先导化合物(leading compound)是通过各种途径和手段得到的具有某种生物活性的化合物,先导化合物的发现途径主要包括:从天然产物活性成分中发现、通过分子生物学途径发现、随机偶遇发现、从代谢产物中发现、临床药物的副作用或老药新用的途径发现及合成的中间体中发现等多种途径。属于新药开发的前期阶段。从天然植物中获得先导化合物,并通过其衍生物的设计合成筛,并选活性物质是新药开发的重要方向[1-2]。醌类化合物是中药中的一类具有醌式结构的化合物的总称。廖科的大黄[3]、茜草科的茜草[4]、唇形科的丹参[5]、紫草科的紫草[6]均含有醌类植物。主要包括苯醌、萘醌、菲醌和蒽醌等四种类型的化学结构。其中,萘醌类衍生物在自然界含量较多,主要的化学结构类型有1,4-萘醌、1,2-萘醌和2,6-萘醌等三种类型。传统中药材紫草中含有多种1,4-萘醌的衍生物。其中,以紫草素(shikonin,5,8-Dihydroxy-2-[(1R)-1-hydroxy-4-methyl-pent-3-enyl]naphthalene-1,4-dione)为先导化合物的萘醌类衍生物具有多种生理活性,包括抗衰老[7-8]、抗肿瘤[9-12]、抗真菌[13-14]、抗寄生虫[15]、抗氧化[16]、抗疟疾[17]以及抗新生血管和抗增殖能力[18]等。因此,萘醌类衍生物的设计合成广泛引起化学研究者的兴趣,已有诸多令人振奋的多种药理作用。其中,2-位含巯基的2-取代萘醌类衍生物的抗肿瘤机制已深入研究其信号途径[19-21]。
含巯基化合物不仅有常见的硫醇、硫酚和硫醚等,还有人体必需的半胱氨酸和硫羟基化合物及砜类、亚砜和磺酸类化合物等高价硫的氧化产物等多种形式。砜类广泛用于医药、塑料及基本有机合成等工业[22-24]。其中,硫的可控性氧化(controllable oxidation)对于探讨2-巯基取代萘醌类衍生物的构效关系、作用机理具,筛选活性更好,毒性更低的新分子实体(New Molecular Entity,NME)具有重要的意义。
课题组在2-取代萘醌类衍生物的合成及氧化研究中发现,化学合成常用的氧化剂中,间氯过氧化苯甲酸(meta-Chloroperoxy benzoic Acid,m-CPBA)不仅反应条件温和,有较高的氧化产率,而且通过物料比、反应温度及时间的变化可控性氧化巯基,可得到亚硫酰基和磺酰基的氧化产物。间氯过氧化苯甲酸同时也是很好的环氧化试剂,随着反应时间的加长,还可以进一步氧化萘醌的2,3位双键,获得含有2,3-环氧基的磺酰基化合物。研究以不同碳链长度的2-烷巯基-5,8-二甲氧基-1,4-萘醌为原料,根据反应物与间氯过氧化苯甲酸的物料比、反应温度和反应时间的变化,得到不同的氧化产物。氧化产物包括含亚硫酰基的亚砜类化合物和含磺酰基砜类化合物及2,3-位含环氧基的砜类化合物三种。旨在萘醌类衍生物的合成设计提供更方便快捷的可控性合成方法,为后期的构效关系研究及筛选活性更好、毒性更低的新型先导化合物提供更多的候选化合物。
1 材料与方法
1.1 药品与试剂
合成原料 2-丙巯基-5,8-二甲氧基-1,4-萘醌(2-Propylthio-5,8-dimethoxy-1,4-naphthoquinone)及 2-壬巯基-5,8-二甲氧基-1,4-萘醌(2-Nonylthio-5,8-dimethoxy-1,4-naphthoquinone) 由实验室合成并经波谱学鉴定确认[25];间氯过氧化苯甲酸(m-CPBA,阿拉丁),碳酸氢钠、二氯甲烷、正己烷、乙酸乙酯、甲醇(西亚试剂);以上各种试剂均为化学纯或分析纯市售产品。柱色谱硅胶及薄层色谱用硅胶HSGF254(200~300目,50~70 μm)为阿拉丁购买。
1.2 仪器
磁力搅拌器(天津大港红杉实验设备厂),RE-52A旋转蒸发器,Bruker AVANCE DPX-400超导核磁共振仪(样品以CDCl3为溶剂,TMS为内标),PE SCIX API 2000 MS/MS质谱分析仪。
1.3 方法
1.3.1 2-丙基亚硫酰基-5,8-二甲氧基-1,4-萘醌(2a)的合成
称取 2-丙巯基-5,8-二甲氧基-1,4-萘醌(1a,0.21 mmol)溶于装有二氯甲烷(30 mL)的单口圆底烧瓶中,置于冰浴,分三次加入间氯过氧化苯甲酸(0.23 mmol),搅拌2 h左右后,每10 min进行一次薄层层析色谱分析,当薄层层析板中的原料完全消失时加入10%的碳酸氢钠溶液20 mL终止反应,并继续搅拌10 min,将反应混合液移入500 mL的分液漏斗,加入150 mL饱和氯化钠溶液,用等体积的二氯甲烷溶剂萃取3次,回收二氯甲烷溶剂,加入适量的无水硫酸钠脱水。过滤除去硫酸钠后,利用旋转蒸发仪进行减压浓缩,回收溶剂,收集反应粗产物。以正己烷:乙酸乙酯=2∶1为洗脱液,用200~300目硅胶进行柱层析,分离纯化目的化合物,减压移除洗脱溶剂,转移至5 mL西林瓶中进行真空干燥,获得鲜红色目的化合物2-丙基亚硫酰基-5,8-二甲氧基-1,4-萘醌(2a)。产物的结构用核磁、质谱等波谱学方法进行鉴定。
1.3.2 2-壬基亚硫酰基-5,8-二甲氧基-1,4-萘醌(2b)的合成
与 2-丙基亚硫酰基-5,8-二甲氧基-1,4-萘醌(2a)的合成同法,以 2-壬巯基-5,8-二甲氧基-1,4-萘醌(1b)为原料进行合成,获得鲜红色目的化合物2-壬基亚硫酰基-5,8-二甲氧基-1,4-萘醌(2b)。
1.3.3 2-丙基磺酰基-5,8-二甲氧基-1,4-萘醌(3a)的合成
称取 2-丙巯基-5,8-二甲氧基-1,4-萘醌(1a,0.21 mmol)溶于装有二氯甲烷(30 mL)的单口圆底烧瓶中,分三次加入间氯过氧化苯甲酸(0.46 mmol),常温下搅拌1 h左右后,每5~6 min进行一次薄层层析色谱分析。反应初期,薄层层析板中先产生亚硫酰基产物的点,待亚硫酰基产物的点越来越小,2,3-二氢-2,3-环氧基产物的点隐约产生时,加入10%的碳酸氢钠溶液30 mL终止反应,并继续搅拌10 min,再将反应混合液移入500 mL的分液漏斗,加入150 mL饱和氯化钠溶液,用等体积的二氯甲烷溶剂萃取3次,回收二氯甲烷层,加入适量的无水硫酸钠脱水。过滤除去硫酸钠后,利用旋转蒸发仪进行减压浓缩,回收溶剂,收集反应粗产物。以正己烷:乙酸乙酯=4∶1为洗脱液,用200~300目硅胶进行柱层析,分离纯化目的化合物,减压移除洗脱溶剂,转移至5 mL西林瓶中进行真空干燥,获得红色目的化合物2-丙基磺酰基-5,8-二甲氧基-1,4-萘醌(3a)。产物的结构用核磁、质谱等波谱学方法进行鉴定。
1.3.4 2-壬基磺酰基-5,8-二甲氧基-1,4-萘醌(3b)的合成
与 2-丙基磺酰基-5,8-二甲氧基-1,4-萘醌(3a)的合成同法,以 2-壬巯基-5,8-二甲氧基-1,4-萘醌(1b)为原料进行合成,获得红色目的化合物2-壬基磺酰基-5,8-二甲氧基-1,4-萘醌(3b)。
1.3.5 2,3-二氢-2,3-环氧基-2-丙基磺酰基-5,8-二甲氧基-1,4-萘醌(4a)的合成
称取 2-丙巯基-5,8-二甲氧基-1,4-萘醌(1a,0.21 mmol)溶于装有氯仿(30 mL)的单口圆底烧瓶中,分3次加入间氯过氧化苯甲酸(0.60 mmol),常温下搅拌2 h以上,每10 min进行一次薄层层析色谱分析,当原料、亚硫酰基产物和磺酰基产物的点完全消失时,加入10%的碳酸氢钠溶液10 mL终止反应,并继续搅拌10 min,再将反应混合液移入500 mL的分液漏斗,加入150 mL饱和氯化钠溶液,用等体积的二氯甲烷溶剂萃取3次,回收二氯甲烷层,加入适量的无水硫酸钠脱水。过滤除去硫酸钠后,利用旋转蒸发仪进行减压浓缩,回收溶剂,收集反应粗产物。以正己烷:乙酸乙酯=10∶1为洗脱液,用200~300目硅胶进行柱层析,分离纯化目的化合物,减压移除溶剂,转移至5 mL西林瓶中进行真空干燥,获得橘黄色的目的化合物2,3-二氢-2,3-环氧基-2-丙基磺酰基-5,8-二甲氧基-1,4-萘醌(4a)。产物的结构利用核磁、质谱等波谱学方法鉴定。
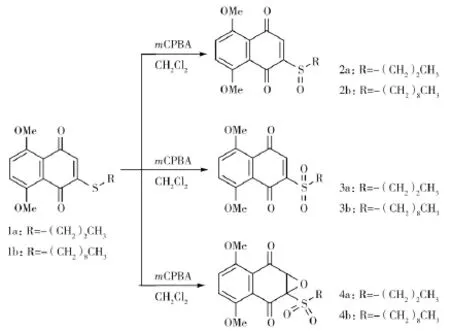
图1 萘醌类衍生物的合成Fig.1 The synthesis of 2-sustituted naphthoquinone derivatives
1.3.6 2,3-二氢-2,3-环氧基-2-壬基磺酰基-5,8-二甲氧基-1,4-萘醌(4b)的合成
与 2,3-二氢-2,3-环氧基-2-丙基磺酰基-5,8-二甲氧基-1,4-萘醌(4a)的合成同法,以2-壬巯基-5,8-二甲氧基-1,4-萘醌(1b)为原料进行合成,获得橘黄色目的化合物2,3-二氢-2,3-环氧基-2-壬基磺酰基-5,8-二甲氧基-1,4-萘醌(4b)。
2 结果与分析
2.1 萘醌类衍生物的结构鉴定
为了验证设计合成的6种萘醌类衍生物的结构准确性,进行了1H-NMR,1C-NMR(TMS为内标)和Mass鉴定,数据如下:
2a:2-丙基亚硫酰基-5,8-二甲氧基-1,4-萘醌(2-Propylsulfinyl-5,8-dimethoxy-1,4-naphthoquinone),Yield:51.9%;1H NMR(CDCl3,400 MHz):δ 7.41(d,J=9.2 Hz,1H),7.37 (d,J=9.6 Hz,1H),7.29(s,1H),3.99(s,3H),3.91(s,3H),3.14(m,1H),2.82(m,1H),1.88(m,1H),1.66(m,1H),1.01(t,J=7.2 Hz,3H);13C NMR(CDCl3,100 MHz)δ 182.0(C-1),181.9(C-4),154.4(C-5),154.4(C-8),154.3(C-2),136.9(C-3),121.7(C-7),120.9(C-6),120.3(C-9),120.1(C-10),56.9(OCH3),56.7(OCH3),55.3(C-1′),16.0(C-2′),13.1(C-3′);m/z 330.9(M+Na)+。
2b:2-壬基亚硫酰基-5,8-二甲氧基-1,4-萘醌(2-Nonylsulfinyl-5,8-dimethoxy-1,4-naphthoquinone),Yield:49.3%;1H NMR (CDCl3,400 MHz)δ 7.42(d,J=9.6 Hz,1H),7.37(d,J=9.6 Hz,1H),7.31(s,1H),3.99(s,6H),3.23(m,1H),2.90(m,1H),1.90(m,1H),1.61(m,1H),1.43(m,2H),1.24(m,10H),0.87(t,J=7.2 Hz,3H);13C NMR(CDCl3,100 MHz)δ 182.0(C-1),181.9(C-4),154.6(C-5),154.4(C-8),154.3(C-2),136.8(C-3),121.7(C-7),120.9(C-6),120.4(C-9),120.4(C-10),56.9(OCH3),56.8(OCH3),53.7(C-1′),31.8(C-2′),29.3(C-3′),29.2(C-4′),29.1(C-5′),28.5(C-6'),22.6(C-7′),22.2(C-8′),14.1(C-9′);m/z 414.8(M+Na)+。
3a:2-丙基磺酰基-5,8-二甲氧基-1,4-萘醌(2-Propylsulfonyl-5,8-dimethoxy-1,4-naphthoquinone),Yield:32.7%;1H NMR(CDCl3,400 MHz):δ 7.50(s,1H),7.41(s,2H),3.99(s,6H),3.53(t,J=8.4 Hz,2H),1.80(m,2H),1.06 (t,J=7.6 Hz,3H);13C NMR(CDCl3,100 MHz)δ 182.6(C-1),179.7(C-4),154.3(C-5),154.0(C-8),144.7(C-2),140.3(C-3),121.3(C-7),121.3(C-6),120.6(C-10),120.2(C-9),56.8(OCH 3),56.8(OCH 3),57.1(C-1′),16.1(C-2′),12.9(C-3′);m/z 347.0533(M+Na)+.
3b:2-壬基磺酰基-5,8-二甲氧基-1,4-萘醌(2-Nonylsulfonyl-5,8-dimethoxy-1,4-naphthoquinone),Yield:29.1% ;1H NMR (CDCl3,400 MHz)δ 7.49(s,1H),7.40(s,2H),3.99(s,6H),3.53(t,J=8.4 Hz,2H),1.75(m,2H),1.40(m,2H),1.24(m,10H),0.86(t,J=6.4Hz,3H);13C NMR(CDCl3,100 MHz)δ 182.6(C-1),179.7(C-4),154.4(C-5),154.0(C-8),144.7(C-2),140.3(C-3),121.3(C-7),121.3(C-6),120.6(C-10),120.3(C-9),56.9(OCH3),56.8(OCH3),55.5(C-1′),31.8(C-2′),29.2(C-3′),29.1(C-4′),28.4(C-5′),28.2(C-6′),22.6(C-7′),22.2(C-8′),14.1(C-9′);m/z 430.7(M+Na)+。
4a:2,3-二氢-2,3-环氧基-2-丙基磺酰基-5,8-二甲氧基-1,4-萘醌(2,3-dihydro-2,3-epoxy-2-propylsulfonyl-5,8-dimethoxy-1,4-naphthoquinone),Yield:65.4%;1H NMR (CDCl3,600 MHz):δ 7.14(s,2H),4.5(s,1H),3.99(s,6H),3.60(m,J=6.4 Hz,2H),1,9(m,2H),1.1(m,3H);13C NMR(CDCl3,150 MHz)δ 187.2(C-1),184.6(C-4),153.4(C-5),152.8(C-8),152.7(C-2),130.3(C-3),128.3(C-7),120.7(C-6),120.3(C-10),120.1(C-9),56.8(OCH3),56.4(OCH3),56.9(C-1′),49.8(C-2′),14.9(C-3′);m/z 364.41(M+Na)+。
4b:2,3-二氢-2,3-环氧基-2-壬基磺酰基-5,8-二甲氧基-1,4-萘醌 (2,3-hydro-2,3-epoxy-2-nonylsulonyl-5,8-dimethoxy-1,4-naphthoquinone),Yield:69.3%;1H NMR(CDCl3,600 MHz):δ 7.14(s,2H),4.5(s,1H),3.99(s,6H),3.60(m,J=6.4 Hz,2H),1,9(m,13H),1.1 (m,3H);13C NMR (CDCl3,150 MHz)δ 191.1(C-1),189.3(C-4),154.8(C-5),153.4(C-8),152.8(C-2),129.9(C-3),128.3(C-7),120.7(C-6),120.6(C-10),119.1(C-9),56.8(OCH3),56.5(OCH3),56.9(C-1′),45.3(C-2'),29.7(C-3′),25.9(C-4′),20.5(C-5′),15.2(C-6′),14.7(C-6′),14.7(C-7′),14.1(C-8′),13.1(C-9′);m/z 447.56(M+Na)+。
以上波谱学分析数据显示,利用间氯过氧化苯甲酸的氧化反应所获得的6种化合物均属于萘醌类衍生物的目的氧化产物,且其化学结构和分子量符合预先合成设计,保证了化合物的准确性。实验过程中,2-烷巯基萘醌类衍生物的三类氧化产物可通过薄层色谱方式和颜色的变化来初步判断反应进行与否。氧化产物中,含亚硫酰基的产物(2a,2b)与含磺酰基产物(3a,3b)的颜色较相近。但亚硫酰基产物(2a,2b)的颜色明显鲜艳于含磺酰基产物(3a,3b),推测是亚硫酰基产物(2a,2b)的2-位巯基属于单氧化,导致2-位对萘醌环系统的吸电子能力明显小与含磺酰基产物(3a,3b)的2-位巯基的双氧化,因此颜色更为鲜艳。同时,薄层层析板中也能观察到,含亚硫酰基产物(2a,2b)的 Rf值明显小于含磺酰基产物(3a,3b),产物也比较单一,这也对磺酰基产物的分离纯化带来了方便。2,3-二氢-2,3-环氧基-2-烷磺酰基的产物(4a,4b)显橘黄色,可能是因为萘醌环的5,8-位有甲氧基的情况下,2,3位的环氧基使得2,3位双键还原成单键,导致萘醌类衍生物失去了共轭体系。同时,Rf值明显大于含亚硫酰基产物(2a,2b)和含磺酰基产物(3a,3b)。
利用1H-NMR的波谱学方法可简单的判断化合物的结构。含亚硫酰基产物(2a,2b)和含磺酰基产物(3a,3b)的3位有标志性氢原子的化学位移。氢谱中,含亚硫酰基产物(2a,2b)的3位氢的化学位移均出现在7.30 ppm附近,且是单峰。而磺酰基产物(3a,3b)的3位氢的化学位移则出现在7.50 ppm附近,同样是单峰。而在2,3-二氢-2,3-环氧基-2-烷磺酰基的产物中,3位的氢由氧-碳单键来取代,氢谱中的7.30 ppm和7.50 ppm均没有单峰出现。
3 讨论
2-烷巯基萘醌类衍生物的氧化过程中,2-烷基亚硫酰基萘醌类衍生物(2a,2b)的合成过程相对于2-烷基磺酰基萘醌类衍生物(3a,3b)的氧化过程容易一些[26]。巯基的氧化过程对反应温度、时间、原料与间氯过氧化苯甲酸的摩尔比有较严格的要求[27]。实验发现:反应温度在0℃,反应物与氧化剂的比例在1∶1时,可顺利获得亚硫酰基产物,且产率较高。反应时间根据2-烷巯基萘醌类衍生物的碳链长度及实际反应温度的不同有所差异,具体反应时间应以薄层层析来决定。当反应完全时,可用10%的碳酸氢钠来中和间氯过氧化苯甲酸来终止反应。
以 2-丙基亚硫酰基-5,8-二甲氧基-1,4-萘醌(2a)的合成为例,加入间氯过氧化苯甲酸之前,将圆底烧瓶置于冰浴,二氯甲烷体系的温度已接近0℃。分次加入间氯过氧化苯甲酸之后,前2 h的反应混合液的主产物为2-丙基亚硫酰基-5,8-二甲氧基-1,4-萘醌(2a)。随着时间的推移,2-丙巯基-5,8-二甲氧基-1,4-萘醌(1a)的量逐渐减少(可在薄层层析板中观察到),同时在薄层层析板中,2a的上方隐约出现新的红色的点。此点为2-丙基磺酰基-5,8-二甲氧基-1,4-萘醌(3a)的点。反应终止时,加入10%的碳酸氢钠溶液20 mL中和多余的间氯过氧化苯甲酸即可。实际产率根据反应体系的温度、物料比及反应时间(中和间氯过氧化苯甲酸的时间)有所差异[28]。若一直进行反应,薄层层析板中,可观察到2-丙烷基磺酰基-5,8-二甲氧基-1,4-萘醌(3a)的点越来越大。若常温下进行反应,即使是2-丙巯基-5,8-二甲氧基-1,4-萘醌(1a)与间氯过氧化苯甲酸的比例为 1∶1,薄层层析板上仍然观察到2-丙烷基磺酰基-5,8-二甲氧基-1,4-萘醌(3a),最后的产物根据实际反应时间的不同,会产生不同比例的2-丙基亚硫酰基-5,8-二甲氧基-1,4-萘醌(2a)和 2-丙基磺酰基-5,8-二甲氧基-1,4-萘醌(3a)。可见,反应时间、温度对反应的影响较大。
2-烷巯基磺酰基 5,8-二甲氧基-1,4-萘醌(3a,3b)的合成反应控制难度较大,反应产率较低。主要是因为2-烷巯基磺酰基5,8-二甲氧基-1,4-萘醌(3a,3b)的产生过程属于产生2-烷基亚硫酰基萘醌类衍生物(2a,2b)和 2,3-二氢-2,3-环氧基-2-烷基磺酰基-5,8-二甲氧基-1,4-萘醌(4a,4b)的中间过程。当薄层层析板中显示2-烷巯基磺酰基5,8-二甲氧基-1,4-萘醌(3a,3b) 的产生较多时,2,3-二氢-2,3-环氧基-2-烷基磺酰基-5,8-二甲氧基-1,4-萘醌(4a,4b)的点也开始出现。
以 2-丙基磺酰基-5,8-二甲氧基-1,4-萘醌(3a)的合成为例,反应在常温下进行。加入间氯过氧化苯甲酸之前,将2-丙巯基-5,8-二甲氧基-1,4-萘醌(1a)充分溶于二氯甲烷溶剂中,分次加入间氯过氧化苯甲酸,搅拌1 h左右后,每5~6 min进行薄层色谱分析。由于2-丙基磺酰基-5,8-二甲氧基-1,4-萘醌(3a)和间氯过氧化苯甲酸比例为1∶2,2-丙基亚硫酰基-5,8-二甲氧基-1,4-萘醌(2a)的产生和 2-丙基磺酰基-5,8-二甲氧基-1,4-萘醌(3a)的产生时间差距较短(根据实际温度和烷基碳链长度有所差异)。随着时间的推移,2-丙巯基-5,8-二甲氧基-1,4-萘醌(1a)的量逐渐减少,2-丙基亚硫酰基-5,8-二甲氧基-1,4-萘醌(2a)的量先多厚少,同时在薄层层析板中,3a的上方隐约出现新的橘黄色的点。此点为 2,3-二氢-2,3-环氧基-2-丙基磺酰基-5,8-二甲氧基-1,4-萘醌(4a)的点。反应终止时,加入10%的30 mL碳酸氢钠溶液中和多余的间氯过氧化苯甲酸即可。实际产率根据反应体系的温度、物料比及反应时间(中和间氯过氧化苯甲酸的时间)有所差异[28]。若一直进行反应,薄层层析板中,可观察到2,3-二氢-2,3-环氧基-2-丙基磺酰基-5,8-二甲氧基-1,4-萘醌(4a)的点越来越大。2-丙烷基亚硫酰基-5,8-二甲氧基-1,4-萘醌(2a)的点和 2-丙烷基磺酰基-5,8-二甲氧基-1,4-萘醌(3a)点和越来越小,最终产物为二氢-2,3-环氧基-2-丙烷基磺酰基-5,8-二甲氧基-1,4-萘醌(4a)。可见,2-丙烷基磺酰基-5,8-二甲氧基-1,4-萘醌(3a)合成过较难以控制,副产物(包括2-烷基基亚硫酰基-5,8-二甲氧基-1,4-萘醌和2,3-二氢-2,3-环氧基-2-烷基磺酰基-5,8-二甲氧基-1,4-萘醌)较多。整个氧化过程受反应温度、时间、物料比的影响较大。
2,3-二氢-2,3-环氧基-2-丙烷基磺酰基-5,8-二甲氧基-1,4-萘醌(4a)的合成事实上属于整个氧化过程的最终过程[20]。反应温度不管是在0℃或在常温下,随着时间的推移,最终产物均为2,3-二氢-2,3-环氧基-2-丙烷基磺酰基化合物[29]。事实上,不受原料与间氯过氧化苯甲酸的摩尔比的影响,严格控制反应时间,可在一个反应中获得三种氧化产物。但是,三种产物的产率控制较为困难。
4 结论
研究以间氯过氧化苯甲酸作为氧化剂,氧化2-烷基-5,8-二甲氧基-1,4-萘醌。利用反应温度、时间及物料比可控制产物的氧化程度。反应产物包括:单氧化的2-烷基亚硫酰基-5,8-二甲氧基-1,4-萘醌、双氧化的2-烷基磺酰基-5,8-二甲氧基-1,4-萘醌及 2,3-二氢-2,3-环氧基-2-丙烷基磺酰基-5,8-二甲氧基-1,4-萘醌。反应温度在0℃时,物料比为1∶1时,2 h左右可获得2-烷基亚硫酰基-5,8-二甲氧基-1,4-萘醌;室温下,物料比为 1∶2,反应时间在 4~6 h时,主产物为2-烷基磺酰基-5,8-二甲氧基-1,4-萘醌。反应时间超过6 h候产物全部为2,3-二氢-2,3-环氧化亚硫酰基化合物。实际产率受到具体反应时间、温度及物料比的影响可用薄层色谱法来控制反应。研究结果为含2-巯基取代萘醌类硫衍生物的合成提供了重要的合成方法,其产物的部分生理活性及结构与活性的关系正在进一步研究中。

