胎牛血清对猪精子常温负压保存质量的影响
李井春,王硕,李雁冰,王国鑫,魏国生
(黑龙江八一农垦大学动物科技学院,大庆 163319)
目前,猪人工授精技术随着近些年国内养殖业的快速发展愈加成熟,养猪业的发展也愈发加快了脚步,从而人工授精技术也相应成为家畜生产中主要的繁殖手段,猪人工授精最大的优点就是以少量的优良公猪的精液能为更多的母猪配种,加速遗传改良[1],猪的人工授精的成败在很大程度上取决于精液的质量[2],随着人工授精技术在养猪业的广泛应用,精液保鲜技术逐步走入大众的视野,获得了日渐增多的关注[3]。精液保存技术的稳固可以使优质基因的传播得以促进,可以加宽精液地域上的使用,提高精液的利用率以及提升猪品种的改良成效,稳定的精液保存技术也可以控制某些病原体的传播[4]。精液常温保存的机理是通过减缓或抑制精子新陈代谢的速度,同时避免精子在体外受损伤,从而延长猪精子在体外存活的时间。国内猪精液保存的研究主要分为两种方式,一种就是猪精液的冷冻保存,另一种就是猪精液的常温保存。因为猪精子自身特有的生理性质,经过冷冻的精子在解冻后投入使用后存在存活率低、受胎率不理想的问题,而常温保存操作简单方便,便于短期保存[5],所以常温下猪精液保存方法的研究也就成为今后猪精液保存的方向。精液常温保存受多种因数影响,如稀释液的pH值、渗透压、抗氧化性等,这些影响因数直接或间接的影响精子质量以及受胎率,研究表明在一次输精中有45%左右的精子损失,通过改进稀释液配方,从而提高精液质量进而提高受胎率[6-7]。
大多数细胞培养实验中均需在培养液中添加一定量的血清,常用的血清为胎牛血清或小牛血清,因为血清含有激素、生长因子、结合蛋白、微量元素等物质,这些物质在细胞的生长和调控细胞生存环境的稳定等方面起到重要作用。胎牛血清(FBS)是一种外观浅黄色澄清、无溶血、无异物稍黏稠液体,FBS取自剖腹产的胎牛。FBS功能包括:FBS含有的蛋白酶抑制剂可使细胞中胰蛋白酶失活,保护精子细胞不受伤害;在溶液中,可起到酸碱缓冲的作用;FBS含有的结合蛋白能够识别维生素类物质、脂类物质、金属离子和其他激素等,能结合或调节所结合物质的活力[8]。试验选择Modena稀释液作为基础稀释液,该稀释液在压强、渗透液、稀释液的筛选等实验中取得良好的效果[9]。试验通过在Modena稀释液中添加不同体积分数的灭活和非灭活的FBS,在17℃负压环境下以精子活率、直线速度、侧摆幅度等为检测参数。分析胎牛血清对猪精液保存效果,试验结果对猪人工授精生产实践起到一定指导作用。
1 材料与方法
1.1 主要试剂
灭活胎牛血清、非灭活胎牛血清;Modena稀释液配方为每1 L溶液中分别准确称量药品含量为:葡萄糖 27.50 g;TRIS 5.65 g;EDTA-2Na 2.6 g;柠檬酸钠6.9 g;NaHCO31 g;柠檬酸 2.9 g;BSA 4 g(现用现配);青霉素 0.074 g;链霉素 0.05 g。无特殊说明下,药品成分均购自西格玛公司。
1.2 精液来源
试验所用样品猪精液来自黑龙江八一农垦大学猪场,对所选择的公猪要求在3 d内未进行过采精活动,采集3头健康长白种公猪精液,年龄为2~3岁。精液品质要求为无异味、色泽为乳白色、密度在2亿以上、精子活力在0.7以上的精液,将3头合格精液分别取等量体积混合在一起保存。猪采集后尽快从猪场在1~2 h内运输到实验室,运输过程的保温工具为泡沫保温箱,泡沫保温箱需封闭完好,避免由于温度下降过快而引起精子冷应激。同时在运输过程行车稳定,以减少剧烈晃动对猪精子的机械损伤。
1.3 实验方法
1.3.1 猪精液的稀释
将猪精液运送到实验室后,需将精液放入经过紫外线灭菌后的无菌操作台内,精液需在室温下缓慢稳定的平衡降温30 min。平衡降温后检测猪精子活力,精子活力不低于0.7[10],则符合实验要求。原精液稀释处理方法为,将适量原精液分别装入离心管中,离心机转数调节为1 800 r·min-1,离心时间调节为5 min。通过精板计数法计算离心后沉降的精液精子密度,将各试验组精子密度均调节为1×108个·mL-1,整个稀释过程要在短时间内完成,减少精子沉积造成损伤的发生,稀释处理后各试验组需放置在室温下待用。
1.3.2 精液保存处理
将各试验组的试管口用铝纸盖住,但要与外界气流相通,将试管缓慢放于负压保存瓶中静立,通过导管将负压保存瓶与真空泵机链接,将负压保存瓶内负压调整为0.4倍大气压强。然后将负压瓶置于17℃恒温箱中保存。每间隔12 h对精液进行一次混匀,且摇匀过程要缓慢进行。
1.3.3 精子质量参数的检测
试验在保存的各时间点(1,2,3,4,5 d)各组取出适量样品,置于37℃加热板上回温2~3 min,通过精子分析仪检测各试验组猪精子活率、直线速度、路径速度、侧摆幅度等质量参数,并记录试验数据。
1.4 试验设计
试验共设计5组,在Modena基础稀释液中分别添加灭活和非灭活的FBS,调节体积分数分别为0、5%灭活、10%灭活、非灭活5%、非灭活10%的FBS,并对每组进行负压处理,在17℃恒温箱保存。试验设4次重复试验。通过迈朗全自动精子分析仪检测不同的保存时间下精子活率、路径速度,直线速度、侧摆幅度等质量参数。
1.5 统计分析
将各时间点的各试验组精子的各质量参数数据通过Excel进行初步汇总,再利用StatView 5.0软件对试验测定的各项质量参数进行方差分析和多重比较,实验结果用平均数±标准差来表示。同行数据肩标字母不同,表示差异显著P<0.05。
2 结果与分析
2.1 胎牛血清对精子活率的影响
由表1可知,各组随着保存时间的延长猪精子活率不同程度的逐渐下降,在2 d时灭活10%FBS组猪精子活率与对照组差异不显著,与5%灭活、非灭活5%、非灭活10%FBS组差异显著(P<0.05);从4 d起对照组与5%灭活、10%灭活、非灭活5%、非灭活10%FBS组猪精子活率相比有显著差异(P<0.05),在4 d时5%灭活、10%灭活、非灭活5%、非灭活10%FBS组之间猪精子活率差异不显著(P>0.05);在5 d时10%灭活组猪精子活率显著0、5%灭活、非灭活5%、非灭活 10%FBS组(P<0.05),且5%灭活、非灭活5%、非灭活10%FBS组之间差异不显著(P>0.05)。

表1 胎牛血清对精子活率的影响Table 1 The effect of FBS on sperm motility rate
2.2 胎牛血清对精子路径速度的影响
由表2可知,各组随着保存时间的延长猪精子路径速度不同程度的逐渐下降,在1 d时各组精子路径速度差异不显著(P>0.05);在2 d时对照组猪精子路径速度显著低于5%灭活、10%灭活、非灭活5%、非灭活 10%FBS组(P>0.05);3 d后对照组与非灭活5%FBS组猪精子路径速度随着时间的增加变化明显,在4 d时10%灭活FBS组精子路径速度显著高于0、5%灭活、非灭活5%、非灭活10%FBS组(P<0.05);在5 d时0灭活组精子路径速度显著高于0、5%灭活、非灭活 5%、非灭活 10%FBS组(P>0.05),且5%灭活、非灭活5%、非灭活10%FBS组精子路径速度显著高于对照组(P<0.05)。

表2 胎牛血清对精子路径速度的影响Table 2 The effect of FBS on sperm path velocity
2.3 胎牛血清对精子直线速度的影响
由表3可知,各组随着保存时间的延长猪精子直线速度不同程度的逐渐下降,从1 d起5%灭活、10%灭活、非灭活5%、非灭活10%FBS组猪精子直线速度显著高于对照组(P<0.05)。在5 d时10%灭活FBS组与非灭活5%FBS组差异不显著(P>0.05),10%灭活FBS组与非灭活5%FBS组猪精子直线速度显著高于灭活5%、非灭活10%FBS组(P<0.05),且5%灭活、非灭活5%、非灭活10%FBS组精子直线速度显著高于对照组(P<0.05)。

表3 胎牛血清对精子直线速度的影响Table 3 The effect of FBS on sperm linear velocity
2.4 胎牛血清对精子侧摆幅度的影响
由表4可知,各组随着保存时间的延长猪精子侧摆幅度变化缓慢,在1 d时0、5%灭活、10%灭活、非灭活5%、非灭活10%FBS组之间猪精子侧摆幅度差异不显著(P>0.05);在 2~3 d时 10%灭活 FBS组猪精子侧摆幅度显著高于0、5%灭活、非灭活5%、非灭活 10%FBS组(P<0.05);在4 d时5%灭活、10%灭活、非灭活5%、非灭活10%FBS组之间猪精子侧摆幅度差异不显著(P>0.05),且 5%灭活、10%灭活、非灭活5%、非灭活10%FBS组猪精子侧摆幅度显著高于对照组(P<0.05);在5 d时10%灭活FBS组猪精子侧摆幅度显著高于0、5%灭活、非灭活5%、非灭活10%FBS组(P<0.05),且 5%灭活、10%灭活、非灭活5%FBS组之间猪精子侧摆幅度差异不显著(P>0.05),5%灭活、10%灭活、非灭活5%FBS组猪精子侧摆幅显著高于对照组(P<0.05)。
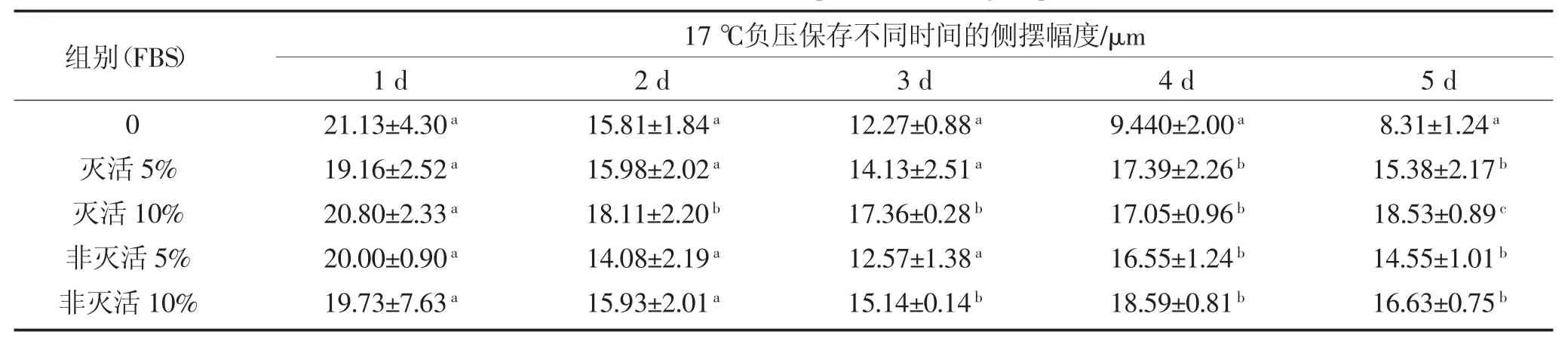
表4 胎牛血清对精子侧摆幅度的影响Table 4 The effect of FBS on sperm side swing amplitude
3 讨论
试验中,选用的Modena基础稀释液对精子保存效果良好,在鲜精中加入一定比例的稀释液能够为精子创建出与公猪睾丸内相似的渗透压、pH值、低代谢强度等的存活环境,可排除对精子长期保存利的因素,同时在17℃负压环境下可有效降低精子的代谢强度,使精子处于半休眠状态,从而延长保存时间。猪的稀释液中所含的多种成分对精液长期保存非常有利,例如在Modena稀释液中的缓冲物质可维持精液pH的稳定,碳酸氢钠、柠檬酸钠等添加剂可中和稀释液中细菌的代谢产物,从而维持稀释液pH的稳定[10]。而试验中在稀释液中分别添加5%灭活、10%灭活、非灭活5%、非灭活10%的FBS,目的在于利用FBS具有抑制胰蛋白酶活性、可起到酸碱缓冲的作用、能够结合识别稀释液中多种成分等功能,从而弱化猪稀释液中的有害物质对精子的损伤,减缓由于猪精子代谢、细菌滋生、营养物质衰变等引起的pH下降速度过快的过程,提高精液的保存时间以及精液质量。
试验结果表明:在基础稀释液中加入10%灭活FBS试验组,精子活率、直线速度、路径速度、侧摆幅度等指标均为最好,维持的时间长达5 d,其他3组试验组综合评价来看各组间差异不显著,并都优于对照组。精子活率是一项检验精液质量的常规指标,精子的活率和运动性与精子结构和功能的完整性紧密相关,并且可以对精子潜在的授精能力作出预测[11-12]。精子活力对配种效率、产仔数、生产性能等都有很大影响,精子活力对雄性生育和受精是很重要的,是保证精子在受精过程中与卵子相遇的重要条件[13-14],而直线速度和路径速度是反应精子活力的重要指标[15],同时侧摆幅度的变化可以反应出精子超激活程度[16],精子尾部侧摆幅度越强,其活力越高,受精能力越好[17]。试验中,选择的精子质量参数都直接或间接的反应出在猪稀释液中添加10%灭活FBS对猪精液保存的优良效果。
FBS的灭活处理方法主要是56℃加热30 min,灭活物质主要为补体、蛋白质、营养物质等热敏感物质。研究表明[18],灭活过程减弱了FBS对细胞的促黏附作用,试验中精液保存效果10%灭活FBS组优于10%非灭活FBS组,推测是FBS提高了精子细胞的黏附性,从而降低了精子的运动性能以及细胞膜的物质运输代谢过程。目前在诸多实验中对FBS灭活目的在于剔除补体对实验的影响,研究表明补体具有提高细胞通透性作用,在非灭活试验组中可能补体提高了精子细胞膜通透性,导致一些有害离子及有毒物质进入细胞内,同时通透性的提高降低了精子的抗冷应激能力,破坏精子细胞内环境,使精子各项质量参数下降加快。并且未灭活的FBS某些成分能够结合、灭活、拮抗或协同激素和药物的作用[2],从而影响精液的保存效果。猪精子随着保存时间的延长,由于精子代谢和细菌滋生稀释液中的产生大量的活性氧(ROS),ROS对猪精子膜的损伤是破坏性的,试验中从第3 d开始对照组猪精子质量大幅度下降,而添加FBS的各试验组下降幅度较小,可能是FBS中某种物质起到抗氧化的作用。研究表明,在FBS中的微量元素硒具有抑制过氧化物酶对细胞的毒性作用,从而缓解ROS对精子细胞膜的损伤。根据试验结果可知对FBS灭活处理后加入基础液中是有必要的。
试验精液保存在2 d时,各组不同程度出现细菌滋生情况,茆达干等[19]研究表明,精液被细菌污染,对精液影响极大,可在短时间内使精子活力、pH值等大幅度下降。精液中大多数细菌为革兰氏阴性菌,其中产生的脂多糖毒性较大[20]。研究表明[8],FBS能结合脂多糖而起解毒作用,并且具有缓冲酸碱度的作用,从而缓解细菌滋生导致的pH值下降问题,同时FBS中所含的蛋白酶抑制因子可以保护精子细胞免受稀释液中蛋白酶的损伤。除此之外,FBS成分中还含有丰富的营养物质,对精液的保存是非常有利的[21],例如FBS成分中的胰岛素能与细胞膜上受体结合形成复合物,具有调节和控制细胞内多种代谢途径的作用,加强糖原、蛋白质、三酸甘油脂等的合成,同时认为胰岛素并非本身起到作用,而可能是结合某些物质或者某些微量元素而发挥作用。又如FBS成分中的结合蛋白可结合培养液中的有毒金属离子,从而减少有害离子进入精子细胞内的数量,减弱对精子细胞内环境的破坏,同时能够与脂类、激素等因子结合具有调节细胞代谢的作用,但FBS在试验中起到的具体作用有哪些方面,需要进行更深入的探究。从试验结果可知,添加FBS的各试验组各项参数都显著高于对照组,说明研究中将FBS的多种功能用于解决猪精液长期保存中所面临的诸多问题是可行的。同时实验采用负压处理,模拟公猪睾丸负压低氧环境,可有效降低精液含氧量,减缓精子代谢过程,再结合FBS的多种功能,从而完善精液配方,提高精液的保存时间及其精液质量。
4 结论
试验得出在精液基础液中添加一定量的FBS在17℃负压环境下可显著提高猪精子活率、路径速度、直线速度、侧摆幅度。其中10%灭活FBS组各项参数显著优于其他组,添加10%灭活FBS是最有利于猪精子在17℃负压环境下保存的,研究结果为猪人工授精生产实践中精液保存技术的发展提供依据。

