6种鸡精液冷冻稀释液以及冻后保存条件比较
何孟纤,汪俊跃,孙玲伟,徐皆欢,吴彩凤,张树山,戴建军,杨凯旋*,张德福*
(1.上海海洋大学水产科学国家级实验教学示范中心,上海 201306;2.上海市农业科学院畜牧兽医研究所,上海市农业遗传育种重点实验室,上海 201106)
精液冷冻保存技术是目前畜禽遗传资源收集与保护中最有应用价值的技术之一,该技术已在多种哺乳动物的保种和商业化推广中得到广泛应用。在家禽上,精液冷冻虽已在其种质资源保护中得到了部分应用[1],但存在冻后精子存活率低,输精后种蛋孵化率不高等问题,因此,仍需对该技术进一步优化[2]。鸡精液冷冻技术能最大限度地利用遗传性能良好的种公鸡,对禽类种质资源的保护具有重要意义[3]。与哺乳动物相比,禽类精子因结构细长,对冷冻损伤更为敏感,抗冻性较差[4]。近年来,中国农业科学院北京畜牧兽医研究所对鸡精子抗冻性基因进行相关研究[5]。但到目前为止,家禽的精液冷冻技术尚未取得良好的效果,仍有待进一步完善。
鸡精液冷冻保存技术主要包括精液的采集、稀释液的添加、精液平衡、精液冷冻、解冻和输精。禽类精液是由精清和精子组成,但其化学成分与哺乳类动物的精液差别较大,如禽类精液中几乎不含果糖和柠檬酸,但含有粘多糖、葡萄糖和甘油等;家禽精子头部直径约为0.5 µm,其精子尾部直径较头部略小。精液冷冻过程中,一方面因精清中的成分不足以保护精子免受冷冻损伤[6];另一方面因公鸡一次射精量少,精液密度较高,需要适当进行稀释[7],因此研发高效冷冻稀释液成为提高鸡精液冷冻效果的关键因素。稀释液中的果糖和葡萄糖可以为精子提供能量,盐类物质等也可以为精液提供合适的渗透压和pH 环境[8]。目前,已有多种稀释液应用于鸡精液冷冻保存,但不同研究结果差异较大。基于此,本研究选择6 种常用的、冻后效果较好的鸡精液冷冻稀释液,比较这6 种稀释液对鸡精子冻后活力、活率以及存活时间等的影响,筛选鸡精液最佳基础冷冻保护剂,为鸡种质资源的收集与保护奠定基础。
1 材料与方法
1.1 材料
1.1.1 公鸡来源 本研究使用的6 只公鸡来源于上海市农业科学院庄行综合试验站,品种为广西容县霞烟鸡,22~30 周龄,健康状况良好,精液质量稳定。
1.1.2 主要试剂 除特殊说明外,所有试剂均购于Sigma公司。
1.2 方法
1.2.1 精液采集 采用腹背按摩法[7]收集精液,将无粪便、杂物和血液污染的精液放入37 ℃水浴,镜检活力>70 %的精液用于后续试验。在运输途中尽量避免剧烈晃动和阳光直射。
1.2.2 稀释液的配制 6 种基础稀释液分别为LR[9]稀释液、Lake’s[10]稀释液、BPSE[11]稀释液、Modified Sasaki[12]稀释液、Beltsville[13]稀释液和Nabi[14]稀释液,组成成分详见表1。冷冻稀释液在基础稀释液的基础上添加终含量为6%二甲基乙酰胺(dimethylacetamide,DMA)[15]。

表1 不同基础稀释液的配方Table 1 Formulations of different basic diluent
1.2.3 精液的稀释与平衡 采用两步法稀释精液,首先将镜检合格精液混合(每次试验混合不少于5 只),测量体积后按照试验分组分为若干等分,按照1∶2 的稀释比例加入等温预热的基础稀释液,用10层纱布包裹,避光放入4 ℃冰箱中平衡1 h[16],再按照1∶1 的比例加入4 ℃预冷的冷冻稀释液,继续平衡10 min后装管冷冻。
1.2.4 精液冷冻 将灌装封口的0.5 mL 细管放入程序冷冻仪(Planer 公司,型号:Kryo 560-16)中并设定:5~-35 ℃时的降温速率为7 ℃·min-1,-35~-120 ℃的降温速率为9 ℃·min-1[17],待冷冻结束后迅速投入到液氮中保存。
1.2.5 精液解冻 将装有精液的0.5 mL 细管从液氮中取出,迅速置于37 ℃水浴锅中30 s 水浴解冻,解冻后用对应的37 ℃基础稀释液按1∶1 的比例稀释,并按照试验设计的不同保存温度(4 和37 ℃)和时间(0、15、30、45、60、90 和120 min)进行各项精液指标检测,每组实验至少重复3次,每次每组至少解冻2管。
1.3 精子质量检测
1.3.1 精子活率与活力检测 取10µL 解冻后的精液制片,使用精液自动分析仪在显微镜下随机选取5 个视野观察,使用Andro Vision 精液分析仪测定精子活力和活率。
1.3.2 精子质膜完整率检测 采用低渗肿胀法(hypoosmotic swelling test,HOST)检测精子质膜完整性[18]。配制HOST 低渗溶液,取10µL 精液样品添加到100µL 等温HOST 低渗溶液中,37 ℃水浴10 min,于光学显微镜下随机观察不少于4 个视野,统计精子数不少于200 个,统计弯尾精子数和总精子数。两者间的比值即为精子质膜完整率。
1.3.3 精子顶体完整率检测 采用吉姆萨染色法测定精子顶体完整率[19]。取适量解冻后精子涂片,风干。甲醛固定15 min后冲洗干净,吉姆萨溶液染色12 h,冲洗干净,风干后镜检。精子顶体结构明显染色,顶体完整、外形正常或顶体轻微膨胀为顶体完整精子,顶体严重膨胀或顶体脱落为顶体畸形精子[20],于光学显微镜下随机观察不少于4个视野,统计精子数不少于200 个,顶体完整精子数和总精子数两者之间的比值即为精子顶体完整率。
分别使用碧云天的试剂盒检测冻后精子的丙二醛(malonaldehyde,MDA)含量及超氧化物歧化酶(superoxide dismutase,SOD)活性。
1.3.4 精子线粒体活性检测 采用罗丹明123(rhodamine 123,Rh123)染色检测线粒体活性。取50 µL 精液样本加入终浓度为100 nmol·L-1的染料,在暗处于37 ℃处理30 min。精子尾部呈现绿色荧光有线粒体活性,在荧光相差显微镜下观察不少于4 个视野,统计精子数不少于200 个,统计尾部呈现绿色荧光的精子数、总精子数,两者间的比值即为线粒体活性比值。
1.4 统计分析
采用SPSS 22.0软件进行数据整理和分析。
2 结果与分析
2.1 不同冷冻稀释液对鸡精液冻后质量的影响
精子解冻后立即对其进行活率、活力和顶体完整率的检测,结果(表2)表明,6 种不同稀释液之间存在显著性差异(P<0.05)。在活率方面,Lake’s和LR稀释液的冻后精子活率最高;Nabi次之;Beltsville最低。在活力方面,Lake’s和Nabi稀释液的冻后精子活力最高,分别为45.70%和43.60%,显著高于其他稀释液。在顶体完整率方面,Lake’s 稀释液最高,为45.26%;LR 和Nabi 次之,分别为41.33%和40.56%;Beltsville 最低,仅20.96%。综上所述,Lake’s 稀释液冻后精子的活率、活力和顶体完整性较高,Nabi次之;LR 虽获得了较高的冻后活率,但精子活力较低;Beltsville稀释液的冷冻效果最差。
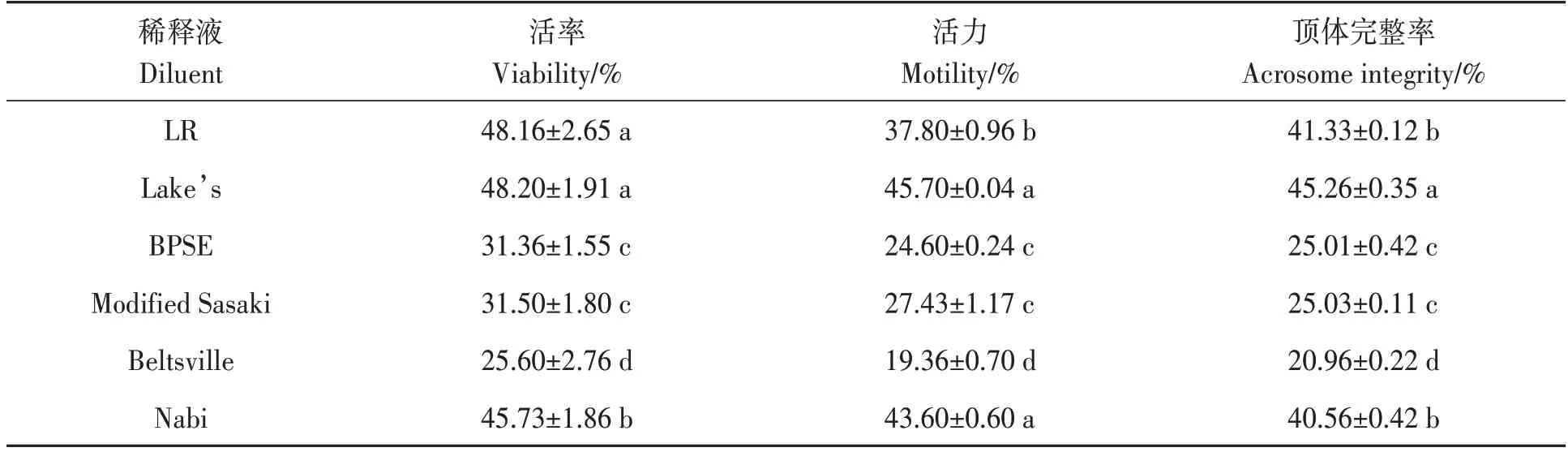
表2 不同稀释液下鸡冻精的质量Table 2 Quality of frozen chicken semen in different diluents
2.2 不同保存温度对3种冷冻稀释液冻后精子活率和活力的影响
由于BPSE、Modified Sasaki、Beltsville3 种基础稀释液鸡精子冻后的活力和活率较低,因此,后续试验仅对LR、Lake’s、Nabi 基础稀释液进行比较。
2.2.1 37 ℃条件下3种稀释液冻后精子的活率和活力 LR、Lake’s、Nabi 稀释液解冻后精子在37 ℃、2 h 内的活率和活力如图1 所示。在活率方面,LR 和Lake’s 稀释液冻后精子的活率在解冻初始时显著高于Nabi 稀释液;但随着保存时间的延长,LR 稀释液的精子活率明显下降,15 min 后显著低于Lake’s 和Nabi 稀释液。在活力方面,LR 和Nabi 稀释液冻后精子活力在解冻初始时显著低于Lake’s;随着保存时间的延长,LR 稀释液精子的活力则迅速下降,在15 min 后均显著低于Lake’s 和Nabi 稀释液;保存30~90 min,Nabi 稀释液的精子活力略高于Lake’s,但差异不显著;保存120 min后,Nabi稀释液的精子活力高于Lake’s和LR。由此表明,Nabi 稀释液在37 ℃条件下表现最佳,Lake’s稀释液次之,LR稀释液最差。

图1 37 ℃条件下下3种稀释液冻后精子的活率和活力Fig.1 Viability and motility of sperm frozen by 3 dilutions at 37 ℃
2.2.2 4 ℃条件下3 种稀释液冻后精子的活率和活力 LR、Lake’s、Nabi 稀释液解冻后精子在4 ℃、2 h 内的活率和活力如图2 所示,3 种稀释液均表现为随着保存时间的延长,精子的活率和活力呈下降趋势。其中,LR 稀释液下降趋势最为明显,Lake’s稀释液次之,Nabi稀释液的耐保存性能最佳。在4 ℃保存条件下,Lake’s 和Nabi 稀释液冻后精子的活率和活力随着保存时间的延长均无显著差异,其精子活率在保存60 min 后分别为31.75 %和31.60 %,活力在保存45 min 也仍保持在30%以上。与37 ℃保存相比较,4 ℃保存可使精子保持更高的活率和活力。
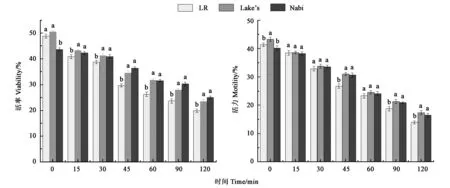
图2 4 ℃条件下3种稀释液冻后精子的活率和活力Fig.2 Viability and motility of sperm frozen by 3 dilutions at 4 ℃
2.3 不同保存温度对冻后精子线粒体活性和质膜完整性的影响
不同温度保存下冻后精子线粒体活性如表3所示。解冻初始,LR、Lake’s 和Nabi 稀释液中高线粒体活性的精子比例分别为43.52%、43.72%和41.27%,三者间差异不显著(P>0.05)。在37 ℃条件下保存15和30 min时,Lake’s和Nabi稀释液中精子的线粒体活性均显著高于LR 稀释液(P<0.05)。在4 ℃条件下保存30 min 后,Lake’s和Nabi 稀释液中精子的线粒体活性分别为32.09%和31.00%,显著高于LR(P<0.05),且明显高于37 ℃条件下精子的线粒体活性(25.42%,27.17%和21.02%)。综上所述,随着保存时间的延长,3 种稀释液中精子的线粒体活性均呈下降趋势,而37 ℃条件下保存,降幅更大。多因素方差分析结果显示,稀释液类型、保存温度和保存时间对冻后精子的线粒体活性影响极显著(P<0.01)。
不同温度保存下冻后精子的质膜完整性如表3 所示。解冻初始,LR 和Lake’s 稀释液精子的质膜完整率显著高于Nabi 稀释液。在37 ℃条件下保存15 和30 min,Lake’s 和Nabi 稀释液中精子的质膜完整率均显著高于LR 稀释液(P<0.05)。在4 ℃条件下保存30 min 后,Lake’s 稀释液中精子的质膜完整率为37.56%,显著高于Nabi 和LR 稀释液(P<0.05),且明显高于37 ℃保存条件下的质膜完整率。综上所述,随着保存时间的延长,3 种稀释液的质膜率均呈下降趋势,而37 ℃条件下保存,降幅更为明显。多因素方差分析结果显示,稀释液类型、保存温度和保存时间对冻后精子的质膜完整性影响极显著(P<0.01)。
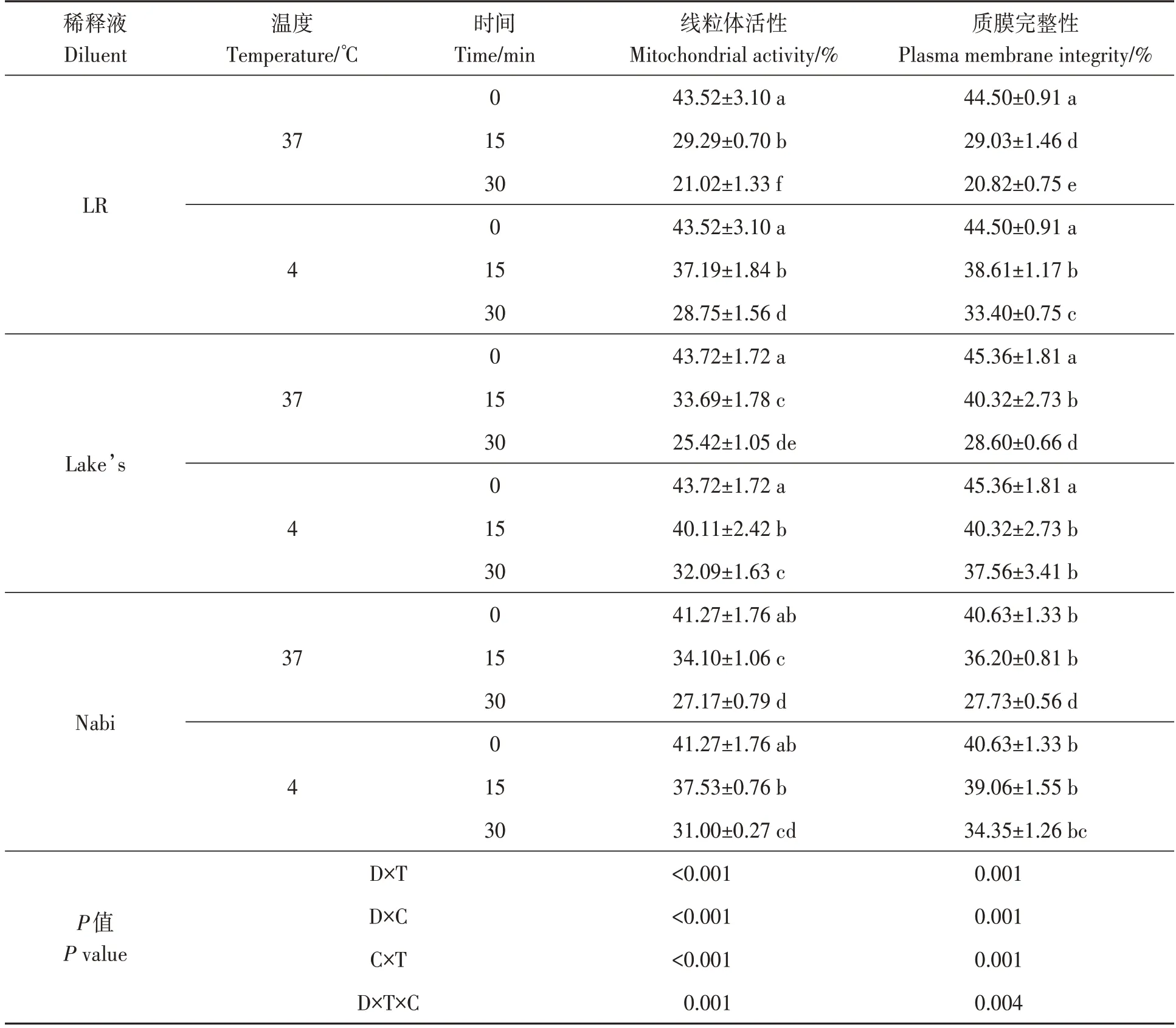
表3 不同保存温度条件下3种稀释液冻后精子的线粒体活性、质膜完整性Table 3 Mitochondrial activity and plasma membrane integrity of sperm frozen by 3 dilutions at different storage temperatures
2.4 不同保存温度对不同稀释液精液抗氧化性的影响
不同保存温度下冻后精液的抗氧化性如表4所示。在MDA 含量上,Lake’s稀释液冻后精液在初始解冻时MDA 含量最低,为7.23 nmol·L-1,但与LR 和Nabi 稀释液差异不显著(P>0.05);随着保存时间的延长,3 种稀释液的MDA 含量均呈上升趋势;Lake’s 稀释液处理的精液在37 和4 ℃条件下保存30 min 后,MDA 含量分别为10.43 和9.73 nmol·L-1,均显著低于LR 和Nabi 稀释液,且4 ℃条件下保存时,MDA 含量的上升速度较慢。在SOD 活性上,Lake’s 稀释液冻后精液在初始解冻时SOD 活性最高,为119.72 U·mL-1,但与LR 和Nabi 稀释液差异不显著(P>0.05);随着保存时间的延长,3 种稀释液的SOD 活性均呈下降趋势;Lake’s 和Nabi 稀释液处理的精液在37 和4 ℃条件下保存30 min 后,SOD 活性分别为102.02、103.26 和109.91、113.05 U·mL-1,均显著低于LR稀释液(P<0.05);且4 ℃保存时SOD 活性的下降速度变慢。多因素方差分析结果显示,稀释液种类、时间和温度间的互作对精液SOD 活性影响极显著(P<0.01)。

表4 不同保存温度条件下3种稀释液冻后精子的丙二醛含量和超氧化物歧化酶活性Table 4 MDA content and SOD activity of sperm frozen by 3 dilutions at different storage temperatures
3 讨论
稀释液组成与精子冻后保存效果关系密切。本研究对6 种稀释液冻后精子的活率、活力等指标进行分析比较,Lake’s稀释液冻后精子的活率、活力、顶体完整性、质膜完整性、线粒体活性优于其他稀释液;Nabi 稀释液的冻后活率、活力低于Lake’s 和Nabi 稀释液,但其表现为最佳的冻后耐保存性。由此说明,稀释液保存效果的优劣与稀释液的成分、渗透压、pH等关系密切。
3.1 渗透压对鸡精子冻后活率、活力的影响
渗透压是鸡精液冷冻稀释液的重要参数,一般为295~360 mOsm·kg-1。张兆旺等[21]研究表明,在等渗或接近等渗的稀释液中鸡精子冻后效果最优。王世银等[22]研究表明,渗透压为360~440 mOsm·kg-1时更有利于鸡精液冷冻保存时精子的存活和保存后的受精力。合适的渗透压可以缓解冷冻和解冻过程对精子造成的损伤。本研究中,冷冻效果较好的Lake’s和Nabi稀释液的渗透压分别为333 和310 mOsm·kg-1,属于较低的渗透压;Modified Sasaki稀释液的渗透压为415 mOsm·kg-1,冻后精子的活率和活力均显著低于Lake’s 和Nabi 稀释液,由此推测,较高的渗透压可能不利于鸡精液的冷冻保存。
3.2 pH对鸡精子冻后活力、活率的影响
精液稀释液的pH 对精子保存非常重要。精子运动性强,能量消耗快,因此,产生的大量代谢物使精液pH 降低,从而抑制一些酶活性,导致精子活力、活率降低,影响其受精能力[23]。丁瑜[24]认为pH 过高会影响精液冻后活性。一般鸡精液稀释液的pH 为7.2~7.6。姚希芳[25]研究显示,当pH为6.7~7.2 时,精子存活时间最长。在本试验中,冷冻效果最好的LR、Lake’s 和Nabi 稀释液的pH分别为7.0、7.0 和7.4,均属于较为理想的稀释液pH;Nabi 稀释液表现为最佳的冻后耐保存性能,可能与其pH 较高有关;Beltsville 稀释液的pH 为7.5,其冷冻效果较差,由此推测,较高的pH 可能不利于提高家禽的精液冷冻保存效果。
3.3 稀释液成分对鸡精子冻后活力、活率的影响
不同稀释液成分对精子冻后活力、活率的影响不同。杨小霞等[26]和金美林等[27]研究显示,在稀释液中添加果糖比添加葡萄糖效果好。张兆旺[28]研究表明,在稀释液中添加谷氨酸钠对精液有保护作用。王世银等[29]研究显示,稀释液中的糖类物质对精子质膜起到保护作用。姚希芳[25]研究显示,糖类物质和谷氨酸钠能够给精子提供能量,并对精子起到保护作用。王秀萍等[30]研究表明,少量的K+可延长精子的寿命。张彩云等[31]研究表明,过量K+会抑制精子活性,影响精子活力。Mg2+是参与多种酶促反应的重要辅因子,在精子发生和调节精子活力中发挥重要作用。在本研究中,BPSE 稀释液中K+过高,且Mg2+缺乏;Lake’s、Nabi和LR稀释液中K+和Mg2+含量适中,有利于冻后精子保有较高的活力、活率和顶体完整性。
3.4 保存温度对鸡精子冻后活力、活率的影响
在精液保存过程中,温度对精子的保存效果有重要影响。鸡精子运动较快,呼吸作用会产生大量代谢物,低温保存可抑制精子活性,使精子活动减弱,降低代谢速率,从而减少酸性物质的累积[32]。1967 年,Van Wambeke[33]首次证明精子在5 ℃下保存24 h 后仍具有受精能力。姚希芳[25]和张兆旺等[21]证明鸡精液在3~5 ℃中保存效果最优。本研究比较了Lake’s、Nabi、LR 3种稀释液冻后在4和37 ℃保存下精子的活性,结果表明,保存于4 ℃条件下的精子在活率、活力、顶体和质膜完整性等均高于37 ℃。
3.5 不同稀释液对精子抗氧化指标的影响
精子在冷冻保存过程中,细胞内外环境会发生较大变化,导致精子产生过量的活性氧,破坏精子自身的抗氧化系统。适当的pH 和渗透压有利于维持精子正常的代谢活动,减少精子的氧化损伤。王世银等[32]研究表明,稀释液中缓冲物质浓度过低或过高都会使精子受到损伤,从而增加精子畸形率,破坏精子自身的抗氧化系统。精液中添加磷酸盐、柠檬酸盐等成分可抵消精子代谢产生的大量酸性物质[34],减少精子的氧化损伤。随着冻后精液保存时间的延长,如保存温度过高,精子代谢会消耗大量能量物质,同时也会产生大量的代谢废物,如乳酸、活性氧等,进而影响精子活力和受精能力[25,35]。本研究表明,Lake’s稀释液在抗氧化性能上优于其他稀释液,且4 ℃条件保存优于37 ℃保存。

