基于CRISPR/Cas9技术建立IGF2R基因修饰PK-15细胞
谢春嫡,郭肖蓉,2,张煦栋,3,周荣*,李奎
(1.中国农业科学院北京畜牧兽医研究所,北京 100193;2.佛山科学技术学院生命科学与工程学院,广东省动物分子设计与精准育种重点实验室,广东佛山 528225;3.内蒙古农业大学动物科学学院,呼和浩特 010010;4.中国农业科学院深圳农业基因组研究所,深圳 518120)
我国是畜禽消费大国,畜禽养殖也是我国重要的经济产业。藏猪是我国优秀的高原品种,其耐粗饲、抗高寒环境、抗逆性强以及皮薄肉好的特质是其他猪种所不及的[1-2],解析藏猪抗逆性强,肉质好的原因有助于培育畜禽新品种,从而促进我国畜牧业的发展。藏猪也能作为良好的研究模型,但是目前对藏猪或者其他优秀高原畜禽种质的研究都很少,这就限制了畜禽品种向抗逆方向的改良。
胰岛素样生长因子家族是一类多功能细胞增殖调控因子,主要包括胰岛素样生长因子1(insulin-like growth factor 1,IGF1)、胰岛素样生长因子2(insulin-like growth factor 2,IGF2)、胰岛素样生长因子1 受体(insulin-like growth factor 1 receptor,IGF1R)、胰岛素 样生长因子2受体(IGF2R)以及多种胰岛素样生长因子结合蛋白(insulin-like growth factor binding proteins,IGFBPs),这些因子在细胞分化、增殖及胚胎、个体生长发育中具有重要的作用。IGF2R 是一种单链跨膜糖蛋白,分胞外区、跨膜区及胞内区,其中胞外区最大,由15 个相邻的单元组成,每个单元都含有8 个位置高度相似的半胱氨酸残基。IGF2R有两种配体结合位点:一种是位于结构域3和结构域9 的甘露糖6-磷酸结合位点(mannose 6-phosphate,M6P);另一种是位于结构域11 的IGF2 的结合位点[3],结构域5 有1 个位点与结构域3、9 以及阳 离子依 赖性的M6P受体(cation dependent M6P receptor,CD-M6PR)结合位点有显著的同源性,但是结合配体的能力不如M6P 和IGF2 位点[4]。IGF2R 的M6P 位点与溶酶体分选相关功能有关,IGF2 位点与生长功能相关,虽然这两个位点并不在同一位置,但是会互相竞争抑制[5]。最新的研究表明,Caspase 9 非凋亡活性会影响IGF2R 的逆行转运,进而影响溶酶体分选过程[6]。IGF2 结合IGF2R 后激活糖原合成激酶3α∕β(glycogen synthase kinase 3α∕β,GSK3α∕β)从而促进甲基转移酶3A(DNA-methyltransferase 3α,Dnmt3A)介导的DNA 甲基化,随后影响液泡型H+-ATP 酶(vacuolar-type H+-ATPase,V-ATPase)的表达,最终导致质子重新传导到线粒体膜间隙,并引起持续的氧化磷酸化[7],说明IGF2R 可能与线粒体某些功能有关。
亚洲猪和欧洲猪种在基因组上存在许多大的结构变异(structural variations,SVs),并且这些SVs比单核苷酸变异(single nucleotide variations,SNVs)对基因表达的影响更大[8]。本实验室前期研究亚洲猪的基因组[9]发现,与国外猪相比,中国藏猪的IGF2R基因在其36内含子上有1段274 bp的缺失,并通过PCR 和实时定量PCR(real time quantitative PCR,RT-qPCR)验证了这段缺失对IGF2R基因表达的影响。基于IGF2R基因功能和前期基础,推测藏猪IGF2R基因内含子上的缺失可能与其低氧耐受的特性有关,本研究利用基因编辑技术制备了IGF2R基因第36内含子上的大片段缺失,并对基因编辑细胞进行了初步研究,以期解析该片段的功能,进一步研究该基因对藏猪抗逆性能的影响,这对品种改良和育种有重要意义。
1 材料与方法
1.1 细胞和载体
PK-15 细胞购自北京中原合聚经贸有限公司,pX458-GFP[10]是实验室前期保存的质粒载体,感受态细胞采购自北京擎科生物科技有限公司。
1.2 主要试剂
细胞用DMEM 培养基(Gibco,12800082)、FBS(ExCell,FSP500)、Pen-strep(YEASEN,60162ES76)、胰酶(Gibco,25200072)培养;电转化用Cell Line Nucleofector Kit V 转染试剂盒(Lonza,VCA-1003);质粒用北京康为世纪无内毒素质粒中提试剂盒提取(CWBIO,CW2105S);用高保真酶进行PCR(Vazyme,P515),CCK-8 试剂(Vazyme,A311)检测细 胞活力,ECL 发光液(Vazyme,E411)、RNA 提取用TRIZOL(Vazyme,R401)、反转录(Vazyme,R312)及荧光定量PCR(Vazyme,Q711)试剂均购自南京诺唯赞生物科技股份 有限公 司。IGF2R抗体(Abmart,T55516)、Actin(Abmart,M20011)、GAPDH(Abmart,M20050)、Caspase9(Abmart,T55049)、BAX(Abmart,T40051)、二抗(Abmart,M21003)均购自艾比玛特公司。
1.3 IGF2R基因修饰载体构建
在IGF2R基因第36 个内含子处按照18-20N+NGG 规律选择sgRNA 打靶序列,设计2条引物:sgRNA1和sgRNA2(表1)。将合成的2对寡聚核苷酸(oligo3nucleotide,oligo)退火后分别连接到线性化质粒上得到重组质粒[11],分别命名为pX458-GFP-IGF2R1和pX458-GFP-IGF2R2,同 时由北京擎科生物科技有限公司从头合成IGF2R基因274 bp修饰的同源序列。
1.4 细胞培养
细胞使用含10%胎牛血清的DMEM 培养基并置于37 ℃、5% CO2的培养箱中培养,细胞密度在90%左右时使用胰酶将其消化下来传代或者冻存。传代将细胞按所需比例传到相应培养皿中培养。细胞冻存时按基础培养基∶血清∶DMSO=7∶2∶1 的比例配制好冻存液,细胞消化离心后用冻存液将细胞吹散转移到冻存管中,在4 ℃中放置10 min,再转移到-20℃冰箱放置20 min,随后放到-80 ℃过夜,尽快将细胞转移到液氮中保存。
1.5 细胞转染
当细胞密度达到90%时将其消化离心,按照Cell Line Nucleofector Kit V 转染试剂盒说明进行细胞转染,转染10 h后更换培养液,48 h内进行流式细胞分选。
1.6 重组质粒突变效率检测
转染后的细胞使用流式细胞术进行富集,收集产生明显荧光的细胞1 万颗,随后与空白细胞一起提取DNA。PCR 后用1%琼脂糖凝胶电泳进行检测,分析经重组质粒切割后产生的突变条带的灰度值,确定重组质粒的突变效率。所用的引物如表1 所示。
1.7 单克隆细胞的培养及基因型鉴定
流式分选后的细胞在培养液中培养每3 d 换1 次,7 d 后在徕卡显微镜(DMI6000 B)明场下观察每个孔是否长出细胞,并及时传代。当传到24 孔培养板时,取少量细胞(100µL 体积细胞液)提 取DNA进行PCR,反应体 系:2 × Phanta Max Master Mix 10µL,上、下游引物(表1)各0.5µL,无菌水8 µL,DNA 1 µL。反应程序:95℃3 min;95 ℃15 s,60 ℃30 s,72 ℃30 s,35 个循环;72 ℃5 min。PCR 产物送生工生物工程(上海)股份有限公司测序。

表1 引物序列Table 1 Primer sequence
1.8 CCK-8实验
挑选出的单克隆细胞与野生型细胞以2 000 孔-1的数量铺入96 孔细胞培养板中,每24 h加入CCK-8 试剂,37 ℃培养箱孵育1 h,使用酶标仪在450 nm 处检测吸光度,分别检测24、48、72、96 h细胞吸光度,计算细胞活力。
1.9 RT-qPCR
将细胞铺到12 孔板中,48 h 后收取细胞,用传统氯仿法提取RNA,再将RNA 反转录成cDNA作为荧光定量的模板,按照诺唯赞荧光定量试剂盒说明书进行操作。
1.10 Western-blot
细胞用蛋白裂解液提取总蛋白后使用5×Loading buffer变性(100 ℃,10 min),经电泳(120 V,15 min;200 V,45 min)后转膜(200 mA,2 h),再将转完膜后的PVDF 膜放入5%的脱脂奶粉中,在室温摇床上孵育1 h,按照抗体说明书稀释后将含有目的条带的膜放入抗体稀释液中,4 ℃摇床中孵育过夜,等渗缓冲盐溶液(TBS with Tween-20,TBST)洗3 次后进行二抗孵育,室温摇床孵育40 min,最后使用ECL 发光显色液进行显色。
1.11 免疫荧光
24孔盘中的细胞用4%多聚甲醛固定30 min,透膜液通透20 min 后经5%奶粉封闭1 h,一抗孵育2 h,二抗孵育40 min,2 ug∕mL DAPI 复染5 min后用荧光显微镜拍照用于后续统计。
1.12 数据分析
采用Image J 软件分析凝胶电泳条带灰度值并计算敲除效率;RT-qPCR 以及CCK-8 结果使用GraphPad prism 8.0分析。

2 结果与分析
2.1 重组质粒突变效率检测
基因缺失的目的序列在野生型PK-15 细胞基因组上存在,而在基因修饰后的细胞基因组上缺失。将构建好的pX458-GFP-IGF2R1和pX458-GFP-IGF2R2质粒转染到细胞中,24 h 后在荧光显微镜下能看到绿色荧光(图1A 和B),说明重组质粒已成功转染进细胞。PCR扩增后凝胶电泳结果显示(图1C),野生型细胞只有1条带(593 bp),而经2 个重组质粒切割后的细胞产生了2 条带(593、450 bp),说明本实验中构建的重组质粒能对目的序列进行有效切割。Image J分析电泳条带灰度值后发现切割效率为30%。
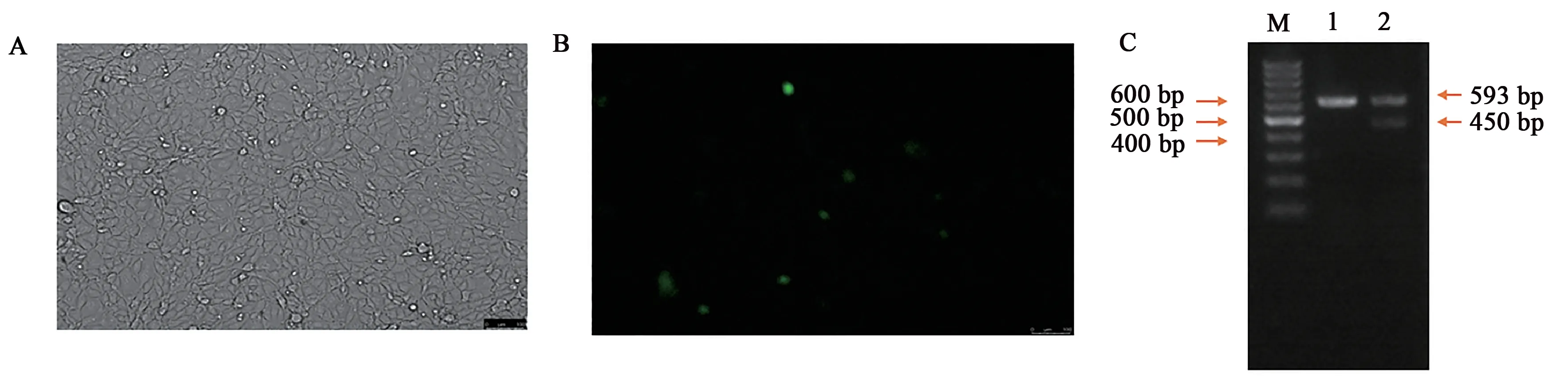
图1 质粒构建及效率检测Fig.1 Plasmid construction and efficiency detection
2.2 单克隆细胞基因型分析
共挑出了418 株细胞,提取DNA 后进行PCR扩增并测序验证。其中共鉴定到双等位基因修饰细胞株37 个,效率为8.85%。流式分选图如图2A所示,方框圈出部分为发绿色荧光并进行流式分选的细胞,这部分细胞占所有细胞的5.15%,重组质粒转染效率较低。图2B展示了部分细胞株PCR鉴定结果,产生了不同基因型的细胞,说明编辑有效。
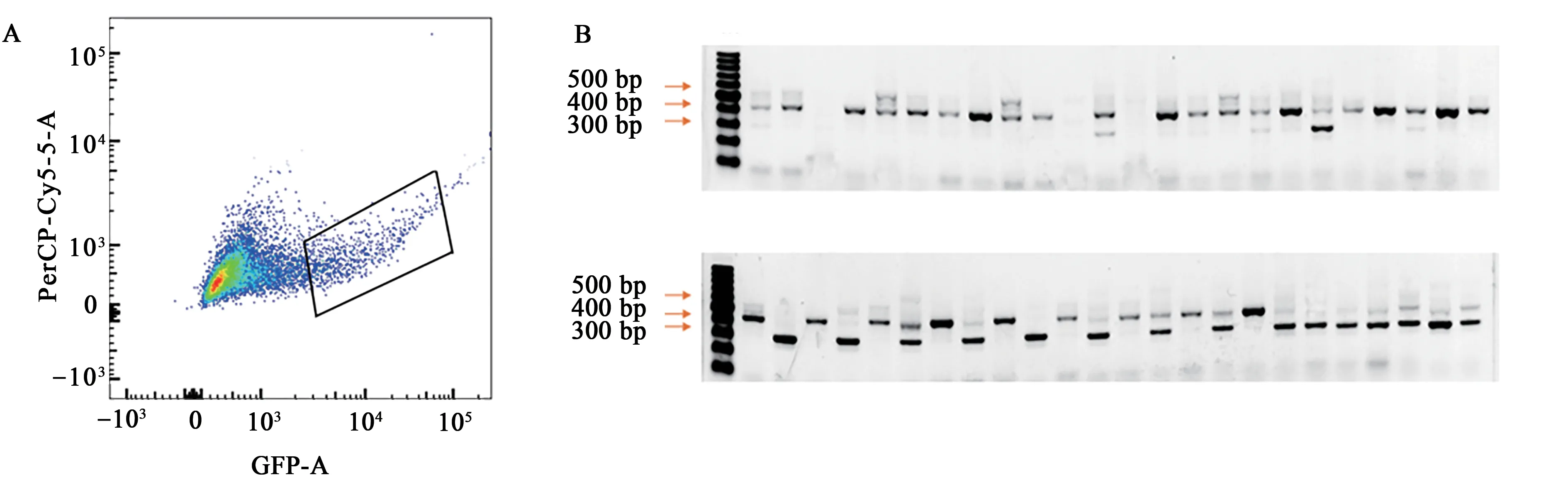
图2 单克隆细胞基因型分析Fig.2 Genotype analysis of monoclonal cells
2.3 IGF2R基因修饰细胞特征分析
利用RT-qPCR、蛋白免疫印迹技术和免疫荧光技术对挑选出的野生型细胞以及双等位基因修饰细胞进行mRNA 和蛋白水平上的分子特征鉴定。结果显示,与野生型细胞(WT)相比,IGF2R双等位基因修饰细胞(IGF2R-∕-)mRNA 表达极显著下调(P<0.01)(图3B),并且蛋白表达水平也显著下调(P<0.05)(图3A和C)。
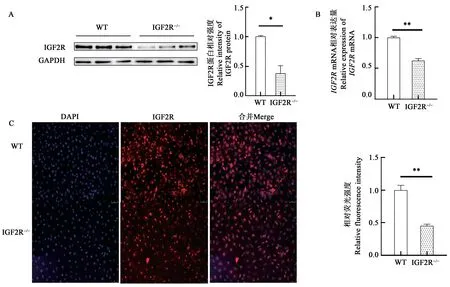
图3 IGF2R基因修饰细胞分子特征鉴定Fig.3 Molecular characterization of the IGF2R gene deletion cell
2.4 IGF2R基因修饰对细胞活力的影响
为了探究IGF2R基因的修饰对细胞活力的影响,利用CCK-8 实验检测IGF2R基因修饰细胞与野生型细胞的活力差异。结果(图4)显示,IGF2R基因274 bp修饰细胞的活力在72 h时极显著高于WT 组(P<0.01),说明IGF2R基因修饰细胞的状态良好。
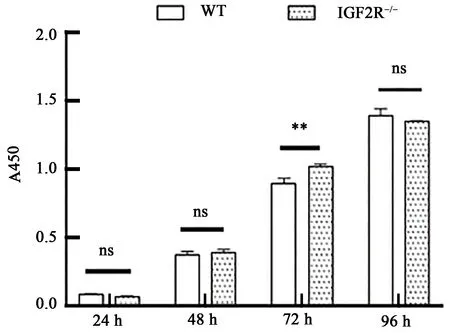
图4 IGF2R基因的修饰对细胞活力的影响Fig.4 Effect of IGF2R gene deletion on cell viability
2.5 IGF2R基因修饰对细胞凋亡的影响
抑制凋亡基因BCL-2mRNA 水平极显著上升(P<0.05),但BAX基因mRNA 水平无显著变化(图5A),说明IGF2R基因的修饰抑制了细胞的凋亡。利用Western-blot 检测了IGF2R基因修饰对细胞凋亡的影响,结果(图5B)发现,与野生型细胞相比,IGF2R基因修饰细胞促凋亡蛋白Caspase9和BAX水平显著下调(P<0.05),抑制凋亡基因蛋白BCL-2水平无显著变化。
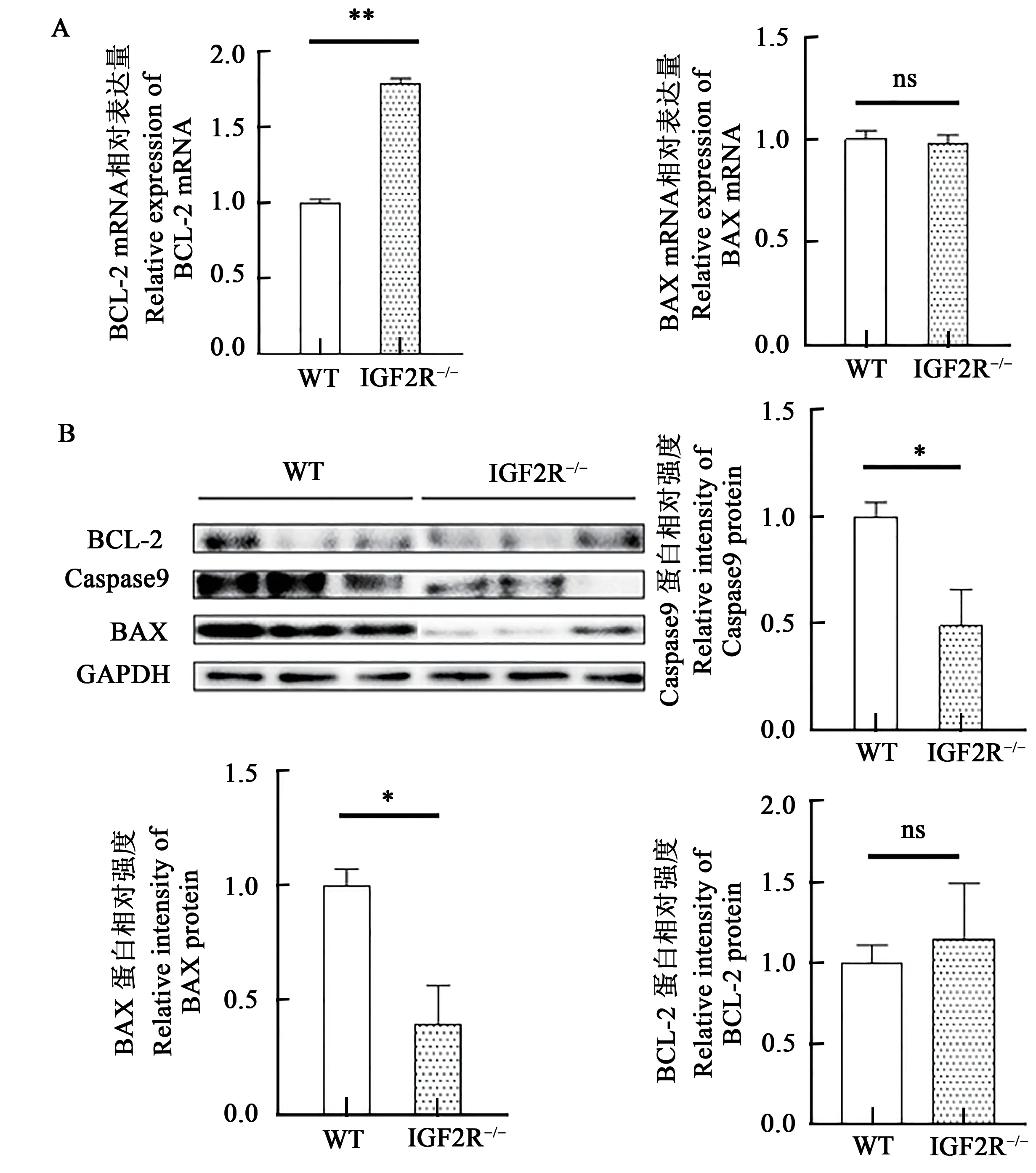
图5 IGF2R基因的修饰对细胞凋亡的影响Fig.5 Effect of IGF2R gene deletion on apoptosis
3 讨论
CRISPR-Cas9 基因编辑工具是一项突破性的技术,可以精确地引起目标基因组上的突变,并且速度快、成本低,这加速了动物模型的建立,提高了研究效率[12]。目前已经通过建立动物疾病模型来研究人类疾病,证明基因治疗是可行的[13-14],这是基因编辑技术的一大应用。我国是畜禽消费大国,猪在畜禽消费中占了举足轻重的地位,但是近几年因为非洲猪瘟以及其他猪流行性疾病导致生猪资源大幅度减少,市场上猪肉价格大幅度上升,这不仅扰乱了市场经济,更是对我国猪业的重创,影响猪业发展。但是目前的技术难以解决畜禽疾病带来的危害或者进行品种改良,CRISPR-Cas9技术是解决这些问题的新手段。目前,詹群美等[15]已通过CRISPR-Cas9 技术制备了肌肉生成抑制素(myostatin,MSTN)基因编辑巴马香猪,显著提高了巴马香猪的瘦肉率。在研究猪疾病方面,姜元[16]将CRISPR-Cas9 和RNAi 技术相结合,制备出了抗猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)的猪;本团队前期通过CRISPR-Cas9制备出了同时抗猪繁殖与呼吸综合征、猪传染性胃肠炎病毒、猪德尔塔冠状病毒等3 种重大疫病的基因猪[17],最近建立了一种高效的基因编辑技术[18],该技术无需进行单克隆细胞分选并且不引入质粒DNA,提高了基因编辑动物制备效率。
Igf2r基因缺陷会引起胎儿过度增长,甚至在围产期死亡[19-21]。在畜禽育种中,IGF2R作为重要经济性状的候选基因被广泛研究,有报道指出IGF2R影响鸭脂肪的形成[22];埃及水牛IGF2R基因单核苷酸突变会引起犊牛日增重增加,这种变化可能是通过IGF2的表达增加实现的[23]。本研究通过CCK-8 和RT-qPCR、Westernblot 发现,IGF2R基因修饰细胞株在培养72 h 时活力显著升高,凋亡蛋白表达降低,抑制凋亡基因的mRNA 水平上升,可能是因为IGF2R表达的降低减少了负性生长因子(transforming growth factor β1,TGFβ1)的活性,使细胞继续增殖。在多个研究中都发现IGF2R基因与肿瘤相关[24-25],刘世博等[26]发现沉默IGF2R基因可以促进肿瘤细胞的增殖。IGF2基因能促进由IGF1R缺乏所导致的心肌细胞的凋亡,并且这种凋亡是线粒体依赖性的,抑制IGF2R的表达可以阻断由IGF2诱导的心肌细胞的凋亡[27],这些结果都表明IGF2R基因与细胞增殖有关。
IGF2R基因对细胞和个体的生长、增殖、凋亡有重要影响,本实验通过基因编辑技术对IGF2R基因进行了精准修饰,这对后续研究其功能有重要作用。本研究还成功构建了IGF2R基因精确修饰的PK-15细胞系,并初步进行了功能研究,为研究IGF2R基因功能提供细胞模型,并为后续基因编辑猪的制备奠定基础。

